| المجلد الثالث - العدد 1 - رمضان 1424 - تشرين الأول 2003 |
| |
رقائق الـ DNA : التقنية والتطبيقات |
| DNA Chips: Technology and Applications |
| د. نهيد بشور |
| Nahid Bachour |
إن الازدياد الهائل لاستعمال رقائق الـ DNA خلال السنوات الأخيرة ما هو إلا دليل على أهميتها في تطور الطب الحديث. نظرياً، على الأقل، ستكون رقائق الـ DNA قادرة على تحديد المورثات المسؤولة في كل إمراضية وبشكل دقيق، وبذلك تفتح إمكانية تحديد الأهداف غير المحددة سابقاً لأدوية جديدة. وبطريقة مماثلة، فإن حلم تخصيص علاج المريض بناء على مستوى تعبير المورثات المسؤولة عن استقلاب الدواء لديه لا يمكن إدراكه إلا من خلال الاستخدام الروتيني لرقائق الـ DNA. إن تباينات وتطبيقات رقائق الـ DNA في تزايد مستمر. ليس فقط بناء على أسس علم الحياة الجزيئي الأساسي وإنما على وضع أنظمة محددة لهيكلية التحليل والتصنيع الدقيق أيضاً.
مع النشاط الكثيف في حقل المجموعة الوراثية وما يتعلق بها للفترة ما بعد دراسة التسلسل الوراثي، فقد شهدت السنوات الأخيرة اهتماماً هائلاً في مجال تطوير وتطبيق تقنيات الرقاقة الحيوية Biochip . تعتمد تقنية الرقاقة الحيوية في جوهرها على التقاط العينة المستهدفة بواسطة مسابر لمستقبل حيوي Biorecpetor probes . تتألف هذه المسابير من أنواع مختلفة من أصناف جزيئية (مثل الصادات، الإنزيمات، البروتينات أو الأحماض النووية) أو من أنظمة حيوية كاملة (مثل الخلايا، النسج أو كائنات حية بكاملها). يكمن دور المستقبلات الحيوية في ربط العينة المراد تحليلها إلى الأجسام الحسية للرقاقة الحيوية وبالتالي مقايستها بطريقة كشف ما. تستعمل جميع المستقبلات الحيوية آليات كيماوية حيوية معينة كي تتعرف على العينة الخاضعة للتحليل وهي بذلك تشكل مفتاح النوعية للرقائق الحيوية. يمكن استخدام أنواع مختلفة من طرق الكشف في تقنية الرقائق الحيوية مثل: القياسات البصرية (كاللمعان، الامتصاص، رنين السطح والمواد الوراثية خارج النواة- البلاسمون Plasmon) بالإضافة إلى القياسات الكيميائية الكهربائية والقياسات الحساسة للكتلة (مثل موجة السطح الصوتية والتوازن الدقيق الصوتي للسطح). |
تعتمد آلية التعرف الحيوي في رقائق الـ DNA الحيوية على تهجين Hybridization الحمض الريبي النووي منـزوع الأوكسجين (DNA) أو الحمض الريبي النووي (RNA) باستخدام ما هو مثبت في قواعد ازدواج للأسس ما بين أسس الأحماض النووية. إذا كان تسلسل جزء معين من جزيء الـ DNA معروفاً، فإنه من الممكن تصنيع تسلسل متمم وتنميطه بواسطة مركبات واسمة كالمواد المشعة أو المتألقة. ويتم الحصول على منمطات كهذه ضمن عينة الـ DNA عادة عن طريق تضخيم تفاعل سلسلة عديد البوليمراز (PCR) لعينة الـ DNA. وفي حال وجود عينات متضمنة أكثر من نوع، فإنه يتم تنميط كل منها بواسمة معينة. عندما تتم إضافة أجزاء من عينات الـ DNA وحيدة السلسلة إلى المسابير على الرقاقة فإنه يتم تشكيل أجزاء من عينات DNA نموذجية مضاعفة السلسلة فقط عندما تكون العينة المستهدفة والمسبار متممين لبعضهما البعض وفقاً لقاعدة ازدواج الأسس. وهكذا تخدم المنظومات الدقيقة Microarrays للمسابر على رقائق الـ DNA الحيوية كمواقع للتفاعل، ويوجد في كل موقع تفاعل وحيدات سلسلة لجزء من DNA ذو تسلسل معين. هذه الأجزاء قد تكون إما تسلسلات لقليل نكليوتيد Oligonucleotide قصيرة (منهجياً حوالي 18-24 أساس) أو خيوط أطول من DNA متممة (cDNA-complementary DNA). ويتم تحري العينة المنمطة المهجنة إلى المنظومات الدقيقة بعد ذلك بواسطة مقايسة وجود التنميط.
وعلى مر السنوات القليلة الماضية، كانت هذه الأجسام الحيوية الحساسة المعتمدة على الحمض النووي بالإضافة إلى الرقائق الحيوية مركز الاهتمام المتزايد للباحثين في حقل المجموعة الوراثية وبشكل متنوع وواسع، وتم تطوير أعداد متنوعة اعتماداً على أسس نظام الحمض النووي. على سبيل المثال، تم استخدام عناصر تعرف حيوية صنعية تدعى الأحماض النووية البروتينية (PNA). هذه الأحماض النووية البروتينية عبارة عن قليل أميدات صنعية Oligoamides، عادة تملك ثبوتية عالية في السوائل الحيوية، وذات مقدرة على الارتباط بقوة بتسلسلات قليلة النكليوتيد المتممة وفقاً لقواعد ازدواج الأسس. ومن التطورات نذكر أيضاً نوع جديد نسبياً من منمط طيفي لمسابر الـ DNA والذي يمكن تحريه بواسطة:
.Surface-enhaced Raman scattering (SERS)
وفي حقل التشخيص المعتمد على الـ DNA فهناك تقارير حول تطوير جسم حيوي حسي يستخدم صبغات مرئية وقرب تحت الحمراء. |
| أنظمة رقاقة الـ DNA الحيوية |
يمكن تصنيف رقائق الـ DNA الحيوية ضمن مجموعتين رئيسيتين: الأولى تدعى منظومات رقاقة الـ DNA .
(DNA chip arrays)، والتي تتألف من مسابر عالية الكثافة محمولة على ركائز ذات أساس صفيحي أو هلامي، والأخرى هي أجهزة الرقاقة الحيوية المدمجة (Integrated biochip devices) والتي تتضمن منظومات DNA بالإضافة إلى رقاقة حسية دقيقة ذات دارة مدمجة.
|
| منظومات رقاقة الـ DNA |
تتألف منظومات رقاقة الـ DNA من نوع من الركيزة المغلفة بمسابير لمنظومات دقيقة من الـ DNA. هذه الركائز عبارة عن صفائح رقيقة مصنوعة من السيليكون أو الزجاج أو الهلام أو مادة البوليميريك كالبلاستيك أو النايلون. هذه الأنظمة ذات منظومات مسابير عالية الكثافة (103حتى 105) وحيث أنها لا تمتلك أنظمة كشف حسية مدمجة؛ فإنها تعمل عادة بواسطة أنظمة كشف منفصلة كبيرة نسبياً (مساحة سطح المنضدة) ومصممة للإستخدم في مجال تطبيقات البحث المخبري (الشكل 1). ويمكن الاستفادة من العدد الكبير من المسابير في تحديد العينات الحيوية المستهدف بسرعة كبيرة جداً وبناتج معلومات عالي. وهكذا نرى أن صفائح المنظومات هذه ذات فائدة كبيرة في تطبيقات اكتشاف المورثة واكتشاف الدواء، والتي غالباً ما تتطلب عشرات الآلاف من المنظومات على ركيزة واحدة.
يمكن استخدام العديد من الطرائق لتصنيع منظومات DNA. حيث تستخدم الأناس الآلية ذات السرعة العالية في إنتاج منظومات الـ DNA على ركائز من الزجاج أو النايلون. |
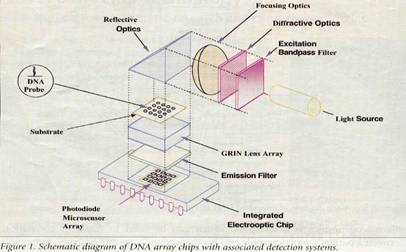
الشكل 1: رسم تخطيطي لمنظومة رقاقة الـ DNA مترافقة مع نظام الكشف. |
تنتج منظومات قليلة النكليوتيد عادة إما بواسطة عمليات التصنيع الدمجية الموجهة بالضوء في الموضع (in situ)، أو بواسطة تصنيع تقليدي يتبع بالتثبيت على ركائز زجاجية. يستخدم نظام التصنيع في الموضع التفاعلات الكيماوية الموجهة بالضوء والمُطبقة لأقنعة تصويرية على كل رقاقة، بالرغم من أنه تم وصف طرق تصنيع منظومات قليلة النكليوتيد موجهة بالضوء وبدون استخدام الأقنعة. في هذه الطريقة يستعيض مصنِّع المنظومة غير المقنعة عن قناع الكروم بتوليد أقنعة فعلية على جهاز كومبيوتر، ثم توصل إلى المنظومات الرقمية الدقيقة. وتتضمن الأنظمة الأخرى تثبيت الـ DNA المُفعَّل على هلام من مادة البولي أكريلاميد المتضمن ألدهيد، بالإضافة إلى أنظمة المنظومة الدقيقة البصرية التي تستخدم جهاز كشف ثنائي الشحن لرقائق الـ DNA المثبتة على صفائح حيث أن مسابير الـ DNA فيها منمطة بواسطة أصبغة مرئية وقرب تحت الحمراء.
إن كل منظومات رقاقة الـ DNA سابقة الذكر موصولة خارجياً إلى جهاز تحسس ضوئي مؤلف عادة من جهاز تحسس تقليدي كجهاز التضاعف الضوئي أو الجهاز ثنائي الشحن. وبالرغم من أن المسابير ومنصات العينة مضغوطة بحد ذاتها، إلا أن النظام ككل والمتضمن مصادر انبعاث أشعة ليزر وأنظمة الكشف (غالباً ما تكون نظام مجهري بؤري) يعد كبيراً نسبياً. لقد أظهرت هذه الأنظمة وبوضوح فعاليتها في مجال البحث والتحليل المورثي، إلا أنها وبسبب حجمها, تبقى في مكانها في المخبر وغير قابلة للحمل.
|
| أنظمة الرقاقة الحيوية المدمجة |
على عكس منظومات رقاقة الـ DNA، تتضمن الرقائق الحيوية المدمجة رقاقة مدمجة مع دارة حسية صغيرة، مما يجعل هذه الأجهزة قابلة للحمل بسهولة بالإضافة إلى أنها غير باهظة الثمن نسبياً. تتكون هذه الأجهزة عادة من منظومات مسابير ذات كثافة متوسطة (10-100 مسبار) وهي ملائمة وبشكل خاص للقياسات في حقل العمل (Field measurements) أو للتشخيص الطبي في عيادة الطبيب أو قرب السرير. لقد تم إنتاج الرقائق الحيوية بالاعتماد على التقنية الحيوية التقليدية المدمجة والمعالَجة بواسطة أنصاف النواقل، الأنظمة الآلية الكهربائية الدقيقة، الالكترونيات البصرية، والحصول على تصوير الإشارة الرقمية المعالَجة. وتم تطوير الرقائق الحيوية كي تتضمن ليس فقط رقائق دقيقة من دارات مدمجة لترانزيستورات ضوئية؛ بل لتشمل أنظمة من طبيعة سائلة حيوية أيضاً.
يصف الشكل 2 رسم تخطيطي لرقاقة حيوية مدمجة ذات منظومـات حسية حيوية بصرية موضوعة على دارة مدمجة. في هذه الرقاقة المدمجة تثبَّت كل من الأجسام الحسية والمضخمات والمفارقات والدارة الكهربائية المنطقية على رقاقة كهرضوئية. يتألف كل عنصر من العناصر الحسية في كل نظام رقاقة حيوية من 220 خلية ترانزيستور ضوئية مفردة موصولة على التوازي كي تزيد من حساسية الجهاز. وكعنصر جديد ومهم في مجال تطور رقائق الـ DNA الحيوية المدمجة تم استعمال تقنية أكسيد السيليكون المعدني المتمم ضمن نظام كهربائي بصري لدارة مدمجة كعنصر من عناصر كشف الرقاقة الدقيقة. تمكن هذه التقنية من تصنيع عناصر حسية بصرية متعددة، كذلك من استعمال الإلكترونيات الدقيقة في نظام وحيد، وبالتالي إمكان توفير رقائق حيوية مدمجة متطورة. ومن تطبيقات هذه الرقائق نذكر التحري عن أجزاء من مورثة فيروس الإيدز، جرثومة المتفطرات السلية، المورثة السرطانية p53، الاشريكية القولونية (E. Coli) ذلك بواسطة استخدام مسابير ذات تسلسل معين.
|
| التطبيقات |
أضحت تقنية رقائق الـ DNA الحيوية وبشكل سريع مفتاح خطة العمل في مجال واسع ومتباين من التطبيقات. نذكر منها:
- الدراسة التحليلية في التعبير والتسلسل المورثي والخريطة الوراثية.
- الاكتشاف المورثي والشكل الجزيئي.
- وصف العقاقير والسموم على المستوى الجزيئي Pharmacogenomics & Toxicogenomics.
- المسح الطبي الحيوي للأمراض الوراثية.
- حماية الصحة العامة.
- التشخيص الطبي قرب السرير.
تم استخدام رقائق الـ DNA عالية الكثافة من أجل تحديد التسلسلات (طفرة مورثة/ مورثة) وكذلك مستوى تعبير المورثات. ففي المادة الوراثية البشرية، أصبحت معلومات تسلسل القطع الرقعية من التسلسل البشري المعبر عنه متوافرة الآن وتم استخدامها في تقييم التعبير المورثي في أنماط مختلفة من الخلايا، أو ضمن ظروف وأوساط مختلفة. إن قوة تقنية رقاقة DNA الحيوية تكمن في مقدرتها على إنجاز تنميط تعبيري مورثي expressed sequence tag (EST) واسع لآلاف المورثات في تجربة واحدة. لقد تم تمثيل هذا الأمر في الدراسات على تعدد شكلياء النكليوتيد الوحيد Single-nucleotide polymorphisms (SNPs) الذي يعتبر أكثر أنماط التباينات في المادة الوراثية البشرية انتشاراً, وكذلك كأدوات فعالة في دراسة التباين في حالات وراثية طبية. تم استخدام الجمع ما بين التسلسل المعتمد على أساس هلامي والمنظومات الدقيقة عالية الكثافة في مسح ذو تدريج واسع للـ SNPs حيث تم فحص 2.3 ميغا كاملة من الأسس في مادة DNA الوراثية البشرية.
يمكن مراقبة التغيرات المعقدة في أنماط التعبير المورثي خلال تطور وتقدم السرطان وكذلك في الإبطال التجريبي لعملية توليد الأورام Tumourigenicity. إذاً، تؤمن منظومات الـ DNA المتمم الدقيقة أداة فعالة لدراسة هذه الظاهرة المعقدة. فعلى سبيل المثال، إن منظومة دقيقة عالية الكثافة ذات 1.161 عنصر DNA يمكن استخدامها في البحث عن الاختلافات بين التعبير المورثي المترافق للتثبيط الورمي. تسمح رقائق منظومات الـ DNA عالية الكثافة بإنجاز عمليات الاكتشاف المورثي وعمليات التعبير المورثي المتوازي بشكل كبير كما أنها تؤمن معلومات حول آلاف المورثات بشكل متزامن. يمكن استخدام هذه المنظومات لفحص كامل مورثات الشخص الواحد على طولها أو لفحص جزء من طولها من أجل التغيرات في أساس واحد عن التسلسل الطبيعي للمورثات. فعلى سبيل المثال، تتوفر رقائق الـ DNA بشكل تجاري من أجل تحري التغيرات في أساس واحد لمورثات BRCA1 و BRCA2 البشرية (المتعلقة بسرطان الثدي)، p53 (مورثة المثبط الورمي والطافرة في الأشكال العديدة من السرطان)، P450 (شيفرة مفتاح نظام الإنزيمات الكبدي الذي يستقلب الأدوية).
|
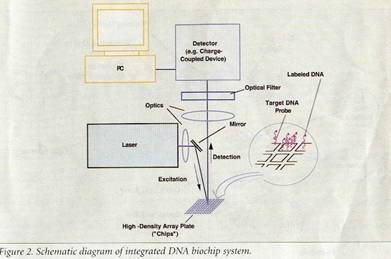
شكل 2: رسم تخطيطي لمنظومة رقاقة الـ DNA حيوية مدمجة |
إن وصف العقاقير على المستوى الجزيئي Pharmacogenomics هو عبارة عن نظام يمكن استخدامه لتحديد الارتباطات ما بين الشكل المورثي للمريض واستجابته العلاجية للأدوية. يمكن أن يؤدي وصف العقاقير، وبشكل رئيسي، إلى تطوير إجراءات تشخيصية جديدة ومنتجات علاجية وبذلك يصبح وصف (إعطاء) الأدوية موجهاً بشكل انتقائي للمرضى الذين يكون تناول الدواء لديهم فعالاً وآمناً. وبشكل مماثل، فإن حقل وصف السموم على المسـتوى الجزيئي Toxicogenomics يهتم بتحديد الارتباطات ما بين الاستجابة الحيوية للجزيئات السمية والشكل المورثي للمرضى المعرضين لتلك المواد السامة. ومرة أخرى نجد هنا أن رقائق الـ DNA الحيوية، والتي تسمح بمراقبة مستويات التعبير لآلاف المورثات بشكل متزامن، تؤمن أداة تحليل هامة. تم وصف واحدة على الأقل من تلك الطرق العامة في تحديد التعبير المورثي بواسطة منظومات الـ DNA المتمم الدقيقة كواسم عالي الحساسية للسمية. كما تم استخدام المنظومات الدقيقة لرقاقة الـ DNA الحيوية في إقرار شرعية الدواء وتحديد تأثيرات الدواء الثانوية وذلك بالاستناد على نماذج تعبير مورثي واسع.
حددت الدراسات الوراثية عدداً من المورثات التي يجب أن تخضع لطفرة كي تنتج سرطاناً أو تحث نمو الخلايا الخبيثة. على سبيل المثال، وجد أن طفرات BRCA1، وهي جين على الصبغي 17، ذات علاقة بسرطان الثدي، وهكذا فإن نسبة عالية من النساء اللواتي يملكن مورثة BRCA1 الطافرة هن أكثر قابلية للإصابة بسرطان الثدي. إن رقائق الـ DNA الحيوية متوفرة أيضاً من أجل تحليل العديد من المورثات البشرية متضمنة BRCA2، p53، P450. ومع التوافر الحالي لبيانات تسلسل الكتلة الوراثية البشرية بات من المتوقع تطوير رقائق حيوية مشابهة لاستخدامها كاختبارات وراثية.
من التطبيقات المهمة الأخرى لأجهزة الرقاقة الحيوية المدمجة المضغوطة تحري العناصر الحيوية الممرضة كالجراثيم والفيروسات. إن أجهزة الرقاقة الحيوية التي تجمع ما بين أنظمة أتمتة جمع العينة وقدرة الكشف المتعدد القنوات يمكن أن تسمح بالتحري المتزامن لعناصر ممرضة متعددة موجودة في عينات وسطها متباين. وفي عيادة الطبيب تملك أنظمة الرقاقة الحيوية المدمجة و القابلة للحمل دوراً أساسياً وميزة ليس فقط الحجم المضغوط بل الأداء العالي أيضاً. إن طرق التصنيع الحديثة لرقائق حيوية مدمجة كهذه تعني أن تكلفة إنتاجها متوسطة نسبياً. يمكن تبسيط عملية تجميع المكونات المختلفة بدمج العناصر العديدة على رقاقة واحدة. ومن أجل التطبيقات الطبية ينبغي أن تسمح ميزة الكلفة بتطوير رقائق حيوية قابلة للإتلاف وذات كلفة منخفضة جداً كي تستخدم في تشخيص الأمراض الطبية في المراكز دون الحاجة لإرسال العينات إلى المخبر لإجراء التحاليل. بالإضافة إلى أن الأحجام الصغيرة للمسابير (مكرولتر وحتى نانولتر) تقلل من حجم العينة اللازمة وتنقص من أحجام الكاشف والناتج عنه.
|
| المرجع |
1- Tuan Vo-Ding
DNA Chips: technology and application, CLI October 2001.
|
| المجلد الثالث - العدد 1 - رمضان 1424 - تشرين الأول 2003 |
| |
