| الملخص Abstract |
تنشأ متلازمة الثلاسيمية بيتا b-thalassemia syndrome من غياب أو نقص في تخليق synthesis سلاسل الغلوبين بيتا السوية
بنيوياً. وينجم عن الثلاسيمية بيتا الكبرى فقر دم وخيم severe يُعالج بنقولات دم متعددة وخالب حديد (ديسفيروكسامين desferrioxamine) (على الرغم من ذلك، غالباً ما يُظهر المرضى الثلاسيميين مضاعفات تضرر أنسجة مختلفة مثل فشل النمو واضطرابات العظم)؛ لهذا يمكن أن تتأثر تراكيز
متثابتات كيميائية حيوية معينة في مصول مرضى الثلاسيمية بيتا الكبرى.
هدفت هذه الدراسة إلى تقييم مستويات الكالسيوم والفسفات و N-MID الأوستيوكالسين المصلية لدى 161 مريضاً مصاباً بالثلاسيمية بيتا الكبرى
(أعمارهم بين 7 و33 عاماً)، بمقارنتهم مع مجموعة الشاهد (80 شخصاً سوياً ظاهرياً، أعمارهم بين 6.5 و41 عاماً) المتقاربة معهم عمرياً.
كانت تراكيز كالسيوم المصل في المرضى أخفض منها لدى الشاهد (9.3 ± 0.8 و 9.6 ± 1.27 "P=0.06"، على الترتيب) إلا أن هذا الانخفاض غير معتد به، في حين كانت قيم الفسفات لدى المرضى أعلى منها لدى الشاهد (6.1 ± 1.2 و4.35 ± 1.25، "P<0.00001"، على الترتيب) وكان هذا الفارق معتداً به. انخفضت مستويات N-MID أوستيوكالسين المصل، بدرجة يُعتد بها إحصائياً لدى المرضى عنها لدى الشواهد (26.86 ± 15.2 و 33.19 ± 15.9، "P=0.0019"، على الترتيب).
تدل هذه التبدلات في التراكيز المصلية للكالسيوم والفسفات N-MIDأوستيوكالسين المصل لدى مرضى الثلاسيمية على أهمية إجراء دراسات تفصيلية أكثر للمضاعفات العظمية الناجمة عن الثلاسيمية بيتا الكبرى، مع الأخذ بعين الاعتبارالتدخلات العلاجية التي
يخضع لها المرضى.
|
The b-thalassemia syndrome originates from the absence of or from reduction in synthesis of structurally normal beta globin chains. ?-thalassemia major results in severe anemia, which is treated with multiple blood transfusions and iron chelator (desferrioxamine) (However, the thalassemic patients often present with complications of different tissue damage, such as growth failure and bone disorders); thus, serum specific biochemical parameters could be affected in the ?-thalassemia patients.
This study was aimed to evalute serum calcium, phosphate and N-MID osteocalcin levels in 161 patients with b-thalassemia major, by comparing them with age-matched control group (80 apparently normal subjects).
Serum calcium concentration was not significantly (P=0.006) lower in patients than in controls (9.3 ± 0.8 and 9.6 ± 1.27 mg/dl, respectively), where as phosphate was significantly higher (P<0.0001) in patients than in controls (6.1 ± 1.2 and 4.35 ± 1.25 mg/dl, respectively).
N-MID osteocalcin levels were statistically lower in patients with ?-thalassemia major as compared to control group (26.86 ± 15.2 and 33.19 ± 15.9 ng/ml, respectively).
These serum calcium, phosphate and N-MID osteocalcin concentration changes, signify the importance of more detailed studies for bone complications due to ?-thalassemia major, with consideration to the therapeutic interventions that patients were undertaken them.
|
| المقدمة Introduction |
تنجم الثلاسيمية b (Beta-thalassemia) عن طفرة وراثية في جين الغلوبين بيتا، تتصف بغياب أو نقص في تخليق synthesis سلاسل الغلوبين ? السوية بنيوياً، والتي تم ذكرها من قبل كولي وليCooly and Lee عام 1925 (1). يتطور لدى مرضى الثلاسيمية ? الكبرى فقر دم وخيم severe يهدد الحياة مما يتطلب العلاج بنقل دم منتظم regular blood transfusion من أجل ضمان البقيا survive لهم ودخولهم في العقدين الرابع والخامس من الحياة (2، 3). من ناحية أخرى، يعاني هؤلاء المرضى من زيادة امتصاص الحديد من الأمعاء إضافة إلى انحلال الكريات الحمر في الدوران والأرومات في النقي مما يعرضهم إلى تحميل مفرط للحديد iron-overloadيفاقمه نقل الدم المتكرر الذي يخضعون له، والذي يمكن أن ينجم عنه اضطرابات جهازية متعددة منها فشل النمو، تبدلات هيكلية، اضطرابات عظمية، اضطرابات صماوية، ...إلخ. لذلك لابد من توليفة combination نقل دم مع معالجة بخلب chelation الحديد من أجل إنقاص ترسب الحديد ضمن الأنسجة (4).
قد يكون زرع نقي العظام bone marrow transplantation شافياً لدى بعض مرضى الثلاسيمية ? الكبرى، كما أن المعالجة الجينية gene therapy للشفاء من هذا المرض في تطور مستمر، إلا أن هذه الوسائل مكلفة وتكتنفها صعوبات كثيرة كما أنها غير مضمونة النتائج (5).
يعد نقص النمو أحد الموجودات النموذجية في الثلاسيمية الكبرى، حيث تترافق اضطرابات النمو والاضطرابات العظمية مع برنامج معالجة غير منتظم، وهي تصحح عادة بنقل دم ملائم. وقد يعاني مرضى الثلاسيمية بيتا الكبرى من نقص في كثافة معدن العظم تتناول المنطقة القطنية Lumbar spine من العمود الفقري بصورة خاصة (6). وقد يتطور لدى بعض مرضى الثلاسيمية الكبرى تخلخل (وهن) العظام osteoporosis وهو شائع حتى في مرضى الثلاسيمية الخاضعين لمعالجة جيدة (7)؛ وتعد الاضطرابات الثانوية المترافقة عموماً مع الثلاسيمية من نقص كالسيوم الدم hypocalcemia، وفرط فسفات الدم hyperphosphatemia ناجمة عن مضاعفات التحميل المفرط للحديد التي تناولتها دراسات تمت على الثلاسيمية بيتا الكبرى (8، 9). لذلك أجرينا هذه الدراسة لتحديد تراكيز الكالسيوم، والفسفات، والـ N-MID أوستيوكالسين في مصول مرضى سوريين مصابين بالثلاسيمية بيتا الكبرى، لمعرفة مدى تبدلات التراكيز المصلية لهذه المتثابتات لدى هؤلاء المرضى بغية استخدامها كنواة لدراسات أكثر عمقاً تتناول الاضطرابات العظمية لديهم.
|
| المواد والطرق Materials and Methods |
تم إجراء هذه الدراسة في مخابر كلية الصيدلة بدمشق ومستشفى الأسد الجامعي بدمشق ما بين عامي 2002-2004.
وشملت هذه الدراسة 241 فرداً توزعوا على الشكل التالي:
*161 مريضاً (102 ذكراً، 59 أنثى) مصاباً بالثلاسيمية بيتا الكبرى، تم تشخيصهم مسبقاً من قبل أطباء إختصاصيين في أمراض الدم، ويراجعون مركز الثلاسيمية في دمشق لنقل الدم المنتظم وأخذ خالب الحديد (الديسفيرال desferal الذي يتم تسريبه تحت الجلد 8 ساعات على الأقل يومياً ولمدة 5 أيام في الأسبوعً، وذلك بجرعة معيارية 20-40 مغ/كغ للأطفال وحوالي 50 مغ/كغ للبالغين)، تراوحت أعمار المرضى بين 7 و 33 (13.9 ± 5.25) عاماً، وكان منهم 131 مريضاً تم استئصال طحالهم.
* 80 فرداً شاهداً أصحاء ظاهرياً (42 ذكراً و 38 أنثى)، تم انتقاؤهم من الطلاب في كافة مراحل التعليم في مدينة دمشق وضواحيها، وليست لديهم أية شكوى حالية أو سابقة لمرض دموي. تراوحت أعمارهم بين 6.5 و41 (14.64 ± 7.8) عاماً.
تم الحصول على العينات ببزل 5 مل من الدم الوريدي للشخص المدروس، في التاسعة صباحاً، بعد صيام طوال الليل. ولقد أُخذت عينات المرضى قبل نقل الدم الدوري لهم (بفاصل شهر واحد تقريباً عن نقل الدم السابق). حيث تم وضع 2 مل من الدم الوريدي على مانع تخثر EDTA من أجل دراسة المتثابتات الدموية والرحلان الكهربائي للهيموغلوبين. وتم تنبيذ القسم المتبقي من عينة الدم (3 مل وضعت في أنبوب جاف مباشرة)، للحصول على المصل الذي تم توزيعه إلى أنابيب صغرية (أنابيب ايبندورف Eppendorf). كانت تحفظ مباشرة في الدرجة -20م? ليتم فيما بعد معايرة المتثابتات الكيميائية الحيوية (كالسيوم، فسفات، N-MID أوستيوكالسين) فيها؛ وفي حال طالت الفترة الزمنية (أكثر من شهرين) لإجراء المعايرة، حفظت العينات في الدرجة -80م?.
تم تحديد المتثابتات الدموية للتأكد من كافة المعطيات الدموية الخاصة بالمريض قبل نقل الدم، (الهيموغلوبين، الهيماتوكريت Hct، تعداد الكريات الحمر RBC، مناسب الكريات الحمر: حجم الكرية الوسطي MCV، هيموغلوبين الكرية الوسطي MCH، تركيز هيموغلوبين الكرية الوسطي MCHC) باستخدام المحلل الآلي R3500Cell-Dyn® لشركة Abbott (USA).
كما استخدم جهاز الرحلان الكهربائي لشركة هيلينا Hellena الفرنسية لفصل الهيموغلوبينات على هلامة أسيتات السلولوز.
تم تعيين تراكيز كالسيوم وفسفات المصل لكافة عينات الدراسة باستخدام عتائد Kits من شركة روش Roche (Germany)، تعتمد مبدأ المقايسة اللونية بتعيين نقطة النهاية end point.
تمت مقايسة N-MID أوستيوكالسين المصل باستخدام عتيدة Kit من شركة روش الألمانية. ويكشف فيها عن الشدفة N-MID الثابتة (مؤلفة من الأحماض الأمينية 1-43 ). وذلك بتطبيق مبدأ الشطيرة sandwich، باستخدام ضدين أحاديي النسيلة نوعيين للأوستيوكالسين N-MID وللشدفة N-، أحدهما معلم بالبيوتين biotin والآخر بالروثينيوم Ruthenium (على الترتيب).
حيث تُضاف الجزيئات الصغرية المغللة بالستربتافيدين إلى معقد الشطيرة، ومن ثم يُُقاس إصدار اللمعان الكيميائي Chemiluminescent باستخدام جهاز®2010 Elecsys.
تم تحليل النتائج إحصائياً باعتماد اختبار ستيودنت student's t-test للمقارنة بين مجموعات الدراسة وتقييم الفروقات بينها. واعتبرت قيمة (P<0.05) معتد بها إحصائياً Statistically significant. كما استخدم برنامج الحاسوب الخاص بالمجموعات الإحصائية للعلوم الاجتماعية Statistically Package for Social Sciences (SPSS) (version 12) لتحليل المعطيات العددية ممثلة بالمتوسط ± الانحراف المعياري وحُددت علاقة الارتباط باستخدام معامل الارتباط بيرسون Pearson.
|
| النتائج Result |
أظهرت دراسة المتثابتات الدموية (الهيماتوكريت، الهيموغلوبين، وعدد الكريات الحمر) لدى مجموعتي الشواهد والمرضى، أن هنالك انخفاضاً واضحاً يُعتد به (P<0.00001) في قيم هذه المتثابتات بين المجموعتين التي تم التعبير عنها بالمتوسط ± الانحراف المعياري.
كما أن هذه الفروقات في المتثابتات الدموية كانت واضحة لدى مجموعتي الذكور المرضى والشواهد (العدد:102، 42 على الترتيب) مع قيمة (P<0.00001) يُعتد بها إحصائياً.
كذلك الحال فيما يخص مجموعتي المرضى والشواهد الإناث (العدد:59، 38 على الترتيب) حيث كانت الفروقات واضحة ومُعتداً بها إحصائياً (P<0.00001) كما هو مبين في الجدول 1.
وبتحديد قيم مناسب الكريات الحمرRed cell indexes، لوحظ وجود فرق يعتد به إحصائياً في قيم متوسط حجم الكرية mean cell volume (MCV) ومتوسط تركيز هيموغلوبين الكريةmean cell hemoglobin concentration (MCHC) لدى مجموعتي المرضى والشواهد. حيث كانت قيمة (P<0.00001). في حين لم يكن هذا الفرق مُعتداً به (P=0.095) بين المجموعتين بالنسبة لمنسِب هيموغلوبين الكرية mean cell hemoglobin (MCH) (الشكل 1).
وكانت النتيجة ذاتها فيما يتعلق بفروقات مناسِب الكريات الحمر لدى مجموعتي الذكور المرضى (102 مريضاً) والذكور الشواهد (42 فرداً). كما أبدت مجموعات المريضات الإناث (59 مريضة) والشواهد الإناث (38 أنثى) نتائج مشابهة.
تم بالاعتماد على نتائج الرحلان الكهربائي التأكد من انتقاء مرضانا من المصابين بالثلاسيمية بيتا فقط دون مشاركة مع فقر الدم المنجلي، لاستبعاد مرضى فقر الدم المنجلي من الدراسة. |
الجدول 1: متوسط قيم المتثابتات الدموية لدى الأفراد المدروسين.
المتثابتة |
المرضى 161 = n*) ) |
الشواهد 80 = n*) ) |
قيمة P** |
الهيماتوكريت (%) Hct |
20.70 ± 3.80 |
42.6 ± 3.55 |
<0.00001 |
الهيموغلوبين (g/dl) Hb |
7.37 ± 1.26 |
13.45 ± 1.17 |
<0.00001 |
تعداد الكريات الحمر
(x106/ cu mm) RBC |
2.67 ± 1.64 |
4.76 ± 0.55 |
<0.00001 |
متوسط حجم الكرية (fl) MCV |
79.70 ± 10.1 |
90.17 ± 6.67 |
<0.00001 |
متوسط هيموغلوبين الكرية
(pg) MCH |
28.84 ± 2.39 |
28.52 ± 2.11 |
0.095 |
متوسط تركيز هيموغلوبين الكرية MCHC (g/l) |
35.73 ± 2.17 |
31.62 ± 0.6 |
<0.00001 |
حيث أن:
Hct: Hematocritويُقدر كنسبة مئوية. Hb: Hemoglobin ويُقدر بـ غ/دل.
RBC: Red blood cell count ويُقدر بالمليون/مم³.
MCV: Mean cell volume ويُقدر بالفمتولتر.
MCH: Mean cell hemoglobin ويُقدر بالبيكوغرام.
MCHC: Mean cell hemoglobin concentration ويُقدر بـ غ/ل.
*n: number عدد الأفراد. ** اعتبرت قيمة P<0.05 فرقاً يُعتد به إحصائياً.
|
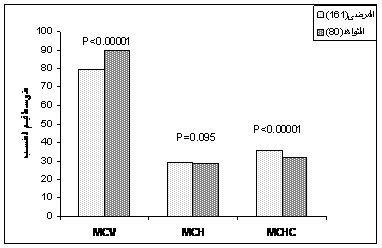
الشكل 1: مقارنة قيم مناسب الكريات الحمر بين مجموعتي المرضى (161 مريضاً) والشواهد (80 فرداً). |
وجدنا أن 10.23% من المرضى كانت لديهم قيم N-MID أوستيوكالسين المصل أقل من الحد الأدنى السوي (أقل من 11 نغ/مل)، وكانت هذه النسبة لدى الذكور (7.87%) أقل منها لدى الإناث (13.64%). بشكل عام كان هذا الانخفاض واضحاً ومُُعتداً به (P=0.0019) في مجموعة المرضى عنه في مجموعة الشاهد.
(انخفضت قيم كالسيوم المصل لدى 9.1% من المرضى المصابين بالثلاسيمية بيتا عن الحد الأدنى السوي (القيم السوية: 8.6-10.2 مغ/دل)، إلا أنه لم يكن هنالك فرق يُعتد به إحصائياً بين مجموعتي المرضى والشواهد (9.3 ± 0.85 ، 9.63 ± 1.27 مغ/دل.، "P=0.06" على الترتيب).
في حين ارتفعت قيم الفسفات اللاعضوية الممثلة لتراكيز فسفور المصل في مصول المرضى مقارنة بالشواهد (6.1 ± 1.21 ، 4.35 ± 1.25 مغ/دل.، على الترتيب) لدرجة يُعتد بها إحصائياً (P<0.00001) وتم تمثيل هذه الفروقات بشكل واضح في الشكل 2 ويلخص الجدول 2 نتائج مقارنة متوسطات المتثابتات الكيميائية الحيوية بين مرضى الثلاسيمية بيتا الكبرى ومجموعة الشاهد.
يُلاحظ أن قيم N-MID أوستيوكالسين في
المصل كانت منخفضة لدى المرضى عنها لدى الشواهد (26.86 ± 15.2، 33.19 ± 15.99 نغ/مل، على الترتيب) وكان هذا الانخفاض معتداً به إحصائياً (0.0019 P=) (الشكل 2). وبنتيجة مقايسة N-MID أوستيوكالسين المصل لدى الذكور (102 مريضاً) ومقارنتها مع الشواهد الذكور (42 فرداً) وجدنا انخفاضاً يُعتد به (P=0.025) لدى المرضى الذكور عنه لدى الشواهد (27.22 ± 14.28 ،33.23 ± 17.59 نغ /مل، على الترتيب)، كما أظهرت نتائج مقايسة N-MID أوستيوكالسين لدى المريضات الإناث (59 مريضة) ومقارنتها بالشواهد الإناث (38 أنثى) (26.65 ± 15.21 ،33.15 ± 14.25 نغ/مل، على الترتيب) وجود انخفاض يُعتد به (P=0.012) لدى المريضات (الشكل 3). ولاحظنا أن قيم N-MID أوستيوكالسين المصل تتناقص مع ازدياد عمر المريض، حيث بلغت 27.10 ± 14.74 نغ/مل لدى المرضى الأقل من 15 عاماً، وكانت ضمن المجال 25.85 ± 14.56 نغ/مل لدى المرضى الأكبر من 15 عاماً.
وجدت علاقة ارتباط ضعيفة بين التراكيز المصلية للكالسيوم والفسفور لدى مجموعة الشاهد (0.36r=) (الشكل 4)، في حين كانت هذه العلاقة أضعف بكثيـر لدى مجموعـة
المرضى (0.1-r=) (الشكل 5).
|
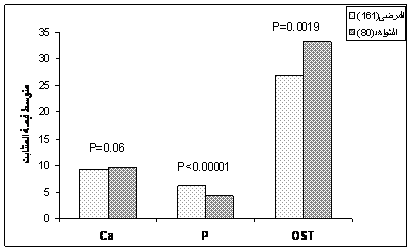
Ca: Calcium , P: Phosphate , OST: Osteocalcin
الشكل 2: مقارنة قيم الكالسيوم والفسفور والأوستيوكالسين في المصل لدى مجموعتي المرضى
(161 مريضاً) والشواهد (80 فرداً).
الجدول 2: مقارنة متوسطات المتثابتات الكيميائية الحيوية المدروسة
لدى مجموعتي المرضى (161 مريضاً) والشواهد (80 شاهداً).
المتثابتة |
المجال المرجعي |
المرضى
161 = n*) ) |
الشواهد
80 = n*) ) |
قيمة **P |
(mg/dl) Ca |
8.6 - 10.2 |
9.3 ± 0.85 |
9.63 ± 1.27 |
0.06 |
(mg/dl) P |
2.7 - 4.5 |
6.1 ± 1.21 |
4.35 ± 1.25 |
<0.00001 |
(ng/ml) OST |
11- 43 |
26.86 ± 15.2 |
33.19 ± 15.99 |
0.0019 |
Ca = Calcium، P = Phosphour، OST = Osteocalcin.
*n = number عدد الأفراد.
** اعتبرت قيمة P<0.05 فرقاً يُعتد به إحصائياً.
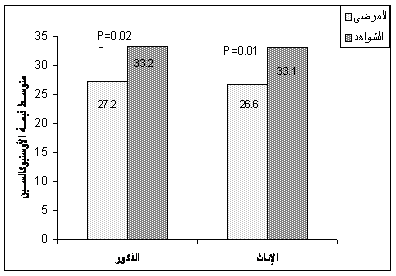
الشكل 3: مقارنة قيم الأوستيوكالسين (N-MID) في المصل لدى مجموعتي الذكور (102 مريضاً و 42 شاهداً) والإناث (59 مريضة و 38 شاهدة).
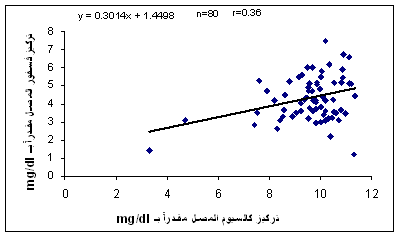
الشكل 4: ارتباط تراكيز الكالسيوم والفسفور في المصل لدى مجموعة الشواهد. n: عدد الشواهد.
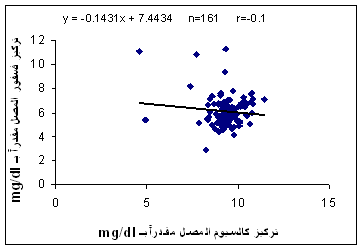
الشكل 5: ارتباط تراكيز الكالسيوم والفسفور في المصل لدى مجموعة المرضى، n: عدد المرضى. |
| المناقشة Discussion |
إن انخفاض قيم المتثابتات الدمويـة المدروسة لدى مرضى الثلاسـيمية بيتا من المُسلَّمات المعروفة مقارنة بمجموعة الأشخاص الشواهد، حيث أن النقص في تخليق الهيموغلوبين السوي يؤدي إلى انخفاض قيم الهيماتوكريت والهيموغلوبين لدى المريض.
أشـارت بعض الدراسات إلى أن منسب حجم الكريـة الوسـطي (MCV) أكثـر مصدوقيـة Valid من تركيز هيموغلوبين الكرية الوسطي (MCH) لتحري الثلاسيمية بيتا (10).
لوحظ في دراستنا أن 10.23% من مرضى الثلاسيمية بيتا الكبرى، كانت لديهم قيم الـ N-MID أوستيوكالسين أقل من الحد الأدنى السوي، ويتفق هذا الانخفاض في قيم N-MID أوستيوكالسين المصل لدى مرضانا مع دراسة تمت على مرضى إيطاليين مصابين بالثلاسيمية بيتا الكبرى (11)، وكانت نتيجتها وجود مستويات أوستيوكالسين منخفضة لدى مرضى الثلاسيمية مقارنة مع الشواهد.
كما اتفقت نتائج دراستنا مع دراسة أجريت في جامعة Messina في إيطاليا عام 2004، تمت على 30 مريضاً و20 شاهداً. وأشارت إلى انخفاض قيم الأوستيوكالسين لدى المرضى مقارنة بالشواهد (12).
أظهرت نتائجنا تقارباً في تراكيز كالسيوم المصل لدى مجموعتي المرضى والشواهد (P=0.06)، مقابل ارتفاع في تراكيز فسفات المصل لدى المرضى مقارنة بالشواهد (P<0.00001)، ويمكن أن يُعزى السبب في في ذلك إلى أنظمة نقل الدم التي تزيد الداء الهيموسيدريني الناجم عن تفاوت مطاوعة المرضى للمعالجة الخالبة للحديد (13)، أو إلى إمكان تأثر الوظيفة الكلوية لهؤلاء المرضى، وهذا ما انعكس في ارتفاع قيم فسفور المصل، وهو ما يتوافق مع دراسة عالمية دلت على وجود عيوب أنبوبية كلوية (ربما تتسبب بها الشدة التأكسدية الناجمة عن ترسب الحديد) لدى مرضى الثلاسيمية بيتا الكبرى (14).
ويُعتقد أن لغياب الطحال الذي يلعب دوراً هاماً في إزالة الكريات الحمر المثقل غشاؤها بالحديد تأثيراً على اضطرابات نسب العديد من الشوارد في الجسم (15).
|
| الاستنتاج Conclusion |
توجد نسبة من المرضى لديهم نقص في سويات أوستيوكالسين المصل، ذلك الواصم marker للتقلب العظمي وهذا له أهمية في ضرورة متابعة دراسة واصمات الاستقلاب العظمي لدى مرضى الثلاسيمية بيتا مستقبلاً بغية إبعادهم قدر الإمكان، عن تخلخل (وهن) العظام.
ينبغي تقييم الكتلة العظمية لكل مريض، ضمن خطة معالجة أكثر تحسناً، لكشف الاعتلالات العظمية دون (تحت) السريرية.
كلمة شكر Acknowledgment
الشكر الجزيل للقائمين على إدارة مركز الثلاسيمية التابع لوزارة الصحة في دمشق (الدكتور قصي الزير والدكتور علو إبراهيم والدكتور أسامة عز) ولكافة العاملين في المركز لمساعدتهم لنا في الحصول على عينات مرضى الدراسة.
|
| المراجع Reference |
1-Cooley TB. and Lee P.
A series of cases of splenomegaly in children with anemia and peculiar changes.
Trans Am Pediatr Soc. 37: 29-30, 1925.
2-Saka N; Sukur M; Bundak R; Anak S; Neyzi O. and Gedikoglu G.
Growth and puberty in thalassemia major.
J Pediatr Endocrinol Meaty. 8: 181-186, 1995.
3-Modell B; Letsky EA; Flynn D M; Peto R. and Weatherall DJ.
Survival and desferrioxamine in thalassemia major.
BMJ., 284: 1081-1084, 1982.
4-Lanca TC; Landing BH. and Neustein HB.
Pathogenetic mechanisms in hepatic cirrhosis of thalassemia major: Light and electron microscopic studies Path.
Annu, 12: 171-200, 1977.
5-Woodard P; Lubin B. and Walters CM.
New approaches to hematopoietic
cell transplantation for hematological disease in children.
Pediatr Clin North Am Oct; 49(5): 989-1007, 2002.
6-Eren E. and Yilmaz N.
Biochemical markers of bone turnover and bone mineral density in patients with b-thalassemia major.
International Journal of clinical Practice. 59(1): 46-51, 2005.
7-De Sanctis V; Vullo C. et al.
Endocrine complications in thalassemia major.
Prog Clin Biol Res., 309: 77, 1989.
8-De Sanctis V; Vullo C. et al.
Hypoparathyroidism in beta-thalassemia major.
Acta Haematol., 88: 105, 1992.
9-Al-Elq AH. and AL-Saeed HH.
Endocrinopathies in patients with thalassemias.
Saudi Med J., 25(10): 1347-1351, 2004.
10-Tabatabaie SMTH. and Khazaie MR.
Comparative evaluation of MCV And MCH validity In beta-thalassemia screening.
J Med Council IR Im; 17 (3): 189-194, 1999.
11-Alagna S; Masala A; Gallisai D. et al.
Parathyroid function and bone metabolism in children with beta thalassemia major: effect of sex steroid treatment.
Eur J Med., 1(3): 153-157, 1992.
12-Morabito N; Gaudio A; Lasco A. et al.
Osteoprotegerin and RANKL in the pathogenesis of thalassemia-induced osteoporosis: new pieces of the puzzle.
J. Bone Miner. Res., 19(5): 722-727, 2004.
13-Pratico G; Di Gregorio F; Caltabiano L; Palano GM. and Caruso-Nicoletti M.
Calcium phosphate metabolism in thalassemia.
Pediatr Med Chir., 20(4): 265-268, 1998.
14-Ong-ajyooth L; Malasit P; Ong-ajyooth S; Fucharoen S; Pootrakul P; Vasuvattakul S; Siritanaratkul N. and Nilwarangkur S.
Renal function in adult beta-thalassemia/Hb F disease. Nephron, 78(2): 156-61, 1998.
15-Tavazzi D; Duca L; Graziadei G; Comino A; Fiorelli G. and Cappellini MD.
Membrane-bound iron contributes to oxidative damage of beta-thalassaemia intermedia erythrocytes.
Br J Haematol, 112(1): 48-50, 2001.
|
| |
