| المجلد 3 , العدد 10 , ذي الحجة 1426 - كانون الثاني (يناير) 2006 |
| |
منشأ الغلوبُلين الكبروي في داء فالدنستروم:
هل هو من طليعة غير اعتيادية للخلية البائية B ؟
|
Origins of Waldenström’s Macroglobulinemia:
Does It Arise from an Unusual B-Cell Precursor?
|
| ترجمة وإعداد د. عماد أبو عسلي |
| Abou-Asaleh I. |
كلية الطب – جامعة دمشق
عن مقال من مجلة Clinical Lymphoma, 5(4), 217-219, 2005 |
| الملخص Abstract |
تكون الخلايا B نموذجية النسائل عند الإصابة بفالدنستروم ووجود الغلوبُلين الكبروي (WM) Waldenström's Macroglobulinemia، هي نفسها الخلايا CD2O+ ذات الغلوبُلين المناعي (Ig) M+IgD+ التي تغيب عنها طفرة مفرطة جسدية متقدمة بدالٍ كلاسيكي Classic Switch Recombination (CSR). وهناك حيز صغير فقط من الخلايا B نموذجية النسائل يقوم بالتعبير عن نازعة أمين السيتوزين المحرضة بالتنشيط. إلا أن التنشيط بوساطة الانترلوكين -4 CD4OL لا ينبِه عملية البدالة الكلاسيكية بالـ WM. ومع ذلك فإننا وجدنا أن الطفرة في المناطق البدالية الضرورية للـ CSR كانت موجودة في الاعتلال الغامائي (خلل في تخلق الغلوبُلينات المناعية) أحادي النسيلة IgM ذو الدلالة المجهولة (MGUS) لكنها كانت غائبة من الخلايا B في الـ WM، وهذا ما يقترح رجحان الاحتمال القائل بأنه ليست كل حالات الـ MGUS IgM ذات مقدرة على إحداث الـ WM، كما أن هذا يعزز بقوة الفرضية القائلة أن الخلايا المستهدفة في عملية الاستحالة نحو WM هي نمط غير اعتيادي من الخلايا B. |
| المقدمة introduction |
|
يدل وجود الغلوبُلين الكبروي بالدم لفالدنستروم (WM) على خباثة في الخلايا البائية B، تتميز بوجود ارتشاحات متعددة الأشكال للخلايا اللمفاوية والبلازمية في نقي العظام والدم، مع وجود الغلوبُلين المناعي (Ig) M أحادي النسيلة في المصل. وتقوم أغلبية الخلايا B في الـ WM والخلايا البلازميـة بالتعبيـر عن واصـمة الخليـة B CD2O وأيضاً عن الـ IgM السطحي. ولأن الـ WM هي سرطان الخلايا B اللمفاوية، فإنه يمكن تحديد النسيلة الخبيثة بشكل لا لبس فيه عن طريق سلسلة من إعادة الترتيب الجيني الـ IgH المتغير والمتنوع والمتواصل (VDJ) (1-4). وتسمى سلسلة الـ IgH VDJ التي تعين هوية الخلايا البلازمية الخبيثة في النقيوم المتعدد بالتحليل نموذجي النسيلة ووحيد الخلية، وهي تستخدم من أجل التأكيد بشكل دقيق على أنه قد تم تعيين هوية الـ IgM VDJ الصحيح. وتكون خلايا WM البائية والخلايا البلازمية قبل البدالة على وجه الحصر (1، 3)، قادرة على التعبير عن IgM نموذجي النسيلة و IgD نموذجي النسيلة أيضاًً. ويكون IgM VDJ الذي يميز أغلبية نسائل الـ WM طافراًً بشكل شديد، ويعتقد عموماً أن يكون ذلك صفة مميزة لحالة خلايا B الذاكرة ولمدى الخبرة مع المستضد.
ومع ذلك فإن قسماًً ضئيلاً من مرضى الـ WM لديهم نسائل خبيثة ذات IgM VDJ من السلالة الجنسية، مما يشير إلى أن حادثة الاستحالة التي تسبب حدوث WM ليست محصورة بالخلايا B الطافرة جسدياً.
|
مراحل تمايز الخلايا B في الـ WM
يمكن تعيين مراحل التمايز الموجودة ضمن نسيلة الـ WM عن طريق تصنيف مجموعات الخلايا B الثانوية المعينة من ناحية النمط الظاهري من نقي العظم والدم, ويلي ذلك إجراء تحليل جزيئي للـ VDJ IgM نموذجي النسيلة، الشكل 1.
ويبدو أن الأغلبية العظمى من خلايا B في الـ WM هي خلايا CD2O+ B التي تعبر عن IgM و IgD.
ومن المهم أن نذكر هنا أن معظم خلايا B الـ WM تفتقر للـ CD27, وهو الواصمة marker التي يعتقد أنها تعين هوية خلايا B الذاكرة. وعندما تصنف خلايا الـ WM ضمن المجموعات الثانوية: CD20+/CD27+, CD2O+/CD27- فإن
النسخ نموذجية النسيلة تكون قابلة للكشف في كلتي المجموعتين الثانويتين، مما يشير إلى أن خلايا WM نموذجية النسيلة يمكن أن تكون CD27+ أو CD27-. ومع هذا فإن إجراء حسابات للعدد المطلق للخلايا B نموذجية النسيلة في كل مجموعة ثانوية اعتماداً على العد وفقاً للتفاعل السلسلي للبوليميراز للمنتسخة العكسية وحيدة الخلية, (RT-PCR) يظهر أن معظم الخلايا نموذجية النسيلة هي في الواقع CD27- (3). ويبدو أن مميزات النمط الظاهري الأخرى لنسيلة الـ WM تتبدل مع الزمن. ويخضع الـ CD45 وهو المستضد العام للكريات البيضاء, لعملية تضفير splicing بديلة لإنتاج فصيلة من الأشكال الاتساقية isoforms التي يعبر عنها بشكل تمايزي كخلايا لمفاوية سوية ناضجة. ومن الضروري أن كل الخلايا B الباقية, على الرغم من حالة الذاكرة, تعبر عن الأشكال الاتساقية لـ CD45RA, لكن حالما تصبح الخلايا B مفعلة, فإنها تبدأ بفقدانها للـ CD45RA ويزداد فيها التعبير عن الشكل الاتساقي CD45RO (7، 10). وفي هذا السياق فإنه يبدو أن WM تجتاز مرحلة من التطور النسيلي طالما أن المرض يتقدم, مع أنه بالبداية تكون نسيلة الـ WM على نحو كبير من النمط CD45RA عند تشخيص المرض, لكن يتبدل ذلك بعد فت
رة ثلاثة أعوام فتعبِر حينذاك عن CD45RO (11). وأحد التفسيرات لهذه الملاحظة هي أن نسيلة الـ WM تتطور من مرحلة الخلية B الهاجعة إلى مرحلة الخلية B المفعلة وذلك بانقضاء فترة طويلة من الزمن. ويعكس نموذج التبدلات الحاصلة في الـ WM تلك المشاهدة في خلايا B السوية عند التفعيل, لكن في حالة الخلايا B السوية فإن هذه التبدلات تحدث بعد ثلاثة أيام وليس فترة ثلاث سنوات.
|
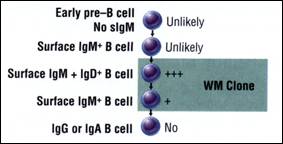
الشكل 1: مراحل تمايز الخلايا في WM |
| تحليل فصيلة الجينات VH |
|
يوجد في الإنسان فصائل الـ VH 6 من الجينات ذات المناطق المغيرة. وفي مجموعة سوية من اللمفاويات B تكون نسبة VH3 (55%) و VH4 (26%) وهما الأكثر تواتراًً . وفي أغلب حالات خباثة الخلايا B, فإن انتشار استعمال فصيلة VH يعكس مدى التواتر الإجمالي لكل فصيلة في المجموعات السوية. ومع هذا فقد وجدنا أن 15 من 16 حالة WM كانت من النمط VH3 (94%), مما يفترض أن الخلايا B المستهدفة للاستحالة بالـ WM هي دوماً وتقريباً الخلايا B المعبرة عن الـ VH3. وقد أكدت لنا التحاليل وحيدة الخلية بأن VDJ IgM WM قد تم تعيين هويتها بشكل صحيح مما يؤيد الاستخدام التفضيلي للـ VH3.
|
| هل تشتق WM من خلية B الذاكرة المنبهة بالمستضد؟ |
|
من الواضح أن IgM VDJ الطافر جسدياًً يشير إلى أن نسيلة WM مشتقة من خلية B
منبَهة بالمستضد. وبتحليل طراز التطفٌر في المناطق المحدَدة - المتتامة (CDRS) وفي المناطق الهيكلية framework regions (FRS) من الـ VDJ خلصنا إلى الاقتراح القائل أنه من أجل اكثر من نصف حالات الـ WM, قد لا يكون هذا هو التفسير الصحيح للمعطيات التي حصلنا عليها. ومع هذا فهنا يجب التشديد على أن هذا الاقتراح هو مجرد برهان إحصائي ومن الصعب تأكيده أو رفضه. وقد أظهر تحليل تسلسلات WM VDJ الطافرة وجود تكررات كثيرة من طفرات الاستبدال المتناثرة في أرجاء مناطق الـ FR و CDR. وتوضيح ما إذا كان طراز الطفرة الجسدية في WM مميزاً للانتقاء المستضدي, فقد تم تحليل كل تسلسل من VH عن طريق نموذج توزع الطفرات الذي يحدد المدى النسبي لطفرات الاستبدال في مناطق CDR بالمقارنة مع مناطق FR (3). وقد اقترحت هذه التحاليل أنه من أجل 5 على الأقل من أصل 13 مريضاً بالـ WM, تكون تسلسلات جين الـ VH الطافرة في الـ WM قد خضعت لعملية الانتقاء المستضدي. ومع ذلك فإنه من أجل 8 مرضى من أصل 13 مريضاً بـ WM لم يكن هناك من دليل على الانتقاء المستضدي لنسيلة الـ WM عندهم, ومن المحتمل أن يعكس ذلك وجود آليات أخرى للتنوع, ومن الممكن أن يشير ذلك إلى خلية B غير اعتيادية والتي تجتاز الانتقاء المستضدي الاعتيادي في المركز الانتاشي، الشكل 2. علاوة على ذلك فإنه من أجل 2 من أصل 15 مريضاً, كان هناك تسلسلاً انتاشياًً الـ Ig VDJ العائد لنسيلة الـ WM مما يشير إلى سلفٍ بسيط للخلية B والذي لم يخضع للطفرة الجسدية في المركز الانتاشي أو في أي مكان آخر.
|
| تشتق WM من خلية B غير قابلة للخضوع للتأشيب البدالي لصنف الغلوبُلين المناعي H |
إن خلايا B في WM لم تخضع للتأشيب البدالي الصنفي (CSR) (1، 3). ولفهم طبيعة خلايا B الورمية غير البدالية, فقد تم في WM تحليل العنصرين الضروريين للـ CSR, وهما غليكوزيلاز DNA اليوراسيل (UDG) و نازعة أمين السيتيدين المحرضة بالتفعيل (AID) (12-20). وقد أظهر تحليل 12 نسيلة WM طافرة أن لبروفيل الطفرة لجينات VH تناسب سوي لحادثتي التحوٌل والانتقال عند المراحل C أو G ولذلك فإن هذا لا يفترض وجود شذوذات في الـ UDG. لقد جرى تعيين هوية تعبير الـ AID بوساطة RT-RCR أحادي المرحلة. حيث تبين أن مريضين اثنين فقط من أصل 14 مريضاً بالـ WM قد عبرا عن AID خارج الحي ex vivo, واحد منهما لديه VH أصلي وآخر لديه VH طافر جسدياًً.
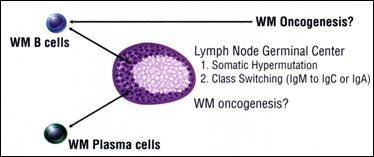
الشكل 2: هل تنشأ WM من خلايا B المركزية بعد الانتاشية أو هل هي تجتاز المركز الانتاشي.
|
وقد أشار التحليل أحادي الخلية إلى أن هناك جزء صغير فقط (<10%) من خلايا B نموذجية النسيلة قد عبرت عن AID وليس الكل. وعند تنشيط خلايا B WM نموذجية النسيلة في المختبر in vitro بوساطة CD40L والانترلوكين (IL)-4 بوجود الحالة التي تحرض CSR في خلايا B السوية لم يؤد هذا التنشيط إلى إعطاء أنماط أتساقية نموذجية النسيلة قابلة للكشف في عينات دم المرضى بالـ WM المدروسة. وقد استجابت خلايا الدم المحيطية أحادية النسيلة من مرضى الـ WM للتنبيه بالـ CD40L/IL-4 وتجلى ذلك بازدياد مستويات نسخ الـ AID, لكنه لم يلاحظ حدوث توسٌع نسيلي قابل للكشف لخلايا B الـ WM.
وقد تم الكشف عن وجود نسخ IgM نموذجية النسيلة في بداية الزرع وعند نهاية فترة 6 أيام على الزرع. من جهة أخرى لم تلاحظ أيضاًً الأنماط الأسوية نموذجية النسيلة بعد البدالية, وهذا ما يقترح بأن خلايا WM B لم تخضع للـ CSR. ومن أجل تقييم ما إذا كانت الشذوذات في عملية البدالة قد تفسر لنا فشل خلايا B الـ WM في الخضوع للـ CSR, قمنا بَسلْسَلة منطقة CDR3-S? ومقارنتها مع المناطق البدالية في الاعتلال الغلوبُليني IgM أحادي النسيلة ذي الاعتداد المجهول (MGUS) وفي الـ MM (الجدول 1). وقد أظهرت نتائجنا أنه في 9 حالات WM, كانت الطفرات قليلة أو غائبة في المنطقة IµSµ&m 1.6kb صعداً من (أعلى مجرى) التسلسلات Sµ التكررية الترادفية. وفي المقابل فإنه من أجل IgM MGUS 2, كانت الطفرات متكررة نسبياً في المنطقة ذاتها من Sµ. وفي 1MM, وهي حالة المرض بعد البدالة, كانت الطفرات المتكررة نسبياً ملحوظة أيضاً في منطقة البدالة.
الجدول 1: وجود أو غياب الطفرات في VH والمناطق البدالية.
Sµ صعداً
(أعلى المجرى) |
JH - Iµ |
طفرة مفرطة جسدية في VH |
المرض |
قليل / لا |
نعم |
نعم عادة |
(9 = n) WM |
نعم |
نعم |
نعم |
(2 = n) IgM MGUS |
نعم |
نعم |
نعم دوماً |
(1 = n) MM |
حيث JH تعني الشدفة الجينية الواصلة. |
يقوم AID, في خلايا B السوية يقوم بتحريض الطفرات في S? صعداً (أعلى المجرى) (17، 21، 22) وفي غياب الـ AID و S? المرافق صعداً (أعلى المجرى) وغير الطافر صعداً, فإنه لا يحدث حالة CSR (17). قد تكون وظيفة الـ AID منقوصة في WM CSR. وقد يفسر غياب الطفرات من S? WM نموذجي النسيلة عدم قابلية الـ WM على إنجاز الـ CSR.
علاوة على ذلك, ومع أن عدد العينات لا يزال قليلاً فإن وجود الـ S? طافر في IgM MGUSيطلق إمكانية فقد البعض على الأقل من حالات IgM MGUS للمميزات البيولوجية اللازمة للتطور نحو الـ WM. قد يكون النظير السوي لخلايا B WM مكوناً للاستجابة المناعية الطبيعية والتي تشكل الخط الأول للدفاع ضد المِمراضات الغازية, وهي الوظيفة التي قد تُطلب لنشاط متصالب كفء efficient للـ IgM وأيضاً لتجنب الانتقاء المستضدي, و/ أو للحوادث التنظيمية التي قد تؤدي بطريقة أو بأخرى للـ CSR.
الاستنتاج
تقترح نتائجنا أن WM قد تشتق من مجموعة ثانوية من خلايا B VH3 غير اعتيادية والتي تخضع في الحالة السوية لطفرة مفرطة في غياب الانتقاء المستضدي, وهي تتجاوز المركز الانتاشي, وهي مبرمجة للاحتفاظ بـ S? الانتاشي, ولذلك فهي تؤمن IgM بشكل مستديم عن طريق اجتناب CSR.
|
| المراجع Reference |
1-Sahota SS; Forconi F; Ottensmeier CH. et al.
Typical Waldenstrons mac¬roglobulinemia is derived from a B-cell arrested after cessation of somat¬ic mutation but prior to isotype switch events.
Blood; 100: 1505-1507, 2002.
2-Sahota SS; Forconi F; Ottensmeier CH. et al.
Origins of the malignant clone in typical Waldenstroms macro-globulinemia.
Sernin Oncol; 30: 136-141, 2003.
3-Kriangkum J; Taylor BJ; Treon SP. et al.
Clonotypic IgM V/D/J sequencc analysis in Waldenstrom macro-globulinemia suggests an unusual B-cell origin and an expansion of polyclonal B cells its peripheral blood.
Blood; 104: 2134-2142; 2004.
4-Kriangkum J; Taylor BJ; Mant MJ. et al.
The malignant clone in Waldenstroms macroglobulinemia.
Semin Oncol; 30: 132-135; 2003.
5-Szczepek AJ; Bergsagel PL; Axelsson L. et al.
CD34+ cells in the blood of patients with multiple myeloma express CDI9 and IgH mRNA and have patient-specific IgH VDJ rearrangements.
Blood; 89: 1824-1833, 1997.
6-Szczepek AJ; Seeberger K; Wizniak J, et al.
A high frequency of circulat¬ing B cells share clonotypic IgH VDJ rearrangements with autologous bone marrow plasma cells in multiple myeloma, as measured by single cell and in situ RT-PCR.
Blood; 92: 2844-2855, 1998.
7-Jensen CS; Poppema S; Mant MJ. et al.
Transition in CD45 isoform expression during differentiation of normal and abnormal B cells.
int Immunol; 1: 229-236, 1989.
8-McElhaney JE; Pinkoski MJ. and Meneilly CS.
Changes in CD45 isoform expression after influenza vaccination.
Mech Ageicy Dev; 69: 79-91, 1993.
9-McElhaney JE; Pinkoski MJ. and Meneilly GS.
Changes in CD45 isoform expression vary according to the duration of T-cell memory after vaccina¬tion.
Clin Diagn Lab Immunol; 2: 73-81. 1995.
10-Jensen GS; Mant MJ; Belch AR. et al.
Selective expression of CD45 iso-forms defines CALLA+ monoclonal B lineage cells in peripheral blood from myeloma patients as late stage B cells.
Blood; 78: 711-719, 1991.
11-Jensen CS; Andrews EJ; Mant MJ. et al.
Transitions in CD45 isoform expression indicate continuous differentiation of a monoclonal CD5+CD1 lb+ B lineage in Waldenstrom`s macroglobulinemia.
Am J Hematol; 37: 20-30, 1991.
12-Begum NA; Kinoshita K; Kakazu N. et al.
Uracil DNA glycosylase activ¬try is dispensable for immutsoglobulin class switch.
Science; 305: 1160-1163, 2004.
13-Imai K; Slupphaug C; Lee WI. et al.
Human uracil-DNA glycosylase deficiency associated with profoundly impaired immunog1obulin class-switch recombination.
Nat Immunol; 4: 1023-1028, 2003.
14-Lee CG; Kondo S. and Honjo T.
Frequent but biased class switch recombina¬tion in the S mu flanking regions.
Curr Biol; 8: 227-230, 2003.
15-Revy P; Muto T; Levy Y. et al.
Activation- induced cytidine deaminase (AID) deficiency causes the autosomal recessive form of the hyper-IgM syndrome (HIGM2).
Cell; 102: 565-575, 2000.
16-Muramatsu M; Kinoshita K; Fagarasan F. et al.
Class switch reconsbina¬tion and hypermuation require activation-induced cytidine deaminase (AID), a potential RNA editing enzyme.
Cell, 102: 553-563, 2000.
17-Nagaoka H; Muramatsu M; Yamamura N. et al.
Activation-induced deaminase (AID)-directed hypermutation in the immunoglobulin Smu region: implication of AID involvement in a common step of class switch recombination and somatic hypermutation.
J Exp Med; 195: 529-534, 2002.
18-Okazaki I; Yoshikawa K; Kinoshita K. et al.
Activation-induced cytidine deaminase links class switch recombination and somatic hypermutation.
Ann N Y Acad Sci; 987: 1-8, 2003.
19-Ta Vi Nagaoka H; Catalan N. et al.
AID mutant analyses indicate reqtsirement for class-switch-specific cofactors.
Nat Immunol; 4: 843-848, 2003.
20-Shinkura R; Ito S; Begum NA. et al.
Separate domains of AID are required for somatic hypermutation and class-switch recombitsation.
Nat Immunol; 5: 707-712, 2004.
21-Dudley DD; Manis JP; Zarrin AA. et al.
Internal IgH class switch region deletions are position-independent and enhanced by AID expression.
Proc NatlAcad Sd USA; 99: 9984-9989, 2002.
22-Khamslichi AA; Claudet F; Oruc Z. et al.
Immunoglobulin class-switch recombination in mice devoid of any S mu tandem repeat.
Blood; 103: 3828-3836, 2004.
|
| |
| المجلد 3 , العدد 10 , ذي الحجة 1426 - كانون الثاني (يناير) 2006 |
|
|
|
