| الملخص Abstract |
| دخل مصطلح المعالجة الجينية gene therapy في قاموس المفردات الشائعة الاستخدام بين الباحثين في المجال الطبي قبل أن تقدم البراهين على مدى نجاعتها إلاّ في بعض الحالات الفردية وبشكل عابر (22). إلا أن وفرة المعلومات حول هذه الفكرة توحي بالعديد من الإمكانات النظرية لتطبيقها، مع الأخذ بالحسبان تعدد الاختطارات الناتجة عن التداخل في عملية التعبير الجينيgene expression، الأمر الذي يبدو في الواقع أكثر تعقيداً مما يمكن تصوره.
|
| تنظيم التعبير الجيني Regulation of gene expression
|
إن تبسيط آلية تخليق البروتين Protein بالقول أنها مجرد عملية نسخ transcription الدنا DNA إلى رنا مرسال mRNA وترجمة translation هذا الأخير في سوية الريباسات ribosomes إلى بروتينات؛ يختصر الكثير من التفاصيل الأساسية والمعقدة، كما أنه يهمل ذكر توسـط آليـات
تنظيمية مختلفة (الشكل1 ).
تضم كلّ خلية من خلايا العضوية الجينات نفسها، لكن في خلايا معينة فقط، تعبر بعض الجينات عن نفسها، وبمعنى آخر تكون مسؤولةً عن تخليق بروتينات نوعية خاصة بهذه الخلايا.
توجد عناصر تنظيم النسخ بالقرب من منطقة الترميز coding region في الدنا إذ يمكن أن تصادف في جهة النسخ صُعداً upstream أو نزلاً downstream. فعنصر التنظيم (وهو جزء من الجين) المتوضع بجانب موقع نسخ منطقة الترميز صُعداً هو إشارة البدء ويسمى المُحَضِّض promoter وعلى مسافة منه، حيث يكون الدنا خطياً، نجد منظِمات ذاتية autonomic قد تكون المِعْزاز enhancer الذي يفعل المُحَضِّض أو العامل المُسْكِت silencer الذي يكبحه.
تنظم فاعلية هذه العناصر بوساطة بروتينات خاصة تعرف بعوامل النسخ TF (Transcription factors) والتي تتمتع
ببنية مميزة، إذ أن لها هيئة الإصبع الذي يتشكل نتيجة ارتباط ذرة زنك Zinc مع أربعة أحماض أمينية (سستئين و/أو هستدين) مما يمنح سلسلة عديد الببتيد polypeptideمظهر الإصبع الذي يسمح لها بأن تندس ضمن الأثلام التي تشكلها البنية الحلزونية المضاعفة للدنا. كما تضم هذه السلسلة جسور لوسين-لوسين منزلقة leucine zipper فهي ارتباطات متغيرة الموضع تنجم عن تتالٍ مكون من خمسة وثلاثين حمضاً أمينياً، يحوي حمض لوسين واحد في كل سبعة أحماض فيها، فتتيح هذه البنية للبروتين أن ينحني مشكلاً مثنويات dimers متوافقة مع الدنا.
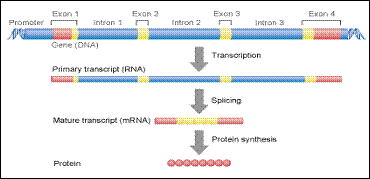
الشكل 1: عملية تخليق البروتين بدءاً من الدنا.
يضم معقد النسخ صُعداً (بدء النسخ) عدة بروتينات، حيث يتكون من:
عامل النسخ TFIID (Transcription Factor II D) الذي يتثبت على المُحَضِّض في سوية المتوالية TATA الغنية بنكليوتيدات الثايمين والأدينين thymine and adenine nucleotides بتوسط البروتين الرابط للمتوالية TATA (TATA Bonding Protein) ويعرف اختصاراً TBP، ومن عامل النسخ TFIIB (Transcription Factor II B) المرتبط مع إنزيم RNA polymerase النشط. وإن القالب الشكلي للكروماتين chromatin يعدل من فاعلية العوامل الناسخة من خلال التآثر بين البروتينات القاعدية (الهستونات histones) والدنا؛ كما أن درجة مَثْيَلة methylation الدنا والتغيرات في الهستونات من خلال الأستلة acetylation تشارك في ذلك أيضاً. إن إحدى أهم آليات تنظيم ما بعد النسخ Post-transcriptional regulation هي عملية التضفير splicing التي تتضمن حذف الإنترونات introns غير المرمزة من الرنا المنتسخ وحفظ إكسونات exons الترميز (الشكل 2).
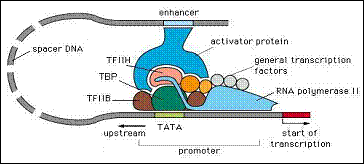
الشكل 2: معقد بدء النسخ.
|
تتم هذه العملية ضمن نواة الخلية وبالتالي يمكن للرنا المُنتسخ انطلاقاً من الجين نفسه، بحسب وظيفة الخلايا، أن يخضع لعمليات تضفير مختلفة تنتج رنا مرسالاً مختلفاً مما يقود بالنتيجة إلى تخليق بروتين مختلف. فانطلاقاً من الجين نفسه، يمكن أن يُخلَّق الكالسيتونين Calcitonin في الغدة الدرقية thyroid gland، والبروتين المتعلق بجين الكالسيتونين CGRP (Calcitonin Gene Related Protein) في العصبونات neurones، فآلية التنظيم كيفية qualitative.
يهاجر الرنا المرسال المتشكل إلى هيولى cytoplasm الخلية مجتازاً ثقوب الغشاء النووي بآلية النقل الفعال المعتمد على الطاقة؛ ثم يترجم إلى بروتينات. فعندما يكون ثابتاً، يمكن أن يكون هو ذاته، ولعدة مرات، المادة الأولية في تخليق البروتين أي أن ينتج عدة جزيئات من البروتين الموافق نفسه وهنا تكون آلية التنظيم كمّية quantitative. وحتى الآن ما تزال الآلية mechanism التي تضمن ثبات الرنا واستقراره مجهولة.
إن هدف هذه التَذكرة الموجزة لطريقة تخليق البروتينات، هو إظهار مدى تعقيد تلك العملية، والوصول إلى نتيجتين متناقضتين قليلاً: الأولى أن لا نهاية لإمكانيّات التعديل الجيني. والثانية صعوبة الوصول إلى تأثيرات خاصة مكيفة عمداً لتصحيح الاضطرابات المطلوب معالجتها دون إحداث تأثيرات مكروهة.
|
| مبادئ المعالجة الجينية Gene therapy principles
|
نعرف، منذ سنوات عديدة، أدوية قادرة على تبديل فاعلية الجينات لكنها لا تصنف كمعالجات جينية، فالهرمونات الجنسية sexual hormones والدرقية والأنسولين والعديد من الفيتامينات كالفيتامين A تبدل من النسخ الجيني، كما أن بعض المركبات كالفينوباربيتال Phenobarbital تحفز نسخ الجينات وتخليق العديد من الإنزيمات.
أما المعالجة الجينية فهي بمعناها الضيق، تبديل جين معطوب (متوالية sequence معينة من الدنا) بجين آخر سوي يرَمّز بروتينات وظيفية تعوض نظيراتها الناقصة أو المعطوبة. فالفكرة تتمحور أساساً حول إيتاء جين إلى نواة الخلية بحيث يكون مصدراً لتخليق بروتين علاجي therapeutic protein، وجوده مرغوب في حالات مرضية خاصة. أما بمعناها الواسع، فالمعالجة الجينية هي إيتاء مادة جينية genetic material إلى الخلية؛ قد تكون جيناً أو قطعة من جين، دنا أو رنا أو توليفة نكليوتيدية كوسيلة معالجة. وتندرج تحت التسمية ذاتها تقانة تحييد neutralization متوالية معينة من الدنا أو الرنا المرسال بإدخال دناوات مكملة complementary DNAs أو رناوات مضادة الدلالة anti-sense RNAs تشكل معقدات عصيةً على الترجمة.
يمكن أن نستخلص طريقتين للعلاج الجيني؛ في المختبر in vitro وفي الأحياءin vivo، ففي الطريقة الأولى، في المختبر in vitro، يتم قبط الخلايا المستهدفة من نسيج من جسم المريض وتنقل إلى أوساط مغذية، وبعد إيتاء المادة الجينية المختارة، تعاد من جديد إلى عضوية المريض (الشكل 3). وقد كانت أولى استخدامات هذه التقانة في إيتاء جين الترميز لإنزيم ADA (Adenosine desaminase) في الكريات البيض اللمفاوية lymphocytes، أو ضمن أروماتها في نقي العظم لـدى مريض يعاني من عوز هذا الإنزيم.
أما في طريقـة في الأحـياء in vivo، فإن
إيتاء المادة الجينية يتم بالحقن الوريدي أو الموضعي أو باستعمال الضبوبات aerosols كي تضمن وصولها إلى الخلية المستهدفة. ومن الجدير بالذكر أن العديد من المحضرات النكليوتيدية أثبتت فاعليتها عند إعطائها فموياً.
|
| إيتاء المادة الجينية Delivering genetic material
|
أياً كانت طبيعة المادة الجينية المراد إدخالها إلى الخلية، فإن آليات النقل هي ذاتها، نظراً لأن الأغشية الخلوية ذات طبيعة شحمية فهي بالتالي غير نفوذة للجزيئات القطبية كالدنا أو الرنا، فكان لزاماً توسط نواقل vectors بغية إيتائها إلى الخلية. طُوِرت أنماط مختلفة من النواقل، لكلٍ منها خصوصية مميزة، لأن فوائدها ومحدودية قدرتها ترتبط أساساً بالنموذج السريري. نميز بصورة رئيسية نواقل فيروسية vectors viral وجسيمات قوامها بلمرات من طبائع عدة ونواقل أخرى تعتمد الطرق الفيزيائية، يوضح الجدول 1 ميزاتها. |
| النواقل الفيروسية Viral vectors |
تعد الفيروسات، بصورة طبيعية، وسائل ممتازة لإيصال المادة الجينية إلى الخلية. وبغض النظر عن النمط الفيروسي المستخدم، فإن الخلية الهدف تُعـدى بالفيروس الحامـل
للمادة الجينية، مع التأكيد على أنـه كناقـل،
ينبغي أن يكون غير ممرض وعديم القدرة على التضاعف replication ضمن الخلية. كما ينبغي أن لا يولّد في العضوية مناعةً ضده لأن هذا سيسبب الكثير من المصاعب في حال تكرار عملية الإعطاء.
لفيروسات التقليدية الأكثر استخداماً في تطبيقات المعالجة الجينية هي الفيروسات القهقرية Retroviruses والفيروسات الغدية Adenoviruses وفيروسات أخرى يوضح الجدول 2 مقارنةً بينها [10].
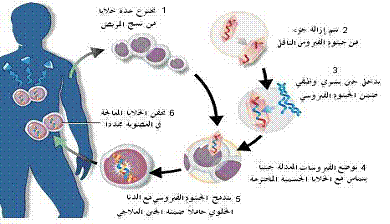
الشكل 3: مراحل المعالجة الجينية خارج الأحياء En vivo.
الجدول 1: سرد لأهم النواقل المستعملة في المعالجة الجينية.
Length of insert sequence |
Type of transduction |
Stable integration |
Vector |
< 35 Kb |
Division + quiescent |
No |
Adenoviruses |
5 to 7 Kb |
In division only |
Yes |
Retroviruses |
5 to 7 Kb |
Division + quiescent |
Yes |
Lentiviruses |
Unlimited |
Division + quiescent |
No |
Naked DNA |
Unlimited |
Division + quiescent |
No |
Polycationic Lipids |
الجدول 2: مقارنة بين الفيروسات الأكثر استخداماً في تطبيقات المعالجة الجينية.
(الكيلو أساس kb: واحدة التعبير عن طول متوالية النيكليوتيدية)
Adeno
associated virus |
Retrovirus |
Adeno
virus |
HSV |
Parvovirus |
virus Family |
DNA |
RNA |
DNA |
DNA |
DNA |
Viral genome |
+ |
- |
+ |
+ |
+ |
transduction in quiescence |
Yes |
Yes |
No |
No |
No |
Integration in cell genome |
5 kb |
8 kb |
8 kb |
30 kb |
- |
Length of
inserted sequence |
+ + |
+ + |
+ |
+ + |
+ + |
Stability |
|
| النواقل الفيروسية القهقرية Retroviral vectors |
كانت الفيروسات القهقرية أولى النواقل المستخدمة لإيتاء جين ما إلى الخلية [17]. وعلى الرغم من أن الفيروسات المنتقاة ضمن هذه العائلة غير ممرضة للإنسان، فإن التقديرات تشير إلى أن إمكان تضاعفها في العضوية ما يزال وارداً. ولحل هذه المشكلة طُورت خلايا خاصة يتم فيها تخليق فيروسات مأشوبة recombinants غير قابلةٍ للتضاعف وتعرف هذه الخلايا بخلايا الضم (الرزم) packaging cells (الشكل 4) وهي عبارة عن خلايا حقيقية النوى eukaryotes عدلت جينياً بحيث تضم في مجينها الجينات الثلاثة gag، pol، env المرمّزة لبروتينات هيكل الفيروس والتي حذفت من مجين الفيروس ذاته كي تمنعه من التضاعف ضمن العضوية محافظةً على قدرة الفيروس على نسخ مجينه المتضمن مادة المعالجة الجينية والتعبير عنها؛ فبذلك تتكفل خلية الضم (الرزم) بتخليق عدد كبير من الفيروسات المأشوبة آمنة الاستعمال عند البشر.
بعد إعطاء administration النواقل الفيروسية القهقرية المأشوبة recombinants retroviral vector، تحرر رناواتها في الخلايا المستهدفة وتحولها، بتوسط إنزيم الناسخة العكسية retrotranscriptase، إلى دنا ثنائي الطاق double stranded DNA يندمج مع مجين الخلية، فتكون هذه الأخيرة قادرةً على إنتاج البروتين المرغوب عبر التعبير عن الجين المنقول transgene والذي سيُوّرث إلى الخلايا البنات الناجمة عن انقسام الخلية المعالجة.
مما تقدم، نجد أن مشكلة المأمونية safety بإتباع هذا المنهج لم تعد مقلقة، لكن الحالات المرضية الممكن تدبيرها جينياً باستخدامه محدودة جداً، لأن الفيروسـات القهقريـة لا
تستطيع تنبيغ transduction الخلايا إلا في طور انقسامها، فهي بالنتيجة عديمة الجدوى في تنبيغ الخلايا الهامدة quiescent cells كالعصبونات أو الخلايا بطيئة الانقسام كخلايا ظهارة الرئة. كما أن خلايا الضم ليست قادرة، على الأقل حالياً، على تخليق أعداد هائلة من الفيروسات بحيث تكون كافية لإعداد تحضيرات مركزة تنبغ كماً مرموقاً من الخلايا.
إن اندماج المادة الجينية المدخلة ضمن مجين الخلية قد يفعّل في حالات نادرة التعبير عن أحد الجينات الورمية oncogenes، مما يؤدي إلى تسرطن الخلية أو أقله تعطيل التعبير عن أحد الجينات السليمة الوظيفة بالنسبة للخلية. تجرى الأبحاث حالياً حول الفيروسات البطيئة lentiviruses المنتمية إلى عائلة الفيروسات القهقرية لأنها بخلاف الأولى تمتاز بقدرتها على تنبيغ الخلايا الهامدة والمنقسمة على السواء (الشكل 5).
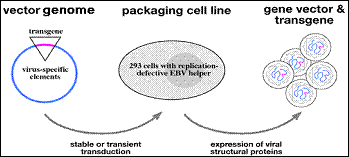
الشكل 4: آلية عمل خلايا الضم (الرزم).
|
| الفيروسات الغدية كنواقل في المعالجة الجينية Adenovirus as a vectors in gene therapy |
إن الفاعلية المحدودة للفيروسات القهقرية ومساوئها العديدة، هي التي تستبعدها، إلا في حالات خاصة، كنواقل للمادة الجينية، لذلك اتجهت الأبحاث نحو الفيروسات الغدية والتي أثبتت بالتجربة أنها تتجاوز العديد من المشكلات التي طرحتها سابقتها. فميزتها الأهم هي قدرتها على تنبيغ الخلايا الهامدة في العضوية ذاتها دون الحاجة لاختزاعها وتداولها manipulation في المختبر in vitro ثم إعادتها، فهي الخيار الأول في المعالجة الجينية لداء التليف الكيسي cystic fibrosis [6]، وعلى العكس من الفيروسات القهقرية، فإن المادة الجينية المنقولة عبرها لا تندمج مع المجين الخلوي، كما أن طول المتوالية المنقولة يمكن زيادته بحذف عدد من جينات الفيروس الأصلية مثل E1A، E1B، E2، E3، E4 وفقاً لفريق الفرنسي [25]، فهناك إذن إمكانية شـبه كليـة
لاستبدال دناها الأصلي بمتواليات علاجية. لكن وبالمقابل نجد عيوباً كبرى، منها صغر الحيز المتاح للمجين الممحفظ. وحتى الآن لا توجد سلالات من خلايا الضم (الرزم) تؤمن أعداداً وافرة من الفيروس بحيث تكفي لإعداد جرعات علاجية.
كما أن اختطار إحداث رد فعل التهابي في موضع الإعطاء أمر وارد، ففي أغلب الحالات، تسبب هذه الفيروسات استثارةً للجملة المناعية، وبصورة خاصة عند تكرار الجرعة، وهو أمر مطلوب لتحقيق نسبة تنبيغ مرتفعة في الخلايا المستهدفة وتعبيرٍ أكيدٍ عن الجين المنقول.
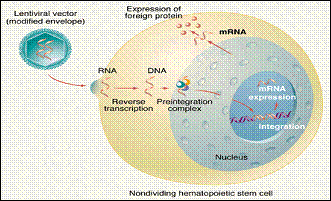
الشكل 5: النواقل الفيروسية البطيئة. |
| النواقل التخليقية Synthetic vectors |
تعتمد العديد من وسائل إيتاء الجينات على بلمرات polymers مخلّقة إيجابية الشحنة، أهم ميزاتها كونها ذوابة في الماء، إضافةً إلى مقاومتها للتدرك في السوائل الخلالية أولاً ثم ضمن هيولى الخلية المستهدفة. وهكذا مكنت هذه الطريقة من إيتاء دنا المعالجة ضمن أقفاص صغيرة الحجم تستطيع الخلايا قبطها سريعاً.
توصل من معهد كاليفورنيا للتقانة MIT إلى طريقة مثيرة للاهتمام تعتمد بلمرات بشكل جسيمات ذات حجوم نانوية من الديكسترينات الحلقية Cyclodextrine B إيجابية الشحنة المطعمة ببولي إيثيلين غليكول PEG المقترن بالأدمانتانadamantane [7]، بحيث تمكن من إيتاء مضمومة من الدنا تقاوم التلازن clumping (الاندماج مع بروتينات المصل) الذي يجعل منها كُداسات عديمة النفع، إضافةً إلى أن هذه الطريقة قد عززت من ثبات معقد الناقل التخليقي مع الدنا synthetic vector-DNA complex مع إمكان توجيهه نحو خلايا معينة عبر إدخال ربائط ligands نوعية مقترنة بالبولي إيثيلين غليكول (الشكل6).
ولعل اكتشاف عام 1965 لقدرات الجسيمات الشحمية liposomes [2]، جعل منها بعد سنوات من الأبحاث والتطوير [8]، إحدى أكثر وسائل إيتاء الدنا استعمالاً في مجال المعالجة الجينية، ومثالها الشحميات إيجابية الشحنة من نمط الفيكتين الشحمي lipofectine، إذ أن هذه الجسيمات التي يتفاوت حجمها بين 50 و 100 نانومتر، تتمكن، بواسطة غشائها ذي الطبيعة الشحمية الفسفورية phospholipids، من الانصهار في الغشاء الهيولي للخلية المستهدفة. وقد رخصت بعض البروتوكولات استخدامها في المعالجة الجينية للورم الميلانيني (الميلانوم) melanoma. بينما استخدم من جامعة يوتا جسيمات شحمية قوامها ستيريل متعدد الليزين stearyl polylisine مغلفة ببروتين شحمي خفيض الكثافة [19] في نقل جين المرَمّز لعامل النمو الوعائي الظهاري VEGF (Vascular Epithelial Growth Factor) إلى الخلايا القلبية المتضررة من الإقفار ischemia، بحيث تمكن من تحريض نمو أوعية دموية جديدة توصل الأكسجين إلى المناطق المحرومة منه في عضلة القلب.
في السياق نفسه، وجد كلٌ من من جامعة وسكينسن-ماديسون و من جامعة كورنيل [19] أن بلمرات ذوابة إيجابية الشحنة متدركة حيوياً قوامها متعدد أمينو إستر polyaminoesters تبدو أكثر فائدة من عدة نواقل غير فيروسية من حيث حسن ربطها للمادة الجينية المنقولة وسرعة دخولها الخلايا المستهدفة.
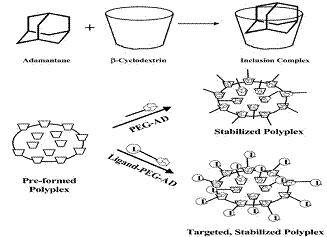
الشكل 6: بلمرات الديكسترينات الحلقية Cyclodextrine B المطعمة ببولي إيثيلين غليكول PEG المقترن بالأدمانتانadamantane |
| الطرق الميكانيكية/ الفيزيائية في الإيتاء Mechanical / Physical Delivery |
ظلّ العلماء، ولسنوات طويلة، يُسخّرون الفيروسات كنواقل أشبه بحصان طروادة، تتسلل عبرها الجينات الغريبة إلى الخلية؛ غير أن الاختطارات الكامنة في استخدام هذا النمط من النواقل، لا يمكن إهمالها. وهذا ما اتضح بالميتة المأساوية عام 1999 للمتطوع الذي أجري عليه اختبار معالجة جينية [33]؛ الأمر الذي دفع الباحثين إلى العمل على استنباط وسائل بديلة للفيروسات، فأحدثوا طرق النقل الفيزيائي "للدنا المجرد naked DNA" والذي أظهر فاعلية واضحة عند حقنه في العضوية تحت الجلد وفي النسيج العضلي [34]. وقد طور لهذا الغرض "مسدس حاقن للدنا" يعمل بضغط مرتفع من غاز الهليوم، مما سمح بتخفيض الجرعة من الدنا المحقون إلى حد أقل بكثير مما لو أعطي عبر محقن عادي.
وعلى الرغم من أن آلية دخول الدنا المجرد إلى الخلية ما تزال مجهولة، فإن فاعلية الجين المنقول كانت أعلى مما لو استخدمت نواقل غير فيروسية. اقترنت تقانة "الدنا المجرد" في المعالجة الجينية بالطرق الفيزيائية؛ كتطبيق حقل كهربي بالاستعانة بمسارٍ كهربية electrodes تتواسط عملية إيتاء الجينات عبر الجلد أو العضلات [28]. تقوم هذه الطريقة من حيث المبدأ على المسامسة الكهربيةelectroporation، حيث تعمل ذبذبات كهربية على تحفيز نفاذ جزيئات الدنا عبر الغشاء الخلوي، لكن لوحظ أن النفوذية الحاصلة عابرة وعكوسة.
طُورت طريقة مشابهة تعرف بنظام ماكس سايت MaxCyte System لتطبيقها في المختبر in vitro تعتمد المبدأ نفسه [13]، وتقوم على إيتاء الجين المنقول ضمن بلازميد plasmid (دنا حلقي) يزيد طوله على 14kb (إن الكيلو أساس kb هي واحدة التعبير عن طول متوالية نيكليوتيدية)؛ بحيث يمكن أن تعالج الخلية الواحدة بعدة جينات في المرة ذاتها، وينجم عن ذلك تخليق كل البروتينات المرمزة بالجينات المنقولة. إن إيتاء المادة الجينية بهذه التقانة يتجنب استخدام عوامل ثانوية كالفيروسات أو البلمرات التخليقية من جهة، ولا يستثير استجابة مناعية من جهة أخرى لأن قوامه هو المادة الجينية المنقولة والحقل الكهربي فقط.
|
| أنظمة إيتاء جديدة Novel Delivery Systems |
طرح المؤتمر السنوي الثالث لإيتاء الجينات، الذي عُقد في بوسطن- الولايات المتحدة في الفترة بين 11 و 13 تشرين الثاني عام 2003، تحت عنوان (النواقل غير الفيروسية & تطبيقات في الأحياء) عدة طرق في كيفية إيتاء المادة الجينية إلى الخلايا المستهدفة. لكن أبرزها من ناحية حداثة الفكرة طريقتان :
الأولى سويسرية طرحتها شركة بيرنا للتقانة الحيوية Berna Biotech Ltd، وتقوم على تسخير سلالات محددة من جراثيم داخل خلوية intracellular bacteria مثل السلمونيلا Salmonella، والشيغلة Shigella والليستيريا Listeria spp. كنواقل للمادة الجينية [9]. فطريقة العدوى بالجراثيم Bactofection، تعتمد على أن الحامل الجرثومي bacterial carrier، سيحرر الدنا البلازميدي في هيولى خلية المضيف، حيث يلج نواتها ويرمز في جزء منه البروتين العلاجي. لكن الجراثيم كنواقل، ستحرض استجابات مناعية خلوية تجاهها، كما أنها تسببت بحالات إنتانية شديدة عند بعض النماذج الحيوانية التجريبية.
أما الطريقة الثانية، فهي النقل الصبغي للجينات وفق نظام Chromos’ ACE System المعد للتداول الجيني للخلايا في المختبر in vitro. فقد أوضح أحد الباحثين في الفريق الذي عمل على هذه الطريقة في نقل الجينات، أنها وبخلاف الطرق المعتمدة على النواقل الفيروسية، تمتاز بكونها تؤتي المادة الجينية إلى نواة الخلية الهدف وتحقق تعبيراً طويل الأمد، وبسوية ثابتة يمكن التنبؤ بها ومراقبتها، عن البروتينات المرمّزة من الجين أو الجينات المنقولة على الصبغي [24]. لكن اتضح أن السوية العالية في التعبير عن الجينات المحمولة وفق هذا النظام، تنخفض بعد فترة، سواء في المختبر in vitro، أو في الأحياء in vivo، بدراسة عزل ACEs بمقياس الجريان الخلوي flow cytometry إثر إيتاء هذه الجينات إلى الخلايا الجذعية المساريقية البشرية human mesenchymal stem cells.
|
| آليات المعالجة الجينية Gene therapy mechanisms |
تعد المعالجة الجينية طريقة تحمل الكثير من الأمل، عبر إيتاء جينات سليمة إلى الخلايا المريضة. وعلى الرغم من أن الجين المدخل لا يتوضع تماماً مكان نظيره الأصلي المعطوب أو الغائب؛ إلا أنه قابل لأن يعبّر عن ذاته بأن ينتسخ ويترجم معطياً البروتين المعوز أو على الأقل بروتيناً جديداً يتمتع بفعالية علاجية. وبنتيجة ما تقدم، نجد أن ضمان الإيتاء السليم للجين إلى الخلية المريضة ليس كافياً وحده، بل لابد من تأكيد أن هذا الجين سينتسخ ويترجم إلى البروتين الموافق دون أن يتداخل في آلية تعبير الجينات الأخرى عن ذاتها من جهة، وأن تكون كمية البروتين الناتج كافية ليست مفرطة ولا قليلة من جهة أخرى.
يمكن أن يطبق نقل الجينات على الخلايا الجسدية somatic cells أو الخلايا المنتشة germinal cells على السواء، لكن ولأسباب أخلاقية ethic، نجد أن إجراء تحويرات وراثية على الخلايا المنتشة للبشر أمر غير مرخص قانونياً، وما يزال إلى اليوم موضع جدل بين الباحثين والمشرعين. ففي هذا الإطار يمكن أن نحصر تطبيق المعالجة الجينية في آليتين رئيستين:
1. تعويض عوز جيني Gene deficiency compensation
في عديد من الأمراض التي نعرف منذ سنوات، أن سببها عيب جيني؛ قد لا تكون المعالجة بالعقاقير وحدها كافيةً، بل قد تكون غير مجديةٍ على الإطلاق. ففي الأمراض الوراثية الناجمة عن طفرة mutation ما في جين معين، تنحصر إمكانات المعالجة بالعقاقير، في تخفيف الأعراض المتأتية عن غياب البروتين الوظيفي المرمَز بالجين الطافر. بينما تحمل طريقة المعالجة الجينية الأمل في إيجاد حل جذري للمرض، بإيتاء نسخة سوية من الجين ذاته إلى الخلايا المريضة، فتكون النتيجة تخليق البروتين المعوز وزوال الأعراض. ومن الجدير بالذكر أن عوز إنزيم ADA (Adenosine desaminase) كان أول حالة مرضية رخصت مداواتها عالمياً عبر نقل جينات علاجية، وكان الباحث الأمريكي أول من نال هذا الترخيص عام 1989 في الولايات المتحدة [11].
يؤدي عطب الجين المرمز لإنزيم ADA إلى عوز مناعي وخيم يقود سريعاً إلى الوفاة بمجرد التعرض لأوهن العضيات الدقيقة الممرضة microorganisms pathogens. ويعزى السبب إلى تراكم مستقلبات metabolites سامة في الكريات البيض اللمفاوية lymphocytes، في مجرى الدم، تؤدي إلى قتلها وبالتالي تراجع الدفاعات المناعية. وفقاً لطريقة في المختبر in vitro، تم قبط لمفاويات من الدم وجرى تداولها جينياً بإيتاء جين ADA بتوسط الفيروسات القهقرية كنواقل ثم حقنت مجدداً فلوحظ تحسن ملموس في الحالة السريرية. لكن المشكلة التي ظهرت هي أن فترة التحسن تقترن بعمر اللمفاويات المعدلة جينياً؛ فالنكس المناعي سيتجدد بموت اللمفاويات المعالجة، لذلك لجأت دراسات متواقتة جرت عام 1993 في فرنسا والولايات المتحدة والمملكة المتحدة إلى قبط الخلايا الأرومية للمفاويات من نقي العظم وتعديلها ثم إعادتها إلى عضوية المريض بحيث تعطي بانقسامها لاحقاً لمفاويات سوية تحمل الجين ADA وتحقق إنتاجاً منتظماً للإنزيم طيلة فترة حياتها. لكن وعلى الرغم من ذلك، فإن النتائج الأولية لم تكن مشجعة.
في مجال أمراض عوز المناعة، حققت المعالجة الجينية فاعلية ملحوظة في تدبير بعض الحالات من عوز المناعة المركب الوخيم Severe Combined Immune Deficiency والمعروف اختصاراً X-SCID، لارتباطه بالصبغي X في %50 من مجموع الحالات المشاهدة، فهو لا يصيب بالنتيجة إلا الأطفال الذكور، فيعطل عندهم المناعة الخلوية، مما يستوجب وضع الطفل المصاب منذ ولادته في حجيرة عقيمة، ومن هنا جاءت تسمية داء ”الصبي الفقاعة“ “bubble boy” disease الذي يتواتر بمعدل ولادة واحدة من كل مئتي ألف عالمياً ويسجل سنوياً في فرنسا خمس حالات.
ينجم المرض عن مجموعة من الشذوذات الجينية تسبب خللاً وظيفياً عظيماً في الجهاز المناعي، عبر عطب الجين IL2RG على الموضع الصبغي Xq13 المرمز للسلسلة البروتينية غاما المشتركة c? في مستقبلات receptors الانترلوكين IL2، الأمر الذي يؤدي إلى الغياب الكامل للمفاويات T والخلايا القاتلة الطبيعية Natural Killer cells. وحتى مطلع العام 2000 كان زرع نقي العظم المعالجة الوحيدة للداء، الأمر الذي يقتضي وجود متبرع ملائم، ولم تتجاوز نسبة تحقق ذلك %20. وبالمقابل، بدأ التوجه نحو المعالجة الجينية على يد في فرنسا عام 1993 والذي أعلن أولى نجاحاته في نيسان عام 2000 باعتماد تقانة التداول في المختبر in vitro للخلايا المختزعة من نقي العظام بالفيروسات القهقرية الحاملة لنسخة وظيفية من الجين المعطوب ثم إعادة حقنها في مجرى الدم. وقد تحقق شفاء تام لحالتين سريريتين. لكن في تشرين الأول عام 2002، أعلن الفريق الباحث ذاته عن إصابة بابيضاض الدم leukemia في واحدة من الحالات العشر المعالجة ثم عن إصابة ثانية عام 2003. وإثر الإعلان الأول، أوقف فريق أمريكي اعتمد تقانة مماثلة جميع تجاربه السريرية. ولعل السبب هو أن الناقل الفيروسي القهقري غرز جين
المعالجة بالقرب من مُحَضِّض الجين الورمي البدئي LMO2، الأمر الذي أدى إلى تكاثر غير مضبوط لنسيلة clone من اللمفاويات T الناضجة [15]. وفي ظل هذه القناعة، صرح ، من قسم أبحاث المعالجة الجينية في جامعة غرونيجين، بأن الفيروسات القهقرية تبدو الخيار المنطقي للسهولة النسبية في عدوائها خلايا نقي العظم لكن يمكن أن يستعاض عنها بنواقل فيروسية أخرى كالفيروسات البطيئة أو الغدية أو بنواقل تخليقية تؤدي الغرض نفسه.
2. تحييد جين شاذ Neutralization of abnormal gene
في منحى آخر، يمكن أن يستهدف التداول الجيني للخلايا، في بعض الحالات المرضية الخاصة، الجين المعطوب ذاته والذي يرمز بروتيناً ذا فعل إمراضي، بأن يمنع التعبير عن هذا الجين. أي أن يتناول التصحيح الدنا مباشرةً في الخلايا المستهدفة. ولعل أولى الطرق التي اختطت هذا النهج، هي الطرق التي استعملت سلاسل نكليوتيدية قصيرة oligonucleotides، حيث تعتمد مبدأ تشكيل حلزوني ثلاثي triple helix[35]. تقوم استراتيجية الحلزون الثلاثي على أن السلسلة القصيرة وحيدة الطاق single stranded تشكل حلزوناً ثلاثياً مع متواليات من الدنا (ثنائي الطاق) حيث تتثبت انتقائياً ضمن ثلم الحلزون المضاعف للدنا على المتواليات المستهدفة، والتي إما أن تكون قليلة البورين oligopurine أو قليلة البيريميدين oligopirimidine.
طُورت تقانة الحلزون الثلاثي بهدف اختبار فعل مضاد للدلالةanti-sense effect، لأن تشكيل الحلزون الثلاثي triplex-forming يصاحب غالباً بتثبيط نسخ الجين المستهدف لأن السلاسل القصيرة المنحشرة ضمن الدنا، يمكنها أن تولد فيه طفرات فوق صبغية extra-chromatic mutations [32] نتيجة تباطؤ النسخ الذي يفعل جمل تصحيح خلوية.
أوضح أن السلاسل الخيمرية chimeric، يمكن أن تطال الدنا الصبغي chromosomic DNA بحيث تشكل معه حلزوناً ثلاثياً [14]. وهذا يفتح الباب أمام إمكان توجيه طبيعة الطفرة الحاصلة نتيجة تشكل الحلزون الثلاثي، إلا أن تطبيقات هذه الطريقة ما تزال محدودة جداً وتنحصر في عزل الجينات [21].
في السياق ذاته، صرح فريق بأن نقل سلاسل خيمرية هجينة رنا / دنا مكملة لشدفات من جين الترميز للغلوبين ?، يسمح بتصحيح %20 من الخلايا متماثلة الزيجوت homozygotes بالنسبة للطفرة ?s في مرض فقر الدم المنجلي sickle cells anemia [5]. إن إنتاج مثل هذه السلاسل الخيمرية، كان نتيجة دراسات في فيلاديلفيا عام 1996، والتي بينت أن وجود الرنا في قلب السلاسل النكليوتيدية، يحفز عملية الازدواج التكاملي [18]. وبالمقابل فإن السلاسل اللا خيمريةnon-chimeric الحاوية دنا فقط، لا تحقق فعلاً تصحيحياً. وتعتمد آلية التصحيح أساساً على إجراء تبادل بين نكليوتيدات السلسلة الخيمرية ونكليوتيدات الدنا الخلوي [4].
ومن طرق تحييد التعبير عن جين معطوب، يمكن اللجوء إلى قَطع متوالية الدنا في سويته؛ ففي نيسان عام 2005 نشرت صحيفة أخبار دَلاس الصباحية The Dallas Morning News journal مقالاً حول أحدث طريقة علاجية لداء X-SCID جاءت ثمرة أبحاث فريق جامعة تكساس- المركز الطبي الجنوبي الغربي في دَلاس بالتعاون مع علماء من شركة Sangamo BioSciences في ريتشموند-كاليفورنيا. حيث صنّع الفريق بروتيناً أسموه نكلياز أصبع الزنك zinc-finger nuclease [1]، مهمته قطع الجين IL2RG الطافر مما يلغي انتساخه والتعبير عنه في خلايا نقي العظم التي ستعالج في مرحلة لاحقة بنسخة سوية من الجين نفسه ثم تعاد إلى عضوية المريض. وقد حققت هذه التقانة الحديثة تصحيحاً كلياً للجين الطافر في %7 من الخلايا التي تم تداولها. ووفقاً للفريق الباحث، فإن البروتين التخليقي، صمم خصيصاً ليساعد الفيروس الناقل في غرز الجين العلاجي في موضعه الصحيح على الصبغي. لكن وبالمقابل، فإن عملية قطع عشوائية لجين آخر، ستخلق مشاكل جديدة. لذا كان من الأسلم التعامل مع الرنا المرسال الناجم عن نسخ الجين المعطوب وليس مع الجين ذاته. وفي هذا الإطار، يمكن أن نذكر استراتيجية معالجة جينية لتدبي
ر داء كولي Cooley's disease، الشائع باسم الثلاسيمية ?، حيث يفترض نظرياً أن تخفيض معدل ترجمة رنا المرسال لجين السلسلة ألفا من الغلوبين globin، بنسبة %20 على الأقل، من خلال تدركه degradation باستخدام سلسلة نكليوتيدية مضادة الدلالة يؤدي إلى تحسن ملموس في الحالة السريرية [30]. تقتضي هذه الاستراتيجية وجود إنزيم نكلياز H nuclease القادرة على تقطيع المعقد الهجين رنا مرسال/ سلسلة نكليوتيدية. وقد أوضحت دراسة أولية، أن هذه التقانة واردة التطبيق في الخلايا التي يتم تداولها في المختبر in vitro. وبالمقابل، كي تكون فاعلة في الأحياء in vivo لابد من توافر دائم للسلاسل النكليوتيدية مضادة الدلالة [41].
|
| تطبيقات المعالجة الجينية Applications of gene therapy |
|
كان تدبير حالات العوز الجيني أول هدف لطريقة المعالجة الجينية؛ الأمر الذي طرح بحق مشكلات عدة، بعضها عصي على الحل، إذ ينجم المرض الوراثي غالباً عن عطب عدة جينات وليس عن جين واحد معزول. كما أن آليات التنظيم ليست معروفة بوضوح في كل الحالات. من هذا المنطلق، لوحظ أن المعالجة الجينية للسرطان، ربما تكون أكثر يسراً من تدبير عوز جيني وراثي. ونظراً للكم الهائل من المعارف حول الفيزيولوجيا الإمراضية، الخلوية والجزيئية، للعديد من السرطانات، يمكن القول اليوم، أن حوالي %70 من بروتوكولات المعالجة الجينية تعنى بعلاج السرطان. وبما أن الشفاء الكامل أمر بعيد الاحتمال فإن أهداف الاستراتيجيات الموضوعة بمعظمها، هي تثبيط التضاعف الشاذ للخلايا.
|
| استراتيجية الجين الانتحاري Suicide gene strategy |
|
ترتبط فعالية المعالجة الكيميائية chemotherapy المضادة للأورام بحساسية الخلايا الخبيثة ومقاومة الخلايا السليمة للعقاقير ذاتها؛ من هنا قامت المعالجة الجينية للأورام على تبديل الطبيعة الجينية للخلايا الورمية بحيث يتاح لها تخليق إنزيمات تتواسط تفعيل activation سلائف عقاقير prodrugs تدمر الخلايا الورمية دون الإضرار بمجاوراتها السليمة. تهدف استراتيجية الجين الانتحاري، تطبيقاً للفكرة السابقة، إلى تدمير الخلية السرطانية عبر إيتاء جين يرمز إنزيم thymidine Kinase العائدة إلى فيروسات الحلأ Herpes viruses، والمعروفة اختصاراً TK، إلى الخلايا الورمية؛ وبالنتيجة تعّبر هذه الخلايا عن الجين منتجةً الإنزيم الموافقة التي تفسفِر في مرحلةٍ تالية عقار(Zovirax®) Gancyclovir، المضاد الفيروسي antiviral drug، الذي يعمل على تدمير كل خلية عبّرت عن الجين المنقول عبر تثبيط إنزيم DNA polymerase فيها [30]. وقد بينت بعض الدراسات، أن للعقار فعالية على الخلايا سلبية الإنزيم المجاورة للخلايا التي تم تداولها بإيتاء جين TK. والنظرية الأكثر احتمالاً، هي أن جزيئات العقار، وبعد أن تمت فسفرتها في الخلايا الورمية إيجابية TK، انتقلت إلى مجاوراتها عبر وصلات خلوية jonctions فعرفت بفعل bystander effect. وبالمقابل، جربت التقانة ذاتها على مرضى يعانون من أورام دبقية glioma (أورام تتطور ضمن الأجواف) وآخرين يعانون من سرطانة الموثة prostate، لكن النتائج أظهرت أن المعالجة الجينية لم تحمل أية ميزة على المعالجات الأخرى بالنسبة لهؤلاء المرضى [27].
|
| تثبيط التكون الوعائي في الورم Inhibition of angiogenesis in tumor |
تبين الأعمال الأولى للباحث ، أن تكون الأوعية الدموية أمر أساسي لنمو الأورام [12]. وتحمل المعالجة المضادة لتكون الأوعيةantiangiogenic therapy عدداً من الحسنات؛ فهي تمنع نمو الورم دون آثار جانبية سامة كتلك التي للمعالجات التقليدية (الكيميائية والإشعاعية)، إن منع تشكل أوعية دموية يؤدي، نظرياً، إلى ظاهرة الاستموات (موت الخلية المبرمج) apoptosis في الخلايا الخبيثة وظهور بؤر متنخرة. وبالنتيجة، فإن الكتلة الورمية ستكون أصغر مما يسهل على الجملة المناعية تصفيتها [3]. ومن جهة ثانية، إن احتمال تسرب الخلايا الخبيثة إلى الدوران يغدو ضئيلاً مما يخفض من اختطار حدوث نقائل metastasis. ويمكن أن نذكر عدداً من المناهج التي اعتمدت هذه النظرية في المعالجة الجينية للأورام : أولها، الاستعانة بمثبطات تكون الأوعية inhibitors of vascularization مثل الأنجيوستاتين Angiostatine والإندوستاتين Endostatine والثرمبوسبوندين thrombospondine عبر إيتاء الجينات المرمزة لها: إما موضعياً في موقع الورم أو جهازياً، نظراً لسميتها الضعيفة ولأن الخلايا الظهارية للأوعية سهلة المنال بالنسبة لجين المعالجة. أما المنهج الثاني، فاعتمد مبدأ تحييد
مفعلات activators تكون الأوعية عبر إيتاء مستقبلات عامل النمو الوعائي الظهاري VEGF في المحيط الورمي. إن إيتاء الجين المرمز للمستقبل الذواب للعامل VEGF في الأحياء in vivo يتيح قبطه قبل ارتباطه مع مستقبلاته الطبيعية على سطوح الخلايا الظهارية مانعاً بذلك تفعيلها. فأمكن من خلال إيتاء جين المستقبل الذواب sTie2 بتوسط فيروس غدي؛ تثبيط النمو الورمي ومنع حدوث نقائل عند الفأر [20]. إلا أنه من الجدير بالذكر أن الخلايا الظهارية الوعائية تتفعل بعوامل نمو أخرى مما قد يحد من فاعلية هذه الطريقة.
|
| طرق أخرى Others approaches |
يمكن أن نحصي عدداً من الطرق العلاجية لتدبير السرطان القائمة على المعالجة المناعية الجينية gene immunotherapy. فبالاعتماد على أن المستضدات antigens الورمية كفيلة بإحداث رد فعل مناعي يتوسط حذف الخلايا الخبيثة؛ بزغت طريقة تقوم على زيادة القدرة المستضدية للخلايا الورمية بحيث تستثير استجابة مناعية أقوى تسرع تصفيتها. وقد أثبتت الدراسات على نماذج من الأورام المخلقة عند الفئران شقية النسل، استجابة واضحة للكتلة الورمية، وبصورة خاصة الورم الميلانيني وسرطانة الكلية، عند إيتاء جين يرمز سيتوكينات cytokines مثل الانترفرون ألفاINF-? أو الإنترلوكين IL2 أو الجين المرمز للجزيئة B7.1 المتآثرة مع المستقبل CD28 المتوضع على سطوح اللمفاويات T [26].
من المشكلات التي تواجهها المعالجة الجينية للأورام؛ استهداف الخلايا الورمية في العضوية، وبصورة عالية النوعية. استنبط عدد من استراتيجيات التوجيه المعتمدة على الخصائص الفيزيولوجية للأورام الصلبة وبيئتها الجزيئية وخاصةً مناطق النخر necrosis ونقص التأكسج hypoxia [16]، ذات تواتر المشاهدة المرتفع. الأمر الذي أوحى بفكرة قلب النمط الظاهري phenotype للخلايا الورمية عبر إيتاء الجين الكابح للورم p53 المتوضع على الذراع القصير للصبغي الأول. إذ يتداخل الجين p53 في التعبير عن جينات عديدة في الخلية، فهو يحفز انتساخ الجين p21 المرمز للبروتين p21 الذي يثبط عدداً من السيكلينات cyclines (بروتينات يتبدل تركيزها تبعاً لدورة الخلية ولها أدوار أساسية فيها)، مما يعني إيقاف نسخ العديد من الجينات وبالتالي توقف النمو الخلوي والتأهب للاستموات. ويكبح الجين p53 نسخ الجينات المثبطة لهذه العملية، كما يتداخل في منع التعبير عن الجينات المرمزة للبروتينات الورمية c-fos و c-myc. فمن خلال مجموعة التأثيرات هذه وتأثيرات أخرى لم تذكر، نجد إن الجين p53 يكبح دورة الخلية ويؤهب لموتها، لذا جرت عدة دراسات قامت على إيتاء هذا الجين في الخلايا الورمية بتوسط
ناقل فيروسي قهقري وبصورة خاصة في سرطانة البلعوم الأنفي وسرطانة الرئة [29]. وكانت النتائج مشجعة، كونها أثبتت النظرية القائلة بإمكانية معالجة الأورام عبر تسريع استموات خلاياها. لكن التطبيقات السريرية لهذه النظرية ما تزال، إلى اليوم، غير مجدية نظراً للمقدرة الضعيفة لأنظمة الإيتاء المتوافرة حالياً.
|
| المحصلة Conclusion |
|
في الواقع، يجب أن تثبت المعالجة الجينية ،كغيرها من المعالجات، كفاءتها وبصورة خاصة فيما يتعلق بتحملها فورياً أو على المدى البعيد. لكن المشكلة الكبرى تكمن في تطوير أنظمة إيتاء آمنة وفعالة تضمن التعبير عن جين المعالجة المنقول، دون أن تتداخل في التعبير عن جينات أخرى. وعلى كل حال، فما نزال في بداية فصل طويل كثير التعقيد من مبحث التعديل الجيني، ونتقدم بكثير من التفاؤل حول إمكان استخدام المعالجة الجينية تطبيقياً في غضون السنوات القليلة المقبلة.
|
| References |
1-Ambros S.G.
Twist on gene therapy offers hope for curing hereditary ills, Technique triggers body's repair process to correct mutation.
The Dallas Morning News, 13, 2005.
2-Bangham A.D; Standish M.M. and Watkins J.C.
Diffusion of univalent ions across the lamellae of swollen phospholipids.
J. Mol. Biol; 13: 238-252, 1965.
3-Boehm K.M; Folkman J; Browder T;. and O'Reilly M.S.
Antiangiogenic therapy of experimental cancer does not induce acquired drug resistance.
Nature. 390, 404-407, 1997.
4-Cole-Strauss A; Yoon K. and Kmiec E.
Targeted gene correction of the episomal DNA in mammalian cells mediated by chimerc RNA/DNA oligonucleotides.
Porc. Natl. Acad. Sci. USA, 93, 2071-2076, 1996.
5-Cole-Strauss A; Yoon K; Xiang Y.m Byrne B. and Rice M.C.
Correction of the mutation responsible for sickle cells anemia by an RNA/DNA oligonucleotides.
Science, 273: 1386-9. (1996).
6-Crystal R.G; McElvaney N.G; Rosenfeld M.A. and Chu C.S.
Administration of an adenovirus containing the human CFTR cDNA to the respiratory tract of individuals with cystic fibrosis.
Nat. Genet. 8: 42-51, 1994.
7-Davis M.E; Pun S.H; Bellocq N.C. and Liu A.
Cyclodextrin-poly (ethylenimine) polymers for gene delivery.
Bioconjugate Chemistry 15:831-840, 2004.
8-Dellatre J; Couvreur P; Puisieux F. and Philippot J.P.
Les liposomes aspects technologiques, biologiques et pharmacologiques.
Les éditions INSERM. 1993.
9-Dietrich G.
Bactofection: Delivery of Plasmid DNA by Bacterial Carriers, 2003. 3rd Annual Conference of Gene delivery: Non-viral Systems & In Vivo Applications, Boston (USA).
10-Encyclopédie Médicale: Thérapie Génique / Le Transfert des gènes. SARL de presse -Bordeaux - août 2000.
11-Etienne J.
Biochimie génétique Biologie Moléculaire.
Masson (éd) - Paris - 5ème édition, 1999
12-Folkman J.
Antiangiogenic gene therapy.
Porc. Natl. Acad Sci USA, 95: 9064-9066, 1998.
13-Fratantoni J.C.
Non-Viral Gene Delivery for Therapeutics
3rd Annual Conference of Gene delivery: Non-viral Systems & In Vivo Applications, Boston, USA. 2003.
14-Giovannangeli C; Diviacco S; Labrousse V; Gryaznov S. and Charneau P.
Accessibility of nuclear DNA to triplex-forming oligonucleotides: the integrated HIV-1 provirus as a target.
Porc. Natl. Acad. Sci. USA, 94, 79-84, 1997.
15-Hacein-Bey-Abina S. et al.
“LMO2-associated clonal T-cell proliferation in two patients after gene therapy for SCID-X1.
Science, 17(302): 415-419, 2003.
16-Ido A; Uto H; Moriuchi A. et al.
Gene therapy targeting for hepatocellular carcinoma: selective and enhanced scuicide gene expression regulated by a hypoxia-inducible enhancer linked to a human alpha-fetoprotein promoter.
Cancer Res. 61: 3016-3021, 2001.
17-Kay MA; Glorioso JC. and Naldini L.
Viral vectors for gene therapy: the art of turning infectious agents into vehicles of therapeutics.
Nature Medicine, 7: 33-40, 2001.
18-Kmiec E.
Targeted gene repair
Gene therapy. 6, 1-3, 1996.
19-Langer R.
Where a pill won't reach: review.
Scientific American, April/May 2004.
20-Lin P.N; Buxton J.A; Acheston A. and George S.E.
Antiangiogenic gene therapy targeting the endothelium-specific receptor tyrosine kinase Tie2.
Porc. Natl. Acad Sci USA, 95: 8829-8834, 1998.
21-Majundar A; Khorlin A; Dyatkina N; Lin F.L; Seidman M. and Glazer P.M.
Targeted gene knock-out mediated by triple helix forming oligo-nucleotides.
Nat. Genet; 20: 212-214, 1998.
22-Maraninchi D; Cano J.P. and Hervé P.
Thérapie cellulaire: Rapport au ministre de la santé. 44. 1995.
23-Moolten FL. and Wells JM.
Curability of tumors bearing herpes thymidine kinase genes transferred by retroviral vectors.
J Natl Cancer Inst, 1990, 82: 297-
24-Perez C.F.
The ACE System: A Chromosome-Based Platform for Adult Stem Cell Mediated Gene Therapy.
3rd Annual Conference of Gene delivery: Non-viral Systems & In Vivo Applications, Boston (USA). 2003.
25-Perricaudet M; Marot D; Opolon P. and Elie N.
The tumor suppressor activity induced by adenovirus-mediated BRCA1 overexpression is not restricted to breast cancers.
Nature online, 6, 2005.
26-Putzer BM; Hitt M; Mueller WJ. et al.
Interleukin 2 and B7.1 co-stimulatory molecule expressed by an anti-viral vector act synergistically to facilitate tumor regression.
Porc. Natl. Acad. Sci. USA, 9: 2481-2492, 1997.
27-Rainov NG.
On behalf of the GL1328 International Study Group. A phase III clinical evaluation of herpes simplex virus type 1 thymidine kinase and ganciclovir gene therapy as an adjuvant to surgical resection and radiation in adults with previously untreated gliobastoma multiform.
Human Gene Therapy. 11: 2389-2401, 2000.
28-Rizzuto G, Cappelletti M, Maione D et al.
Efficient and regulated erythropoietin production by naked DNA injection and muscle electroporation.
Porc. Natl. Acad. Sci. USA, 323: 570-578, 1999.
29-Roth JA; Nguyen D; Lawrence DD. et al.
Retrovirus-mediated wild type p53 gene transfer to tumors of patients with lung cancer.
Nature Med. 2: 985-991, 1996.
30-Russell J; Morales J. and Liebhaber S.
Destabilization of human alpha-globin mRNA by translation anti-termination is controlled during erythroid differentiation and is paralleled by phased shortening of poly A tail.
J. Biol.Chem. 272, 6607-6613, 1997.
31-Vasques KM; Wang G; Havre PA. and Glazer PM.
Chromosomal mutations induced by triplex-forming oligonucleotides in mammalian cells.
Nucleic. Acids. Res. 27, 1176-1181, 1999.
31-Wang G; Seidman M. and Glazer PM.
Mutagenesis in mammalian cells induced by triple helix formation and transcription-coupled repair.
Science, 271, 802-805, 1996.
33-Washington post article: “Teen Dies Undergoing Gene Therapy”.
Washington post, 28 September 1999.
34-Wollf JA; Malone RW; Williams P. et al.
Direct gene transfer into muscle in vivo.
Science, 247: 1465-1468, 1990.
35-Yokoyama K; Hou D; Tang X. and Gachelin G.
Inhibition of expression of a mouse alpha-globin gene by plasmids that include anti-sene oligonucleotides.
Cell Struct Funct. 17, 433-442, 1992.
|
| |
| |
| |
