| المجلد 3 , العدد 3 , صفر 1425 - نيسان 2004 |
| |
| تقنية القياس الخلوي بالجريان |
| Flow Cytometry Technique |
| د. بول ك. والاس* و د. عبير الأسعد** |
Paul K. Wallace* and Abeer alassaad**
*Laboratory of Flow Cytometry
Roswell Park Cancer Institute, Buffalo, NY 14263
**Laboratory of Flow Cytometry, Alassad university hospital
|
| الملخص Abstract |
تتطلب المقايسة الخلوية بالجريان تسليط أشعة ليزر على مجموعة معينة منعزلة من الخلايا. حيث يمر الضوء عبر المجموعة (تشتت متقدم) أو ينعكس بعيداً عنها (تشتت جانبي). ويقاس كلا التشتتين الجانبي والمتقدم بواسطة مكشافات ضوئية. في معظم الأحيان، تكون المادة / أو المواد المتألقة، التي يتم ضبطها بطول موجة الليزر، مرتبطة بشكل انتقائي بالخلايا. يُرشّح الضوء الصادر من خلال استخدام مراشح ضوئية نوعية طول الموجة، والتي تنقل أطوال أمواج محددة من الضوء وتعكس الأخرى. ويتم تحويل الضوء المنعكس إلى إشارة كهربائية بواسطة أنابيب مضخم ضوئي (RMTs). وتفرز جميع هذه المعطيات بواسطة الكمبيوتر، ويتم اختطاطها على شاشة الكمبيوتر. يمكن لأحدنا بقليل من المعرفة والممارسة فرز أنماط مختلفة من الخلايا بتحديد ميزات المعطيات الناتجة. فالمقايسة الخلوية بالجريان هي تلك التكنولوجيا التي تسمح بقياس خلية مفردة لضرب variety من المميزات characteristics. ولقد صممت الأدوات المستخدمة في هذه التكنولوجيا بحيث يمكنها جمع المعلومات عن الخلايا، مما يسمح بفرز الخلية اعتماداً على خلاتها traits المستضدية والفيزيائية والكيميائية الحيوية.
|
Flow Cytometry involves shining a laser on discrete groupings of cells. The light passes through the group (forward scatter) or reflects off it (side scatter). The side scatter and forward scatter are measured by photodetectors. Most of the time, fluorescent material(s), tuned to the wavelength of the laser, is/are selectively bound to the cells. The emitted light is filtered out through the use of wavelength-specific light filters, which transmits certain wavelengths of light and reflects others. The reflected light is turned to an electrical signal by photomultiplier tubes (PMTs). All of this data is sorted out by a computer, and plotted onto the computer screen. With a little practice and knowledge, one can tell different types of cells by the characteristics of the data produced. Flow cytometry is a technology that allows a single cell to be measured for a variety of characteristics. Instruments built to utilize this technology can gather information about cells, allowing cell sorting based physical, biochemical and antigenic traits.
|
| المقدمة Introduction |
يعرف القياس الخلوي بالجريان بأنه تقنية تعتمد على نظام الجريان (أي مرور الخلايا في وسط سائل)، توجيه الخلايا الموجودة ضمن معلق خلوي (يمكن أن تكون الخلايا المدروسة من الدم المحيطي, من نقي العظم, سوائل الجسم أو معلق لخلايا الأنسجة) في رتل واحد حتى الوصول إلى نقطة القياس التي يتم فيها تسليط الضوء على الخلية مما ينتج عنه تشتت وتألق الضوء Scatter light, Fluoresence light حسب صفات الخلية.
تمكننا هذه التقنية من:
1- تحديد خصائص الخلايا: من خلال
- تحديد حجم الخلية Cell size .
- تحديد درجة تحبب الخلية Granulity.
- تحديد المستضدات السطحية للخلية Cell surface antigens.
- قياس التبدل في خصائص الخليـة من خلال قياس محتوى الخلية من الـ DNA.
- قياس النشاط الإنزيمي داخل الخلايا.
- تحديد درجة الحموضة "pH".
يمكن أن تقاس خصائص عديدة في وقت واحد.
2- فرز الخلاياCell sorting : تملك هذه التقنية القدرة على فصل مجموعة خلوية معينة موجودة ضمن جماعات خلوية متغايرة Heterogenous population.
جهاز الجريان الخلويFlow Cytometer
يطلق على جهاز القياس الخلوي بالجريان اسم Fluorescence Activated Cell Sorter /FACS/. يتألف الجهاز من المكونات التالية (Owens MA et al.,1995):
1- مصدر ضوئي Light source: يكون منبع الضوء عادة إما الليزر أو مصباح قوس كهربائية. وتفضل المنابع الليزرية لأنها تعطي ضوءاً وحيد اللون. تختلف الأجهزة بعدد المنابع الليزرية فقد تكون ذات منبع ليزري واحد أو ذات منبعين أو ذات ثلاثة منابع ليزرية.
2- حجرة جريانFlow cell : تتوضع حجرة الجريان في قلب الجهاز والغرض منها إرسال الخلايا إفرادياً لنقطة معينة هي النقطة التي يتركز فيها منبع الضوء.
3- مكونات بصرية لتركيز الضوء من ألوان مختلفة على المكشـافات (المتحريات)
Detectors.
4- المكشافات (المتحريات) Detectors: اما أن تكون:
* photodiode من أجل قياس تشتت الضوء الأماميforward light scatter /FSC/.
* أو photomultiplier tube من أجل قياس تألق الضوء /FL/ fluorescence light وتشتت الضوء الجانبي الناجم عن انعكاس الضوء بزاوية قائمةside scatter light /SSC/.
5- الحاسوب.
يجب التأكيد على وجود نمطين أساسيين من أجهزة القياس الخلوي بالجريان:
1- تلك التي تقوم بتحليل الخلايا فقط.
2- تلك التي تقوم بتحليل الخلايا مع إمكانية فرزها فيزيائياً أيضاً.
مبدأ الجهاز:
إن أول خطوة في تقنية القياس الخلوي بالجريان تعتمد على تحضير معلق خلوي من الخلايا المطلوب دراستها ويتم ذلك بحضن الخلايا مع أضداد وحيدة النسيلة monoclonal antibody موصومة بملون تألقي Fluorochromeوموجهة ضد بروتينات خلوية سطحية معينة. ويمكن تطبيق العديد من الأضداد في وقت واحد شريطة أن تكون موصومة بملونات تألقية مختلفة.
يمكن استخدام العديد من الملونات التألقية نذكر الأكثرها استخداماً في الجدول 1. |
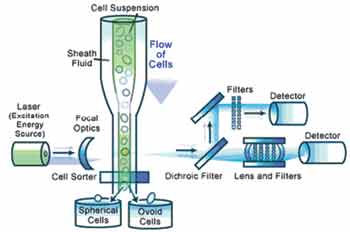
الشكل 1: مخطط ترسيمي لاكتشاف التألق بواسطة المقياس الخلوي بالجريان ومخطط ترسيمي للفرز الخلوي بالمقياس الخلوي بالجريان. |
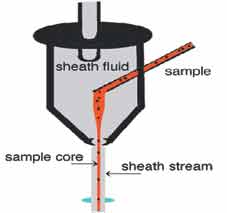
حجرة الجريان |
الجدول 1: الأصبغة المتفلورة المستخدمة.
Application |
EM.
(Emission) |
EX.
(Excitation) |
FLUOROCHROME |
phenotyping |
519 |
495 |
FITC |
Phenotyping |
670 |
470 |
PerCP |
Phenotyping |
660 |
650 |
Allophycocyanin (APC) |
Phenotyping |
578 |
480 |
Phycoerythrin (PE) |
DNA analysis |
470 |
350 |
Hoechst 33342 |
DNA analysis |
462 |
359 |
DAPI |
Phenotyping |
670 |
488 |
PE-Cy5 (TriColor, Cychrome) |
Phenotyping |
770 |
488 |
PE-Cy7 |
DNA analysis |
637 |
495 |
Propidium Iodide |
Phenotyping |
615 |
596 |
Texas Red |
|
بعد تحضير المعلق الخلوي يتم إمراره بشكل رتل أحادي من الخلايا أمام المصدر الضوئي فعندها يصطدم الضوء بالخلية مما يؤدي الى(Roederer M. 1997 Givan A 2001, ):
1- انعكاس أو انكسار الضوء (تشتت الضوء light scatter) و الذي إما أن يكون تشتتاً أمامياً forward scatter light / FSC/ يعطينا فكرة عن حجم الخلية cell size, أو تشتتاً جانبياً ناجماً عن انعكاس الضوء بزاوية قائمة side scatter light /SSC/ والذي يعطينا فكرة عن المكونات الداخلية للخليةgranulity .
2- ضوء التألق Fluorescence Light:
ينجم التألق عن إستثارة الملونات التألقية excitation بالضوء الصادر عن المصدر الضوئي ذو طول الموجة المحدد مما يؤدي إلى إصدارها ضوء بطول موجة مختلف (ضوء التألق). ففي حال وجود ضوء التألق فإن هذا يعني ارتباط الضد وحيد النسيلة مع مستقبله النوعي.
طريقة عرض وتفسير معطيات القياس الخلوي بالجريانDisplay and Interpretation of Flow Cytometry Data
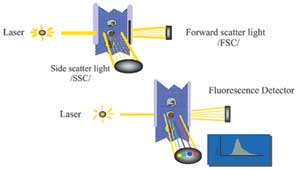
بعد أن يتم قياس تشـتت الضوء وتـألـق الناتج عن الخلايا بواسطة المكشافات (المتحريات) detectors فإنـه لابـد مـن
عرض النتائج من أجل تفسيرها. إن الخطوة الأولى لتفسير النتائج هي إجراء تبويب للخلاياcell gating أي حصر التمثيل النقطي البياني لجماعة خلوية ضمن قطاع محدد ثم أظهار التمثيلات البيانية لقياسات هذه الجماعة دون غيرها بالنسبة لبقية متثابتات و/ أو الأضداد الأخرى، بهدف التشخيص الدقيق للجماعات الخلوية غير الطبيعية (Stewart, 1994)، (Loken, 1990).
يتم إظهار القياسات الخلوية بالجريان بأنماط من التمثيلات البيانية المستعملة نوردها فيما يلي:
1- طريقة الاختطاطات (المنحنيات) النقطية Dots plots display
الرسم النقطي هو تمثيل لمخطط بياني ثنائي المعيار تمثل فيه كل خلية بنقطة على
المخطط ثنائي البعد.
تقوم هذه الطريقة بتمثيل معلمين للخلية نفسها في فراغ ثنائي الأبعاد, و تعبر كل نقطة في هذه الطريقة عن مرور خلية واحدة خلال المكشاف (المتحري) detector, و تظهر الخلايا التي لها قيم متماثلة في أماكن متماثلة في ذلك الفراغ. يعد هذا النوع من التمثيلات البيانية من أفضل التمثيلات للبيانات متعددة المعالم ولتمييز تحت جماعات خلوية معينة ضمن جماعات خلايا مختلطة (Recktenwald DJ., 1993).
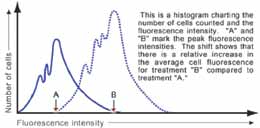
2- المنسجات Histograms: في هذه الطريقة يبين المحور x كثافة التعبير عن الإشارة المكتشفة في حين يظهر المحور Y عدد الخلايا. يعتبر هذا النوع من التمثيلات الأبسط والأسهل ويسمح بتطبيق الإحصاءات والمعادلات الرياضية المستعملة في التحليل الإحصائي للتوزعات الطبيعية للقيم.
|
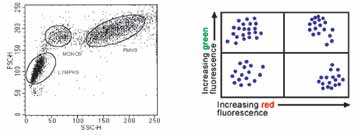
الشكل 3: اختطاط نقطي لمعطيات القياس الخلوي بالجريان.
 |
- اختطاطات (منحنيات) الكفاف contourplots: تعبر هذه الاختطاطات (المحنيات) عن معلمين للخلية نفسها في فراغ ثنائي الأبعاد فتظهر الخلايا التي لها قيم متماثلة في أماكن متماثلة في ذلك الفراغ وتظهر جماعات الخلايا المتماثلة كمخططات منفصلة عن بعضها البعض. يفضل استخدام هذا النوع من التمثيلات من أجل تحليل البيانات المتعددة المعالم لأعداد ضخمة من الخلايا ولمعاينة العينات الملوثة بأعداد كبيرة من الخلايا غير المطلوبة أو الأشلاء الخلوية.
2- اختطاطات (منحنيات) الكثافة Density plots: تعبر هذه الاختطاطات (المحنيات) عن معلمين للخلية نفسها في فراغ ثنائي الأبعاد فتظهر الخلايا التي لها قيم متماثلة في أماكن متماثلة في ذلك الفراغ وتظهر جماعات الخلايا المتماثلة كمساحات متدرجة الكثافة ومنفصلة عن بعضها البعض. تعتبر هذه المنحنيات الأفضل لمعاينة البيانات متعددة المعالم لأعداد ضخمة من الخلايا ولمعاينة بيانات العينات التي تبدي تدرجاً في سويات التعبير عن المستضدات.
|
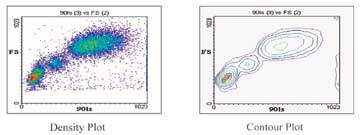
|
تطبيقات القياس الخلوي بالجريان
Application of flowcytometry
لتقنية القياس الخلوي بالجريان العديد من التطبيقات في علم المناعة Immunology, علم الأمراض Pathology, أمراض الدم Haematology وفي العديد من فروع الطب الأخرى, وسنورد فيما يلي بعض أهم هذه التطبيقات استخداماً:
1- تحديد الواصمات السطحية للخليةEvaluation of Cell-surface Markers
إن التطبيق الروتيني الأكثر شيوعاً للقياس الخلوي بالجريان هو التحديد الكيفي والقياس الكمي للواصمات السطحية للخلية بواسطة الوصم بالتألق المناعي باستعمال الأضداد وحيدة النسيلة.
يتم في هذا التطبيق وصم الضد بملون تألق ثم تتم إضافة الأضداد وحيدة النسيلة الموصومة بملون التألق إلى الخلايا وبعد استكمال عملية التحضير يمرر المعلق الخلوي خلال جهاز الجريان الخلوي ففي حال ارتباط الضد مع مستقبله النوعي نحصل على تألق الضوء الناجم عن هذا الارتباط والعكس بالعكس.
نستطيع في هذه التقنية استخدام أكثر من ضد موصوم شريطة أن يكون ملون التألق مختلف بين الأضداد وبالتالي إمكانية اكتشاف (تحري) أكثر من مستضد سطحي للخلية نفسها في الوقت نفسه ( Stewart CC, Nicholson JKA, eds. 2000).
نورد مثال على ذلك تحديد الواصمات الموجودة على الخلايا T وهي نوع من الخلايا المناعية التي تملك مستقبلات بروتينية سطحية تعرف بـ CD4,CD8, وعند الثدييات هناك خلايا تحمل CD4 فقط وخلايا تحمل CD8 فقط وخلايا تحمل CD4و CD8 ولتحديد وجود ونسبة كل نوع من هذه الأنواع نقوم بحضن الخلايا مع أضداد وحيدة النسيلة موجهة ضد الـCD4 وموصومة بالـ FITC وأضداد وحيدة النسيلة موجهة ضد الـ CD8 وموصومة بالـTexas red وبعد إتمام عملية التحضير وإمرار المعلق الخلوي في الجهاز فإننا نجد أن الخلايا الحاملة لـCD4 تتألق بلون أخضر في حين أن الخلايا الحاملة لـCD8 تتألق بلون أحمر, ومن خلال اكتشاف تألق الضوء نستطيع تحديد عدد خلايا T الموجودة.
ولتفسير النتائج نلاحظ في الشكل الأول على سبيل المثال ما يلي:
- يمثل القسم العلوي الأيمن upper right الخلايا التي تحمل CD4 والتي تحمل CD3 أي CD4+/CD3+.
- يمثل القسم العلوي الأيسرupper left الخلايا التي تحمل CD4 فقط أي
- يمثل القسم السفلي الأيمن low right الخلايا التي تحمل CD3 فقط أي CD3+/CD4-.
- يمثل القسم السفلي الأيسر low left الخلايا التي لا تحمل أيCD4 أو CD3 أي CD3-/CD4-.
يستخدم تحديد المستضدات السطحية الموجـودة على سـطح الخـلية أو فـي
هيولاها في:
1- الأمراض المناعية:
* تحديد نسبة الخلاياT cell, T cell subset, B cell, NK cell عند مرضى الأعواز المناعية.
* تحديد مدى فعالية اللمفاويات Lymphocyte activation test .
* اختبار وظيفة العدلات Neutrophil function test .
* اكتشاف (تحري) السيتوكينات داخل
الخلوية Intracellular cytokines.
2- أمراض الدم:
* وظيفة الصفيحات function Platelets
* تشخيص الابيضاضDiagnosis of leukemia.
* تشخيص اللمفومةDiagnosis of lymphoma .
* مراقبة المرض المتبقيMonitoring residual disease .
3- تحري البيلة الهيموغلوبينية الليلية الانتيابيةParoxysmal Nocturnal Hemoglobinuria /PNH/
4- مراقبة مرضى الإيدزMonitoring AIDS.
|
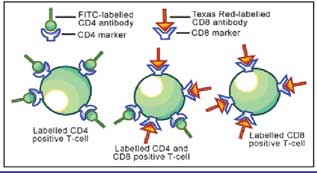
الشكل 5: خلايا CD8T و CD4 المحللة بالقياس الخلوي بالجريان. |

|
- تحديد محتوى الخلية من الـ DNA DNA Content
يهدف قياس الـDNA إلى إعطاء صورة عن الدورة الخلوية.
تتألف الدورة الخلوية من أربعة أطوار هي:
- الطورG1: تكون فيه الخلايا الطبيعية ذات محتوى من الـ DNA مضاعف الصيغة الصبغيةdiploid .
- الطور S (طور تركيب الـ DNA): يزداد خلاله محتوى الـ DNA حتى يتضاعف، وعندئذ تصبح الخلايا في الطور G2.
- في نهاية المطاف تدخل الخلايا بالانقسام الفتيلي mitosis (الطـور M) وتنقسـم
لتعيد دورتها الخلوية.
يمكن بقياس المحتوى من الـ DNA، أن نُحدد فيما إذا كانت الخلايا في الطورG0/G1، أو الطور S أو الطور G2/M من الدورة. وأي تبدل في معايير الدورة الخلوية (مثلاً الإبطاء في عبور الطور S) سينعكس في شكل المخطط الترسيمي أحادي المعيار للـ DNA.
يطلق مصطلح منسب DNA Index على محتوى الخلايا الورمية من الـ DNA في الطور G1 من الدورة الخلوية مقارنة مع ذلك الموجود في الخلايا الطبيعية.
3- فرز الخلاياCell Sorting
يمكن استخدام تقنية القياس الخلوي بالجريان من أجل فرز وتنقية نوع معين من الخلايا موجود ضمن مزيح من خلايا متغايرة, وتبلغ سرعة الفرز 15.000 خلية بالثانية وبدرجة نقاوة 98%.
يمكن أن نعرف فرز الخلايا بأنها عملية فرز فيزيائية لخلية أو لجزيء محط الاهتمام موجود ضمن مجموعات خلوية مختلفة, و يعتمد مبدأ الفرز على الانحراف الكهربائي elecrostatic deflection للقطرات المشحونة, فعندما تمر الخلية بشعاع الليزر، يتولد تشتت الضوء وإشارات تألق وتقرر لوحة الفرز فيما إذا كانت الخلية ستفرز أو لا (طبقاً للمعايير المحددة من قبل المستخدم).
|
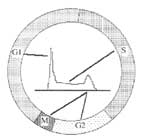
الشكل 6: الدورة الخلوية ومحتوى الخلية من الـ DNA. |
نذكر من أمثلة فرز الخلايا تحليل وفرز الصبغياتchromosome analysis and sorting.
سنتكلم بشيء من التفصيل عن أحد تطبيقات تقنية القياس الخلوي بالجريان ألا وهي التنميط المناعي للابيضاض واللمفومة.
التنميط المناعي للابيضاض واللمفومة
Immunophenotyping of Leukemia and Lymphoma
يمكننا الكشف عن المستضدات الخلوية الغشائية أو الهيولية الداخلية، التي تعبر عنها الخلايا الورمية بشكل شاذ، من دراسة النمط المناعي الذي يميز كل نمط من أنماط الابيضاض أو اللمفومة (Loken et al., 1987; Campana, 1990; Stewart, 1994; Chan et al., 1985; Braylan, 1993; Duque, 1993; Janossy, 1991; Foon et Todd, 1986 ) ويدعى التحليل الذي يسمح بالكشف الكيفي و/أو الكمي عن تلك المستضدات الخلوية باستعمال الأضداد وحيدة النسيلة بالتنميط المناعي Immunophenotyping Stewart 1994)(.
يعد استخدام تقنية القياس الخلوي بالجريان من أجل التنميط المناعي طريقة سريعة, دقيقة, كيفية, كمية، وتسمح بالكشف المتواقت عن أكثر من مستضد في آن معاً وعلى أعداد كبيرة من الخلايا - عدة ألاف- في بضع ثواني (Stewart, 1994).
وقد استعمل التنميط المناعي لخلايا الدم المتسرطنة في:
1- دراسة وتشخيص وتصنيف معظم أورام الخلايا الدموية المنشأ وتفريقها عن أنواع السرطانات اللادموية.
2- التمييز بين حالات الإبيضاضات اللمفية الحادة عن حالات الإبيضاضات النقوية(Campana et al., 1990) (Rothe et al., 1996)
3- تشخيص الأنماط المختلفة من حالات الابيضاض المزمنة واللمفومات من نمط اللاهودجكن(Catovsky, 1992; Freedman,1996).
4- الكشف عن المرض المتبقي بعد العلاج Minimal Risidual Disease (MRD) (Van Dongen, 1992).
ويعتمد التحليل على الكشف عن مستضد Antigen أو عدة مستضدات خلوية غشائية أو هيولية في الخلايا المعلقة في وسط مناسب بواسطة الأضداد وحيدة النسيلة الموصومة بملونات تألق، إضافة إلى الكشف عن خواص تلك الخلايا لتشتت الضوء (Stewart, 1994, 1997). تحدد الجماعة الخلوية المرضية اعتماداً على صفات تشتيت الخلايا للضوء بشكل متجانس أو شاذ، واعتماداً على توسعها النسيلي، وعلى النمط المناعي الشاذ، غير الناضج عادة، الذي تبديه تلك الخلايا (Rothe et al.1996; Rayn 1992; Trestappen et al., 1992c; Stewart et al., 1997)، وتشخص الجماعة الخلويةCell population غير الطبيعية، المحددة على أساس صفات تشتت الضوء أو الصفات المناعية بشكل أعمق، بحثاً عن أصلها الخلوي أو السلالة الخلوية Cell lineage التي انشقت عنها، ودرجة تمايزها وشذوذات التعبير عن المستضدات وعدم التجانس الذي تبديه بالمقارنة مع الخلايا الطبيعية المولدة لخلايا الدم (1996 (Rothe et al., وذلك من خلال:
1- تعيين الأصل الخلوي أو السلالة الخلوية Cell lineage التي اشتقت منها الخلايا السرطانية.
2- تشخيص درجة تمايز ونضوج الخلايا السرطانية (وبالتالي درجة الورم)، إضافة إلى درجة نضوج وتمايز الخلايا الطبيعية.
3- دراسة قابلية التنسيل Clonality في لمفومات الخلايا B من نمط اللاهودجكن، وفي الاضطرابات المزمنه في تضاعف الخلايا B حيث يحدث توسع نسيلي لنمط واحد من الخلايا B؛ لأن هذه الخلايا متعددة النسائل في الحالة الطبيعية بعضها يحمل السلسلة الخفيفة لامبدا l والبعض الأخر يحمل السلسلة كابا k. والكشف عن الزيادة النسيليةClonal excess، من خلال نسبة k/l، تؤكد وحدانية نسل الخلايا B الورمية أو اشتقاقها من عدة نسائل.
4- كشف تغايرية Heterogeneity أو عدم تجانس الجماعات الخلوية الخبيثة وصفاتها الشاذة.
5- التقدير الكمي للخلايا المولدة لكريات الدم.
لابد قبل الدخول في تفاصيل تشخيص الابيضاض واللمفومة من أن نتطرق إلى تعريف عناقيد (صفوف) التمايز Clusters of Differentiation /CD/:
تعرض الخلايا على سطوحها عدداً من المستضداتAntigens التي تميز بعضها عن البعض الأخر، وهذه المستضدات هي في معظمها بروتينات وظيفية تلعب أدواراً فيزيولوجية مختلفة في حياة الخلية:
فمنها بروتينات لها علاقة باتصال الخلية بوسطها أو مع غيرها من الخلايا، ومنها ما يسهم في نقل الإشارة إلى داخل الخلية, ومنها بروتينات لها دور في عمليات الأستقلاب.
ولأن كل مستضد بروتيني يشتمل على العديد من الحواتم (المحددات المستضدية) Epitopes فإنه يمكن للخلايا البلازمية Plasma Cells، المشتقة من خلايا بائية B-cells، أن تفرز ضدها بروتينات مضادة أو أضداد نوعية أحادية النسيلة monoclonal antibodies. جمعت كل الأضداد التي ترتبط بحواتم (بمحددات مستضدية) مختلفة على المستضد (البروتين) نفسه في عنقود أو صف واحد يعطى رقم معين دعي بعنقود أو بصف التمايز (CD) Cluster of Differentiation. وقد اتفق على تصنيف هذه العناقيد المعينة لبروتينات الكريات البيض في ورشات عمل ومؤتمرات دولية تناولت تنميط الكريات البيض l eukocytes typing (Schlossman s.et al. 1995; Knapp W. et al., 1989). ويعرف حالياً ما يزيد على 160 عنقود (صف) تمايز محددة بأرقام متسلسلة، إضافة إلى العديد من البروتينات التي تنتظر تصنيفها.
وبشكل عام يمكن القول أن لدينا:
1- واصمات خاصة بسلالة خلوية معينة دون أخرىLineage marker مثال ذلك الـCD3 المميز للخلايا T.
2- واصمات تتعلق بدرجة نضج الخلية Maturation markers مثال ذلك الـ CD1 وهو واصم نضج خاص بالخلايا T حيث أنه يوجد على سطح الخلايا التي تتطور في التوتة ولا يوجد على الخلايا الموجودة في الدم المحيطي.
واصمات التفعيلActivation marker مثال ذلك الـ CD25 وهو مستقبل للـIL2 الذي يعتبر عامل نمو للخلايا T ويتم التعبير عن هذا الواصم في حالة تفعيل الخلايا T فقط.
إن الهدف الأساسي لاسـتخدام تقنية القياس الخلوي بالجريان في أمراض الابيضاض واللمفومة هي لتقديم التشخيص الدقيق الضروري لاختيار العلاج الأفضل للمريض.
|
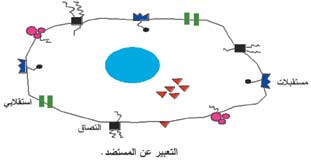
التعبير عن المستضد |
- الابيضاض اللمفاوي الحادAcute Lymohocytic Leukemia
هو عبارة عن تسرطن للخلايا اللمفاوية غير الناضجة. غالباً ما يشاهد عند الأطفال بينما لا تتجاوز نسبة إصابة البالغين 20% من الحالات.
1- الابيضاض الحاد للسلالة بيتا
lineage Acute Leukemia b
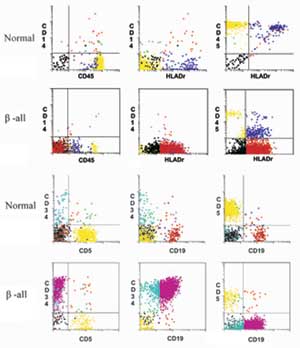
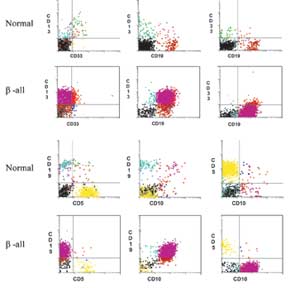
1- precursor b-ALL: في هذه الحالة نجد أن هناك تعبير عن CD22 في هيولى الخلايا (Stewart, 2000; Greaves, 1992; Rothe, 1996). ويشاهد الـ CD34 في 21% من الحالات, كما يتم التعبير عن CD19, HLA- DR TdT, ويجب الإشارة هنا إلى أن كثافة التعبير عن المستضد تختلف بين الخلايا الطبيعية والخلايا السرطانية (Farahat et al., 1995b; Weir et al., 1999 ). يمكننا أن نميز ثلاثة تحت أنواع:
-bEarly pre- : التي يكون فيها الـCD10- والتي تدعى أحياناً بـpre- pre- b أو pro - b -ALL وغالباً ما يشاهد عند الأطفال الرضع.
- Early pre- b: التي يكون فيها الـ CD10+ والتي تدعى أيضاً بـCommon
ALL ( CALL)
-- b Pre: يعرف هذا النوع بوجود غلوبولينات مناعية ثقيلة السلسلة في الهيولى وليس على السطح بالتالي يسهم الكشف عن IgM في الهيولى في تعيين حالات Pre- b cell ALL (Van Dongen, 1997).
2- b Cell ALL: يعرف بوجود غلوبولينات مناعية سطحية تعبر عن السلسلة الخفيفة وغياب للـCD 34 والـ TdT (Terminal Deoxy Transferase).
وسنذكر مثالاً عن نتائج تقنية القياس الخلوي
بالجريان حالة b ALL.
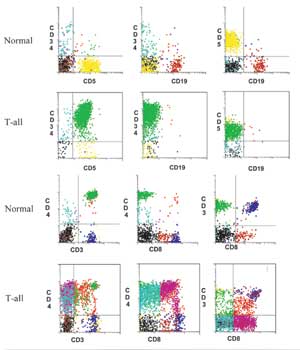
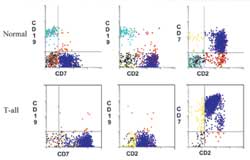
2- الابيضاض الحاد للسلالة T
T Lineage Acute Leukemia
يشكل هذا النوع 15-20% من حالات ALL، ويحدد هذا النوع من الابيضاض، بتعبير الخلايا الإبيضاضية عن CD45, CD7,CD38 (Rothe et al., 1996; Trestappen et al., 1992b)، أما التعبير عن بقية المستضدات المميزة للخلايا التائية، فيختلف من حالة إلى أخرى: فهناك حالات T-ALL لا تعبر فيها الخلايا الإبيضاضية عن CD3، وهنالك حالات أخرى تعبر فيها الخلايا الابيضاضية عنCD3، وينطبق هذا الأمر أيضاً على المستضداتCD2, CD4, CD8, CD5. وتشير الدراسات إلى أن معظم الحالات التي تكون سالبة التعبير عن CD3 الغشائي تعبر عن CD3 في الهيولى (Rothe et al., 1996). ويعتقد معظم الباحثون عموماً أن النمط المناعي الذي تبديه خلايا T-ALL يشابه النمط المناعي الذي تبديه خلايا التوتة
المبكرة (الخلايا التائية غير الناضجة).
هناك عدة أنماط من T-ALL هي:
1- Pre Thymic ((early: يتميز بـ CD7+, CD1a-, CD4/CD8-, CD3.
2-Thymic (middle): يتميز بـ CD1a+, CD4/CD8+, CD3-.
3- mature (late): يتميز بـ CD3+، CDla
|
|
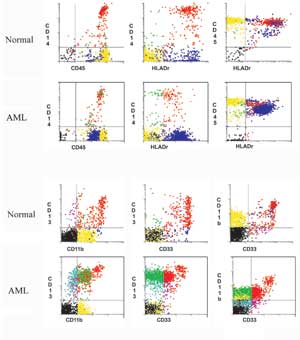
- الابيضاض النقوي الحاد
Acute myeloid leukemia / AML/
يحدد تعبير الخلايا الإبيضاضية عن CD34, CD13, CD33, HLA-DR, CD15 غالبية حالات ابيضاض الدم غير
اللمفاوي الحاد (Stewart, 2000, Rothe et al., 1996, Freedman, 1996) وباستعراض أنماط الابيضاض النقوي الحاد نجد أن:
1- أغلب حالات AMLمن تحت النمط M1 و M2 تكون موجبة التعبير عن CD34 و CD11b (Duqu, 1993)، وتفقد التعبير عن CD14 و CD33 (Trestappen, 1992 a, c)، وتفقد خلايا تحت النمط M1 أيضاً التعبير عن CD15.
2- لا تعبر خلايا الابيضاض من تحت النمط M3 عن HLA-DR وCD14،
ولكنها تعبر بشكل ضعيف عن CD15 (Rothe et al., 1996).
1- تكون خلايـا تحت النمطين M5, M4 موجبة التعبير عنCD15, CD13, CD14 (Rothe et al. 1996).
2- يمكن تحديد تحت النمط M6 من تعبير خلايا الابيضاض عن CD71، والتعبير المتغاير عن CD15, HLA-DR (Trestappen et al., 1992 a, c).
3- أما تحت النمط M7 فيحدده التعبير عن
المستضداتCD41, CD61, CD34, CD11c, HLA-DR ((Trestappen et al.,1992c; Rothe et al., 1996, (Stewart, 2000)، لكن خلايا هذا النمط تفقد التعبير عنCD14 وCD13. والملاحظ أن ظاهرة عدم التجانس في التعبير عن المستضدات المميزة للخلايا النقوية شائعة جداً في ابيضاضات الدم الحادة النقوية المنشأ (Ryan, 1992).
|
|
2- اللمفوماتLymphoma
تقسم اللمفومات وفقاً للتصنيف الأوروبي- الأمريكي الحديث لأنواع اللمفومة، Revised European-Amarican Classification (REAL) إلى مجموعتين هما: لمفومات الخلايا b، ولمفومات الخلايا T. وسنأخذ على سبيل المثال لمفومة الخلايا b.
1- لمفومة الخلايا b
b Cell Lymphoma
تقسم إلى:
I- أورام الخلايا b الأروميةLymphoblastic Leukemia /Lymphoma
II – أورام الخلايا b المحيطية:
|
1- b -CLL.
2- Lymphoplasmoytoid lymphoma
3- Mantel Cell Lymphoma
4- Hairy Cell Leukemia
5- Plasmacytoma / Myeloma
6- Follicule center cell Lymphoma (FCC)
Grade I : Small Cell
Grade II: Mixed (Small and Large Cell)
Grade III: Large Cell
7- Marginal Zone b -Cell Lymphoma
MALT (+/- MonoCytoid cell
Monocytoid cells
Villous Lymphocytes
8- Diffuse Large b -Cell Lymphoma
Mediastinal (Thymic) b - cell NHL
9- Burkitt’s Lymphoma
10- High-Grade Burkitt-like NHL
|
وسنأتي على ذكر أهم الواصمات للمفومة الخلايا b.
|
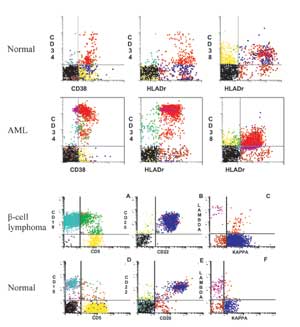 |
- الابيضاض اللمفاوي المزمن
Chronic Lymphocytic Leukemia
1- ابيضاض الدم اللمفاوي المزمن بائي الخلايا b-CLL
ومعظم حالات ابيضاض الدم اللمفاوي المزمن (95 %) هي من نسل خلايا بائية، وغالبية حالات b-CLL تعبر بشكل متجانس عن المستضدات العامة المميزة للخلايا b (CD45R, CD19, CD20, CD24, CD40, HLA-DR)، وعن sIg، وتبدي توسعا نسيلياً في التعبير عن أحد السلاسل الخفيفة للغلوبولين المناعي (Macey, 1993; Braylan, 1993; Matutes et al., 1994; Rothe et al., 1996; Freedman, 1996; Van Dongen et al., 1997; Stewart, 2000;).
2- الابيضاض سليف اللمفاوي المزمن
Chronic Prolymphocytic Leukemia (PLL)
تختلف حالات PLL عن حالات b -CLL في كون خلايا الابيضاض فيها تعبر بشكل قوي عن FMC7, sIg, CD1a بعكس خلايا الابيضاض في حالات b -CLL (Macey, 1993; Rothe et al., 1996; Catovsky, 1992; Braylan, 1993; Freedman, 1996).
3- ابيضاض الدم المزمن تائي الخلايا
Chronic T-Cell Leukemia (T-CLL)
وتبدي غالبية حالات T-CLL نمطاً مناعياً مماثلاً للنمط المناعي الذي تبديه الخلايا التائية الناضجة وبخاصة الخلايا T المساعدة أي أنها تكونCD3+, CD7+, CD2+, CD5+, CD11a+, CD4+، بالإضافة إلى أنها موجبة التعبير عن CD25 (Braylan, 1993; Freedman, 1996; Macey, 1993).
4- ابيضاض/لمفومة الخلايا التائية عند البالغين
Adult T-Cell Leukemia / Lymphoma (ATL)
أظهرت الدراسات أن حالات إبيضاض الدم تائي الخلايا عند البالغين مرتبط بالإصابة بالفيروس البشري المسبب لابيضاض الخلايا التائية من النمط I (HTLV-I)، (Kamihira et al.,1992) تبدي هذه الحالات النمط المناعي التالي: CD3+, CD4+, CD5+, CD38+, CD30+, CD28+, CD71+, HLA-DR + وتعبيراً متغير عن CD25. وتشير الدراسات إلى أن خلايا ATL تكبح انتاج Ig الطبيعي (Freedman, 1996).
5- إبيضاض الدم المزمن باللمفاويات المحببة الضخمة
Large Granular lumphocyte leukemia
وقد تكون هذه الخلايا مشتقة من الخلايا القاتلة الطبيعية أو الخلايا T التي تحمل مستقبل الخلايا التائية- السلسلة غاما TCR-g (Braylan, 1993).
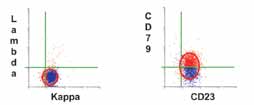
6- إبيضاض الدم بالخلايا المشعرة
Hairy Cell Leukemia (HCL)
يشتق ابيضاض الدم من نمط HCL من خلايا بائية، وتبدي الخلايا نمطاً مناعياً مشابهاً للنمط المناعي الذي تبديه الخلايا البائية المفعلة، فهي تعبر عن CD45, CD19, CD20, CD22, CD40, CD79, CD72, FMC7, sIg, CD23, CD25، كما وتعبر بقوة عن CD11c وعن CD20، CD22 وعن CD11b وCD103. وتبدي خلايا HCL صفات تشتت ضوء مميزة، فهي أكبر حجماً من اللمفاويات الطبيعية. وأغلب حالات HCL تكون سالبة التعبير عن CD24 (Braylan, 1993; Freedman, 1996;
Rothe et al, 1996).
تحديد المرض المتبقي الصغري
Minimal Residual Disease
يمكن الكشف بتقنية القياس الخلوي بالجريان عن أي خلية شاذة (أي تملك نمط مناعي غير طبيعي) بعد انتهاء المريض من المعالجة. وبالتالي فإن تحديد وجود بقايا مرض متبقي يجنب المريض حدوث نكسة قوية ويزيد من نجاعة العلاج.
|
Chronic Lymphocytic Leukemia
 |
Gated on Cd19 Positive B-Cells for Clarity
 |
Aberrant Antigen Expression on Cll/Sll
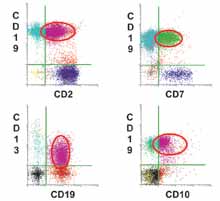
|
| المراجع Refrences |
1-Braylan PC.
Lymphomas. In: Clinical flow cytometry: principles and applications. 1993.
2-Bauer K. D., Duque R.E., Shankey T.V. (edit.). Williams & Wilkins co., Baltimore, Maryland.
3-Freedman AS.
Cell surface antigens in leukemias and lymphomas.
Cancer investigation, 14(3): 253-276, 1996.
4-Rothe G., Schmitz G., Adford D., Barlage S., Gramatzki M., Hanenberg H., Hbffkes H. G., Janossy G., KnUchel R., Ludwig W. D., Nebe T., Nerl C., Orfao A., Serke S., Sonnen R., Tichelli A., Wbrmann B.
Consensus Protocol for the flow cytometric immunophenotyping of hematopoietic malignancies.
Lukemia, 10: 877- 895, 1996.
5-Kamihira S, Sohda H, Atogami S et al.
Phenotypic diversity and prognosis of Adult T-cell leukaemia.
Leuk Res., 16: 435-441, 1992.
6-Macey Mj.
Flow-cytometric analysis of lymphocytes, Leukaemias and Lymphomas.
Brit. J. Of Biomedical Sci., 50: 334-349, 1993.
7-Catovsky D.
Lymphoproliferative disorders.
Br. J. Haematol, 82: 46-49, 1992.
8-Matutes E, Owusu-Ankomah K, Morilla R, Macro JG, Houlihan A, Que TH, CatovskyD.
The immunological profile of B-cell disorders and proposal of scoring system for the diagnosis of CLL.
Leukemia. 8: 1640-1645, 1994.
9-Van Dongen JJM.
Immunodiagnosis of human B cell Malignancies. In: Immunology methods manual.
Lefkovits, I (ed.), 4: Acadimic press, 1882-1887, 1997.
10-Stewart C. C., Stewart S. J.
Multiparameter flow cytometry of clinical samples- including 4-color immunoflourescence. ISAC XX Scintific tutorial / III. On CD-ROM, 2000.
11-Rayn DH.
Phenotyping heterogenity in acute leukemia.
Clin chim Acta. 206: 9-23, 1992.
12-Terstappen LWMM, Safford M, Unterhalt M, Konemann S, Zurlutter K, Piechotka K, Drescher M, Aul C, Buchner Th, Hiddemann W, Wormann B.
Flow cytometric chracterization of acute myeloid Leukemia. IV. Comparision to the different-tiation pathway of normal hematopoietic progenitor cells.
Leukemi, 6: 993-1001, 1992c.
13-Terstappen LWMM, Buescher S, Nguyen M, Reading C.
Differentiation and maturation of growth factor expanded early human hematopoietic progenitors assessed by multidimentional flow cytometry.
Leukemia 6: 10001-1011, 1992a.
14-Duque RE.
Flow cytometric analysis of lymphomas and acute leukemias.
Annals New Yourk Academy of Science, 677: 309-325, 1993.
15-Duque RE.
Acute leukemias. In: Clinical flow cytometry: principles and applications. Bauer K. D., Duque R.E., Shankey T.V. (edit.). Williams & Wilkins co., Baltimore, Maryland, 1993.
16-Farhat N,Lens D,Morilla R, Matutes E, Catovsky D.
Differential TdT expression in acute leukemia by flow cytometry: a quantitative study.
Leukemia, 9: 583-587, 1995a.
17-Weir EG,Cowan K, LeBeau P, Borowitz MJ.
Alimited antibody panel can distinguish B-precursor acute lymphoblastic leukemia from normal B precursors with four color flow cytometry: implication for residual disease detection.
Leukemia, 13: 558-567, 1999.
18-Campana D, Coustan- smith E, Janossy G.
Immunophenotyping in haematological diagnosis.
Bailliere’s clinical Haematol. 3:906-909, 1990.
19-Stewart CC, Behm FG, Carey JL, Cornbleet J, Duque RE, Hundnall SD, Hurtubise PE, Loken M, Tubbs RR, Wormsley S.
U. S.–Canadian Consensus Recommendations on the immunophenotypic analysis of hematologic neoplasia by flow cytometry: selection of antibody combinations. Cytometry (communications in clinical cytometry). 30: 231-235, 1997.
20-Stewart C. C. , Stewart S. J.
Immunophenotyping. Current Protocols in Cytometry on CD-ROM. Ch. 6.2.1., Ch. 6.2.18. John Wiley & Sons, Inc. 1998.
21-Stewart C. C. , Stewart S. J.
The use of directly and indirectly labeled monoclonal antibodies in Flow Cytometry.
In: Methods in Molecular Biology. Vol. 45: Monoclonal Antibody Protocols. Edited by: W. C. Davis. Humana Press InC., Totowa, NJ. 1994.
22-Stewart CC.
Multiparameter flow cytometry. In: immunochemestry.
Van Oss CJ, Van Regenmrtel MHV (ed.).Marcel Dekker, Inc. New Yourk. 849-866, 1994.
23-Schlossman S, Boumsell L., Gilks W, Harlan JM, Kishimoto T, Mormoto C, Ritz J, Shaw S, Silverstein R, Springer T, Tedder TF, Todd RE.
Leucocyte Typing V: Proceedings of the fifth international workshop and conference on Humman leukocytes deferentiation Antigens, Oxford University Press. Oxford. 1995.
24-Knapp W., Dbrken B., Gilks WR, Rieber EP, Schmidt RE, Stein H, Vondem Borne AEGK.
Leukocytes Typing IV: proceedings of the fourth international workshop and conference on human leukocyte Differentiation Antigens, Oxford University Press. Oxford. 1989.
25-Givan A.
Flow Cytometry: First Principles. New York: Wiley-Liss. 273, 2001.
26-Owens MA, Loken MR.
Flow Cytometry: Principles for Clinical Laboratory Practice. New York: Wiley-Liss. 288. 1995.
Roederer M.
Conjugation of monoclonal antibodies, 1997.
27-Recktenwald DJ.
Introduction to Flow Cytometry: Principles, Fluorochromes, Instrument Set-Up, Calibration.
J. Hematotherapy, 2(3): 387-394, 1993.
28-Stewart CC, Nicholson JKA, eds.
Immunophenotyping. New York: Wiley-Liss. 442, 2000.
29-Loken MR, Brosnan JM, Bach BA, Ault KA.
Establishing optimal lymphocytes gates for immunophenotyping by flow cytometry.
Cytometry, 11: 453- 459, 1990.
30-Recktenwald DJ.
Introduction to Flow Cytometry: Principles, Fluorochromes, Instrument Set-Up, Calibration.
J. Hematotherapy, 2(3): 387-394. 1993.
31-Campana D, Coustan- smith E, Janossy G.
Immunophenotyping in haematological diagnosis.
Bailliere’s clinical Haematol, 3: 906-909, 1990.
32-Knapp W., Dbrken B., Gilks WR, Rieber EP, Schmidt RE, Stein H, Vondem Borne AEGK.
Leukocytes Typing IV: proceedings of the fourth international workshop and conference on human leukocyte Differentiation Antigens, Oxford University Press. Oxford. 1989.
33-Schlossman S, Boumsell L., Gilks W, Harlan JM, Kishimoto T, Mormoto C, Ritz J, Shaw S, Silverstein R, Springer T, Tedder TF, Todd RE.
Leucocyte Typing V: Proceedings of the fifth international workshop and conference on Humman leukocytes deferentiation Antigens, Oxford University Press. Oxford. 1995.
34-Greaves MF.
Acute lymphoblastic Leukeamia.
B. J. Haematol., 82: 1-2, 1992.
|
| |
| المجلد 3 , العدد 3 , صفر 1425 - نيسان 2004 |
|
|
|
