| الملخص Abstract |
|
يُعد التشخيص قبل الولادة خطوة هامة للوقاية من الثلاسيمية بيتا وفقر الدم المنجلي. وهو يعتمد على عمل تمهيدي تم القيام به للتعرف على طفرات جين الغلوبين بيتا لدى مرضى سوريين. استخدمنا ثلاث من تقانات البيولوجيا الجزيئية لتشخيص الثلاسيمية بيتا (9 حالات) وفقر الدم المنجلي (حالتان). كانت هذه الطرق: التخليق الحيوي للغلوبين، ونظام تضخيم الطفرة المعندة (ARMS) وتعدد أشكال الشدف مقيدة الطول (RFLP)؛ حيث أجريت الأولى على عينة من دم الحبل السري، وتم إجراء الطريقتين الباقيتين بتحليل DNA مستخلص من عينات زغابات مشيمائية (CVS). كان الجنين سوياً في 5 حالات بالنسبة للثلاسيمية بيتا، وكان متغاير الزيجوت بالنسبة للطفرات الثلاسيمة بيتا IVS II nt 1 و IVS1nt 6 و Codon 39 في ثلاث حالات. حالة واحدة فقط كان الجنين فيها مصاباً بالثلاسيمية بيتا الكبرى وتم إنهاء الحمل. وبالنسبة لفقر الدم المنجلي، واحدة من الحالتين كان الجنين فيها متماثل الزيجوت وتم إنهاء الحمل، بينما كان متغاير الزيجوت في الأخرى بالنسبة للهيموغلوبين المنجلي (خلة الخلية المنجلية).
|
|
Prenatal diagnosis is an important step for the prevention of ?-Thalassemia and sickle cell anemia. It is based on preliminary work has done for the identification of beta-globin gene mutations of Syrian patients. We used three molecular biology techniques for prenatal diagnosis of b-Thalassemia (9 cases) and sickle cell anemia (2 cases).
These methods were: Globin biosynthesis, amplification refractory mutation system (ARMS) and restriction fragments length polymorphism (RFLP); where the first one is carried out on cord blood sample and the others were carried out by analyzing DNA extracted from chorionic villus samples.
For ?-Thalassemia, the fetus was normal in five cases, it was heterozygote for b-Thalassemia mutation: IVS II nt 1, IVS I nt 6 and Codon 39 in three cases. Only one case the fetus was affected of b-Thalassemia major and the pregnancy is terminated. For sickle cell anemia, the fetus was homozygote in one of the two cases and the pregnancy is terminated, while the fetus was HbS heterozygote (sickle cell trait) in the other.
|
| الكلمات المفتاح: التشخيص قبل الولادة prenatal diagnosis، الثلاسيمية بيتا b-Thalassemia، فقر الدم المنجلي Sickle cell anemia، طفرة mutation، زغابات مشيمائية Chorionic villi. |
| المقدمة Introduction |
تمثل اعتلالات الهيموغلوبين hemoglobinopathies (الثلاسيمية thalassemia والداء المنجلي sickle cell diasease "SCD") نموذجاً فريداً للاضطرابات الوراثية genetic disorders للهيموغلوبين، وتشخيصها قبل الولادة prenatal diagnosis وسيلة هامة جداً للوقاية من ازدياد المصابين بها (1). فالثلاسيمية بيتا ?-Thalassemia واحدة من أكثر اضطرابات الجين المفردة الجسدية المتنحية autosomal recessive شيوعاً في بلدان حوض المتوسط (2). ويتصف هذا الاضطراب بضرب variety من طفرات mutations جين gene الغلوبين بيتا، والتي ينجم عنها إما نقص في تخليق synthesis الغلوبين –? (تلاسيمية – ?+) أو إلغاء تام له (ثلاسيمية – ?0). وتحدث الإصابة بفقر الدم المنجلي sickle cell anemia عندما يحل الحمض الأميني الفالين Valine محل حمض الغلوتاميك Glutamic acid في الموضع 6 من سلسلة الغلوبين بيتا.
تتم معالجة الإصابة بالثلاسيمية بيتا وفقر الدم المنجلي بمعالجة الأعراض طيلة الحياة، عن طريق نقل دم منتظم لزيادة مستويات الهيموغلوبين؛ لكن تراكم accumulation الحديد الناجم عن ذلك يمكن أن يسبب تأثيرات جانبية خطرة، كالمرض القلبي مثلاً، وعادة يستخدم الديسفيروكسامين desferrioxamine أو الديسفيرال Desferal لإزالة الحديد الزائد من الدم، وتتجه الأنظار حالياً إلى زرع النقيbone marrow tansplantation والمعالجة الجينية gene therapy للشفاء من هذين المرضين (3، 4) وهي طرق مكلفة ونتائجها غير إيجابية دوماً. لذلك تبقى وسيلة الوقاية prevention هي الأقل كلفة لمنع ولادة مصابين جدد، وهي تعتمد على خطة يتم تطبيقها قبل الولادة antenatal plan وتشتمل على: 1- الاستشارة الوراثية genetic counselling؛ 2- تعيين الحوامل موضع الاختطار risk بواسطة التحري الرجعي retrospective screening (تاريخ اختطار معلوم) والتحري المستقبلي prospective screening للنساء اللاأعراضيات asymptomatic؛ 3- إجراء التشخيص قبل الولادة prenatal diagnosis لتحديد إصابة الجنين؛ 4- إنهاء termination الحمل المتأثر (أي في حال كان الجنين مصاباً بالمرض).
يمكن أن يتم تشخيص اضطرابات الهيموغلوبين قبل الولادة في الأسابيع 18 – 23 من الحمل باعتيان sampling دم الجنين والتخليق الحيوي biosynthesis للغلوبين (6)؛ أو اعتيان الزغابات المشيمائية chorionic villi في الأسابيع 10 - 12 من الحمل، ويعتمد التشخيص هنا على تحليل حمض الديوكسي ريبونوكلييك deoxyribonucleic acid (DNA). ومنذ عام 1990 أصبح التشخيص قبل الولادة على مستوى DNA ممكناً في الثلث الأول من الحمل first trimester باستخدام تفاعل سلسلة البوليميراز polymerase chain reaction (PCR)(7)، ونظام تضخيم الطفرة المعندة amplification refractor mutation system (ARMS)، وتعدد أشكال الشدف المقيدة الطول restriction Fragment length Polymorphism (RFLP). ولتطبيق هذه الطرق التشخيصية لا بد من التعرف أولاً على طفرات الثلاسيمية بيتا لدى الأبوين المعرضين لاختطار إنجاب مصاب بالمرض، خاصة وأن هنالك أكثر من 200 طفرة في جين الغلوبين بيتا تتسبب في الثلاسيمية بيتا وهي تتواجد بتواتر عالٍ في حوض المتوسط (8)، إلا أن بعضها يعد الأكثر تواتراً في كل مجموعة سكانية وهي الأهم في التشخيص قبل الولادة.
|
| المواد والطرق Materials and Methods |
تناولت الدراسة 11 حالة تشخيص قبل الولادة لسيدات حوامل من أصل عربي سوري لديهن مصاب واحد على الأقل بالثلاسيمية بيتا الكبرى (9 حالات) أو بفقر الدم المنجلي بشكله مماثل الزيجوت homozygote (حالتان)؛ ولقد أبدت السيدات، بموافقة أزواجهن، رغبة واستعداداً لإجراء هذا الاختبار قبل الولادة لتجنب ولادة مصابيـن
جدد بأمراض الهيموغلوبين تلك.
تمت دراسة المتثابتات الدموية hematological parameters (قيم هيموغلوبين الدم والهيماتوكريت ومناسب الكريات الحمر) والرحلان الكهربائي للهيموغلوبين، كما تم استخلاص extraction الـ DNA المجيني genomic (9) من عينات الدم الكامل المأخوذة من الوالد ومن المريض متماثل الزيجوت في كل حالة، في مخابر الكيمياء الحيوية والبحث العلمي في كلية الصيدلة، جامعة دمشق، سورية. ثم نُقلت عينات DNA المستخلص إلى معهد الوراثيات وطب الجهاز العصبي في نيقوسيا في قبرص The Cyprus Institute of Neurology & Genetics لاستكمال الدراسة الجينية، بحيث تزامن هذا النقل، في كل حالة، مع سفر السيدة الحامل إلى قبرص لإجراء التشخيص قبل الولادة.
تم اعتيان samlping دم الحبل السري unbilical cord أو الزغابات المشيمائية chorionic villi من الأم الحامل، بواسطة أيدٍ خبيرة، في مستشفى الأسقف مكاريوس في نيقوسيا، في قبرص. فبالاستعانة بالأمواج فوق الصوتية ultrasound تم بزل الحبل السري cordocentesis لثلاث حالات كانت فيهم السيدة في الثلث الثاني second trimester من حملها، وذلك بإدخال إبرة دقيقة fine needle عبر جدار البطن ضمن الحبل السري الجنيني fetal umbilical cord؛ ودُرست معدلات التخليق الحيوي للغلوبين globin biosynthesis في هذه العينة، بحضنها مع مزيج الأحماض الأمينية جميعها والتي تحوي اللوسين بشكله المشع leucine (H3)، ثم فُصلت سلاسل الغلوبينات بتمريرها على عمود (أبعاده 1.0 × 30.0 سم) من كربوكسي ميثيل سلولوز CM23 (Whatman cat. No. 4033-025). وقيست الفاعلية الإشعاعية في الأجزاء المشطوفة من العمود، وأخيراً تم حساب النسبة b / c + b.
كنا قد قمنا في دراسات سابقة (10، 11) بكشف الطفرات الثلاسيمية بيتا الأكثر شيوعاً لدى المرضى السوريين ووجدنا أنها ثمان طفرات هي:
(G→A) 110 – IVSI، IVSI-1 (G→A)، Codon 5 (-CT)، -30 (T→A) Codon 39 (C→T)، IVSI-6 (T→C)، IVS II-1 (G→A)، Codon 15 (TGG→TAG)،
وتم ذلك بتحليل DNA، المستخلص من الكريات البيض، باستخدام تفاعل سلسلة البوليميراز Polymerase Chain Reaction (PCR)، والتلطيخ (التوصيم) النقطي Dot Blotting ونظام تضخيم الطفرة المعندة Amplification Refractory Mutation System (ARMS).
وكانت نتائج تلك الدراسة السابقة بمثابة الأساس لتسهيل العمل في الكشف عن الطفرات الثلاسيمية بيتا (6 حالات) لدى الأبوين الراغبين بإجراء التشخيص قبل الولادة وكذلك لدى المريض متماثل الزيجوت لديهما أو الكشف عن طفرة الغلوبين المنجلي (حالتان)، بعد تأكيد وجود الهيموغلوبين المنجلي بإجراء الرحلان الكهربائي للهيموغلوبين.
تم اعتيان الزغابات المشيمائية chorionic villi sampling في الحالات الثمان (6 حالات ثلاسيمية وحالتا فقر دم منجلي) لسيدات في الثلث الأول first trimester من حملهن، وذلك بإدخال إبرة عبر الجدار البطني abdominal wall، بتوجيه بواسطة الأمواج فوق الصوتية، للوصول إلى الزغابات المشيمائية (الشكل 1).
استخلص DNA من الزغابات المشيمائية ومن عينة دم الأم (المرأة الحامل) (9)، وتم تحليله، في كل حالة، بالإضافة إلى DNA باقي أفراد الأسرة (الأبوين والمصاب متماثل الزيجوت)، باستخدام نظام تضخيم الطفرة المعندة Amplification (ARMS) Refractory Mutation System (7)، وتعدد أشكال الشدف المقيدة الطول (RFLP) Restriction Fragment length Polymorphism (12). فاستخدام كلا الطريقتين جعل من الممكن تشخيص جميع الحالات المدروسة وفي الوقت ذاته قلل الأخطاء إلى حدها الأدنى.
بواسطة طريقة الـ ARMS أمكننا تعيين هوية طفرات الثلاسيمية بيتا في العينات باستخدام المَشْرَعات primers المذكورة في الجدول 1. بينما قمنا بواسطة
haplotype المترافق مـع الطفـرة، وذلك باستخدام المَشْرَعات التي تظهر في الجدول 2.
|
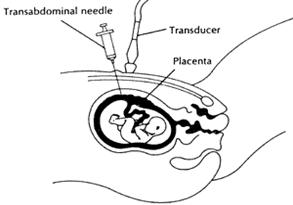
الشكل 1: طريقة الحصول على الزغابات المشيمائية من أجل تحليل DNA الجنيني.
|
| |
| الجدول 1: تسلسلات قليل النوكليوتيد لمَشْرَعات primers الشاهد الداخلي والمَشْرَعات المشتركة ومشرعات الـ ARMS. |
A. Internal control primers for all PCR reactions
Forward: 5` GAAGATCTAGACAGTGGATACATAACAAAHTGCATG 3`
Reverse: 5` TTCTCCGAAGGTAATTGCCTCCCAGATCTGAGTCC 3`
B. Common Primers
B1. 5` TACGGCTGTCATCACTTAGACCTCACCCTG 3`
B2. 5` ATGCACTGACCTCCCACATTCCCTTTTTAG 3` |
| C. ARMS primers |
|
Used with |
| *IVS-I-110 |
normal 5` ACCAGCAGCCTAAGGGTGGGAAAATAGACC 3`
mutant 5` ACCAGCAGCCTAAGGGTGGGAAAATAGACT 3`
|
B1 |
| *IVS-I-6 |
normal 5` TCTCCTTAAACCTGTCTTGTAACCTTGATA 3`
mutant 5` TCTCCTTAAACCTGTCTTGTAACCTTGATG 3`
|
B1 |
| *IVS-I-1 |
normal 5` TTAAACCTGTCTTGTAACCTTGATACCAAC 3`
mutant 5` TTAAACCTGTCTTGTAACCTTGATACCAAT 3`
|
B1 |
| *IVS-II-745 |
normal 5` TCATATTGCTAATAGCAGCTACAATCCAGC 3`
mutant 5` TCATATTGCTAATAGCAGCTACAATCCAGG 3`
|
B2 |
| *C39 |
normal 5` CAGATCCCCAAAGGACTCAAAGAACCTGTG 3`
mutant 5` CAGATCCCCAAAGGACTCAAAGAACCTGTA 3`
|
B1 |
| *IVS-II-1 |
normal 5` AAGAAAACATCAAGGGTCCCATAGACTGAC 3`
mutant 5` AAGAAAACATCAAGGGTCCCATAGACTGAT 3`
|
B1 |
* كما وصفت من قبلOld J.M; Varawalla N. Y. and Weatherall D.J. Lancet, 336: 834-837, 1990.
لكشف HbS يُستخدم المَشْرَعات ARMS1/ ARMS2 للتضخيم. ويتم الهضم بالإنزيم Sau I أو BSU 36I.
|
|
الجدول 2: المَشْرَعات primers المستخدمة أثناء تحليل RFLP لموضع الغلوبين –b.
Sequence 5` → 3` |
RHFLP |
TTAAGAGAGCTAGAACTGGGTGAG |
Hind II/ e |
TCAAGGCTGACCTGTGTCCTCAGG |
TCCTATCCATTACTGTTCCTTGAA |
Hind II/ 5` y b |
ATTGTCTTATTCTAGAGACGATTT |
GTACTCATACTTTAAGTCCTAACT |
Hind I I / 3` y b |
TTAGCAAGATTATTTCTGGTCTCT |
TGCTGCTAATGCTTCATTACAA |
Hind III G g |
AAGTGTGGAGTGTGCACATGA |
GAGTAGTGCTTGAAGGGGAACAAC |
Hind II I A g |
CCTCTGCTGATTCATTTCTTACAC |
CCTAATAAGTAACTAATGCACAGA |
Rsa I/ b |
AGCTTTGGGATATGTAGATGGATC |
GTACGCATGGTACAGGATTCTTTG |
AvaII/ y b |
ATTGTCTTATTCTAGAGACGATTT |
GGCTGTCATCACTTAGACCTCACC |
Ava II/ b |
TTCGTCTGTTTCCCATTCTAAACT |
|
| النتائج Results |
|
وجدنا، باستخدام التخليق الحيوي للغلوبين
لتشخيص الثلاسيمية بيتا قبل الولادة، لدى الحالات الثلاث التي أجريت في الثلث الثاني من الحمل أن النسبة b / g + b كانت 0.0100، 0.052، 0.089 على الترتيب؛ وفي الحالة السوية تبلغ هذه النسبة قيمة قريبة
من 0.1. فالجنين كان متأثراً بالمرض بشكله متماثل الزيجوت في الحالة الأولى، لذلك تم إنهاء الحمل بعد موافقة الأبوين؛ وفي الحالة الثانية كان الجنين متأثراً بالمرض بشكله متغاير الزيجوت heterozygot وهذا لم يمنع من استمرار الحمل؛ أما الحالة الثالثة فكانت تلك النسبة كبيرة (0.089) وقريبة من السوية وفيها استمر الحمل أيضاً.
أما نتائج التشخيص بتحليل الـ DNA، باستخدام طريقتي ARMS و RFLP، فيلخصها الجدول 3 الذي يعرض النمط الجيني genotype للجنين لسيدات أجري لهن التشخيص قبل الولادة في الثلث الأول من حملهن (8 حالات) باعتيان الزغابات المشيمائية.
إن استخدام كلا الطريقتين (ARMS و RFLP) له أهميـة كبيرة في تأكيد نتيجة التشخيص قبل الولادة، خاصة إذا لم يكن بالإمكان الكشف عن الطفرة عند أحد الأبوين (نظراً لكونها لا تندرج ضمن قائمة الطفرات الثلاسيمية الشائعة التي يتم العامل معها ضمن مجموعة سكانية محددة)، وهذا ماصادفناه في دراسة الحالة رقم 2؛ حيـث كانت الوالدة تحمل طفرة جين الغلوبين بيتا IVSI-6 (T→C) أما الطفرة لدى الوالد فلم
تكن ضمن الطفرات التي تمـت دراسـتها
باستخدام المَشْرَعات المذكورة في الجدول 1. وكان لا بد من تأكيد التشخيص بسرعة، وهو ما توصلنا إليه اعتماداً على نتائج طريقتي الـ ARMS و RFLP معاً (كما هو موضح
في الشكل 2).
ويبين الشكل 3 تخطيطاً نتيجة دراسة النمط الجيني لجنين في أسبوعه العاشر من العمر ويحمل والده الطفرة IVSII-1 (G→A) بشكلها متغاير الزيجوت، بينما تحمل والدته الطفرة IVSI-110 (G→A) بشكلها متماثل الزيجوت. ولحسن الحظ كان الجنين مصاباً بخلة trait الثلاسيمية بيتا أي حاملاً للطفرة IVSII-1 (G→A) بالشكل متغاير الزيجوت ولم تكن هنالك خطورة من استمرارية الحمل.
يتضح من الشكل 3 أنه لا بد من التلازم بين طريقة ARMS التي يتم فيها تحديد طفرة جين الغلوبين بيتا وطريقة RFLP للتعرف على النمط الفرداني haplotype المرتبط مع هذه الطفرة، وذلك من أجل التشخيص الدقيق قبل الولادة. بينت النتائج التي حصلنا عليها أن هنالك جنين مصاب بفقر الدم المنجلي b / bs (الحالة رقم 7 في الجدول 3) لأبوين يحملان الخلة المنجلية N / bs فكان لا بد من إنهاء الحمل بعد موافقة الزوجين، ولقد تم ذلك بسهولة باعتبار أن الحمل كان في ثلثه الأول.
|
الجدول 3: نتائج تشخيص الثلاسيمية بيتا وفقر الدم المنجلي قبل الولادة بتحليل الـ DNA باستخدام طريقتي ARMS و RFLP.
رقم الحالة |
طفرة جين الفلوبين بيتا |
النمط الجيني للجنين |
استمرارية الحمل |
1 |
( G → A ) 110 – IVSI |
N / N |
نعم |
2 |
IVSI-6 (T → C) |
N / IVSI - 6 (T → C) |
نعم |
3 |
( G → A ) 110 – IVSI |
N / N |
نعم |
4 |
IVS II-1 (G → A) |
N / IVSI – 1 (G → A) |
نعم |
5 |
IVSI-6 (T → C) |
N / IVSI - 6 (T → C) |
نعم |
6 |
Codon 39 (C → T) |
N / Codon 39 (C → T) |
نعم |
7 |
Hb S |
S / S |
لا |
8 |
Hb S |
N / S |
نعم |
| N= Normal سوي. |
|
DNA Analysis
I. ARMS: Father: Heterozygote (N/X)
Mother: Heterozygote (N/I-6)
CVS: Negative for the IVSI-6 mutant primer – Normal or ?-that trait
II. RFLPs:
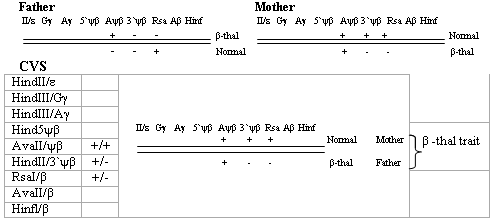
Diagnosis: b-thalassemia trait (N/X)
الشكل 2: نتيجة تشخيص الثلاسيمية بيتا قبل الولادة بتحليل الـ DNA باستخدام طريقتي ARMS و RFLP لطفرة معروفة لدى الوالدة وغير معروفة لدى الوالد.
|
N = Normal سوي؛ ND = None definite غير مؤكد تماماً.
الشكل 3: تمثيل تخطيطي لنتيجة تشخيص الثلاسيمية بيتا بتحليل DNA (باستخدام طريقتي ARMS و RFLP) زغابات مشيمائية مأخوذة من سيدة في الثلث الأول من حملها ولديها طفرة (IVSI – 110) مختلفة عن طفرة زوجها (IVSII-1).
|
| المناقشة Discussion |
أظهرت النتائج التي حصلنا عليها أنه بالإمكان الاعتماد على طريقة نظام تضخيم الطفرة المعندة (ARMS) في برنامج التشخيص قبل الولادة لطفرات الثلاسيمية بيتا وفقر الدم المنجلي، نظراً لكونها طريقة سهلة وسريعة، حيث يستغرق الحصول على النتيجة 3 ساعات في حال كانت الطفرة من الطفرات الشائعة المحددة مسبقاً لدى المجموعة السكانية المعروفة، ويتطلب ذلك يوماً كاملاً في حال كانت الطفرة نادرة؛ وهذا ما تم التأكيد عليه في دراسة سابقة تناولت مجموعة سكانية قبرصية ومن أصل هندي (7).
استخدمنا مشَرَعات ARMS المذكورة في الجدول 1 للتشخيص قبل الولادة لست حالات في الثلث الأول من الحمل، وتم تأكيد هذا التشخيص بتحليل النمط الفرداني RFLPs للجنين والأبوين وكان لهذا أهميته الكبيرة، خاصة لتأكيد النتيجة في الحالتين 2 و 5 المذكورتين في الجدول 3. حيث أنه لم يكن بالإمكان تحري الطفرة لدى الوالد بطريقة ARMS (الشكل 2)، كونها لا تندرج ضمن طفرات جين الغلوبين بيتا الشائعة التي تمت دراستها، خاصة وأن هنالك أكثر من 200 طفرة تتسبب في الإصابة بالثلاسيمية بيتا (8). لذلك نؤكد على ضرورة تحري حملة المرض وكشف الطفرة لديهم ضمن خطة واضحة لتقديم النصحية الوراثية للزوجين موضع الاختطار risk، وعالمياً تم التأكيد على الحاجة إلى معايير خدمة تتضمن سياسة تحري واضحة وخطة مسؤولة في كل منطقة صحية لتحري الحملة وتقديم النصيحة الوراثية (13). ويفيد حصر الطفرات الشائعة بصورة تامة في استخدام طريقة جديدة، تعتمد على التحديد الكمي لمنتج تفاعل سلسلة البوليميراز في الزمن الحقيقي للتفاعل Real-Time PCR، لإجراء اختبار سريع ودقيق ومأمون safe (لا تستخدم فيه مواد مشعة) قبل الولادة (8).
لقد تم الإجهاض الانتقائي selective abortion في حالتين من الحالات المدروسة كان فيهما الجنين متأثراً بالمرض بشكله متماثل الزيجوت homozygote، وذلك بعد موافقة الأبوين. إلا أنه في كثير من الأحيان يمكن أن يكون المعتقد الديني religion العامل الرئيسي ضد قبول التشخيص قبل الولادة، كما هو الحال في بلدان أخرى مثال نيجيريا مثلاً (14)، وهنا تبرز الحاجة إلى تثقيف المجتمعات والحوار مع قادة الدين والمنظمات الحكومية وغير الحكومية للوقوف على حقيقة الواقع الصحي للمرض والعواقب المستقبلية من تزايد أعداد المصابين بهذه الأمراض الوراثية.
ينبغي التواصل مع كل ما هو جديد في مجال التشخيص قبل الولادة لاضطرابات الهيموغلوبين الشائعة في بلدنا، فعلى الرغم من أن الطرق التشخيصية المطبقة ذات دقة عالية، إلا أنها تعتمد على إجراءات باضعة invasive procehdure، مثل بزل دم الحبل السري أو اعتيان الزغابات المشيمائية، تترافق مع اختطار risk، مع أنه قليل الحدوث، لكل من الم والجنين؛ لذلك تم اللجوء مؤخراً إلى إجراءات غير باضعة، حيث أمكن تحري طفرة الثلاسيمية بيتا النوعية الجنينية في عينة بلازما أمومية بالاعتماد على تحري فروقات النوكليوتيد المفرد بين DNA الجنيني والأمومي في البلازما الأمومية وهي تعرف باسم تعدد أشكال النوكليوتيد المفرد النوعية الجنينة Fetal-specific single-Nucleotide polymorphisms (SNPs) (15) فهنالك أمل مستقبلي لعملية تحري طفرة جين الغلوبين بيتا، بصورة آلية، بتحليل رقائق صغيرة جداً microchips analysis، وتشخيص طفرة الجنين بتحاليل خلاياه في الدوران الأمومي (16).
نعود للتأكيد أنه لن يكون بإمكاننا الاستفادة من طرق التحليل الجزيئي، لبني يتم تطويرها بسرعة كبيرة، ما لم نبدأ العمل على إنشاء قاعدة أساسية لكشف طفرات جين الغلوبين بيتا لدى كافة الأفراد المعرضين لاختطار هذا المرض الوراثي، وإن كانت هناك بضع دراسات (10، 11) قاد أجريت لتحديد أكثر هذه الطفرات شيوعاً لدى مرضانا. ويتطلب هذا التعاون المكثف بين كافة الأفراد العاملين في مختلف القطاعات الصحية والتثقيفية والخدمية والإعلامية لوضع نواة برنامج قابل للتطبيق عملياً للوقاية من الثلاسيمية بيتا وفقر الدم المنجلي في قطرنا، وأن يتزامن ذلك مع التأكيد على أهمية التشخيص قبل الولادة.
|
| |
| كلمة شكر Acknowledgements |
|
نتوجه بجزيل الشكر للمرضى الذين ساهموا في هذه الدراسة ولكافة العاملين في مركزي الثلاسيمية في قبرص وسورية لمساعدتهم في الحصول على عينات الدم لأفراد الدراسة. كما نشكر طاقم العمل في قسم التوليد التابع لمشفى الأسقف مكاريوس في قبرص لتزويدنا بالعينات الجنينية، كذلك نتوجه بالشكر للزملاء العاملين في معهد الوراثيات وطب الجهاز العصبي في قبرص لمساعدتهم في تطبيق طرق التحليل الجيني.
|
| المراجع References |
1-Rappaport V.J; Velazquez M. and Williams K.
Hemoglobinopathies in pregnancy.
Obstet Gynecol Clin North Am. 31(2): 287-317, 2004.
2-Weatherall D.J.
The Thalassemias.
In Beutler E; Lichtman M.A; Coller
B. S. and Kipps T.J. (eds). Williams Hematology. Mc Graw-Kill, New York, USA, 581-615, 1995.
3-Schrier S.L. and Angelucci E.
New strategies in the treatment of the thalassemias.
Annu Rev Med. [Epub ahead of print], 2004.
4-Puthenveetil G. and Malik P.
Gene Therapy of hemoglobino-pathies: are we there yet?
Curr Hematol Rep., 3(4): 298-305, 2004.
5-Tongsong T., Wanapirak C; Sirivatanapa P; Sanguansermsri T; Sirichotiyakul S; Piyamongkol W. and Chanprapaph P.
Prenatal diagnosis of severe thalassemia.
Chiang Mai Strategy Prenat Dia., 20(3): 229-234, 2000.
6-Matsakis M; Berdoukas V.A; Angastiniotis M; Mouzouras M; Ioannou P; Ferrari M. et al.
Haematological aspects of antenatal diagnosis for thalassaemia in Britain.
B. J. Haematol., 45: 185-197, 1980.
7-Old J.M; Varawalla N. Y. and Weatherall D.J.
Rapid detection and prenatal diagnosis of beta-thalassaemia: Studies in Indian and Cypriot populations in the UK.
Lancet, 336: 834-837, 1990.
8-Naja R.P; Kaspar H; Shbaklo H; Chakar N; Makhoul N.J. and Zalloua P.A.
Accurate and rapid prenatal diagnosis of the most frequent East Medite-rranean beta-thalassemia mutation.
Am. J. Hematol., 75(4): 220-224, 2004.
9-Miller S.A; Dykes D.D. and Polesky H.F.
A simple salting out procedure for extraxting DNA from human.
Nucleated cell.
Nucl. Acids Research, 16 (3): 1215, 1988.
10-Kyriacon K; Al Quabaili F; Pavlon E; Christopoulos G; Ioannou P. and Kleanthous M.
Molecular characterization of beta-thalaeemia in Syria.
Hemoglobin, 24(1): 1-13, 2000.
11-Al Quabaili F; Jouma M.D; Al-Shwaiki M.Z; Kulozik A.E. and Kleihauer E.
Beta thalassemia, genetic diagnosis, molecular genetic associated with certain hemoglobinopathies and their epidemiological aspects in Syria.
Thesis for doctorate degree, Faculty of Pharmacy- Damascus University, Syria, 1992.
12-Semenza G.L; Dowling C.E. and Kazazian H.H.Jr.
Hinf I polymorphism 3` to the human ?-globin gene detected by the polymerase chain reaction (PCR).
Nucl Acids Res., 17: 2376, 1989.
13-Model B; Petrou M; Layton M; Slater C; Ward R.H.T. and Rodeck C.
Audit of prenatal diagnosis for haemoglobin disorders in the united Kingdom: the first 20 years.
BMJ., 315: 779-784, 1997.
14-Kagu M.B; Abjah U.A. and Ahmed S.G.
Awareness and acceptability of prenatal diagnosis of hsickle cell anaemia among health professionals and students in North Eastern Nigeria.
Niger J. Med., 13(1): 48-51, 2004.
15-Sekizawa A. and Saito H.
Prenatal screening of single-gene disorders from maternal blood.
Am. J. Pharmacogenomics, 1(2): 111-117, 2001.
16-Cao A., Rosatell M. C., Monni G. and Galauhello R.
Screening for thalassemia: a model of success.
Obstet Gynecol Clin North Am., 29 (2): 305-328, 2002.
|
| |
