| المجلد 3 , العدد 5 , شعبان 1425 - تشرين الأول (أكتوبر) 2004 |
| |
استخدام الواصمات الكيميائية الحيوية في تشخيص الحثل العظمي الكلوي
عند مرضى الفشل الكلوي بالمرحلة النهائية قبل الديال
|
The Use of Biochemical Markers for Diagnosing Renal
Osteodystrophy in Predialysis End-Stage Renal Failure Patients |
| د. هشام عبد الصمد، د. سحر الفاهوم و د. فايزة القبيلي |
| Abdulsamad H., Al-Fahoum S. and Al-Quobaili F. |
| كلية الصيدلة – جامعة دمشق |
| الملخص Abstract |
تترافق الشذوذات العظمية الاستقلابية مع خلل وظيفة الكلية والتي تعرف بمجملها بالحثل العظمي الكلوي Renal Osteodystrophy. يعد مرضى هذا الداء ضمن هامش اختطار متزايد لكسور الورك والعمود الفقري. يضم هذا الداء عدة أشكال من الشذوذات العظمية الاستقلابية منها: التهاب العظم الليفي Osteitis Fibrosa، تليّن العظام Osteomalacia، والداء العظمي الواهن Adynamic Bone Disease. يمكن إلقاء نظرة معمقة على التقلّب العظمي بشكل غير مباشر بواسطة الواصمات الكيميائية الحيوية لتشكل وارتشاف العظم التي تعكس فعالية بانيات وناقضات العظم. تعد واصمات تشكل العظم منتجات خلايا بانيات العظم مثل: الفسفاتاز القلوية العظمية، والأوستيوكالسين. يعد الكولاجين نمط I المكون الرئيسي لمطرس العظم، بينما يؤلف الأوستيوكالسين معظم البروتينات غير الكولاجينية المطرسية. ويبدو أن الأوستيوكالسين والفسفاتاز القلوية كلاهما يلعب دوراً هاماً في تمعدن مطرس العظم. لكن يُقيم ارتشاف العظم بمنتجات تدرّك الكولاجين نمط I مثل: الروابط المتصالبة في النهاية الكربوكسيلية b-Crosslaps وICTP التي تعاير في المصل. أظهرت الدراسات العالمية والمجراة في كلية الصيدلة، جامعة
دمشق، فائدة هذه المتثابتات في تقييم معدل التقلّب العظمي وتغيراته في الأدواء العظمية المختلفة. هدفت الدراسة إلى تقييم دور هذه الواصمات في مرضى الفشل الكلوي المزمن قبل الديال.
لاحظنا ارتفاع قيم الواصمات الكيميائية الحيوية. وجدنا في دراستنا حوالي 11% من المرضى لديهم داء عظمي واهن مع تقلّب عظمي منخفض، بينما كانت النسبة المئوية للذين لديهم التهاب العظم الليفي بفرط التقلّب حوالي 54.35%. لاحظنا ارتباط الـ iPTH مع كل من N-Mid OC وb-CTXz، هذا يعكس زيادة الاستقلاب العظمي عبر زيادة عدد وفعالية بانيات وناقضات العظم. كما ارتبطت الفسفاتاز القلوية الكلية t-ALP مع b-CTX وكذلك N-Mid OC مع b-CTX بينما لم يلاحظ وجود علاقات هامة بين واصمات التشكل العظمي أي الفسفاتاز القلوية الكلية وN-Mid OC وواصم الارتشاف ICTP، لذلك لم يتبين لدينا أن هذا الأخير معلم اختياري في هذه المجموعة من المرضى. وبمقارنة متوسطات قيم المتثابتات المدروسة بين مجموعتي المرضى والأسوياء، وجدنا أن كل المتثابتات أظهرت فروقاً ذات دلالة إحصائية.
|
Metabolic bone abnormalities are often associated with kidney dysfunction which are known collectively as renal osteodystrophy. Patients with this disease are at incresead risk for vertebral and hip fractures. This disease comprises several forms of metabolic bone abnormalities such as: Osteitis Fibrosa, and Adynamic Bone Disease. A deep insight into bone turnover could be done indirectly by biochemical markers of bone formation and resorption reflecting the activity of osteoblasts and osteoclasts.Markers of bone formation are products of osteoblasts such as: bone alkaline phosphatase and Osteocalcin. Collagen type I is the major component of bone matrix, where Osteocalcin constitute the majority of non-collagen matrix proteins. Both Osteocalcin and alkaline phosphatase plays an important role in bone mineralization. However, bone resorption is assessed by products of collagen type I degredation such as: Crosslinks of C-terminal collagen (I) telopeptides (b-Crosslaps) and crosslinked telop
eptides of Collagen (I), which are assayed in serum. Recent studies demonstrated the usefullnes of these markers in bone turnover rate assessment and its variations in different pathological diseases, including renal osteodystrophy.
Results demonstrated elevation in serum levels of all bone markers. We found that 11% of patients had adynamic bone disease, and 54.35% of them had osteitis fibrosa. (iPTH) correlated positively with N-Mid OC and b-CTX, reflecting increased bone metabolism by increasing number and activity of both osteoblasts and osteoclasts. Total alkaline phosphatase correlated positively with N-Mid OC and b-CTX, whereas no significant correlation was found between bone formation marker and ICTP. Thus, it wasn’t shown that this parameter could be a marker of choice in this patient group. A significant difference has been found by comparing the mean values of all measured biochemical markers between patients and Control group.
|
| الكلمات المفتاح: الحثل العظمي الكلويRenal Osteodystrophy، هرمون الدريقة الكاملIntact Parathyroid Hormone، ببتيدات النهاية C الانتهائية للكولاجين نمط I Type I Collagen C-terminal telopeptides (ICTP). |
| المقدمة Introduction |
يعرّف الداء الكلوي المزمن Chronic Kidney Disease (CKD) بأنه تخرّب كلوي أو نقص في مستوى وظيفة الكلية لئلاثة أشهر أو أكثر (1)، يؤدي فيما بعد إلى نقص الرشح الكبيبيGlumerular Filtration Rate (GFR). وبنقص هذه الأخيرة، يزيد احتمال حدوث العديد من الأدواء المميتة المرافقة مثل فرط ضغط الدم، فقر الدم، ضخامة البطين الأيمن، نقص ألبومين الدم، فرط فسفات الدم Hyperphosphatemia، نقص كالسيوم الدم Hypocalcemia وفرط الدريقة الثانوي.
يعد شذوذ استقلاب المعادن شائعاً في الداء الكلوي المزمن CKD، حيث تزداد فسفات المصل وينقص 1.25 Dihydroxy vit. D3 مبكراً في سياق المرض، بينما يعد نقص كالسيوم الدم مظهراً متأخراً فيه. تساهم هذه الشذوذات الثلاثة بمجملها في ازدياد مستوى هرمون الدريقة Parathyroid Hormone PTH وفرط الدريقة الثانوي اللذان يعدان نتاجاً لـ CKD. يقود فرط الدريقة الثانوي إلى فرط تنسج غدة الدريقة.
تترافق الشذوذات العظمية الاستقلابية مع خلل وظيفة الكلية والتي تعرف بمجملها بالحثل العظمي الكلوي Renal Osteodystrophy. يعد مرضى هذا الداء ضمن هامش اختطار risk متزايد لكسور الورك والعمود الفقري (2). يضم هذا الداء عدة أشكال من الشذوذات العظمية الاستقلابية منها: التهاب العظم الليفيOsteitis Fibrosa، تليّن العظام Osteomalacia، والداء العظمي الواهن Adynamic Bone Disease. يتطور التهاب العظم الليفي نتيجةً لازدياد مستوى PTH الذي يزيد بدوره عدد وفعالية بانيات وناقضات العظم (تقلّب عظمي مرتفع). ويتطور تليّن العظام نتيجة عوز 1,25(OH)2D3، ويتميز بوجود عظم غير متمعدن وسطوح متآكلة. بينما ينقص في الداء العظمي الواهن تشكل وارتشاف العظم (تقلّب منخفض) (3).
يطلب عادةً خزعة العظام لتحديد نمط الحثل العظمي الموجود بدقة، لكن لم يلقَ هذا الإجراء تقبلاً عاماً لكثير من الأسباب. لذلك نصح الباحثون بمتابعة قياس الـ PTH مع الواصمات العظمية الكيميائية الحيوية عند المرضى الذين يُتوقع عندهم حدوث الشذوذات العظمية مع انحدار وظيفة الكلية. يمكن إلقاء نظرة معمقة على التقلّب العظمي بشكل غير مباشر بواسطة الواصمات الكيميائية الحيوية لتشكل وارتشاف العظم التي تعكس فعالية بانيات وناقضات العظم. تعد واصمات تشكل العظم منتجات خلايا بانيات العظم مثل: الفسفاتاز القلوية العظمية، الأوستيوكالسين، وطليعة ببتيد البروكولاجين نمط I، حيت ينتج الأخير بعد شطر جزيئة البروكولاجين. يعد الكولاجين نمط I المكون الرئيسي لمطرس العظم، ويؤلف الأوستيوكالسين معظم البروتينات غير الكولاجينية المطرسية. ويبدو أن الأوستيوكالسين والفسفاتاز القلوية كلاهما يلعب دوراً هاماً في تمعدن مطرس العظم. يمكن أن يُقيم ارتشاف العظم بمنتجات تدرّك الكولاجين نمط I مثل: الروابط المتصالبة في النهاية الكربوكسيلية b-Crosslaps وICTP التي تعاير في المصل، والروابط المتصالبة في النهاية الأمينية NTX التي تعاير في البول. يوجد ICTP بشكل فعال منا
عياً في المصل والذي يبدو أنه مشتق من ارتشاف وتدرّك العظام والنسج الضامة. وُجد مؤخراً أن مستضد ICTP يتنج من خلال فعل إنزيمات Metalloproteinases المطرسية المتورطة في تدمير النسج بحالات مرضية مختلفة. وبالتالي، تشاهد مستويات مرتفعة من ICTP في الحالات المصحوبة بانحلال متزايد في العظم مثل: النقيوم المتعدد (4)، النقائل العظمية (5)، التهاب المفصل الرثياني، والتثبيت (6). كمل يزداد ICTP في الداء السكري مما يقترح أن الاعتلال الكلوي السكري يساهم في فقدان العظم باضطراب نظام IGF (7).
يتنج الأوستيوكالسين والفسفاتاز القلوية خلال الأطوار المختلفة من تمايز البانيات في
المختبر In vitro (8)، بينما ترتبط المستويات
المصلية لهذه المتثابتات مع معدل تشكل العظم في الأحياء In vivo والتي حُددت من خلال دراسة حركيات وتوازن الكالسيوم (9) وقياس الأشكال النسيجية Histomorpho-metry (10). أثبتت الدراسات المجراة على مرضى تخلخل العظام فائدة المتثابتات الكيميائية الحيوية بسبب نوعية وحساسية كل من N-Mid OC و ?-CTX المعايرة بالتألق المناعي الكهربائي عالي الحساسية واستجابتها للتداخلات الدوائية في علاج تخلخل العظام في العديد من الحالات المرضية (11)، بما فيها الحثل العظمي الكلوي (12، 13). كما أثبتت معولية الفسفاتاز القلوية الكلية كواصم تشكل عظمي بدلاً من الفسفاتاز القلوية العظمية نظراً لارتباطها الجيد مع N-Mid OC، في حال غياب الأدواء الكبدية والدموية عند المرضى (14). هدفت دراستنا لتحديد الفائدة التشخيصية لواصمات تشكل وارتشاف العظم، ودراسة ICTP كواصم ارتشاف عظمي حديث التطبيق على مرضى الفشل الكلوي ممن لم يخضعوا للديال الدموي أو البريتواني من قبل.
|
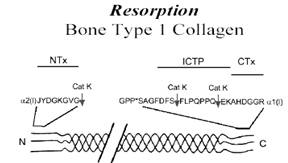
الشكل 1: مواقع الشطر البروتيني لإنزيم الكاثيبسين-K ومستضدات الواصمات العظمية في النهاية الأمينية والكربوكسيلية. |
| المرضى والطرق Patients & Methods |
المرضى Patients
ضمّت الدراسة 46 مريض فشل كلوي مزمن قبل الديال Predailysis (21 ذكر، 25 أنثى)، كانوا يراجعون قسمي الكلية في مستشفيي المواساة والأسد الجامعي في جامعة دمشق. معدل أعمارهم 53 ± 14.7 سنة. وكان متوسطا متثابتي اليوريا والكرياتينين لديهم 220 ± 139.5 و7.8 ± 8.4 مغ/دل على الترتيب، مما يشير إلى حالة فشل كلوي صريح. لم يكن أحد من هؤلاء المرضى خاضعاً لإجراء الديال الدموي أوالبريتواني أو لعملية اغتراس كلية لتصحيح وظيفة الكلية.
كما تضمنت هذه الدراسة 50 من الأفراد الأسوياء (28 ذكر، 22 أنثى)، ومعدل أعمارهم 45.78 ± 9.9 سنة، للمقارنة مع مجموعة المرضى من حيث العمر والجنس. وأُخذ بالحسبان عند انتقاء هذه المجموعة استبعاد أفراد الفشل الكلوي المزمن والخاضعين للديال ومرضى اغتراس الكلية، لما لهذه العوامل من أثر كبير على التقلّب العظمي لديهم. كان الأفراد الأسوياء من المراجعين لوحدة سحب الدم في مستشفى الأسد الجامعي، ولم يكن أي منهم مصاباً بتخلخل العظام Osteoporosis المحدد من قبل منظمة الصحة العالمية WHO (قيمة T أقل من -2.5).
الطرق Methods
أخذت عينات الدراسة من دم المرضى والأسوياء بين الساعتين 8 و 9 صباحاً بعد فترة صيام طوال الليل، لتجنّب التغيرات اليوماوية التي تصيب كلاً من الأسيتوكالسين (15) و b-CTX (16). حيث بُزل الدم على أنبوب جاف وأنبوب حاوٍ على EDTA-3K كعامل مضاد للتخثر من شركة Becton Deckinson®. جُمّد المصل والبلازما بالدرجة -80?م إلى حين إجراء المقايسات. قيست المستويات المصلية لتراكيز الكالسيوم، الفسفات، اليوريا، الكرياتينين، والفسفاتاز القلوية الكلية بواسطة المحلل الآليHitachi 912® الذي يعتمد على المقايسات اللونية المعيارية لشركة روش الألمانية. كما قيست المستويات المصلية لواصمات تقلّب العظم بما فيها: هرمون الدريقة الكامل iPTH، شدفة النهاية الأمينية المتوسطة للأوستيوكالسين N-Mid Osteocalcin، الروابط المتصالبة للكولاجين نمط I: b-Crosslap، بواسطة المحلل الآلي Elecsys 2010® الذي يعتمد على المقايسات المناعية بالتألق الكهربائي الكيميائي ECLIA عالية الحساسية من شركة روش الألمانية. بينما قيست مستويات ICTP Type I Collagen Crosslinked (Telopeptide)، واصم الارتشاف حديث التطبيق، بعتيدة تعتمد على المقايسة المناعية الشعاعية التقليدية RIA من شركة أوريون الفنلندية.
الإحصائيات:
عُبر عن النتائج بقيمة (المتوسط ± الانحراف المعياري) واستعمل اختبار T student لتحليل الاختلاف بين المتوسطات، واستعمل معامل الارتباط Pearson لمعرفة الارتباط بين المتثابتات واعتبرت القيمة P<0.05 ذات أهمية إحصائية يعتد بها. |
| النتائجResults |
من خلال النتائج التي حصلنا عليها، لاحظنا فرط قيم الواصمات الكيميائية الحيوية (الجدول 1).
الجدول 1: قيم المتثابتات والواصمات العظمية الكيميائية الحيوية المدروسة.
ReferenceRange |
Mean ± SD |
Biochemical Marker |
8.4 – 10.2 |
8.6 ± 1.9 |
Ca (mg/dl) |
2.7 – 4.5 |
6.98 ± 3.4 |
P (mg/dl) |
10 – 50 |
220.2 ± 139.5 |
Urea (mg/dl) |
0.7 – 1.2 |
7.75 ± 4.37 |
Creatinine (mg/dl) |
39 – 270 |
304.7 ± 156.1 |
t-ALP (U/L) |
15 – 65 |
278.9 ± 218.4 |
iPTH (pg/ml) |
Men up to 46
Women up to 48 |
123.7 ± 80 |
N-Mid OC (ng/ml) |
Men up to 0.3
Women up yo 0.5 |
1.9 ± 1.13 |
b-CTX (ng/ml) |
Male 1.4-5.2
Female 1.6-5.3 |
78.1 ± 85.13 |
ICTP ( µ g/L) |
|
ارتبط الكالسيوم سلبياً مع الفسفات (r = -0.47, P = 0.004) ومع اليوريا (r = -0.49, P < 0.0001) بارتباطات ذات دلالة إحصائية يعتد بها، وهذا يعد منطقياً لأن هؤلاء المرضى يعانون من نقص كالسيوم الدم، أحد اختلاطات الداء الكلوي المزمن المتأخرة. يزيد هذا الاختلاط الـPTH وذلك بإطالة نصف عمر PTH mRNA (17)، وترتبط البروتينات السيتوزولية من غدة الدريقة مع تتالي في المنطقة 3َ غير المترجمة الحساسة للتدرّك وبالتالي تثبت النسخة (18).
كان الارتباط الأبرز للفسفات مع اليوريا (r = 0.89, P < 0.0001) والمعروف أنه يحصل احتباس الفسفات مع نقص الوظيفة الكلوية مما يحرّض مباشرةً إفراز PTH وفرط تنسـج غدة الدريقة الذي يؤدي بدوره
إلى زيادة إضافية في مستوى هذا الهرمون في النماذج الحيوانية (19).
وكان الارتباط الإيجابي القوي بين اليوريا والكرياتينين (r =0.87, P<0.0001) مؤشراً طبيعياً على فرط هذين الواصمين مع انحدار الوظيفة الكلوية.
يعد PTH الواصم الأكثر استعمالاً في تقييم التقلّب العظمي، فقد بيّن Hutchison وزملاؤه أن مستويات PTH الأقل من65 pg/ml ذات حساسية 88% ونوعية 91% في تشخيص الداء العظمي الواهن، بينما تعد المستويات الأكثر من 200 pg/ml ذات حساسية 83% ونوعية 88% لتشخيص التهاب العظم الليفي (20). وجدنا في دراستنا حوالي 11% من المرضى لديهم داء عظمي واهن مع تقلّب عظمي منخفض، بينما كانت النسبة المئوية للذين لديهم التهاب العظم الليفي بفرط التقلّب حوالي 54.35%.
لاحظنا ارتباط الـ iPTH مع كل من N-Mid OC (r =0.6, P<0.0001) و b-CTX (r =0.49, P<0.0001). وهذا يعكس زيادة الاستقلاب العظمي عبر زيادة عدد وفعالية بانيات وناقضات العظم عند معظم المرضى. كما ارتبطت الفسفاتاز القلوية الكلية t-ALP مع b-CTX (r =0.39, P<0.0001)، وكذلكN-Mid OC مع b-CTX (r =0.47, P<0.0001). بينما لم تلاحظ وجود علاقات هامة يعتد بها بين واصمات التشكل العظمي أي الفسفاتاز القلوية الكلية وN-Mid OC مع واصم الارتشاف ICTP حديث التطبيق في دراستنا، مما يدل على أن b-CTXلا يزال ذو معولية أكبر في رصد حوادث الاقترانCoupling events في الصياغة وإعادة الصياغة العظمية. كان لـ ICTP علاقة هامة مع b-CTX (r =0.6, P<0.0001)، يعود ذلك إلى التحرر المتأخر لهذا الببتيد بعد تحرر الروابط المتصالبة ?-Crosslaps عند حدوث التدرّك في الكولاجين نمط I .
وقمنا بمقارنة متوسطات قيم المتثابتات المدروسة بين مجموعتي المرضى والأسوياء، فوجدنا أن كل المتثابتات أظهرت فروقاً ذات دلالة إحصائية يعتد بها (P<0.0001)، ( الشكل 1 و 2).
يبين الجدول 2 أهم الارتباطات التي حصلنا عليها بين المتثابتات المدروسة. |
المناقشة والاستنتاج
Discussion and Conclusion |
|
يعد مرضى الداء الكلوي بالمرحلة النهائية ضمن هامش اختطار متزايد لحدوث كسور الورك والعمود الفقري، كما يعد المصابون بالداء العظمي الواهن ضمن هامش الاختطار الأكبر. فقد بينت دراسة إحصائية في الولايات المتحدة أجريت على الرجال والنساء المصابين بالفشل الكلوي خضعوا حديثاً للديال بين عامي 1989 - 1996 على زيادة عدد حالات كسور الورك، وكان الاختطار النسبي لكسور الورك بالنسبة للرجال والنساء بـ 4.44 و 4.4 أعلى على الترتيب بالمقارنة مع أفراد أسوياء من العمر نفسه والجنس (21).
|
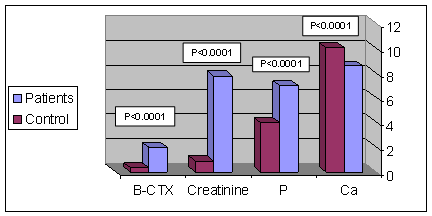
الشكل 1: متوسطات متثابتات الكالسيوم، الفسفات، الكرياتينين، و
b-CTX بين المرضى (46 مرضاً) والأسوياء (50 فرداً ).
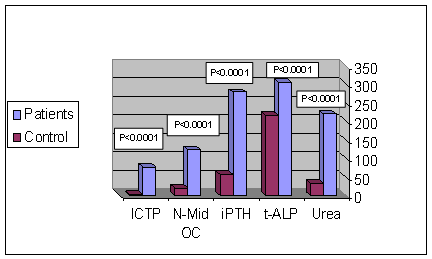
الشكل 2: متوسطات متثابتات اليوريا، الفسفاتاز القلوية الكلية، هرمون الدريقة الكامل، الأوستيوكالسين، و ICTP ، بين المرضى (46 مريضاً) والأسوياء (50 فرداً) . |
الجدول 2: الارتباطات التي يعتد بها إحصائياً بين المتثابتات المدروسة لدى مرضى الفشل الكلوي المزمن قبل الديال (n=46 مريضاً).
p |
r |
Correlated Parameters |
0.004 |
-0.47 |
Ca vs P |
<0.0001 |
-0.49 |
Ca vs Urea |
<0.0001 |
0.89 |
P vs Urea |
<0.0001 |
0.87 |
Urea vs Crea |
<0.0001 |
0.36 |
Urea vs iPTH |
<0.0001 |
0.42 |
Crea vs iPTH |
<0.0001 |
0.39 |
Crea vs B-CTX |
<0.0001 |
0.41 |
Crea vs ICTP |
<0.0001 |
0.6 |
iPTH vs N-Mid |
<0.0001 |
0.49 |
iPTH vs B-CTX |
<0.0001 |
0.39 |
t-ALP vs B-CTX |
<0.0001 |
0.47 |
N-Mid vs B-CTX |
<0.0001 |
0.6 |
B-CTX vs ICTP |
|
قامت العديد من الدراسات بقياس الواصمات الكيميائية الحيوية على هذه المجموعة من المرضى. فقد وجد Rix M وزملاؤه فرط جميع الواصمات العظمية المطبقة بما فيها :P, PTH, b-ALP, OC في المصل في الأطوار المتقدمة من الفشل الكلوي مع نقص مستويات الكالسيوم الشاردي، كما أبدت الواصمات العظمية ارتباطات إيجابية هامة إحصائياً مع iPTH (22)، وهذا يتطابق مع نتائج دراستنا إذ كان للـiPTH الارتباطات نفسها وكان أقواها مع الأوستيوكالسين وb-CTX.
وأشار Kumchev وزملاؤه إلى وجود الحثل العظمي الكلوي بأكثر من 50% في مرضى الفشل الكلوي بالمرحلة النهائية (23)، وهذا يتفق إلى حدٍ ما مع نتائج دراستنا لأن مجموع النسبة المئوية للمصابين بالتقلّب العظمي المرتفع والمنخفض كان 63% من مجموع المرضى.
وأوضح Kazama وزملاؤه أفضليةiPTH كواصم غير مغير في تحديد نوع التقلّب العظمي فقد أجرى مقارنة بين iPTH وWhole PTH ولم يجد فروقاً هامة في مجموعة الفشل الكلوي قبل الديال (24). من ناحيةٍ أخرى، وجد Okabe R وزملاؤه ارتباطاً وثيقاً بين الأوستيوكالسين و b-CTX عند مرضى فرط الدريقة (r =0.79, P=0.0003) وخلص إلى أن مقايسة b-Crosslaps توفر وسيلةً ذات فائدة في تحري ارتشاف العظم (25)، وهذا ما أكدته نتيجة الارتباط الإيجابي الذي يعتد به إحصائياً بين المعلمين في دراستنا. ومن خلال تقييم أداء ICTP لاحظنا أن هذا الأخير يمكن أن يعكس حالة الارتشاف العظمي التي يعاني منها مرضى الفشل الكلوي بالمرحلة النهائية قبل الديال فقد ارتبط بشكل إيجابي يعتد به إحصائياً مع b-CTX، إلا أن هذ الارتباط الذي لا يعتد به مع أي من iPTH أو N-Mid OC لايجعل هذا الواصم مرشحاً لأن يأخذ دورb-CTX في تقييم حالة الارتشاف العظمي بدقة. لذلك، لا يزال كل من N-Mid OC و b-CTX أحد أهم الواصمات النوعية جداً في تقييم الحالة السريرية لاستقلاب العظم (26) والتي تتميز بخصائص الاقتران في الأحياء In vivo (27).
|
| المراجع References |
1-National Kidney Foundation NKF, kidney disease outcome quality initiative, advisory board.Clinical practice guidelines for chronic kidney disease: evaluation, classification, and stratification.
Am. J. Kidney Dis., 39 (2 suppl 2): S1-246, 2002.
2-Atsumi K. et al.
Risk factors for vertebral fractures in renal osteodystrophy.
Am. J. kidney Dis. 33: 287-293, 1999.
3-Robert F. Reilly.
Disturbance of mineral meta-bolism in chronic kidney disease.
Hospital Physician. May 2003.
4-Fonseca R. et al.
Prognostic value of serum markers of bone metabolism in untreated multiple myeloma patients.
Br. J. Haematol. 109: 24-29, 2000.
5-Horiguchi T. et al.
Usefulness of serum carboxy-terminal telopeptide of type I collagen ICTP as a marker of bone metastasis from lung cancer.
Jpn. J. Clin. Oncol., 30: 174-179, 2000.
6-Aman S. et al.
Prediction of disease progress in early rheumatoid arthrathis by ICTP, RF, and CRP. A compa-rative 3-year follow-up study.
Rheumatology, 39: 1009-1013, 2000.
7-Jehle P. M. et al.
Serum levels of insulin-like growth factor system compoents and relationship to bone metabolisime in type 1 and type 2 diabetes mellitus patients.
J. Endo., 159, 297-306, 1998.
8-Negri A.L. et al.
Osteoporosis following heart transplantation.
Transplant. Proc., (28): 3321-3324, 1996.
9-Charls P. et al.
Assessment of bone formation by biochemical markers in metabolic bone disease: separation between osteoblastic activity at the cell and tissue level.
Calcif. Tissue. Int., (51): 406-411, 1992.
10-Eriksen E.F. et al.
Serum markers of type collagen I formation and degredation in metabolic bone disease: correlation with bone histomorphometry.
J. Bone. Miner. Res., (8): 129-132, 1993.
11-Hosami S. and Al-Fahoum S.
Bone homeostasis and the laboratory diagnosis of bone turnover. Master thesis,197, 2002.
12-Urena P et al. Circulating biochemical markers of bone remodeling in uremic patients.
Kidney Int., 55(6) :2141-2156, 1999.
13-Bervoets A.R. et al.
Useful biochemical markers for diagnosing renal osteodystrophy in predialysis end-stage renal failure patients.
Am. J. Kidney. Dis., 41(5): 997-1007, 2003.
14-Kanama A.. and Al-Fahoum S.
The application of bone formation and resorptive markers for growth study in normal and pathologic states.
Master thesis, 159, 2003.
15-Allison J.L. et al.
Measurement of osteocalcin.
Ann. Clin. Biochem., 37: 432-446, 2000.
16-Reiko O. et al.
Clinical evaluation of the Elecsys B-Crosslaps serum assay, a new assay for degradation products of type I collagen C-terminal telopeptides.
Clinical Chemistry. (47:8) 1410-1414, 2001.
17-Moallem E. et al.
RNA-protein binding and post-trnscriptional regulation of parathyroid hormone gene expression by calcium and phosphate.
J. Biol. Chem., 273: 5253-5259, 1998.
18-Kilav R. et al.
A conserved cis-acting element in the parathyroid hormone 3`-untranslated region is sufficient for regulation of RNA stability by calcium and phosphate.
J. Biol. Chem., 276: 8727-8733, 2001.
19-Slatopolsky E et al.
Phosphorus restriction prevents parathyroid gland growth. High phosphorus directly stimulates PTH secretion in vitro.
J. Clin. Invest., 97: 2534-2540, 1996.
20-Hutchison A.J. et al.
Correlation of bone histology with parathyroid hormone, Vit. D3, and radiology in end stage renal disease.
Kidney Int., 44: 1071-1077, 1993.
21-Alem A.M. et al.
Increased risk of hip fracture among patients with end-stage renal disease.
Kidney Int., 58: 396-399, 2000.
22-Rix M. et al.
Bone mineral density and biochemical markers of bone turnover in patients with predialysis chronic renal failure.
Kidney Int., 56(3): 1084-1093, 1999.
23-Kumchev E.P. et al.
Assessment of serum osteocalcin level in predialysis patients with chronic renal failure.
Folia Med (Plovdiv). 42(1): 14-18, 2000.
24-Kazama J.J. et al.
Circulating 1-84 PTH and larg C-terminal PTH fragment levels in uremia.
Clin. Exp. Nephrol., 7(2): 144-149, 2003.
25-Okabe R. et al.
Clinical evaluatiuon of Elecsys-Crosslaps serum assay, a new assay for degredation products of Collagen type I C-telopeptides.
Clin. Chem., 47(8): 1410-1414, 2001.
26-Polak-Jonkisz D. et al.
Usefulness of osteocalcin and crosslaps as markers of bone turnover in children with chronic renal failure.
Pol. Merkuriusz Lek.12(70): 257-260, 2002.
27-Peichl P. et al.
Serum crosslaps in comparison to serum osteocalcin and urinary bone resorption markers.
Clin. Biochem., 34(2): 131-139, 2001.
|
| |
| |
| المجلد 3 , العدد 5 , شعبان 1425 - تشرين الأول (أكتوبر) 2004 |
|
|
|
