| الملخص Abstract |
| تمت دراسة مستوى GH المصل بتطبيق اختباري تنبيه: كلونيدين، وبروبرانولول + غلوكاكون لدى 50 طفلاً من المقبولين في قسم الأطفال، بتأخر نمو و/ أو تأخر بلوغ، في مستشفى الأسد في اللاذقية.
إن الأطفال الذين أبدوا قيماً منخفضة لـ GH المصل بعد التنبيه بالكلونيدين والذين بلغت نسبتهم 30% من الحالات، أظهروا قيماً سوية في المقايسة الثانية بواسطة التنبيه بـ (بروبرانولول + غلوكاكون) وبفارق يعتد به إحصائياً.
نستنتج أن اختبار التنبيه بالكلونيدين لا يكفي وحده لنفي عوز GH أو تأكيده عند الأطفال، وأن الاختبار الثاني (بروبرانولول + غلوكاكون) كان ذا فعالية أكبر في تنبيه إفراز GH وبفارق هام.
يؤكد كل ما سبق أهمية إجراء اختباري تنبيه اثنين أمام كل حالة قصر قامة لتشخيص عوز هرمون النمو.
|
| The studying of serum's GH level was performed by using two stimulation tests: Clonidine, and (Propranlolo + Glucagon), for fifty children accepted with growth deficiency and / or delayed puberty at Al Asad University Hospital in Lattakia.
The children who showed low values of serum's growth hormone by using Clonidine stimulation test (Their percentage is 30%), showed normal values in the second titration by using (Propranolol + Glucagon) stimulation test, and with a statistically significant difference.
That indicates to the fact that the Clonidine stimulation test is not enough for negation or confirmation the deficiency of growth hormone
for children, and the second test (Propranolol + Glucagon) was more active for stimulation of GH secretion and with an important variation.
All what we mentioned assures the importance of using two stimulation tests for diagnosis of GH deficiency for any states of short stature.
|
| المقدمة Introduction |
1-الغدة النخامية Pituitary Gland
النخامية غدة صماوية بيضوية تزن حوالي 0.5 – 1 غ وهي تقيس 6×10×13 مم. وتقع في قاعدة الدماغ تحت الوطاء ضمن تجويف عظمي يدعى بالسرج التركي، وهي تتصل بالوطاء بواسطة السويقة النخامية.
تقسم النخامية فيزيولوجياً إلى قسمين بارزين: النخامية الأمامية وتعرف أيضاً بالنخامية الغدية، والنخامية الخلفية أو النخامية العصبية.
جنينياً: ينشأ كل قسم من مصدر مختلف، فالنخامية الأمامية تنشأ من جيب Rathke والذي هو عبارة عن انغلاف جنيني من الظهارة البلعومية، أما النخامية الخلفية فتنشأ من قاع البطين الثالث.
يفسر منشأ النخامية الأمامية من الظهارة البلعومية الطبيعة شبه الظهارية لخلاياها، أما منشأ النخامية الخلفية من نسيج عصبي فيفسر وجود عدد كبير من الخلايا الدبقية في هذه الغدة (1).
النخامية الأمامية (الغدية)
تعد الجزء الأسـاسي من الغدة النخاميـة
لأنها تشكل حوالي 75% من الغدة ككل وهي تركب وتطلق إلى الدوران عدداً من الهرمونات والحاثات الببتيدية أو الببتيدية السكرية (11).
تحوي النخامية الأمامية على الأقل خمسة نماذج مختلفة من الخلايا المفرزة، وباستعمال ملونات خاصة مرتبطة بأضداد ذات جاذبية عالية ترتبط مع الهرمونات المميزة تم تفريق الأنماط الخلوية المختلفة بعضها عن بعض وهي:
1- الموجهة الجسديةSomatropes أي هرمون النموhuman growth hormone (hGH)
2- هرمون موجهة قشر الكظر (الموجهة القشرية)adrenocorticotropin hormone (ACTH)
3- الهرمون المنبه للدرقية
thyroid-stimulating hormone (TSH)
4- موجهة الغدد التناسلية (حاثات الأقناد) Gonadotropins وهي تتضمن: الهرمون المنبه للجريب (FSH) follicle stimulating hormone والهرمون الملوتن (LH) luteinizing hormone
5- هرمون اللاكتـوتروبينLactotropin ،
أي البرولاكتين (PRL) prolactin.
2- هرمون النمو GH
- البنية: هو بروتين مؤلف من 191 حمضاً أمينياً، جينه GH 1 هو الأول في عنقود مؤلف من خمس جينات مرتبطة مع بعضها تقع على الذراع الطويل للصبغي 17، وتملك الجينات الأربع الأخرى تماثلاً homology بنسبة 90% مع الجين GH 1 (1).
يعرف هرمون النمو بالموجهة الجسدية Somatotropin بسبب تأثيراته المحرضة لنمو الجسم وهو الهرمون الأكثر وفرة في النخامية حيث أن 30 – 40% من خلايا النخامية الأمامية هي Somatotropes.
- تأثيراته الفيزيولوجية: هو هرمون ابتنائي يحرض تركيب البروتينات، حال للشحوم، مدر للبن، ومسبب للداء السكري بواسطة ازدياد المقاومة للأنسولين، بالإضافة إلى أن GH يحرض إفراز السوماتوميدين Somatomedin (IGF-I) من الكبد والذي يعد مع GH والهرمون الدرقي مكونان للغضاريف عند الأطفال (3).
- الإفراز: يفرز هرمون النمو من النخامية الأمامية ويسيطر على إفرازه بشكل رئيسي هرمونان وطائيان:
1- الهرمون المطلق لهرمون النمو GHRH، يحرض الإفراز.
2- السوماتوستاتين Somatostatin، يثبط.
فالإفراز المتناوب من GHRH و Somatostatin هو المسؤول عن الإفراز النظمي لـ GH، الشكل 1.
يفرز GH بشكل نبضي، ويكون الإفراز أعظمياً خلال المرحلة الثالثة والرابعة من النوم أي بعد 90 دقيقة من بدء النوم (5).
يحرض إفراز GH كل مما يلي: الشدة العاطفية، التمرين، الجراحة، الوجبات الغنية بالبروتين، نقص السكر، في حين يتثبط إفراز GH بزيادة السكر كذلك بوجود الحرمان العاطفي عند الأطفال.
العمر أيضاً عامل مهم حيث يكون إفراز GH عالياً عند الولادة وينخفض مع تقدم العمر باستثناء زيادة هامة في الإفراز خلال فترة المراهقة (6). الشكل 2.
3- النمو الطبيعي:
يمر النمو الطبيعي بأطوار أربعة منذ الولادة وحتى بلوغ الطول النهائي، ويعتمد الطول الطبيعي على جهاز غدي سالم داخلي وهيكل عظمي سالم (7).
يكون الطول الوسطي للأطفال عند الولادة حوالي 50 سم ثم يزداد 25 سم في السنة الأولى من الحياة، و 12.5 في السنة الثانية، ثم 6 سم كل عام حتى البلوغ. ولقـد أنشـئت مخططـات المعادلــة nomograms لتعطي صورة أكثر دقة من معدل النمو ومجال الانحرافات الطبيعية عن
الوسطي. الشكل 3.
- ضبط النمو:
يتأثر النمو بالعوامل التالية:
آ- النمو داخل الرحم: يعكس التطور داخل الرحم تعقيدات تكامل وضبط النمو، ويكون معدل النمو أكثر سرعة خلال الثلث الثاني من الحمل (2)، ويعد نقص النمو داخـل الرحم مسؤولاً عن 10% من أسباب قصر القامة (7).
ب- عوامل وراثية: هناك ارتباط بين الطول
الوسطي للأهل والأطوال الوسطية لأولادهم.
ج- التغذية: وهي من أهم العوامل المكتسبة
المؤثرة على النمو، فالحرمان الغذائي الشديد والمدديد كما في السَغَل Marasmus أو القَشَر Kwashoirkor يضعف النمو بشكل واضح.
د- عوامل هرمونية:
* هرمون النمو GH: يلعب الدور الرئيسي في النمو منذ الولادة وحتى إتمام البلوغ.
* عوامل النمو المشبهة بالأنسولين Insulin-like Growth Factor (IGF): أو ببتيدات السوماتوميدين التي تتوسط معظم التأثيرات المحرضة للنمو التي يقوم بها GH، وأهمها IGF-I وIGF-II.
* الهرمونات الدرقية: تؤثر على استقلاب الخلايا، ويضعف نقصها إفراز GH كاستجابة على التنبيه، كما أن تأثير الـ IGF-I على الخلايـا الغضروفيـة يمكن أن
يعتمد على الهرمون الدرقي.
* السـتيرويدات القندية: إن للأندروجيـنات
والأستروجينات دوراً رئيسياً محرضاً للنمو عند البلوغ.
* الأنسـولين: له تأثيـرات ابتنائية تتضمن
تنبيه تركيب البروتين والانقسام الخلوي، وهذا ما يفسر كبر حجم الجنين من أم سكرية بسبب السويات العالية من الأنسولين في دم الجنين.
هـ- عوامل نفسية اجتماعية: ويدخل ضمن سياقها القَزَامة نفسية المنشأ (بسبب الاضطهاد أو الحرمان العاطفي) (2).
قياس النمو: إن أخذ قياس طول واحد لا يمكن أن يعطي فكرة صحيحة عن النمو عند الطفل، لذلك لا بد من تحديد سرعة النمو لمعرفة فيما إذا كان الطول الحالي متأتياً عن نمو منتظم أو نتيجة تبدل في مسار مخطط النمو، لذلك لا بد من إسقاط أطوال الأطفال المقاسة على مخطط النمو المعتمد لمعرفة إن كـان النمو طبيعياًَ عندهم أم لا.
وقد اعتمدنا في بحثنا هذا على جداول الدكتور M.Sempe، باريس، لحساب الانحراف المعياري للطول لدى أطفال عينة الدراسة.
|
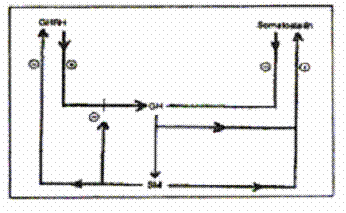
الشكل 1: مخطط يبين ضبط التلقيم الراجع لإفراز GH (2).
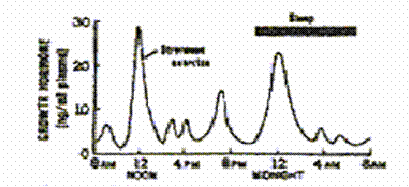
الشكل 2: مخطط يبين التغير الفيزيولوجي النموذجي لإفراز GH خلال اليوم، ويوضح التأثير الفعال لتمرين شاق على الإفراز، كذلك يوضح أن المعدل الأعلى لإفراز GH يحدث خلال الساعات الأولى من النوم العميق (1).
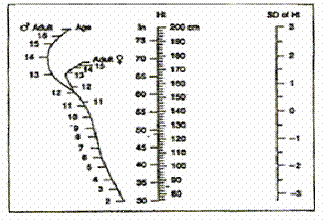
الشكل 3: مخطط معادلة الطول عند الذكور والإناث (2). |
4- قصر القامة Short Stature
يعد قصر القامة أحد مشاكل عيادات الأطفال، ويعود في أكثر من 70% من الحالات لأسباب بنيوية.
نعدُّ قِصَرَ القامة عرضاً مرضياً عند ترافقه بالعناصر التالية:
- الانحراف المعياري للطول يعادل - 2 أو أكثر عن الوسطي بالنسبة للعمر.
- اختلاف ما بين مستوى الطول الحالي للطفل (بالانحراف المعياري) والطول الهدفي المحسوب بدءاً من طول أبويه.
- سرعة نمو غير طبيعية بالنسبة للعمر، وخاصة تبدل مسار النمو عند الطفل (7).
أسباب قصر القامة: - أسباب غير غدية.
- أسباب غدية.
الأسباب غير الغدية:
1) قصر القامة البنيوي.
2) قصر القامة الوراثي (العائلي).
3) إعاقة النمو داخل الرحم.
4) تناذرات قصر القامة: تناذر ترنر.
5) الأمراض المزمنة مثل: الداء الزلاقي، التهاب الأمعاء الناحي، التليف الكيسي وغيرها.
6) سوء التغذية: وهو السبب الأكثر شيوعاً لقصر القامة.
الأسباب الغدية:
1) نقص هرمون النمو.
2) قصور الدرقية.
3) تناذر كوشينغ Cushing's Syndrome.
4) قصور الدرقية الكاذب.
5) اضطرابات استقلاب الفيتامين D.
6) الداء السكري.
7) البوالة التفهة (4).
|
5- عوز هرمون النمو عند الأطفال GHD
Growth hormone deficiency
يعد GHD سبباً نادراً لقصر القامة، إذ يشكل 1- 2% فقط من أسباب قصر القامة.
يتظاهر GHD عند الأطفال بقصر قامة وانخفاض سرعة النمو GV – Growth Velocity بالنسبة للعمر (5).
يعود عوز هرمون النمو غالباً لأسباب ورمية، ويعد الورم القحفي البلعومي أهم هذه الأورام إذ يشكل 30% من الحالات، وتشكل الأعواز مجهولة السبب أكثر من ثلث الحالات، أما الأسباب الوراثية فهي قليلة جداً.
تكون العلامات السريرية عند الأطفال المصابين بـ GHD قليلة جداً ما عدا في حالات العوز الخِلْقي، حيث يميل الطفل أميل للبدانة (بدانة جزعية)، مع أطراف نحيلة، وعند ترافق حالة نقص سكر الدم مع قضيب قصير توحي بقوة بحالة عوز خلقي لـ GH (7).
المواد والطرق Materials and Methods
- طريقة العمل:
تمت مقايسة هرمون النمو GH في المصل بواسطة المقايسة المناعية الإشعاعية IRIA باستخدام عتيدة Immunotech®.
يتم حضن العينات والعياري في أنابيب مبطنة بالضد الأول وحيد النسيلة مع إضافة ضد آخر وحيد النسيلة موسوم باليود المشع، ثم يرشف محتوى الأنابيب من السائل و تغسل بعد الحضن، وبعد ذلك تقاس الفاعلية الإشعاعية المرتبطة، ويلي ذلك حساب التراكيز باستخراجها من المنحني المعياري.
تتناسب الفاعلية الإشعاعية المرتبطة مباشرة مع تركيز هرمون النمو في العينة.
- جمع وتحضير العينات:
في البداية يجب إخضاع المريض لفترة صيام أثناء أخذ العينات
I. بروتوكول الكلونيدين Clonidine
* الساعة الثامنة صباحاً: يبزل 2 مل دم وريدي بشكل عقيم ويوضع في أنبوب جاف أو أنبوب يحوي Heparin أو EDTA (GH0).
يعطى الطفل جرعة من الكلونيدين قدرها 0.150 ملغ/م2 عن طريق الفم.
* الساعة التاسعة صباحاً: أي بعد 60 دقيقة من تناول الكلونيدين يتم بزل 2 مل دم وريدي وبنفس شروط البزل الأول (GH60).
II. بروتوكول بروبرانولول + غلوكاكون Propranolol + Glucagon
* الساعة السابعة صباحاً: يعطى الطفل جرعة من البروبرانولول (أنديرال) قدرها 40 ملغ عن طريق الفم.
* الساعة التاسعة صباحاً: يحقن 1 ملغ غلوكاكون حقناً عضلياً. يبزل 2 مل دم وريدي (GH0). ثم يبزل بعد 120 دقيقة من حقن الغلوكاكون 2 مل دم وريدي (GH120). ومن ثم يبزل 2 مل دم وريدي بعد 180 دقيقة من حقن الغلوكاكون (GH180) (8، 9).
|
النتائج Results
بما أن إفراز هرمون النمو نبضي، والقيم الأساسية لهرمون النمو في المصل ليست ذات أهمية تشخيصية فهي منخفضة كما هو حالها لدى مرضى عوز هرمون النمو، لذا لم نقم بإجراء مجموعة شاهدة.
تم عيار مستوى هرمون النمو في المصل لدى عينة الدراسة المؤلفة من خمسين طفلاً من المقبولين في قسم الأطفال بتشخيص تأخر نمو و/ أو تأخر بلوغ وبانحراف معياري للطول - 2 أو أكثر عن المقاييس العالمية وذلك بتطبيق بروتوكول الكلونيدين، فأبدى 35 طفلاً قمة إفرازية لهرمون النمو أعلى من 20 mU/L أي نسبة 70% من الحالات، أما الـ 15 طفلاً المتبقين فكان مستوى هرمون النمو لديهم أقل من المجال المحصور ما بين 15-20 mU/L أي نسبة 30% من الحالات
كما هو مبيّن في الجدول رقم 1.
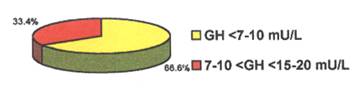
وقُسِّم الـ 15 طفلاً الذين أبدوا انخفاضاً في قيم GH إلى قسمين حسب مستوى GH كما هو مبيّن في الجدول 2.
أجريت مقايسة ثانية لمستوى GH المصل عند الـ 15 طفلاً المتبقين وذلك بإتباع بروتوكول (بروبرانولول + غلوكاكون) وذلك بعد أسبوع من المقايسة الأولى، فأبدى 11 طفلاً قمة إفرازية لـ GH المصل أعلى
|
الأولى، فأبدى 11 طفلاً قمة إفرازية لـ GH المصل أعلى
الجدول 1: مستوى هرمون النمو في المصل لدى عينة الدراسة.
مستوى GH المصل |
عدد الحالات |
النسبة المئوية |
GH > 20 mU/L |
35 |
70 % |
GH < 15-20 mU/L |
15 |
30 % |
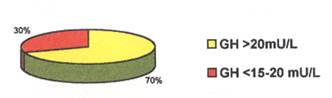
الجدول 2: عدد الأطفال ونسبتهم الذين أبدوا انخفاضاً في قيم GH.
مستوى GH المصل |
عدد الحالات |
النسبة المئوية |
GH < 7 mU/L |
10 |
66.6 % |
7 - 10 < GH < 15 - 20 mU/L |
5 |
33.4 % |
 |
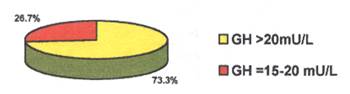
من 20 mU/L أي بنسبة 73.3% من الحالات، بينما كانت قيمة GH عند الأربعة أطفال المتبقين تتراوح ما بين 15-20 mU/L أي بنسبة 26.7% من الحالات، الجدول 3.
بعد حساب المتوسطات الحسابية لقيم GH المصل بعد التنبيه بالطريقتين، وانحرافها المعياري حصلنا على النتائج المدونة في الجدول 4.
|
- أجريت فحوص متممة أخرى لعينة الدراسة المؤلفة من 50 طفلاً وهي:
1- عيار IGF-1 في المصل.
2- عيار Free T4 و TSHus لتقصي سلامة الوظيفة الدرقية.
3- تعداد عام وصيغة دموية.
4- فحص براز عام.
5- فحص بول وراسب.
أما نتائج عيار IGF-1 فهي موضحة في الجدول 5.
كانت نتائج اختبارات وظائف الغدة الدرقية المذكورة آنفاً ضمن الحدود السوية لكل أطفال عينة الدراسة
أما نتائج فحص البراز فهي موضحة في الجدول 6:
أما نتائج فحص البول والراسب البراز فهي موضحة في الجدول 7:
أما نتائج التعداد العام والصيغة الدموية فهي موضحة في الجدول 8:
تمت دراسة متوسطات قيم GH بعد التنبيه بالطريقتين باستخدام القانون الإحصائي للمقارنة بين متوسطين حسابيين وكانت قيم الاختبار كالتالي:
- قيمة اختبار المقارنة t بين متوسط قيم GH60 عند تطبيق بروتوكول الكلونيدين ومتوسط قيم GH120 عند تطبيق (بروتوكول بروبرانولول + غلوكاكون) = 2.11.
- قيمة اختبار المقارنة t بين متوسط قيم GH60 عند تطبيق بروتوكول الكلونيدين ومتوسط قيم GH180 عند تطبيق (بروتوكول بروبرانولول + غلوكاكون) = 3.03.
نلاحظ مما سبق أن قيم الاختبار المحسوبة هي أعلى من قيم مؤشر الاختبار عند مستوى الدلالة 5% (2)، مما يعني وجود فارق معتد به إحصائياً في تبدلات قيم GH عند تطبيق بروتوكولي تنبيه مختلفين للطفل نفسه.
المناقشة Discussion
إذا استعرضنا النتائج العملية السابقة نلاحظ أن قيم GH المصل بعد ساعة واحدة من التنبيه بالكلونيدين كانت ضمن الحدود السوية أي أعلى من 20 mU/L عند 35 طفلاً أي بنسبة 70% من الحالات، أما الـ 15 طفلاً المتبقين أي 30% من الحالات فكانت قيم GH عندهم ناقصة عن الحدود السوية 15 - 20 mU/L
|
الجدول 3: عدد الحالات ونسبتها التي طُبق عليها بروتوكول (بروبرانولول + غلوكاكون).
مستوى GH المصل |
عدد الحالات |
النسبة المئوية |
GH > 20 mU/L |
11 |
73.3 % |
GH = 15 – 20 mU/L |
4 |
26.7 % |
الجدول 4: مستوى GH المصل عند 15 طفلاً وذلك بإتباع بروتوكول (بروبرانولول + غلوكاكون).
رقم الحالة |
HT
SD |
Clonidine |
Propranolol + Glucagon |
GH0 |
GH60 |
GH0 |
GH120 |
GH180 |
1 |
- 3.4 |
4.7 |
6.2 |
4.7 |
65.5 |
72 |
2 |
- 3 |
8.8 |
7.8 |
11.58 |
15.6 |
13.8 |
3 |
- 2.9 |
12.6 |
14.3 |
16.7 |
15.7 |
25.9 |
4 |
- 2 |
0.05 |
1.8 |
1.9 |
29.3 |
22.4 |
5 |
- 2.8 |
4.3 |
12.7 |
5 |
0.7 |
26.6 |
6 |
- 2.9 |
5.6 |
6.8 |
3.6 |
11.6 |
13.2 |
7 |
- 2 |
0.29 |
13.4 |
3.1 |
25.3 |
12.2 |
8 |
- 2.8 |
0.06 |
7.5 |
1.2 |
17.8 |
13.5 |
9 |
- 2.4 |
0.01 |
9.2 |
0.06 |
12.5 |
19 |
10 |
- 2 |
0.2 |
0.4 |
0.19 |
1.13 |
31 |
11 |
- 3.3 |
0.7 |
8.5 |
2.3 |
11 |
17.8 |
12 |
- 2 |
0.27 |
7.98 |
0.9 |
27.6 |
11.9 |
13 |
- 2 |
0.14 |
10.6 |
3.8 |
0.8 |
34.5 |
14 |
- 3.8 |
0.99 |
11.2 |
6.38 |
10.2 |
20.2 |
15 |
- 2.5 |
1.2 |
8 |
1.8 |
15.6 |
23.5 |
بروتوكول التنبيه |
المتوسط الحسابي X لقيم GH المصل |
الانحراف المعياري |
كلونيدين |
GH60 |
8.42 |
3.74 |
بروبرانولول +
غلوكاكون |
GH120 |
24.32 |
28.9 |
GH180 |
29.6 |
31.75 |
الجدول 5: عيار IGF-1 في مصل مجموعة الدراسة.
مستوى IGF-1 في المصل |
عدد الحالات |
النسبة المئوية |
ضمن الحدود السوية |
36 |
72 % |
أقل من الحدود السوية |
14 |
28 % |
الجدول 6: نتائج فحص البراز لدى مجموعة الدراسة.
فحص البراز |
طبيعي |
أكياس جيارديا |
بيوض أسكاريس |
قطيرات
دسمة |
خمائر فطرية |
عدد الحالات |
30 |
10 |
5 |
3 |
2 |
الجدول 7: نتائج فحص البول لدى مجموعة الدراسة.
فحص البول |
طبيعي |
بلورات |
كريات بيض |
هيموغلوبين في البول |
عدد الحالات |
36 |
12 |
1 |
1 |
الجدول 8: نتائج فحص الهيموغلوبين لدى مجموعة الدراسة.
عيار Hb |
Hb < 10 g /dl |
Hb = 10 – 12 g / dl |
Hb > 12 g / dl |
عدد الحالات |
6 |
35 |
9 |
|
وعند إجراء مقايسة ثانية لـ GH المصل بتطبيق بروتوكول تنبيه مضاعف عند الـ 15 طفلاً ممن أبدوا انخفاضاً في قيم GH المصل في المقايسة الأولى، أبدى 11 طفلاً قمة إفرازية لـ GH وأعلى من (20 mU/L) أي بنسبة 73% من الحالات، وأربعة أطفال كانت قيم GH تتراوح لديهم ما بين (15 -20 mU/L).
هذا يشـير إلى عدم إمكانية الاعتماد على التنبيه بالكلونيدين فقط لنفي عوز هرمون النمو في المصل أو تأكـيده، حيث أن جميع الحالات التي أبدت قيماً منخفضة باستخدام الكلونيدين أظهرت قيماً أعلى باستخدام بروتوكول بروبرانولول + غلوكاكون.
كذلك أظهرت الدراسة الإحصائية للفروق بين متوسطات قيم GH المصل الناتجة عن التنبيه بالطريقتين أن قيمة مؤشر الاختبار المحسوبة أعلى من قيمة مؤشر الاختبار المفترضة عند مستوى الدلالة 5% مما يعني وجود فـارق يعتد
به إحصائياً فيما بينهما.
إن ملاحظة انخفاض مستويات IGF-1 بنسبة 28% من الحالات دون ترافق ذلك مع انخفاض مماثل في مستويات GH يدل على أن مستويات IGF-1 في المصل لا تعكس بشكل دقيق مستوى GH المصل، ولا يمكن اعتباره مؤشراً له إلا في حالة نقص الاثنين معاً.
|
الاستنتاجات Conclusions
1- لا يمكن الاعتماد على مستوى GH المصل بعد ساعة واحدة من التنبيه بالكلونيدين في تشخيص عوز النمو عند الأطفال.
2- ضرورة إجراء اختباري تنبيه لدى كل حالة قصر قامة لنفي أو لتأكيد عوز هرمون النمو.
3- لا يمكن اعتبار انخفاض مستوى IGF-1 في المصل مؤشراً لعوز هرمون النمو.
|
المراجع References
1-Ghyton A.
Textbook of medical physiology, 7th Edition- W.B Saunders Company, U.S.A, 1986.
2-Hintz R.
Harrisons Principles of internal medicine, Volume 2 14th Edition-Challenger Corporation, U.S.A., 1998.
3-Henry J.
Clinical Diagnosis and mana-gement by laboratory methods, 19th Edition-W.B Saunders Company, U.S.A., 1996.
4-Francis S.
Greenspan and GRDON J. Strewler. Basic and clinical endocrinology, 5th Edition – De lange, U.S.A., 1997.
5-Prader A.
Clinical pediatric endocrinology, 3rd Edition – Blackwell science, London, 1995.
6-Wiliams.
Textbook of endocrinology, 9th Edition W.B Saunders Company, U.S.A., 1998.
7-Brauner R.
Conduite Pratique devant une anomalie de la croissance staturale. Encyl Méd chir (pediatrie) Paris, 4-005-A-10, 2-3, 1999.
8-Schlienger J.L.
Explorations Fonctionelles en endocrinologie et metabolisme, 2nd Edition, Expantion sientifique française, Paris. 1993.
9-Léger J.
L'hypophyse. Encyl Méd chir (pediatrie) Paris, 4107 D10, 1-2, 1990.
10- عجلوني أيمن ومارديني أحمد
المرجع في طب الأطفال نلسون، الطبعة الأولى، دار المعاجم للطباعة والنشر، دمشق، سورية، 1995.
11- درويش علي والمرعي منيف
أمراض الغدد الصم والاستقلاب، منشورات جامعة تشرين، كلية الطب. مطبعة دار الكتاب، دمشق، سورية، 1993- 1994.
|
| |
