| المجلد 3 , العدد 7 , صفر 1426 - نيسان (أبريل) 2005 |
| |
| عوز الفيتامين B12 (أسبابه، أعراضه وتشخيصه) |
| Vitamin B12 Deficiency (Causes, Symptoms and Diagnosis) |
| د. مها النابلسي |
| Al Nablssi M. |
| الملخص Abstract |
يؤدي تراجع وارد الفيتامين B12 من الغذاء أو وجود خلل في نقله واستقلابه إلى حدوث توازن سلبي لهذا الفيتامين، وينجم عنه ظهور عوز الفيتامين B12. ولا يمكن بقياس مستوى الفيتامين B12 الكلي استعراف تلك الحالات التي تحتاج إلى معالجة.
إن إجراء قياسات المستقلبات المعروف أنها تتراكم في عوز الفيتامين، مثل حمض الميثيل مالونيك (MMA) في البلازما والهوموسيستئين الكلي في البلازما، صعبة تحليلياً ومكلفة.
توفرت حديثاً وسيلة تشخيصية جديدة هي: تعيين الترانزكوبلامين الكامل (HoloTC) وهو بروتين النقل الذي يكون مرتبطاً بالكوبالامين الفاعل والمتوفر للنقل إلى الخلايا. يزودنا قياس الجزء (HoloTC) بحساسية تشخيصية عالية ويسمح باستعراف مبكر للمرضى المصابين بسوء امتصاص الفيتامين B12. |
The reduced uptake of B12 from food or problems with its transport and metabolism in the body can lead to negative B12 balance and subsequent deficiency. Measurement of total vitamin B12 level in the blood does not identify all of those in need of treatment.
Measurements of the metabolites known to accumulate in Vitamin deficiency, such as plasma methylmalonic acid (MMA) and plasma total homocysteine are analytically difficult and expensive to perform.
Recently, a new diagnostic tool has become available: determination of holotranscobalamin (HoloTC) that is the transport protein with selectively bound active cobalamin, available for transport into the cell. Measurement of the (HoloTC) fraction affords superior diagnostic sensitivity and allows early identification of patients with Vitamin B12 malabsorption. |
| المقدمة introduction |
تتجلى أهمية الفيتامين B12 (الكوبالامين Cbl) بدوره كتميم الإنزيم coenzyme في تفاعلين رئيسين داخل الخلايا: حيث يقوم الشكل الأدينوزيليِ منه (Adenosyl Cbl) داخل المتقدرات بدور التميم لإنزيم Methylmalonyl CoA-mutase في تحويل L- Methylmalony CoA إلى Succinyl CoA وهو تفاعل له صلة بحلقة حمض الليمون وبالتالي أهميته في استقلاب السكريدات والشحميات فقد لوحظ ازدياد تركيز حمض اللبن والبيروفات بين (50 – 100%) خلال عوزالكوبالامين (Cbl) من جراء تراكم L-Methylmalonyl CoA الذي يتحول إلىD-Methylmalonyl CoA ومن ثم إلىAcid Methylmalonic (MMA) الذي يؤثر تراكمه أيضاً على سلسلة اصطناع الحموض الدسمة الضرورية لاصطناع المييلين (Myelin) مما يفسر ظهور الأعراض العصبية المختلفة وأهميتها خاصة إذا علمنا أن Adenosyl Cbl يشكل القسم الأعظم (حوالي الثلثين) من خزين الفيتامين B12 في الجسم (6، 22، 25).
أما الشـكل الميثيلي Methyl Cbl والـذي يشكل ما يقارب ثلث خزين الفيتامين B12 في الجسم فهو المسؤول إلى جانب الفولات عن تحويل الهوموسيستئين Homocysteine إلى مثيونين Methionine كتميم لإنزيم مثيونين سينثاز Methionine synthase (MS) في ما يسمى بحلقة المثيلة (Methylation) حيث يقوم ميثيل الكوبالامين بنقل مجموعة ميثيلية من الركيزة 5-Methyl-tetrahydrofolate إلى الهوموسيستين مشكلاً المثيونين وتتراهدروفولاتTetrahydrofolate ((THF ومؤدياً في الوقت نفسه إلى انخفاض تراكيز الهوموسيستين المصلي مما يقي الخلايا البطانية من تأثيراته الضارة (2، 6، 24).
يتحول المثيونين Methionine فيما بعد تحت تأثير إنزيمMethionine adenosyl transeferase وبوجود ATP إلى S-adenosylmethionine أو (SAM) الذي يعد معطياً رئيسياً لجذر الميثيل لأكثر من مائة من التفاعلات الحيوية، من بينها تفاعلات مثيلة (إضافة جذر الميثيل) الحموض النووية (RNA & DNA)، الفسفوليبيدات، (الميالين أو Myelin)، عديدات السكاريد، والوسائط الناقلة مثل (الدوبامين، السيروتونين، النورادرنالين، الميلاتونين الهيستامين)، وربما يفسر هذا سبب تظاهر عوز الفيتامين B12 بأعراض سريرية مختلفة جداً (2، 6).
أما THFفيستخدم في اصطناع البورينات (purines) وتحويل deoxyuridylate (dUTP) إلى (dTMP) Deoxy-thymidine Monophosphate الذي يفسفر ليشكل (dTTP)Deoxythymidine Triphosphate الضروري لاصطناع DNA (الشكل 1)، وهكذا يسبب عوز الكوبالامين خللاً في اصطناع dTTP وتراكماً غير مقبول لـ 5-Methyl THF الذي هو شكل فولاتي غير قابلٍ للاستخدام وبالتالي يتقهقر اصطناعDNA ، كما تحتوي سلاسل RNA في هذه الحالة أيضاً على Deoxyuraciltriphosphate (dUTP) بدلاً من dTTP جاعلاً اصطناع البروتين مستمراً بلا انقطاع مما يؤدي إلى كثرة الكريات الحمر الكبروية (Macrocytosis) (6، 13). |
حركية الفيتامين B12 في الجسم:
ما زالت عمليات التقاط الفيتامين B12 واستقلاب عمليات معقدة وغير مفهومة بشكل كامل، فهو ينتج فقط من قبل العضيات المجهرية الموجودة في منطقة القولون التي هي بعيدة جداً عن أماكن امتصاص هذا الفيتامين ولهذا يجب التزود به عن طريق الأغذية بشكل أساسي (منتجات الألبان والبيض
واللحوم)، والتي يكون فيها الكوبالامين مرتبطاً بالبروتينات الغذائية التي يتحرر منها في المعدة تحت تأثير حموضة العصارة المعدية والببسين ليرتبط مباشرة مع المَحْزَم R (binder R) الذي يفرز من الغدد اللعابية والمريئية ومن المخاطية المعوية وهو ذو أُلفة كبيرة تجاه الكوبالامين في وسط حمضي كالوسط المعدي. ينجم عن هذا الارتباط معقد Cbl-R ينتقل على طول المعي الدقيق حيث يتدرك هناك بواسطة البروتياز البنكرياسية بوجود البيكربونات فيتحرر الفيتامين مرة ثانية ليرتبط ببروتين آخر هو العامل الداخلي -IF-Intrinsic Factor الذي يفرز من الخلايا الجدارية المعدية. إن المعقد المتشكل IF-Cbl يكون قادراً على مقاومة الهضم الحال للبروتين خلال مروره في المعي الدقيق حتى وصوله إلى المعي اللفائفي حيث يرتبط هناك مع مستقبلاته النوعية (CUBLIN)على الحاجز الزغابي للخلايا اللفائفية ليمتص بواسطة حادثة الاحتساء pinocytosis بوجود الكالسيوم الحر, وهناك داخل الخلايا المعوية يتدرك العامل الداخلي ويتحرر الكوبالامين ليلتقط من قبل بروتين ناقل ثالث هوTranscobalamin II الذي يصطنع داخل الخلايا المعوية والكبدية وفي بطانة الحبل السري ونقي العظام وا
لكلية، مشكلاً معقداً Holo TCII -Holotranscobalamin II ينتقل إلى كل أنسجة الجسم بواسطة الدوران الدموي البابي والسائل الدماغي الشوكي، ليتم قبطه من قبل مستقبلاته النوعية على سطح كل الخلايا المصنعة للـ DNA وخلايا الكبد ونقي العظام. وعلى الرغم من أن Holo TCII هو الشكل الناقل الوحيد للفيتامين إلى الخلايا فهو ينقل فقط (6-25%) من الفيتامين الممتص، أما الباقي فيرتبط مع الهابتوكورينات HC-Haptocorrins التي تقوم بنقل الفائض منه في الخلايا والأنسجة إلى مخازنه في الكبد والكليتين. والهابتوكورينات هذه هي عبارة عن بروتين سكري ذي وزن نوعي كبير يرمز إلى خليط من البروتينات الرابطة للكوبالامين Transcobalamin I & III, R-binder, Cobalophins التي تختلف عن بعضها البعض بجزئها السكري فقط (3، 14، 16، 18، 22، 24).
وما يجب ذكره أن للدوران المعوي الكبدي enterohepatic circulation دوراً فعالاً في المحافظة على خزين الكوبالامين في الجسم فحوالي ثلثي الفيتامين الممتص في المعي اللفائفي قد سبق له وتحرر من الكبد بواسطة الصفراء، حيث يفرز في الحالة السوية حوالي (1.4 مكغ / يومياً) من الفيتامين B12 في المعي الدقيق بواسطة العصارة الصفراوية ليعاد امتصاص (0.7 مكغ / يومياً) في مستوى المعي اللفائفي وعلى هذا فإن الأشخاص الموضوعين على حمية فقيرة بهذا الفيتامين وبالذات النباتيين وأيضاً الصارمين منهم يمكن أن يحصلوا على وارد من هذا الفيتامين يفوق الوارد الغذائي لهم بفضل عملية الاستعادة هذه، وربما يفسر هذا سبب تأخر ظهور أعراض عوز الفيتامين B12 بعد تبدل النمط الغذائي لسنوات قد تصل حتى العشرين عاماً في حين يحتاج ظهور العوز الناجم عن آفات سوء الامتصاص بعد فترة تتراوح من شهر وحتى سنوات ثلاث فقط وذلك بسبب تراجع الامتصاص من الأغذية ومن الدوران المعوي الكبدي في آن واحد (3، 5، 15، 18).
|
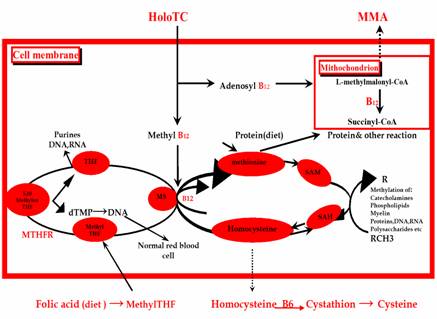
Blood stream: MS (Methionine Synthase) MTHFR (Methylenetetrahdrofolate Reductase).
الشكل 1: تمثيل الفيتامين B12 داخل الخلية (2، 5، 6، 18). |
كما يساهم هذا الدوران المعوي الكبدي في تخليص الجسم من مضاهيات الفيتامين B12 التي تتسرب عادة إلى الدوران الدموي اعتباراً من المعدة، فيقوم الكبد بقبطها وإفرازها من جديد إلى المعي حيث تعجز هناك عن الارتباط بالعامل الداخلي فتطرح إلى الخارج مع الفضلات (12). |
أسباب عوز الفيتامين :B12
يمكن أن نلخص أسباب عوز الكوبالامين بالنقاط التالية:
1- عدم كفاية الوارد الغذائي (الكحولية المزمنة، سوء تغذية مزمن، حمية نباتية صارمة) (2).
2- سوء امتصاص معدي يؤدي إلى قصور
امتصاص الكوبالامين الغذائي دون الشكل الحر منه.
3- التهاب المعدة الضموريAtrophic gastritis، التهاب المعدة المزمن نتيجة الإصابة بعصيات العُطُف البوابية (المتقوسات) Helicobacter Pylori، اللاهيدروكلورية Achlorhydria، استعمال محصرات المستقبلات الهيستامينية 2 (H2 Receptor blockers)، مثبطات مضخة البروتونProton pumps inhibitors (5، 24).
4- غياب العامل الداخلي مما يؤدي إلى فشل امتصاص شكلي الفيتامين الغذائي والحر معاً: فقر الدم الوبيلpernicious anemia استئصال المعدة أو جزء منها gastrectomy، وجود أضداد ذاتية ضد الخلايا الجدارية في المعدة أو ضد العامل الداخلي نفسه (22، 24).
5- قصور بنكرياسي: التهاب البنكرياس المزمن، متلازمة زولينجر آليسون Zollinger Ellison syndrome (حالة نادرة تتصف بوجود أورام في البنكرياس والعفج مفرزة للغاسترين الذي يحرض على زيادة الإنتاج الحمضي من المعدة مما يؤدي إلى الإصابة بتقرحات معدية واثني عشرية تمنع ارتباط المعقد Cbl-IF بالمستقبلات اللفائفية) (11، 22).
6- فرط نمو لجراثيم الأمعاء الدقيـقة والتي
تقوم بقبط الكوبالامين الغذائي كما هو الحال عند المسنين بسبب نقص حركة الحوية المعوية واللاهيدروكلورية أو متلازمات العروة العمياء Blind loop والإصابة بالرتوج الكبيرة diverticula أو وجود طفيليات كالإصابة بشريطية السمك Tapeworm Fish (Diphyllo-bothrium Latum) التي تلتصق بجدار الأمعاء لدقيقة وإذا وجدت بكميات كبيرة فإنها تحول دون امتصاص المعقد IF-Cbl إضافة إلى أنها تحتاج إلى كميات كبيرة من Cbl لاستمرارها (8، 14، 24).
7- آفات في المخاطية اللفائفية تؤدي إلى غياب مستقبلات IF- Cbl كما في قطع اللفائفي resection، الالتهاب اللفيفي، الاسهال الدهني الاسـتوائي، التـهاب القولون التقرحي، التهاب الأمعاء المنطقي، اللمفومة اللفائفية، الداء النشواني المعوي amyloidosis، متلازمة Imershund Grasbec (عيوب وراثية في مستقبلات IF اللفائفية تترافق عادة مع بيلة بروتينية)، متلازمة زولينغرأليسون، عوز وراثي في (TCII)، الإصابة بفيروس العوز المناعي المكتسب (HIV) (22، 24).
8- آفات في النقل البلازمي للكوبالامين كما في عوز TCII وعوز الروابط R وعوز
TCII (22).
9- قصور وظيفي في قبط الكوبالامين واستعماله من قبل الخلايا كما في آفات اصطناع deoxyadenosy-cobalamin (AdoCb1) و Methyl-cobalamin داخل الخلايا (22).
10- الاستعمال المديد لأدوية تسبب سوء امتصاص (مضادات حيوية, Phenytoin، Metformin، cholchicine، Para amino salicylic acid, Cholesteramine) حيث لوحظ العوز بعد الاستمرار باستعمالها لمدة ثلاثة أشهر (24). |
الآلية الإمراضية والأعراض السريرية لعوز الفيتامين B12:
إن الفيتامين B12 ضروري لتخليق خلايا الدم الحمراء والحفاظ على الجملة العصبية وعلى النمو والتطور عند الأطفال وهكذا يمكن أن يؤدي العوز به إلى الإصابة بعرضين رئيسيين:
1- فقر دم ينجم عن توقف تحول 5-methyl THF إلى THF الضروري لنقل وحدات الكربون خلال تفاعلات التخليق الحيوي لكل من السيرين والمثيونين والغليسين والكولين ووحدات البورين و dTMP وبالتالي حدوث خلل في تخليق الـ DNA، كما أن الفيتامين B12 ضروري جداً لسرعة تخليق DNA خلال عملية انقسام الخلايا وبشكل خاص في أنسجة نقي العظم المسؤولة عن تكوين كريات الدم الحمر مما يؤدي إلى تشكل خلايا تبقى فيها النواة غير ناضجة تسمى الأرومات الضخمة Megaloblasts يتخرب معظمها في نقي العظم فلا تنطلق إلى الدوران و يتطور الباقي لتصبح كريات حمر كبروية Macrocytes ثم ضخمة Megalocytes (خاصة في حالات العوز الشديد) التي تنطلق إلى الدوران بوظيفة غير سوية (16، 24).
2- اعتلال عصبي يشمل تنكس degeneration الألياف العصبية وتضررها بشكل غير عكوس ويحدث هذا لأن الأعصاب محاطة بعازل دسم يتكون من معقد بروتيني يسمى الميالين Myelinحيث يقوم الفيتامين B12 بدور حيوي في المحافظة على هذا العازل من خلال المحافظة على تركيز SAM الضروري لمثيلة الفسفوليبيدات وبالذات Phosphatidylcholine الضروري للمحافظة على العصبون وأيضا من خلال منع تراكم MMA الذي هو مثبط تنافسي للتخليق الحيوي للحموض الدسمة ولأي حمض دسم مما قد يؤدي عند تراكمه إلى انحراف سلسلة اصطناع الحموض الدسمة في البنية الغشائية للخلايا العصبية (16، 24).
سريرياً يمكن لعوز الفيتامين B12 أن يمر
بأطوار أربعة كما وصفها Victor Herbert حيث يترافق الطور الأول والثاني مع حدوث تبدلا ت كيميائية حيوية في الجسم أما الطور الثالث والرابع من هذا العوز فيترافق مع حدوث التبدلات الاستقلابية والتظاهرات السريرية، ومع ذلك يمكن لعوز الفيتامين B12 أن يكون لا عرضياً أو يتظاهر بواحد أو أكثر من الأعراض السريرية (العصبية والعامة) أو الأعراض الدموية أو بكليهما معاً (24).
|
الأعراض السريرية العصبية (8، 17، 19، 22، 24):
1- العَنّة، تكرار الحاجة إلى تفريغ المثانة، سلس بولي وغائطي، نوبات اسهال غير مفسرة (اعتلال في الأعصاب اللاإرادية).
2- الإحساس بالوخز أو التنميل أو الحرق والحكة في نهايات الأطراف وبشكل غير مفسر (إصابة الأعصاب المحيطية).
3- شخصية نزقة - محبطة، ضعف الثقة بالنفس وانحراف نفسي، ذهان وعقل ضبابي مع فترات من التشويش وفقدان ذاكرة، اضطراب حس التوجه قد يتطور في غياب المعالجة إلى الخرف وبشكل خاص خرف الزهايمر (اعتلال وعائي دماغي ينجم عن ارتفاع تركيز الهوموسيستين في المصل).
4- هزع (عدم تناسق الحركات العضلية الإرادية)، تشـنجات (اعتـلال نخـاعي
وانحلال أعصاب تحت حاد).
5- ضعف الإحساس بالذبذبات وبالجس وبالألم وبالوضعة كما تكون علامة رومبرغ Romberg's ايجابية (زيادة تقلقل الأقدام عند إغماض العينين).
6- ضعف في إحدى عضلات السير وضعف المنعكسات الوترية مما يؤدي إلى الرنح أو ارتخاء عام (اعتلال عصبي وإصابة الجهاز الحسي والحركي).
7- تدهور في حاسة البصر والسمع وفقدان حاستي الذوق والشم (إصابة الأعصاب الفردية وضمور العصب البصري وعصب الشم).
8- علامة Lhermitte's إيجابية (صدمات شبه كهربائية تصيب أسفل العمود الفقري وتؤدي الى التواء الرأس).
يمكن لهذه الأعراض العصبية أن تشاهد حتى في غياب الأعراض الدموية خاصة عند الأشخاص الذين يتناولون كميات كبيرة من مكملات حمض الفوليك.
|
* الأعراض السريرية العامة (8، 22).
1. خمول ووهن عام، فقدان شهية للطعام وفقدان وزن متوسط إلى كبير غير مفسر
2. لسان متقرح متضخم وأملس أو ما يعرف بالتهاب اللسان Glossitis.
3. جلد شاحب وسحنة ليمونية وأحيانا يرقانية.
4. قصر تنفس أو انقطاعه، تسرع قلبي قد يترافق مع نفخات انقباضية أو انبساطية، قصور قلب احتقاني مع ضخامة كبدية.
5. تصبغات بقعيه جلدية خاصة عند الأشخاص ذوي البشرة الغامقة، شيب مبكر.
6. يرافق فقر الدم الشديد زيادة إفرازات العين أو نزوف شبكية.
* الأعراض الدموية (7، 22، 24):
1- فقر دم (قيم منخفضة لكل منRBC, HT, HB)، نقص تعداد الصفيحات مع اختلاف في حجمها، ارتفاع متوسط هيموغلوبين الكريات الحمر (MCH)، ومتوسط حجم الكريه الحمراء (MCV)، بينما يكون متوسط تركيز هيموغلوبين الكريه الحمراء (MCHC) ضمن الحدود السوية، نقص تعداد الكريات البيض ويكون تعداد الشبكيات منخفضاً أو سوياً، فقر دم بعوز الحديد مرافق في حالات اللاهيدروكلورية التي تحول دون انحلال الحديد الثنائي من المواد الغذائية.
2- تبدي اللطاخة المحيطية في البداية وجود عدلات كبيرة زائدة التفصص (الفصوص ? 5) تعكس شذوذاً في انقسام النوى ثم تظهر الكريات الأهليلجية الضخمة Macroovalocytosis, وعدد من الكريات الحمر المتفاوتة في الحجم Anisocytosis ومختلفة الأشكال poikilocytosis أما في الحالات الشديدة فتشاهد كريات حمر تحتوي على مشتملات مثل أجسام هاول جولي أو حلقات كابوت كما تشاهد أسسات منقطة. 3- تبدي اللطاخة النقوية زيادة الخلوية وفرط تنسج وارتفاع نسبة myeloid erythroid وكثرة مخازن الحديد، فرط تنسج بالأرومات الضخمة، ويكون النضج النووي والهيولي في سلسلة الكريات الحمر مختل التزامن مما يجعلها عرطلة الشكل، كما يلاحظ نقص في أعداد النوّاءات Megakaryocytes مع شذوذ في شكلها. 4- الموجودات المصلية (7، 22، 24): * ارتفاع كل من البيلروبين غير المباشر (انحلال الكريات الحمر الشاذة داخل النقي). * ارتفاع تركيز LDH خاصة النظير 1 (تراجع تكوين الحمر وتخريب النقي لطلائع الحمر غير السوية وتحرر LDH منها) ويتعلق هذا الارتفاع بدرجة الفاقة الدموية الحاصلة. * ارتفاع حديد المصل (تراجع في تخليق الحمر). * السعة الرابطة للحديد TIBC سوية أو منخفضة قليلاً. * انخفاض كل من البوتاسيوم المصلي، والكوليستيرول والفسفاتاز القلوية.
|
تشخيص عوز الفيتامين B12:
اعتقد لعشر سنوات سابقة، أن تشخيص عوز الفيتامين B12 بسـيط للغاية، عندما اعتبر أنه ناجم فقط عن عوز العامل الداخلي (IF) المفرز من المعدة وبذلك كان تشخيصه مخبرياً يتطلب إجراء معايرة الفيتامين في الدم وتطبيق اختبار شيلينغ Schilling الذي كان حاسماً في كشف عوز العامل الداخلي. إن سواء نتائج الاختبارين كان ينفي بالضرورة وجود هذا النمط من العوز على الرغم من وجود بعض الحالات السلبية الكاذبة كما في استئصال المعدة الجزئي حيث يكون المريض قادراً فقط على امتصاص الفيتامين البلوري المستعمل في الاختبار دون الكوبالامين الغذائي مما يعطي نتيجة سوية كاذبة لاختبار شيلينغ؛ ووجود حالات ايجابية كاذبة مع جمع غير كامل لبول 24 ساعة والقصور الكلوي ووجود أضداد ضد العامل الداخلي تقوم بتعطيل IF في المرحلة الثانية من الاختبار (5، 22، 24).
ثم جاءت معايرة Homocysteineلتعزز أبحاث هذا الفيتامين خاصة بعد أن ظهرت دراسات عديدة تؤكد عدم علاقة بعض حالات عوز هذا الفيتامين بعوز العامل الداخلي IF)) فقط، وإنما بسبب حاجة هذا الفيتامين إلى درجة الحموضة المناسبة لكي يتحرر من البروتينات الغذائية قبل ارتباطه بهذا العامل الداخلي المفرز من قبل الخلايا الجدارية المعدية والضروري من أجل امتصاص ونقل سوي لهذا الفيتامين إلى مواقع الارتباط النوعية في نهاية المعي الدقيق أو المعي اللفائفي، ولكن وجد أن هذا الهوموسيستين يفتقر إلى النوعية إذ لا يميز بين عوز الفيتامين B12 وعوز الفولات باعتباره يعكس في الواقع مستوى (Methyl Cbl) و/ أو مستوى (Methyl THF) كعوامل متممة للإنزيم Methionine Synthase في تخليق المثيونين (5).
لوحظ حديثاً ارتفاع تركيز الهوموسيستين في حالات أخرى إلى جانب عوز الكوبالامين أهمها أمراض التصلب العصيدي Atherosclerotic diseases وأمراض الخثار الوريدية Venous thrombosis وأيضاً اعتلالات الأوعية الدماغية والمحيطية، علماً أن تركيزه المصلي يتعلق بعوامل كثيرة مثل الوظيفة الكلوية والوظيفة الدرقية ووجود أمراض وراثية مرافقة (24)
أما بالنسـبة لمعايرة حمض ميثيل المالونيك (MMA) الذي يتداخل في استقلابه الفيتامين B12 بشكل نوعي فهو يعكس فاعلية إنزيمmethylmalonyl CoA-mutase في تحويل methylmalonyl CoA L- إلى Succinyl CoA بوجود adenosyl-cobalamin كتميـم وباعتـبار أن الأخير يشكل القسم الأعظم من مخزون الكوبالامين في الجسم فإنه لا يحدث ارتفاع MMA في الدم إلا بعد تراكمه داخل الخلايا نتيجة نفاد كامل الشكل الأدينزويلي من الكوبالامين أي حصول العوز داخل الخلية نفسها فهو يقيس في الواقع الفاعلية الإنزيمية داخل الخلايا فقط، ومن جهة أخرى لوحظ ارتفاع متوسط تركيز MMA عند الأشخاص المسنين بسبب تراجع الوظيفة الكلوية بتقدم العمر وفي حالات أخرى مثل نقص حجم الدم والحمل وقصور الدرق إضافة إلى أن تكلفة التحليل المرتفعة نسبياً تجعله بعيداً عن الاستعمال الروتيني (5، 22، 24).
يعتمد حالياً في تشخيص عوز الفيتامين B12 على معايرة مستوياته المصلية وباعتبار أن هذا الفيتامين يرتبط بعد تحرره من العامل الداخلي في مستوى الأمعاء الدقيقة وعبوره إلى الدم مع نوعين من البروتينات الناقلة:Transcobalamine II (TC II ) & haptocorrin (HC) إذاً فطرق المعايرة هذه هي عبارة عن طرق معايرة الفيتامين الكلي أي الفيتامين المرتبط بنوعيه وبالتالي نحصل على نوعية وحساسية مشكوك بهما للأسباب التالية:0000
1- لا تسمح هذه الطرق بالتمييز بين الشكل الفعال (المرتبط مع TC II) والشكل غير الفعال منه (المرتبط مع & II I TC) مما يسمح بإعطاء نتيجة سوية مضللة عند المرضى المصابين بانخفاض في الشـكل
الفعال من هذا الفيتامين (5).
2- لوحظ وجود مضاهيات للفيتامين B12 B12 Analogues تجول في دوران بعض الأشخاص الأصحاء النباتيين، يعتقد أن مصدرها الأطعمة النباتية مثل منتجات الصويا المختمرة وبعض الأشنيات والطحالب وأيضاً عند المصابين بالخرف Dementia فبينما كانت نسبةHoloTC II منخفضة لدى هؤلاء الأشخاص أظهرت معايرة الفيتامين B12 المصلي لديهم مستويات سوية أو حتى عالية (5).
3- انخفاض مستوى الهابتوكورين Haptocorrin يمكن أن يكون مسؤولاً عن انخفاض 15% من مستوى الفيتامين B12 المصلي أي يمكن أن يكون سبباً لحالات ايجابية كاذبة (5، 23).
4- إن تعطل أكسدة B12 من الشكل الأحادي إلى الشكل الثلاثي تجعله غير قابل للارتباط بالترانزكوبالامين الذي يرتبط فقط بالفيتامين المؤكسد وبالتالي يتقهقر نقله إلى مستقبلاته على سطح الخلايا فيحصل العوز داخل الخلية نفسها على الرغم من سواء الامتصاص المعوي وبالتالي سواء التركيز المصلي لهذا الفيتامين (5).
5- وجود حالات ايجابية كاذبة (انخفاض كاذب للفيتامين B12 وذلك في عوز الفولات، الإصابة بورم نقيي متعدد Multiple Myeloma، استعمال مانعات الحمل الفموية، زيادة استهلاك الفيتامين C عند الحوامل الأصحاء (24).
6- وجود حالات سوية كاذبة (تراكيز سوية كاذبة للفيتامين B12 وذلك في آفات الكبد الحادة، اللمفوما، الكحولية، فرط نمو جراثيم النبيت المعوي، آفات النقي التكاثرية Myeloproliferative (24).
7- لا تعكس القيم المصلية للفيتامين B12 بين 400-100 بيكوغرام/ مل المستويات الفعلية له داخل الأنسجة (5، 24).
|
للأسباب سابقة الذكر تم التوجه حديثاً لمعايرة المعقد HoloTC خاصة عندما لوحظ وجود مستويات منخفضة تشخيصية في الحالات التالية:
1- سوء امتصاص للفيتامين B12 أو نقص وارده الغذائي (كما هو الحال عند النباتيين) بحساسية عالية تعود إلى قصر عمر النصف لهذا المعقد الذي يقدر بـ (0.75 يوم) مقارنة مع عمر النصف للمعقد (HCs Cbl) الذي يبلغ تسعة أيام الأمر الذي يسبب انخفاضاً سريعاً في معدل تشكل المعقد (Holo TC) من الأمعاء وبالتالي الحصول على تشخيص سريع وحاسم ومنذ الفترة الأولى لانخفاض امتصاص الفيتامين B12، أي قبل ظهور الأعراض السـريرية مما يقي المريض من المعاناة نتيجة تأخر التشخيص والمعالجة (21).
2- حالات عوز TC IIأو غيابه وراثياً: فقد تبين أن الأشخاص المصابين بخلل وظيفي في هذه البروتينات الناقلة أو غيابها كلياً يبدون أعراضاً وصفية لعوز الفيتامين B12 كالإصابة بفقر دم ضخم الأرومات Megaloblastic anemia وأعراض عصبية منذ بداية حياتهم تتحول في غياب المعالجة إلى شذوذات عصبية على الرغم من وجود مستويات سوية من هذا الفيتامين في مصول هؤلاء المرضى. هذا وقد بينت دراسة عوز الترانزكوبالامين الولادي بأن وظيفة هذا البروتين هو السماح للخلايا بقبط المقادير الفيزيولوجية من الكوبالامين دون أي تدخل خلوي إضافة إلى دوره في الامتصاص والتوزيع ما بعد الامتصاص وفي النهاية إعادة تصنيع الترانزكوبالامين نفسه (10، 20).
3- آفات الكبد الحادة من منشأ كحولي والتي يختل فيها ارتباط الفيتامين B12 وتخزينه بواسطة (TC I & III) ضمن الأنسجة الكبدية مؤدياً إلى تسرب هذا الفيتامين خارج الكبد باتجاه الدوران مما يؤدي في النهاية إلى عوز حاد للفيتامين B12 داخل الأنسجة وظهور الاختلال الوظيفي الاستقلابي على الرغم من ارتفاع تراكيز (Holo TC I & Holo TC III) بهدف حماية الفيتامين البلازمي من الإفراز خارج الجسم، أما الصورة المخبرية فتبدي تراكيز عالية من الفيتامين في البلازما في حين يتناقص تركيز Holo TC II مشيراً إلى وجود تثبيط في انتقال الفيتامين ذي المنشأ الخارجي باتجاه البلازما والأنسجة. هذا ويمكن اعتبار هذا الشكل المخبري مشعراً جيداً لشدة الآفة الكبدية وانذاراً للتوجه نحو العلاج الوقائي المناسب (4).
4- حالات العدوى بفيروس HIV-1 أو الايدز حيث تتعرض مخاطية المعدة والمعي الدقيق لدى 50% من المصابين إلى الأذية والانتانات الانتهازية مما يجعل امتصاص الفيتامين B12 تحت الحدود السوية، ومع ذلك فهم يبدون مستويات سوية للفيتامين B12 المصلي والهوموسيستين المصلي على الرغم من وجود عوز لهذا الفيتامين في مستوى الخلايا الذي تعبر عنه المستويات المنخفضة للمعقد Holo TCII.
5- عند المسنين يسبب تراجع اصطناع هذه البروتينات الناقلة مع تقدم العمر ارتفاع مستويات الفيتامين المصلي وانخفاضه داخل الخلايا فبينما تعتبر التراكيز المصلية للفيتامين B12 الأكبر من 150 pmol / L سوية فان مستويات تتراوح بين 150-250 pmol/L من هذا الفيتامين عند هؤلاء المسنين يمكن أن يرافقها عوز داخل الخلايا (5).
6- ترافقت حالات انخفاض مستويات هذا المعقد مع زيادة تعرض الأمهات لولادة أطفال مصابين بعيوب الأنبوب العصبي NTD (Neural tube defects) الذي يفسر بنقص B12 داخل الخلايا والضروري لمثيلة الهوموسيستئين (1).
هذا ويمكن أن تتم معايرة هذا الواصم بطرق RIA باستعمال الكوبالت المشع CO57 أو بطرق ELISA، مع ملاحظة أن متوسط تركيزه يكون أعلى عند الأشخاص الذين يملكون النمط الجيني PP أو النمط RP لهذا الناقل أكثر من الأشخاص الذين يملكون النمط متغاير الزيجوت RR للرامزة 259(Codon 259) حيث يحل الحمض الأميني Proline بدل الحمض الأميني Arginine، وهناك دراسات تمت في الثمانينات أشارت إلى أهمية هذا النمط الجيني في الفة الناقل البروتيني TC تجاه الفيتامين B12 إذ لوحظت زيادتها في النمط PP مقارنة ببقية الأنماط الوراثية، وبالتالي تأثيره المباشر أيضاً على تفاعل تحويل Succinyl CoA إلى Methylmalonyl CoA دون أن يكون لهذا النمط الجيني أي تأثير على قيم الهيماتوكريت أو تركيز الفيتامين B12 أو قيمMCV (9).
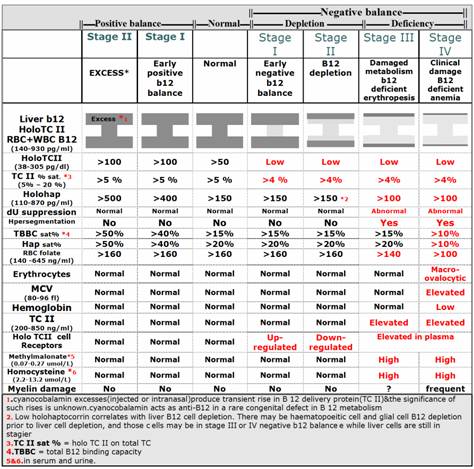
وفي النهاية يمكن أن نلخص المراحل الأربع التي يمر بها التوازن السلبي للفيتامين B12 أي اعتباراً من نقص وارده بالنقاط التالية (15) والمفصلة أيضاً في الجدول (1):
* نفاد المخزون المصلي (انخفاض عيار Holo TC II)؛
* نفاد المخزون الخلوي (انخفاض عيار كل من HC والفيتامين B12 الموجود داخل الكريات الحمر)؛
* ظهور أعراض العوز الكيميائي الحيوي (تباطؤ تخليق DNAمع ارتفاع تركيز كل من الهوموسيستئين وحمض ميثيل المالونيك).
* ظهور الأعراض السريرية لفقر الدم.
|
في النهاية وبهدف تحسين حساسية تشخيص عوز الفيتامين B12 ونوعية ينصح باللجوء إلى معايرة HoloTC II، فتراكيزه السوية وحدها تسمح للخلايا النوعية بالحصول على كفايتها من الكوبالامين الفعال حيوياً، كما أنه واصم سريع التقلب Turnover يبدأ تركيزه بالانخفاض بعد أيام قليلة من توقف امتصاص الفيتامين B12 مشيراً إلى بدء التوازن السلبي له وبشكل خاص عند وجود إحدى الحالات التالية (3، 22، 24):
* الأشخاص المسنون }50 عاماً (كل خمس سنين) 65 عاماً فما فوق (سنوياً){؛
* وجود أعراض عصبية أو دماغية أو حركية مبهمة؛
* فقر دم غير معلل مع ارتفاع في MCV،
فقر دم بعوز الفولات أو بعوز الحديد؛
* وجود متلازمات سوء امتصاص أو اعتلالات معدية معوية أو سوابق جراحية على الأنبوب الهضمي؛
* العدوى بفيروس HIV1؛
* النسـاء الحوامـل، إذ أن إعطاء الفولات
يصحح الأعراض الدموية لعوز الفولات والفيتامين B12 دون أن يصحح الأعراض العصبية الناجمة عن عوز الفيتامين B12؛
* أطفال رضع لأمهات نباتيات، أو أطفال مصابون بأي مما يلي: حدة طبع، فقدان
الشهية للطعام، ضعف عام وفقر دم، نعاس أو سبات، ضعف أو تأخر نمو، اشتداد منعكسات شديدة؛
* النباتيون والصارمون منهم بالذات بعد عام واحد من بداية الحمية؛
* وجود أمراض مناعة ذاتية (مثال: أمراض الدرق، الداء السكري من النمط الأول، داء باركنسون، عوز الغلوبولين المناعي A، التهاب القولون التقرحي)؛
* استعمال مديد لبعض الأدوية.
|
الجدول 1: المراحل الأربعة التي يمر بها عوز الفيتامين B12 (5).
 |
| |
| المراجع Reference |
1-Afman L.A; Van Dev Put N.M; Momas C.M; Trijbels J.M. and Blom H.J.
Reduced: Vitamin B12 binding by transcobalamin II increases the risk of neural tube defects.
Q. J. M., 94(3): 159-166, 2001.
2-Alan L. Miller
Homocysteine & Cognitive: The Methionine-Homocysteine cycle and its effects on conginitive Disease.
Alternative Medicine review, Feb 2003.
3-Axis shield
Holo TC assay RIA , 2001
4-Baker H; Leevy C.B; DeAngelis B; Frank O. and Baker E.R.
Cobalamin (vitamin B12) and holotranscobalamin changes in plasma and liver tissue in alcoholics with liver disease.
J. Am. Coll. Nutr; 17(3): 235-238, 1998.
5-Christina Bolander Gouaille
The changing conception of vitamin B12 deficiency and diagnosis.
Clinical Laboratory International, 27: 27, 2003,
6-Christina Bolander-Gouaille.
Vitamin B12 and Mercury, DUMEX-Al Pharma, April 2005
7-Clinical laboratory science web ring
Megalobalstic Anemia`s and Vitamin B12 deficiency, Laboratory results for Hematological disorders
8-Diagnose-Me, June 2004: Vitamin B12 Requirement.
9-Ebba Nexo, Anna-Lisa Christensen, Anne-Mette Hvas, Torben E. Petersen and Sergey N.
Fedosov: Quantification of Holo-Transcobalamin, a Marker of Vitamin B1 Deficiency.
Clinical Chemistry, 48: 561-562, 2002 .
10-Hall C.A.
Congenital disorders of vitamin B12 transport and their contributions to concepts.
Yale. J. Biol. Med; 54(6): 485-95, 1981.
11-Herzlich B. and Herbert V.
Depletion of serum Holotranscobalamin II: an early sign of Negative Vitamin B12 balance .
Lab. invest. 58: 332-337, 1988.
12-Herbert V.
Starting Vitamin B12 (cobalamin) Status in vegetarian.
Am. J. Clinical nutritients, 59: 1213s-1222s, 1994,
13-Herbert V.
Vitamin B12 Plant sources, requirements and assay.
Am. J. Clinical nutritients, 48: 852-858, 1988.
14-Kudo H; Inada M; Ohshio G; Wasatsiki Y; Ogawa K; Hamashina Y. and Miyake T.
Immunohistochemical localization of Vitamin B12 R-binder in the human digestive tract.
Gut. Bmj Journals, 28, 339-345, 1987.
15-Home. come groupe. org: Vitamin B12.
Clinical, December 2004.
16-Jack Norris R.D.
Vitamin B12: Are you getting it? Vegan Health, May 2002.
17-Khasnis A. and Gokula R.M.
Romberg's Test, Journal of postgraduate Medicine.
Clinical Signs, Issue 2, 49, 169-172, 2003,
18-Klaus Radebold.
Zollinger Ellison syndrome.
Medicine specialties, 2003.
19-Diet-and-health.net.
Cobalamin (Vitamin B12), October 2002.
20-Teplitsky V; Huminer D; Zoldan J; Pitlik S; Shohat M. and Mittelman M.
Hereditary partial transcobalamin II deficiency with neurological mental and hematological abnormalities in children and adults.
Med. Assoc. J., 5(12): 868-872. 2003.
21-Lindgren A., kilander A., Bagge E. and Nexo E.
Holotranscobalamin a sensitive marker of Cobalamin malabsorption.
Eur. J. Clin. Invest; 29: 321-329, 1999.
22-Marcel E. and conrard M.D.
Pernicious anemia, emedicine.
Specialities, 1-11, 2004.
23-Carmel R.
National library of medicine.
Clinical Chemistry, 49: 1367-1374, 2003.
24-Dharmarajan T.S., Gu Adjia and Edward p. norkus.
Vitamin B12 deficiency recognizing subtle symptoms in older adults.
Geriatrics, 58, 3. 2003,
25-www.vegsoc.org
Vitasmin B12.
Vegetarian Society, 2004.
26-Henanann W., schorr H., obeid R. and Greisel I.
Hyperhomocysteinemia and vitamin B12 deficiency in vegetarians.
WWW.homocysteine.net
|
| |
| المجلد 3 , العدد 7 , صفر 1426 - نيسان (أبريل) 2005 |
|
|
|
