| المجلد 4 ,
العدد 3
, رمضان 1427 - تشرين الأول (أكتوبر) 2006 |
| |
| دراسة أضداد العامل VIIIلدى مجموعة من مرضى الناعور A السوريين |
Study of the Antibodies Anti-F VIII
in Syrian Patients Group of Hemophilia A
|
| د. سحر الشماع |
| Al-Shamma S. |
| كلية الصيدلة - جامعة دمشق |
| الملخص Abstract |
قد يؤدي النزف المتكرر عند مرضى الناعور A إلى تعرض المريض لإعاقة مؤقتة أو دائمة نتيجة لضمور في العضلات وتخرب المفاصل. والأخطر من ذلك ظهور أضداد العامل الثامن التي تبطل أو تعيق المعالجة عند بعض المرضى.
هدف هذه الدراسة تحديد بعض حالات مرضى الناعور في سورية ودراسة التبدلات التي تحصل على اختبارات التخثر بتتبّع تغيّر النسبة المئوية للعامل الثامن وبالتالي اختبار ظهور مثبطات عامل الناعور.
من خلال دراستنا التي تمت على 58 مريضاً ومقارنتها بمجموعة من الأشخاص يتمتعون بصحة جيدة، وجدنا أن النسبة الكبرى من المرضى ينتمون أصلاً إلى مجموعة مرضى العوز الوخيم للعامل الثامن وان المرضى الذين يحملون مثبطات العامل الثامن ينتمون إلى هذه المجموعة.
|
Frequent bleeding in hemophilia A patients may leads to obstruct the patient as a result of temporary or permanent destructions in muscles and articulation. More seriously, some patient develop Anti-F.VIII antibodies witch may delay or invalid the treatment.
The objective of this study is to identify some cases of hemophilia disease in Syria and to study coagulation test results according to the changes of F. VIII percentage and thus examine the emergence hemophilia F.VIII inhibitors.
After studying 58 patients and comparing them with a group of 50 healthy persons, we conclude that the largest percentage of patients belongs to the group of patients that safer from F. VIII severe destitutions and patients with F.VIII inhibitors belong to this group.
|
| المقدمة Introduction |
يمس مرض الناعور وبشكل خطير النواحي
الوظيفية والنفسية والاجتماعية للمريض وخاصة في البلدان النامية. فكونه مرضاً وراثياً مرتبطاً بالجنس لأن مورثته محمولة على الصبغي X تحمل الأنثى إمكان نقل المعانات إلى أولادها الذكور مما قد يسبب بعض المشاكل الاجتماعية. إلى يومنا هذا لا يصل مرضى الناعور للشفاء الدائم ويتألف العلاج الوقائي أو في حالات النزوف بإعطاء المريض مركبات العامل الثامن أو التاسع الجاهزة (وذلك حسب نوع النزف) ومجموعة من قواعد السلامة والتدابير على المرضى إتباعها مدى الحياة (1، 2).
مورثة مرض الناعور محمولة على الصبغي الجنسي X وهو ينتقل كصفة متنحية، لذلك فهو يصيب الذكور فقط وتكون الإناث حاملات له؛ وإذا كان العوز بالعامل VIII سمي بالناعور A وإذا كان العوز بالعامل IX سمي بالناعور B.
يمكن تصنيف العوز بالعامل VIII عند مرضى الناعور A إلى الأصناف التالية (3):
1- عوز خفيف حيث تكون نسبة العامل VIII من 25 – 50%.
2- عوز معتدل حيث تكون نسبة العامل VIII من 5 – 25%.
3- عوز متوسط حيث تكون نسبة العامل VIII من 1 – 5%.
4- عوز شديد حيث تكون نسبة العامل VIII أقل من 1%.
يؤدي عوز العامل VIII إلى نزوف خفيفة، أو معتدلة أو شديدة حسب شدته وكلما كان العوز شديداً كانت النزوف غزيرة. تختلف الصورة السريرية حسب شدة العوز فالحالات الخفيفة التي تكون فيها نسبة العامل VIII أكثر من 25% قد لا تكتشف إلا بالصدفة وفي سن متأخرة إذا احتاج المريض إلى مداخلة جراحية أو تعرض لنزف شديد.
أما الحالات المعتدلة والتي تتراوح فيها نسبة العامل VIII من 5 – 25% فتظهر النزوف عند المرضى في حالات استثنائية بعد تداخل جراحي بسيط أو بعد قلع الأضراس. وإذا كان الناعور متوسطاً بين 1 – 5% تكون النزوف شديدة حتى بعد الرضوض البسيطة وأعمال الجراحة الصغرى. أما عند المرضى الذين تكون نسبة العامل VIIIلديهم أقل من 1% فالنزوف تتميز بأنها تحصل عقب رضوض بسيطة جداً وأحياناً قد تكون عفوية وأهم ما يميزها بأنها تستمر لفترات طويلة.
يمكن أن تحدث هذه النزوف في أماكن عميقة وحشوية وأخطرها النزوف ضمن العضلات والمفاصل ولا سيما مفاصل الركبة والفخذ والمرفق. تؤدي النزوف المتكررة إلى تخريب المفاصل وتشويه العضلات وضمورها.
كان يعالج هؤلاء المرضى سابقاً بتعويض العامل VIII باستخدام بلازما طازجة مجمدة Fresh Frozen Plasma والتي تحتوي على عوامل التخثر جميعها دون استثناء ولكن بنسب خفيفة. أو بالرسابة البَرْدَّية Cryoprecipitate والتي تحتوي على نسب أعلى من سابقتها من العامل VIII وعامل فون ويلبراند vonWillebrand والفبرينوجين Fibrinogen.
استخدمت فيما بعد ركازات تحتوي على فعالية نوعية من العامل VIII (Concentrates of F الثامن) بتراكيز 10 - 150- 3000 وحدة/ملغ حسب نقاوة الركازة مثلAlphanate®,Humate® , Koate®-HP هذه الأدوية تحتوي أيضاً على عامل فون فيليبراند. أو ®Hemophil , ®Monarc-MTM-Monoclate والتي لا تحتوي على عامل فون فيليبراند.
ثم استخدمت ركازات العامل VIII المحضرة من بلازما الخنزير (Porcinefactor) مثل Hyate:C® تحتوي على كمية قليلة من عامل فون فيليبراند (4، 5).
تم التوصل حالياً إلى استعمال العامل VIII المأشوب Recombinant المحضر بالهندسة الوراثية، والذي تصل فيه الفعالية النوعية للعامل VIII 4000-6000 وحدة/ملغ. اكتشفت تقانات Recombinate® في 1984، وعزلت ™Bioclate من أرومات خلايا المبيض للخنزير ويمكن أن تساهم في إنتاج عامل فون فيليبراند. عزلت مركبات Helixate® و Kogenate® من الخلايا الكلوية للخنزير وهي لا تساهم في إنتاج عامل فون فيليبراند. تم في عام 2001 إنتاج مركب ®Albumin free ReFact الذي يجرب حالياً لمدة 7 سنوات ويعتقد بأنه سيقلل كثيراً من الإصابات الفيروسية. وفي عام 2003 تم إنتاج مركب ® Advate(rAHF-PFM) (6، 7).
يستخدم العامل VIII المأشوب كعلاج وقائي في العمليات الجراحية أو لمعالجة النزوف عند مرضى الناعور الذين تتشكل لديهم أضداد للعامل VIII (أو ما يمكن تسميته مثبطات العامل الثامن) كأحد مضاعفات المعالجة المستمرة بالعامل VIII المحضر من البلازما البشرية وبخاصة عند المرضى شديدي العوز. حيث بينت الدراسات الدولية بأنه يمكن مصادفة أضداد العامل VIII عند أكثر من 25% عند المرضى شديدي العوز، وعند 10% عند المرضى متوسطي العوز. وتزداد هذه النسبة عند الأطفال والمرضى الذين توجد عندهم طفرات متصالبة مع مركبات العامل VIIIالصنعية.
تحدد الجرعة حسب حالة المريض أي حسب نسبة العامل VIII البدئية، وبشكل عام تكون 30-50 وحدة لكل كغ. علما بأن 1 مكروغرام من العامل VIIIتكون فعاليته ما يعادل 5 وحدات وبالتالي تكون الجرعة 6-10 مكروغرام لكل كغ (8).
يمثل الشكل 1 بنية العامل VIII ويمثل الشكل 2 مكان ارتباط الأضداد على العامل VIII (10). على مستوى السلسلة الثقيلة والسلسلة الخفيفة أضداد العامل VIII أضداد
مكتسبة، حالة للبروتين Proteolytic antibody's وهي من النمط IgG4 Kappa (10) وتكون موجهة ضد الوحدتين A2-C2 (9، 10)، هذه الأضداد قادرة على إبطال فعالية العامل VIII بعد حضنها معه بالدرجة 37°م لمدة 2 – 3 ساعات. يمكن أن تظهر هذه الأضداد ليس فقط عند بعض مرضى الناعور وإنما أيضاً في سياق أمراض المناعية الذاتية أو خلال فترة الحمل أو عند تناول بعض الأدوية. تتدخل مجموعة من العوامل في تشكل Anti-FVIIIمثل: شدة العوز، عمر المريض (تواتر تشكل الأضداد عند الأطفال أكثر من البالغين)، عدد مرات نقل العامل الثامن، نوع العامل VIII المستخدم في المعالجة.
عند المعالجة بالعامل المأشوب تتشكل الأضداد بنسبة أكبر خلال فترة قصيرة وبعد عدة مرات من إعطائه بالمقارنة مع المرضى الذين يعالجون بالعامل VIII المحضر من بلازما المتبرعين بالدم. إلا أن الأضداد المثبطة بشكل فعال تكون أقل من 50% من مجموع الأضداد، وما يقارب الثلث هو من الأضداد العابرة غير الفعالة. أما المرضى الذين يعالجون بالعامل VIII المحضر من بلازما المتبرعين بالدم فإن 80% من الأضداد عالية التثبيط (11، 12، 13).
يؤدي تشكل أضداد العامل VIII إلى نقص استجابة المرضى للمعالجة، وبالتالي تتكرر النزوف مما يؤدي لازدياد معدل الوفيات وازدياد التداخلات الدوائية وبالتالي ازدياد كلفة المعالجة. يجب توقع وجود Anti-F VIII عندما يلاحظ نقص استجابة المريض للمعالجة بالعامل VIII أو لدى المرضى المصابين بآفات مناعية ذاتية (14-17) أو خلال فترة الحمل (18) أو عند تناول بعض الأدوية أو المصابين ببعض الأمراض الخبيثة لمرضى لا يوجد لديهم عوز بالعامل VIII ولكنهم يعانون من نزوف مهددة للحياة (19-21). من ناحية مخبرية يلاحظ عند هؤلاء المرضى تطاول زمن PTTa والذي لا يصحح عند مزج حجم متساوٍ من بلازما المريض مع بلازما سوية حيث تحدد كمية الأضداد بطريقة Bethesda Assay، وهي تتم بأن تحضن بلازما المريض مع بلازما طبيعية بنسب متساوية لمدة ساعتين بدرجة حرارة 37°م. وتقدر كمية الأضداد بوحدة Bethesda وهي تساوي كمية الأضداد القادرة على إبطال فعالية 50% من العامل الثامن. تكون قيم الـ (PT, Fib) سوية عند هؤلاء المرضى (22، 23).
إن المعالجة بالعامل VIII يمكن أن تثبط الوظائف المناعية وخاصة عند مرضى الناعور والمصابين بالايدز. أظهرت بعض الدراسات بأنه عند المعالجة بركائز متوسطة النقاوة يحدث نقص كبير في قيم CD4 مقارنة بالمرضى المعالجين بركازات عالية النقاوة (24 - 26).
إن المرضى المهيئين لتوليد مثبطات للعامل VIII هم: المرضى اليافعون، المرضى الذين لديهم قصة عائلية والمهيئون وراثياً والمرضى المعالجون بمضادات الالتهاب. ويلاحظ ذلك بعدم الاستجابة للمعالجة وعدم ارتفاع قيم العامل VIII اللازمة لإيقاف النزف، تعتمد المعالجة عند هؤلاء المرضى أولا على معالجة النزوف وإعطاء FVIIa (27 - 29) ويلجأ في الحالات الشديدة إلى إعطاء مثبطات مناعية. إن التحمل المناعي هو إعطاء متكرر للعامل في فترات زمنية متقاربة: يومياً، أو كل يومين أو بمعدل ثلاث مرات في الأسبوع. يجب البدء بمعالجة هذه المثبطات حين اكتشافها مباشرة وعندما تكون قيم FVIII أقل 10% وعيار هذه المثبطات أكثر من 10 BU (30-34).
|
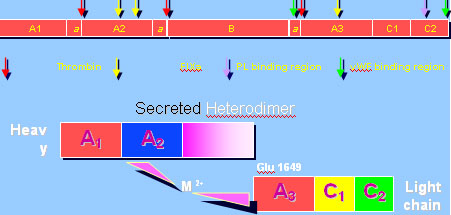
الشكل 1: جزء من بنية F.VIII مع أماكن ارتباط أو تأثير العوامل الأخرى التي تلعب دوراً في السبيل الداخلي للإرقاء الأولي.
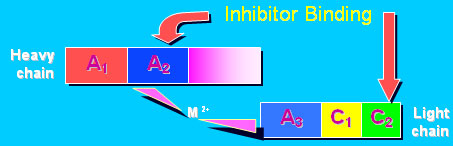
الشكل 2: مكان ارتباط الـ Anti-VIII بالـ F.VIII وبالتالي يؤدي لتثبيط عمل الـ VIII. |
| المواد والطرق Materials and Methods |
جُمعت العينات من مجموعات سكانية مختلفة في سورية ومن مستشفيات المواساة والأطفال والمجتهد ومركز الثلاسيمية الذي يراجعه مواطنون من جميع مناطق سورية. ضمت مجموعة المرضى 58 مريضاً. أخذت عينات صباحية وذلك على الشكل التالي:
أنبوب حاوٍ على سترات الصوديوم باستخدام نظام بزل الدم تحت الضغط السلبي Vacutines، ثم نُبِّذت العينات بسرعة 4000g لمدة 15 دقيقة بالدرجة +4°م. تم إجراء بعض التحاليل مباشرة ثم حفظت البلازما المتبقية بعد توزيعها في عدة أنابيب ايبندورف بالدرجة -80°م لمدة لم تتجاوز الشهرين. تمت معايرة aPTT، PT، الفبرينوجين، اختبار تصحيح تطاول aPTT على العينات الطازجة مباشرة. كما أجريت معايرة للعامل VIII والعامل IX، والعامل XI وأخيراً تم التقصي عن وجود أضداد للعامل VIII على العينات المحفوظة في الدرجة -80°م.
شملت المجموعة الشاهدة أشخاصاً أسـوياء
ظاهرياً لا يعانون من أية إصابة خمجية أو التهابية أو كبدية أو كلوية أو غدية. بلغ عدد أفراد هذه المجموعة خمسين شخصاً (ثلاثون ذكراً وعشرون أنثى) وتراوحت أعمارهم بين 20 و45 عاماً. تمت معايرة الـ aPTT، PT، الفبرينوجين، العامل VIII والعامل IX والعامل XI لجميع أفراد المجموعة الشاهدة.
تم مقايسة الـ PT و aPTT والفبرينوجين خلال أربع ساعات من جمع العينات بواسطة عتائد جاهزة من شركة هيومان على جهاز نصف آلي لشركة دياميد.
تمت معايرة فعالية كل من العامل VIII والعامل IX والعامل XI باستخدام عتائد لشركة دياميد على جهاز لشركة دياميد.
تم إجراء اختبار تصحيح تطاول زمن aPTT على المرضى جميعهم باستخدام عتائد aPTT وبلازما سوية لشركة هيومان حيث تم قياس زمن aPTT بعد إضافة بلازما سوية بحجم مساوٍ لحجم عينة المريض. تبين أنه تم تصحيح تطاول زمن الـ aPTT للمرضى جميعهم عدا أربعة مرضى.
تمت معايرة أضداد العامل VIIIعند أولئك المرضى الأربعة الذين لم يصحح زمن الـ aPTT لديهم.
|
| النتائج Results |
يمثل الجدول 1 نتائـج المجـال السـوي للمتثابتات المدروسة التي حصلنا عليـها من
المجموعة الشاهدة. لوحظ من خلال النتائج التي حصلنا عليها عند تلك المجموعة بأن قيم المتوسط الحسابي والانحراف المعياري لجميع المتثابتات المقاسة تقع ضمن القيم السوية المعروفة عالمياً (3، 4، 5).
يمثل الجدول 2 نتائج جميع الاختبارات التي أجريت على مجموعة المرضى. إن دراسة العلاقة بين تطاول الـ aPTT ونسبة عوز العامل VIIIعند مرضى الناعور تبين لنا من خلال الدراسة الإحصائية باستخدام الاستدلال الإحصائي بأن هناك تأثيراً كبيراً لانخفاض نسبة العامل VIII على تطاول aPTT. أما قيم المتثابتات الأخرىPT, Fib, F.IX, F.XI المدروسة فهي ضمن الحدود السوية.
يمثل الشكل 3 توزع القيم المتطاولة الـ aPTT مع نسبة العوز بالـ F.VIII عند المرضى.
تظهر قيم الـ aPTT الأكـثر تطاولاً عنـد
مجموعة العوز الشديد بالـ F.VIII ثم عند مجموعة العوز المتوسط ثم عند مجموعة العوز المعتدل وهذا يؤكد أهمية معايرة الـ aPTT في الكشف عن عوز الـ F.VIII. في المجموعة الشاهدة كانت القيم السوية كما في الجدول 1 لعدم وجود أي عوز بعوامل التخثر.
ثم أجرينا اختبار تصحيح الـ aPTT وقد تم تصحيح تطاول الـ aPTT عند 54 مريضاً وبقي 4 مرضى لم نتمكن من تصحيح aPTT عندهم حيث تمت معايرة Anti-VIII بطريقة Bethesda، تراوحت القيم بين 2-4 BU. تم التعبير عن النتائج بوحدة (BU) وهي تعادل كمية الأضداد اللازمة لإبطال 50% من فعالية العامل VIII في مزيج من بلازما المريض وبلازما شاهدة سوية وذلك بعد حضن المزيج لمدة ساعتين بالدرجة 37°م، كما هو مبين في الجدول 3 والشكل 4.
يمثل الشكل 5 تبدلات الـ PT عند المرضى تبعاً لنسبة عوز العامل VIII، حيث لوحظ بان تبدلات الـ PT طفيفة عند مجموعة المرضى ذات العوز المعتدل بـ F.VIII ثم تزداد عند مرضى العوز المتوسط وأكثر من ذلك عند مرضى العوز الشديد بـ F.VIII، إلا أن هذه القيم لا تخرج عن الحدود الدنيا للمجال السوي. يبين العوز بالعامل VIII بدرجاته المختلفة (كبقية العوز بأحد عوامل التخثر بالسبيل الداخلي) بان العوز الشديد فقط بالعامل VIII هو الذي يؤدي إلى تطاول معتدل في زمن PT.
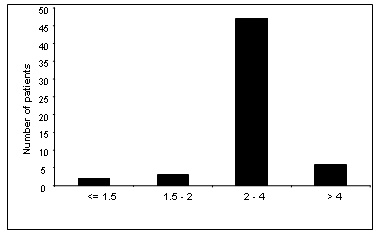
يبين الشكل 6 قيم الفبرينوجين عند مجموعة المرضى، حيث لوحظ عند مريضين بأن عيار الفبرينوجين أقل بقليل من 1.5غ/ل علماً بأن القيم السوية 2-4 غ/ل ووجدنا عيار الفبرينوجين عند 3 مرضى 1.5 > فبرينوجين > 2 غ/ل، وكانت قيم الفبرينوجين مرتفعة < 4غ/ل عند 5 مرضى من مجموعة الدراسة. أما بقية مرضى الدراسة فكانت قيم الفبرينوجين ضمن الحدود السوية.
|
الجدول 1: المجال السوي لمتثابتات المجموعة الشاهدة.
الانحراف المعياري |
المتوسط الحسابي |
المتثابتة |
3.22 |
28.55 |
aPTT (sec) |
9.34 |
110.96 |
FVIII(%) |
11.62 |
111.65 |
PT (%) |
9.65 |
114 |
FIX (%) |
9.47 |
117 |
FXI (%) |
0.16 |
2.84 |
Fibrinogen (g/L) |
الجدول 2: نتائج الاختبارات التي أجريت على مجموعة المرضى.
الانحراف المعياري |
المتوسط الحسابي |
المتثابتة |
12.73 |
73.08 |
aPTT (sec) |
2.51 |
1.2 |
FVIII(%) |
15.61 |
77.48 |
PT (%) |
18.92 |
101.98 |
FIX (%) |
12.80 |
67.62 |
FXI (%) |
0.83 |
2.92 |
Fibrinogen (g/L) |

الشكل 3: توزع القيم المتطاولة الـ aPTT مع نسبة العوز بالـ F.VIII عند المرضى.
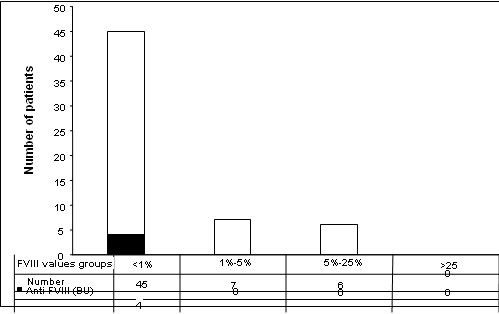
الجدول 3 والشكل 4: توزع المرضى إلى مجموعات حسب نسبة العوز بالـ العامل VIII، حيث نشاهد بأن 45 مريضاً يعانون من عوز شديد و7 عوز متوسط و6 يعانون من عوز معتدل. كما يمثل اللون الأسود مرضى الناعور الذين يحملون أضداداً للعامل الثامن، ومن الملاحظ بان جميع المرضى الذين يحملون أضداداً للعامل الثامن هم جزء من مجموعة مرضى العوز الشديد بالعامل الثامن.
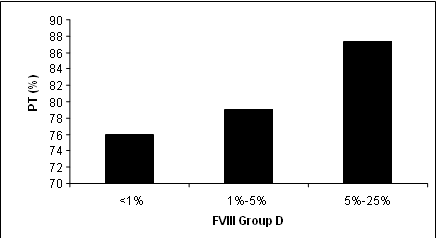
الشكل 5: تبدلات الـ PT عند المرضى حسب نسبة عوز العاملVIII .
الشكل 6: قيم الفبرينوجين عند مجموعة المرضى. |
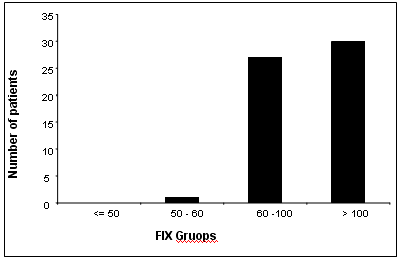
يمثل الشكل 7 توزع نتائج F.IX عند مرضى مجموعة الدراسة، حيث لوحظ بأن قيم F.IX سوية عند معظم مرضى مجموعة الدراسة مع وجود عوز خفيف عند مريضين كان لديهم قيم الـ F.IX بحدود 50% كما كانت نسبة الـ F.IX < 100% عند 29 مريضاً وفي المجال السوي بين 60-100% عند 27 مريض.
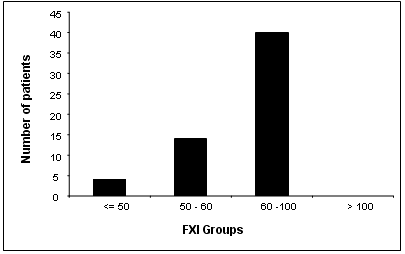
يمثل الشكل 8 توزع قيم العامل XI التي حصلنا عليها عند المجموعة المرضية، حيث لوحظ بأن قيم F.XI سوية عند معظم مرضى مجموعة الدراسة (41 مريضاً) مع وجود عوز خفيف عند 4 مرضى كان لديهم الـF.XI بحدود 50% وعند 13 مريضاً كانت قيم الـ F.XI بين 50-60%.
|
الشكل 7: توزع نتائج F.XI عند مرضى مجموعة الدراسة.
الشكل 8: توزع قيم العامل IX التي حصلنا عليها عند المجموعة المرضية. |
| المناقشة Discussion |
لوحظ عند جميع المرضى قيم PT سوية أو متطاولة قليلاً كما هو مبين في الشكل 5. حيث كانت قيم الـ PT < 70% عند جميع مرضى الناعور في المجموعة المدروسة إلا أنه لوحظ عند مجموعة مرضى العوز الشديد بأن قيم الـ PT في الحدود الدنيا السوية. تتوافق هذه الدراسة مع الدراسات العالمية التي تؤكد ضعف تأثير عوز الـ F.VIII على انخفاض نسبة البروترومبين (3، 5، 8).
إن معايرة العاملين IX و XI عند مجموعة المرضى كانت تهدف فقط لتأكيد عدم وجود عوز بأحد العوامل التي تلعب دوراً أساسياً في السبيل الداخلي للإرقاء الثانوي. وقد تم إهمال معايرة العامل XII نظراً لندرة تواتره من ناحية أولى ومن ناحية ثانية لثبوت العوز بالعامل VIIIعند جميع هؤلاء المرضى، وهو السبب في تطاول زمن الـ aPTT، بالإضافة إلى أن العامل XII لا يسبب نزوفاً إلا في حالات العوز الشديد. تؤكد هذه الدراسات بأن مرضى الناعور في مجموعة الدراسة يعانون من عوز منفرد بـ F.VIII وبأنه لا يوجد نقص وراثي معقد لمجموعة من عوامل التخثر ويتوافق هذا مع الدراسات والأبحاث المنشورة (11، 12، 14).
أما قيم الفبرينوجين فكانت سوية مع وجود عدد قليل من المرضى الذين كانت لديهم قيم الفبرينوجين أقل بقليل من القيم السوية (الشكل 6). حيث وجدنا عند مريضين قيم الفبرينوجين أقل من 1.5 غ/ل وعند 3 مرضى قيم الفبرينوجين بين 1.5-2 غ/ل وعند 6 مرضى قيم الفبرينوجين أكبر من المجال السوي الذي هو 2-4 غ/ل. من المحتمل أن يكون سبب القيم المنخفضة قليلاً عند بعض المرضى يعود إلى حالات ازدياد استهلاك الفبرينوجين بسبب حالات النزف المتكررة ولو كان خفيفاً عند هذا النوع من المرضى. أما القيم المرتفعة قليلا" عند 5 مرضى من المجوعة المدروسة فقد تعود إلى تفاعلات التهابية موضعية في مكان النزف وبالتالي إلى ارتفاع البروتينات الالتهابية ومن بينها الفبرينوجين وخاصة بعد حالات النزف المتوسطة أو الشديدة ضمن العضلات والمفاصل. تتوافق هذه النتائج مع الدراسات المنشورة (15، 17، 20).
وجدنا عند أربعة مرضى فقط أضداداً للعامل VIII، وجميع هؤلاء المرضى ينتمون إلى المجموعة ذات العوز الشديد. عويرت الأضداد عند هؤلاء المرضى وكانت القيم بين 2-4 BU. تعتبر هذه التراكيز خفيفة ولا تثبط سوى نسبة قليلة من العامل الثامن عند المعالجة. يمثل هذا العدد القليل من المرضى الذين لديهم أضداداً للعامل الثامن أقل من 7% من مجموع المرضى وهذه النسبة اقل من النسبة المعروفة عالميا (5، 10، 11، 12). يمكن أن يعزى ذلك إلى كون المرضى في سورية يتلقون عدداً أقل من جرعات المعالجة وخاصة الوقائية منها، كما أن قسماً منهم لا يتلقون علاجاً إلا في حالات النزوف الشديدة أو المهددة للحياة. وكذلك لكون منتجات ركازات العامل الثامن المستوردة محضرة من البلازما البشرية وهذه أقل تحريضاً على تكوين الأضداد من البلازما المحضرة من بلازما الخنزير أو من العامل الثامن المأشوب المحضر بالهندسة الوراثية.
|
| الاستنتاج Conclusion |
| تؤكد لنا هذه الدراسة بأن الـ PT، F.IX، F.XI والفبرينوجين عند معظم مرضى الناعور المصابين بعوز العامل الثامن تكون سوية أو في الحدود الدنيا من القيم السوية، وفي حالات نادرة تكون أقل بقليل من الحدود السوية. بالنسبة للفبرينوجين في حالات نادرة لا تتجاوز الـ 5%، وجدنا ارتفاعاً في قيمة الفبرينوجين بشكل معتدل وقد عزينا ذلك إلى التفاعلات الالتهابية في أماكن النزف. أما المرضى الذين كونوا أضداداً للعامل الثامن فلم تتجاوز نسبتهم الـ 7% من مرضى مجموعة الدراسة كما أن عيار الأضداد عندهم كان غير مرتفع. |
| المراجع References |
1-Hedner U et al.
Congenital Hemorrhagic Disorders: New insights into the pathophysiology and treatment of hemophilia.
Hematology (Am Soc Hematol Educ Program), 241-265, 2000.
2-Burnet SP, Duncan EM, Lloyd JV. and Han P.
Acquired hemophilia in South Australia: a case report.
Internal Medicine Journal, 31: 556-559, 2001.
3-Boggio LN. and Green D.
Acquired Hemphilia.
Rev Clin Exp Hematol; 5, 43: 389-404, 2001.
4-Kessler CM. and Ludlam CA.
The treatment of acquired factor VIII inhibitors: worldwide experience with porcine factor VIII concentrate. International Acquired
Hemophilia Study Group.
Semin Haematol; 30 (Suppl 1): 22-27, 1993.
5-Brettler DB et al.
The use of porcine factor VIII concentrate (Hyate:C) in the treatment of patients with inhibitor antibodies to factor VIII. A
multicenter US experience.
Arch Intern Med; 149: 1381-1385, 1989.
6-Dingli D, Gastineau DA, Gilchrist G, et al.
Continuous factor VIII infusion therapy in patients with hemophila A undergoing surgical procedures with plasma derived or
recombinant factor VIII concentrates.
Haemophilia, 8: 629-634, 2002.
7-Minor PD.
Are recombinant products really infection risk free?
Haemophilia, 7: 114-117, 2001.
8-Yee TT, Beeton K. and Griffioen A.
Experience of prophylaxis treatment in children with severe hemophilia.
Haemophilia, 8: 76-82, 2002.
9-Hoyer LW, Gawryl MS. and de la Fuente B.
Immunological characterization of factor VIII inhibitors.
Prog Clin Biol Res; 150: 73-85, 1984.
10-Fulcher CA, de Graaf Mahoney S. and Zimmerman TS.
FVIII inhibitor IgG subclass and FVIII polypeptide specificity determined by immunoblotting.
Blood, 69: 1475-1480, 1987.
11-Maansouri Torghabeh H, Pourfathollah AA, Mahmoodian Shooshtari M, Rezaie Yazdi Z. and et al.
Evaluation pattern of factor VIII inhibitor in patients with hemophilia A in Khorasan.
Hakim J; 8: 1-15, 2004.
12-Hoyer LW.
The incidence of factor VIII inhibitors in patients with severe hemophilia A
Adv Exp Med Biol; 386: 35-45, 1995.
13-Sultan Y.
Inhibitor development in haemophiliacs: theoretical background and clinical aspects.
Blood Coagul Fibrinolysis, 6 (Suppl 2): 55S-57S, 1995.
14-Bendandi M, Zaccaria A, Zinzani PL. et al.
Factor VIII inhibitor prior to and during secondary acute nonlymphocytic leukemia in a patient with cured Hodgkin's disease.
Leuk Lymphoma; 16: 511-513, 1995.
15-Hultin MB.
Acquired inhibitors in malignant and nonmalignant disease states.
Am J Med; 91 (5A): 9S-13S, 1991.
16-Lopez R, Mateo J, Cruz J, Lopez A, Urrutia T. and Fontcuberta J.
Presentation of an acquired factor VIII inhibitor with a muscular haematoma mimicking a deep venous thrombosis in a patient with breast cancer.
Blood Coagul Fibrinolysis, 6: 680-682, 1995.
17-Nasonova VA. and Korotaeva TV.
Rosenthal’s syndrome (hemophilia C) in a patient with psoriatic arthritis (a clinical case).
Ter Arkh; 69: 77-78, 1997.
18-Boudo F.
Acquired factor VIII inhibitors in pregnancy: data from the Italian Haemophilia Register relevant to clinical practice.
International J Obstet Gynaecol, 110: 311-314, 2003.
19-Sohngen D, Specker C, Bach D. et al.
Acquired factor VIII inhibitors in nonhemophilic patients.
Ann Hematol; 74: 89-93, 1997.
20-Amiral J, Minard F. and Chambrette B.
Development of standardized immunoassay for identification, characterization and qualification of antiphospholipid antibodies (APA).
Biol Clin Hematol; 13: 81-88, 1991.
21-Moccia F, Tognoni E. and Boccaccio P.
Acquired factor VIII inhibitor associated with prostatic cancer: successful treatment with steroid and immunosuppressive therapy.
Ann Ital Med Int; 15: 172-176, 2000.
22-Sallah S. and Wan JY.
Inhibitors against factor VIII in patients with cancer. Analysis of 41 patients.
Cancer, 91: 1067-1074, 2001.
23-Colvin BT, Hay CR, Hill FG. and Preston FE.
The incidence of factor VIII inhibitors in the United Kingdom 1990-93. Inhibitor Working Party. United Kingdom Haemophilia Centre
Directors Organization.
Br J Haematol; 89: 908-910, 1995.
24-Jy W, Gagliano-DeCesare T, Kett DH. et al.
Life-threatening bleeding from refractory acquired FVIII inhibitor successfully treated with rituximab.
Acta Haematol; 109: 206-208, 2003.
25-Shobeiri SA, West EC, Kahn MJ. and Nolan TE.
Postpartum acquired hemophilia (factor VIII inhibitors): a case report and review of the literature.
Obstet Gynecol Surv; 55: 729-737, 2000.
26-Dannhauser D, Casonato A, Pietrogrande F. et al.
Acquired factor VIII: C inhibitor in a patient with Sj?gren's syndrome: successful treatment with steroid and
Shapiro AD et al.
Prospective, randomised trial of two doses of rFVIIa (Novo Seven) in haemophilia patients with inhibitors undergoing surgery.
Thromb Haemost; 80: 773-778. 1998.
27-Macik BG. et al.
Safety and initial clinical efficacy of three dose levels of recombinant activated factor VII (rFVIIa): results of a phase I study.
Blood Coagulation and Fibrinolysis; 4: 521-527, 1993.
28-Guerin V, Chossat I, Dutronc H, Dubreuil M. and Valentin F.
Recombinant FVIIa in the treatment of bleeding in acquired hemophilia.
Am J Hematol; 70: 333, 2002.
Santagostino E, Gringeri A. and Mannucci PM.
Home treatment with recombinant activated factor VII in patients with factor VIII inhibitors: the advantages of early intervention.
Br J Haematol; 104: 22-26, 1999.
29-Schwartz RS, Gabriel DA, Aledort LM, Green D. and Kessler MC.
A prospective study of treatment of acquired (autoimmune) factor VIII inhibitors with high-dose intravenous gammaglobulin.
Blood, 86: 797-804, 1995.
30-Moccia F, Tognoni E. and Boccaccio P.
Acquired factor VIII inhibitor associated with prostatic cancer: successful treatment with steroid and immunosuppressive therapy.
Ann Ital Med Int; 15: 172-176, 2000.
31-Ling M, Duncan EM, Rodgers SE. et al.
Classification of the kinetics of factor VIII inhibitors in haemophilia A: plasma dilution studies are more discriminatory than time-course studies.
Br J Haematol; 114:861-867, 2001.
32-Matsumoto T, Shima M, Fukuda K et al.
Immunological characterization of factor VIII autoantibodies in patients with acquired hemophilia A in the presence or absence of underlying disease.
Thromb Res; 104: 381-388, 2001.
33-Hall RL. and Leahy MF.
Acquired Factor VIII autoantibody: four cases demonstrating the heterogenous nature of this condition and problems involved in diagnosis and treatment.
Eur J Haematol; 66: 206-209, 2001.
|
| |
| المجلد 4 ,
العدد 3
, رمضان 1427 - تشرين الأول (أكتوبر) 2006 |
|
|
|
