| المجلد 4 , العدد 4 , ذو الحجة 1427 - كانون الثاني (يناير) 2007 |
| |
| اضطراب نظام الأكسدة الاختزالية للغلوتاثيون عند مرضى السكري |
| Perturbation du Système Redox de Glutathion
Chez les Diabétiques
|
| د. سعد ساقع و د. وسيلة عواشري |
| Saad SAKA et Wassila AOUACHERI |
| قسم الكيمياء الحيوية، كلية العلوم، جامعة باجي مختار، عنابة، الجزائر |
| الملخص Abstract |
| يؤدي داء السكري إلى اضطرابات كبيرة في استقلاب السكريات، ويظهر هذا جلياً في انخفاض معدل تفاعلات الغلكزة وحلقة البنتوز الفسفاتي. وخاصة إنزيم glucose-6-phosphate déshydrogénase (G6PDH) المنتج الأساسي للكوإنزيم المختزل NADPH+H+، وهذا الأخير ضروري للحفاظ على النسبة الطبيعية لحلقة الأكسدة الأختزالية للغلوتاثيون GSH/GSSG. يؤدي النقص في نشاط الإنزيم G6PDH إلى حالة الجهد التأكسدي للخلايا stress oxydatif، مما يزيد من اختطار مضاعفات داء السكري كنتيجة لزيادة تخليق العوامل المؤكسدة مثل الجذور الحرة والبيروكسيدات المختلفة.
حصلنا في هذا البحث على نقص في نشاط الإنزيم G6PDH عند غالبية مرضى السكري وخاصة في حالة مرضى السكري غير المعتمد على الأنسولين DNID. وقد صاحب ذلك نقص في تركيز الهيموغلوبين في الدم. بالمقابل زاد نشاط النظام الإنزيمي للغلوتاثيون ويتضح ذلك من خلال نقص مستوى الغلوتاثيون GSH وزيادة نشاط الإنزيم غلوتاثيون بيروكسيداز GPx. حيث أن النقص الملحوظ في نشاط الإنزيم G6PDH أدى إلى زيادة سرعة تكوين العوامل المؤكسدة، وبالتالي دخول العضوية في حالة جهد تأكسدي خطير نتيجة لانخفاض مستوى الغلوتاثيون ومن ثم اضطراب حلقة الأكسدة الاختزالية للغلوتاثيون. هذا ما يظهره النقص في مستوى الهيموغلوبين نتيجة لتعرض كريات الدم الحمر على وجه الخصوص إلى هجوم الجذور الحرة والبيروكسيدات وحدوث تحلل دموي خطير.
|
| Le diabète provoque des perturbations dans le métabolisme des carbohydrates, ceci est signalé par la diminution de l’activité des réactions de la glycolyse et de la voie du pentose phosphate. Cette diminution atteint l’activité enzymatique de la glucose-6-phosphate déshydrogénase (G6PDH) qui constitue le producteur principal du coenzyme réduit NADPH+H+. ce dernier intervient dans la conservation du rapport naturel du cycle d’oxydoréduction du glutathion (GSH/GSSG). L’activité réduite de la G6PDH induit un stress oxydatif cellulaire donnant des complications graves du diabète suite à l’augmentation de synthèse des facteurs oxydants (radicaux libres et peroxydes).
Nous avons obtenu dans cette étude une diminution de l’activité enzymatique de la G6PDH chez la plupart des patients diabétiques, surtout dans le diabète non insulino dépendant (DNID). Ceci est accompagné par une baisse dans la concentration de l’hémoglobine du sang. En revanche, l’activité du système enzymatique du glutathion a augmenté d’où une diminution du niveau du glutathion et une augmentation de l’activité enzymatique de la glutathion peroxydase (GPx).
En conclusion, la diminution observée dans l’activité enzymatique de la G6PDH a accéléré la vitesse de formation des facteurs oxydants suite à la diminution de niveau du glutathion. Le cycle d’oxydoréduction du glutathion a été donc perturbé et l’organisme subit un stress oxydatif dangereux induisant une forte hémolyse des hématies, ce qui a causé la baisse de la concentration d’hémoglobine.
|
| الكلمات المفتاح Mots clés: داء السكريDiabète ، غلوكوز-6-فسفات ديهيدروجينازG6PDH ، نظام الأكسدة الاختزالية للغلوتاثيونSystème d’Oxydoréduction du Glutathion، الهيموغلوبينHémoglobine . |
| المقدمة Introduction |
يُعد داء السكري من أهم الأمراض الاستقلابية التي تصيب الإنسان من الجنسين، وفي جميع أطوار حياته. تعود أهم أسباب الإصابة بهذا المرض إلى النقص في إفراز هرمون الأنسولين من غدة المعثكلة (البنكرياس) (خلايا ,b في جزر لنغرهانس)، مما يؤدي إلى اضطراب في تمثيل المواد السكرية وانخفاض درجة حموضة pH الدم بفعل زيادة تركيز الأجسام الكيتونية (1). تعد زيادة الجهد التأكسدي للخلية الحية stress oxydatif من أهم المضاعفات الخطيرة لارتفاع مستوى سكر الدم، والتي سوف تؤدي حتما إلى حدوث خلل في العديد من المسارب الاستقلابية المختلفة، وبالتالي أصبحت هذه الظاهرة من أهم محاور البحث العلمي في مختلف الدراسات السريرية. تؤدي زيادة الجهد التأكسدي يؤدي إلى زيادة العمليات الحيوية المنتجة للمركبات المؤكسدة produits oxydants المستهلكة للمركبات الحيوية الدفاعية والتي تتمثل في مضادات التأكسد anti-oxydants (2).
يلعب إنزيم glucose-6-phosphate déshydrogénase (G6PDH) دوراً أساسياً في تنظيم الجهد التأكسدي من خلال تخليق الكوإنزيم المختزل الخلوي الأساسي NADPH+H+.
يعد هذا الإنزيم محدداً لسرعة حلقة البنتوز الفسفات وهو ضروري لنشاط النظام الدفاعي المضاد للتأكسد، كونه هو الإنزيم الرئيسي المسؤول عند إنتاج أهم المركبات المختزلة الخلوية والمتمثل أساساً في الكوإنزيم المختزل NADPH+H+ (3).
يعد NADPH+H+ المركب الأساسي المحافظ على الوسط داخل-الخلوي المختزل اللازم لنشاط العديد من الأنظمة الإنزيمية الدفاعية، وخاصة نظام الأكسدة الإختزالية للغلوتاثيون système redox du glutathion. حيث يشارك الإنزيم glutathion peroxydase (GPx) في اختزال المركبات المؤكسدة السامة (بيروكسيدات، جذور حرة ومسرطنات) إلى كحولات غير سامة، وذلك من خلال أكسدة الغلوتاثيون المختزل GSH إلى الغلوتاثيون المؤكسد GSSG، ومن أجل المحافظة على نسبة GSH/GSSG طبيعية يتدخل الإنزيم glutathion réductase (GR) ليعيد اختزال GSSG إلى GSH بوجود التميم NADPH+H+ (4) )الشكل 1(.
يشارك الغلوتاثيون في مختلف تفاعلات الأكسدة الاختزالية، وخاصة تلك المتعلقة باختزال البيروكسيدات العضوية منها وغير العضوية. وبالتالي حماية العضوية الحية من آثار التسمم الناتجة عن الأكسدة البيروكسيدية
وذلك بوجود الإنزيم GPx (3). إذ يساهم الغلوتاثيون في الحفاظ على تركيب ووظيفة الأغشية الخلوية من الهجمات المتكررة للبيروكسيدات والجذور الحرة وخاصة تلك الخاصة بالكريات الدموية الحمر. حيث أوضحت العديد من الدراسات العلمية الحديثة بأن هذه المركبات المؤكسدة يزيد مستواها بشكل ملحوظ عند مرضى السكري أو في حالات العوز الوراثي لإنزيم G6PDH (5 - 4). كما يعمل الغلوتاثيون على حماية الجسم البلوري للعين من آثار الجذور الحرة وفوق أكسيد الهيدروجين (H2O2) من خلال اختزالها في وجود الإنزيم GPx. فغالباً ما يصاحب داء السكري الإصابة بمرض السادّ (الماء الأبيض) cataracte ويحدث هذا نظراً للغياب الكلي لإنزيم catalase المسؤول عن تمثيل H2O2 في بلورة العين (6).
|
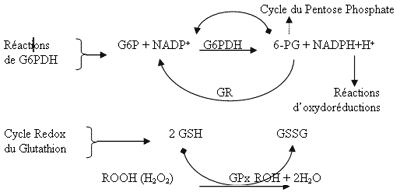
شكل 1: دور إنزيم G6PDH في تنشيط نظام الأكسدة الاختزالية للغلوتاثيون.
|
| المواد والطرق Matériels et méthodes |
* الاعتيان Prélèvement
تم أخد عينات دم كافية من مجموعة أشخاص أسوياء ومجموعة من المرضى المصابين بالداء السكري في حالة صيام. وضع جزء من الدم في أنابيب تحتوي على مضاد التخثر EDTA لقياس تركيز الهيموغلوبين والغلوتاثيون المختزل وكذلك نشاط الإنزيمات G6PDH وGPx، بينما وضع الجزء الآخر من الدم في أنابيب جافة من أجل قياس مستوى السكر في الدم.
* المجموعة الشاهدة Groupe témoin
أشتملت على 18 شخصاً سوياً ظاهرياً لا يعانون أية إصابة مشخصة، من مختلف الفئات العمرية الموافقة (30 – 48 سنة) لعينة البحث من المرضى ومن الجنسين.
* مجموعة المرضى بالسكري
Groupe atteints du diabète
اشتملت الدراسة على 27 حالة مرضية تتراوح أعمارهم ما بين 28 و 52 سنة من معتادي مصلحة أمراض الغدد الصماء بمستشفى ابن سينا، عنابة، الجمهورية الجزائرية. تم تشخيص حالات السكري من قبل الأخصائيين من خلال التحاليل المخبرية وبالتالي تحديد نمط الإصابة لدى جميع أفراد هذه المجموعة. تم تحديد مدة الإصابة لغالبية المرضى من بداية ظهور أعراض السكري وزيارة المصلحة، والتي تتراوح ما بين 3 - 6 سنوات. تم اختيار المرضى الذين لم تكن لديهم أية إصابات أخرى مشخصة غير الإصابة بالسكري فقط، من أجل استبعاد أي احتمال لتأثير تلك الإصابات على القيم المراد تحديدها. جميع أفراد المجموعة المختارة من المرضى يتبعون حميات غذائية مناسبة لنوع المرض بدون أخذ أدوية منظمة لمستوى السكر إلا للضرورة. وعلى هذا الأساس لم نتمكن من الحصول على عينات مرضية أكثر. من بين المجموعة المصابة بالسكري تم تمييز 13 حالة مصابة بالسكري المعتمد على الأنسولين DID و14 حالة مصابة بالسكري غير المعتمد على الأنسولين DNID.
* عتائد المعايرة Coffrets des analyses
1- عتيدة لمعايرة مستوى السكر في الدم، لشركة Biosystems الأسبانية.
2- عتيدة لمعايرة نشاط الإنزيم G6PDH، لشركة Sigma diagnostics الفرنسية.
3- عتيدة لمعايرة تركيز الهيموغلوبين في كريات الدم الحمر، لشركة Sigma diagnostics الفرنسية.
4- عتيدة لمعايرة مستوى الغلوتاثيون في البلازما بطريقة ELISA، لشركة Biomerieux الفرنسية.
5- عتيدة لمعايرة نشاط الإنزيم GPx في البلازما بطريقة ELISA، لشركة Biomerieux الفرنسية.
* الدراسة الإحصائية
Traitement statistique
تمت مقارنة متوسط القيم بين المجموعات المرضية والمجموعة الشاهدة وذلك باستعمال اختبار ستيودنت t test.
|
| النتائج Résultats |
| إن التبدلات في مستوى السكر الدموي عند مرضى السـكري سـواءً بـ DID أو بـ DNID موضحة في الجدول 1. حيث زاد مستوى السكر بصورة معتد بها عند الحالات المرضية مقارنة بالمجموعة الشاهدة. وكنتيجة لهذه التبدلات حدث نقص في نشاط الإنزيم G6PDH عند مرضى DID بنسبة تقدر بـ 27.8% أما عند مرضى DNID فكانت النسبة 31.3% مقارنة بالأصحاء )الجدول 1(. هذا ما أدى إلى حدوث اضطراب في حلقة الأكسدة الأختزالية، والذي يمكن ملاحظته من خلال النتائج الخاصة بتركيز الغلوتاثيون ونشاط الإنزيم GPx )الجدول 2(. حيث نقص تركيز الغلوتاثيون عند مرضى DID بنسبة 35% وعند مرضى DNID بنسبة 23.8% مقارنة بالمجموعة الشاهدة. وبالمقابل زاد نشاط الإنزيم GPx عند جميع المرضى سواءً بـ DID أو DNID بنسبة تفوق 35% مقارنة بالشواهد. من أسوأ العواقب التي تنتج عن هذه الاضطرابات في حلقة الأكسدة الأختزالية هي تبدل النسبة GSH/GSSG كنتيجة للاستهلاك المفرط للغلوتاثيون، مما يؤدي إلى مهاجمة البيروكسيدات والجذور الحرة لمختلف البروتينات وخاصة على مستوى جدر أغشية الكريات الدموية الحمر وبالتالي موتها، وهذا ما أدى إلى نقص مستوى الهيموغلوبين عند جميع المرضى. فقد بلغت نسبة النقص عند مرضى DID 34.5% وعند مرضى DNID 42.8% مقارنة بالأصحاء )الجدول 3(.
|
الجدول 1: مستوى سكر الدم (g/l) ونشاط الإنزيم G6PDH (U/g Hb) عند مرضى السكري DID) و(DNID ومقارنتها بالأصحاء. (متوسط القيم ± الانحراف المعياري).
الفحوص المجراة |
الأصحاء |
المرضى بـ DID |
المرضى بـ DNID |
سكر الدم (g/l) |
0.93 ± 0.13 |
1.83 ± 0.73 |
2.13 ± 0.82 |
نشاط G6PDH (U/g Hb) |
11.15 ± 0.88 |
8.08 ± 0.87 |
7.66 ± 0.85 |
الجدول 2: تركيز الغلوتاثيون (µM/ml) ونشاط الإنزيم GPx (U/ml) عند مرضى السكري DID) و(DNID ومقارنتها بالأصحاء. (متوسط القيم ± الانحراف المعياري).
الفحوص المجراة |
الأصحاء |
المرضى بـ DID |
المرضى بـ DNID |
تركيز الغلوتاثيون (µM/ml) |
3.55 ± 0.55 |
2.29 ± 0.73 |
2.71 ± 0.49 |
نشاط الإنزيم GPx (U/ml)) |
2.70 ± 0.28 |
3.66 ± 0.54 |
3.76 ± 0.35 |
الجدول 3: تركيز الهيموغلوبين (g/dl) عند مرضى السكري DID) و(DNID ومقارنتها بالأصحاء. (متوسط القيم ± الانحراف المعياري).
الفحوص المجراة |
الأصحاء |
المرضى بـ DID |
المرضى بـ DNID |
تركيز الهيموغلوبين (g/dl) |
14.82 ± 1.96 |
9.70 ± 1.06 |
8.47 ± 1.12 |
|
| المناقشة Discussion |
يؤدي داء السكري إلى حدوث زيادة سويات السكر في الدم، وذلك لعدم إمكان دخول الغلوكوز إلى الوسط داخل-الخلوي لعدم وجود كميات كافية من هرمون الأنسولين. فنقص مسـتوى السـكر داخل-الخلوي يبطئ من تفاعلات حلقة الأكسدة الاختزالية، وبالتالي ينقص نشاط الإنزيم G6PDH في حالة مرضى السكري )4(، ويكون بشكل أوضح في حالة السكريين غير المعتمدين على الأنسولين DNID. حيث حدث نقص في نشاط هذا الإنزيم وذلك بنسبة 27.8% عند مرضى DID و31.3% عند مرضى DNID. أصبح من المؤكد الآن أن إنزيم G6PDH هو المصدر الرئيسي للكوإنزيم المختزل NADPH+H+ اللازم لمختلف عمليات الأكسدة الاختزالية، وبالتالي فإن لهذا الإنـزيـم دوراً فعالاً في تنظيـم الأكسـدة
الاختزالية في الخلية الحية (7).
النقص الملحوظ في نشاط هذا الإنزيم يقابله نقص أكيد في مستوى الكوإنزيم NADPH+H+ وبالتالي نقص في عملية إعادة اختزال الشكل المؤكسد للغلوتاثيون GSSG إلى الشكل المختزل GSH )8(. فقد حصلنا في هذا البحث على انخفاض يعتد به في مستوى الغلوتاثيون عند جميع المرضى السكريين وخاصة في حالات DID، إذ اتضح بأن مستوى الغلوتاثيون قد نقص بنسبة 35% و 23.8% عند مرضى DID و DNID على الترتيب مقارنة بالمجموعة الشاهدة. النتائج نفسها تم الحصول عليها من خلال أعمال Xu et al.
تعد زيادة سرعة تخليق المواد المؤكسدة والتي تتمثل أساسا في البيروكسيدات والجذور الحرة من أهم الظواهر الكيميائية الحيوية التي تحدث في حالة داء السكري )9(، ويحدث هذا كنتيجة لانخفاض تخليق NADPH+H+، وذلك من خلال تفاعلات بيولوجية عادية بمشاركة مجموعة من إنزيمات oxydases مثل NADPH oxydase وmonoamine oxydase وxanthine oxydase وurate oxydase. تتكون هذه المركبات في بعض العضيات الخلوية منها الميتوكوندري والبيروكسيزومات والميكروزومات (المتقدرات والجسيمات فوق المؤكسدة والجسيمات الصغرية) (10). تشتمل آثار زيادة الجهد التأكسدي على أكسدة الدهون والبروتينات والسكريات والأحماض النووية، والتي تؤدي إلى اضطراب خطير في استقلاب ونمو العضوية الحية. وبالتالي فإن لهذه الظاهرة الدور الكبير في تفاقم اختلاطات داء السكري (11). يتم تنظيم تفاعلات الأكسدة الاختزالية بواسطة مجموعة من الأنظمة الإنزيمية مثل النظام الإنزيمي للغلوتاثيون وإنزيمات catalase وsuperoxyde dismutase، حيث يعد الكوإنزيم NADPH+H+ المختزل الرئيسي داخل-الخلوي، والذي ينتج بصورة أساسية بواسطة إنزيم G6PDH (12). من أجل حماية الخلايا الحية من الأثار المخربة لهذه العوامل المؤكسدة يتدخل الإنزيم GPx ليختزل ويزيل سمية الجذور الحرة والبيروكسيدات المختلفة وذلك باستعمال الغلوتاثيون المختزل، مما يؤدي إلى زيادة نشاط هذا الإنزيم وانخفاض مستوى الغلوتاثيون. والنتائج التي حصلنا عليها في هذا البحث تؤكد ذلك. إذ زاد نشاط الإنزيم GPx عند جميع المرضى بنسبة تفوق 35 % مقارنة بالمجموعة الشاهدة.
على الرغم من النشاط الملحوظ في حلقة الأكسدة الاختزالية، فإن الكميات الكبيرة من العوامل المؤكسدة (الجذور الحرة والبيروكسيدات) سوف تهاجم مختلف البروتينات وخاصة تلك المكونة للأغشية الحيوية لكريات الدم الحمر مما يؤدي لانفجارها وتلفها، وبالتالي حدوث انخفاض في مستوى الهيموغلوبين في الدم )13(، وهذا كنتيجة مباشرة لانخفاض كل من مستوى الغلوتاثيون ونشاط الإنزيم G6PDH، وتؤكد نتائج البحث ذلك، فقد بلغت نسبة نقص الهيموغلوبين عند مرضى DID 34.5% وعند مرضى DNID 42.8% مقارنة بالأصحاء. حيث أكدت الدراسات العلمية الحديثة بأن التلف الخلوي الناتج عن زيادة الجهد التأكسدي يعتمد أساساً على التبدل في نشاط هذا الإنزيم عند مرضى السكري (4). وقد أرجع Xu et al. ذلك إلى زيادة تركيز cAMP الذي يؤدي إلى زيادة نشاط الإنزيم protéine kinase A وبالتالي فسفرة الإنزيم G6PDH وتثبيطه. ونظراً لأن الإنزيم G6PDH هو المسؤول الرئيسي عن تخليق الكوإنزيم المختزل NADPH+H+ الضروري لإعادة اختزال GSSG إلى GSH، فإن أي تأثير على نشاط هذا الإنزيم سوف يؤثر بدوره على مستوى NADPH+H+ اللازم لنشاط غالبية تفاعلات الأكسدة الاختزالية (14). بمعنى أن تثبيط الإنزيم G6PDH سوف يؤدي إلى نقص في مستوى NADPH+H+ وبالتالي تعرض العضوية الحية إلى هجوم المركبات المؤكسدة خاصة على كريات الدم الحمر مؤدية إلى تحطيمها وحدوث الانحلال الدموي، وقد توصلنا إلى هذا الاستنتاج من خلال النقص الملحوظ في تركيز الهيموغلوبين كنتيجة للانحلال الدموي الحاد.
|
| الاستنتاج Conclusion |
|
من أهم العواقب الخطيرة لداء السكري هي حدوث خلل في تمثيل السكريات، والمتمثل عادة في الارتفاع الحاد في سكر الدم، مما يؤدي إلى نقص ملحوظ في نشاط الإنزيم G6PDH، وسيؤدي هذا بدوره إلى زيادة سرعة تكوين العوامل المؤكسدة (الجذور الحرة والبيروكسيدات) ودخول العضوية في حالة جهد تأكسدي خطير وذلك كنتيجة لانخفاض كل من مستوى الغلوتاثيون ونشاط الإنزيم G6PDH ومن ثم اضطراب حلقة الأكسدة الاختزالية للغلوتاثيون، مما يؤدي إلى تعرض كريات الدم الحمر على وجه الخصوص إلى هجوم العوامل المؤكسدة وبالتالي إمكانية حدوث تحلل دموي خطير.
|
| المراجع Références |
1-Khiati M.
Le diabète sucré chez l’enfant. OPU, Alger, 1993.
2-Horold A. et Harper D.
Précis de biochimie. Université Laval, Québec, 1969.
3-Kosower NS. and Kosower EM.
Functional aspects of glutathione disulfide and hidden forms of glutathione (159-173). In: Arias IM.
and Jacoby WB. (Eds). Glutathione: metabolism and function. Raven Press, New York, 1976.
4-Zhang Z; Apse K; Pang J. and Stanton RC.
J. Biol. Chem., 275 (51), 40042-40047, 2000.
5-Satoh M; Fujimoto S; Haruna Y; Arakawa S; Horike H; Komai N; Sasaki T; Tsujioka K; Makini H. and
Kashihara N.
Am. J. Physiol., 288, 1144-1152, 2005.
6-El-Farra MA; Aouacheri W; Saka S. and Guellati M.
C. R. Acad. Bulg. Sci., 56 (6), 89-92, 2003.
7-Tian WN; Braunstein LD; Apse K., Pang J; Rose M; Tian X.and Stanton RC.
Am. J. Physiol., 276, 1121-1131, 1999.
8-Xu Y; Osborne BW. and Stanton RC.
Am. J. Physiol., 289, 1040-1047, 2005.
9-Satoh M; Fujmoto S; Haruna Y; Arakawa S; Horike H; Komai N; Sasaki T; Tsujioka K; Makino H. and
Kashihara N.
Am .J. physiol., 288, 1144-1152, 2005.
10-Fridovich I.
J. Biol. Chem., 272, 18515-18517, 1997.
11-Giugliano D; Ceriello A. and Paolisso G.
Diabetes Care, 19, 257-267, 1996.
12-Simonian NA. and Coyle JT.
Annu. Rev. Pharmacol. Toxicol., 36, 83-106, 1996.
13-Cooper AR. et Bunn HF.
Anémie hémolytique (1517-1519). Dans: Harison T. (Ed). Principe de médicine interne. 5ème édition,
Flammarion Médicine-sciences, Paris, 1992.
14-Kamal K; Du W; Mills I. and Sumpio BE.
J. Cell. Biochem., 71, 491-501, 1998.
|
| |
| المجلد 4 , العدد 4 , ذو الحجة 1427 - كانون الثاني (يناير) 2007 |
|
|
|
