| المجلد 4 ,
العدد 6
, جمادى الآخرة 1428 - تموز (يوليو) 2007 |
| |
| دراسة مستويات ريزستين المصل لدى مرضى الداء السكري من النمط الثاني |
| Serum Resistin Levels in Patients with Diabetes Mellitus Type II |
| د. إسماعيل الساري*، أ.د. فايزة القبيلي* و أ.د. يونس قبلان** |
| Al-Sari I*; Al-Quobaili F*. and Kabalan Y** |
* كلية الصيدلة، جامعة دمشق،** كلية الطب، جامعة دمشق
* Faculty of Pharmacy, Damascus University
** Faculty of Medicine, Damascus University
|
| الملخص Abstract |
تم مؤخراً استعراف سيتوكين شحمي اسمه الريزستين، يُعبّر عنه في النسيج الشحمي. يُنقص الريزستين الحساسية على الأنسولين في كافة أنحاء الجسم. وقد افترض أن الريزستين يشكل رابطاً بين البدانة والداء السكري من النمط الثاني.
قمنا في دراستنا بتعيين مستويات ريزستين المصل لثلاث مجموعات من الأفراد: الأفراد البدينون (31 فرداً) والأفراد البدينون المصابون بالداء السكري من النمط الثاني (35 فرداً) والأفراد الأسوياء (21 فرداً) باستخدام مُقَايَسَة المُمْتَز المَناعِي المُرْتَبِطِ بالإنزيم ELISA. وباستخدام جملة المقايسة هذه وجدنا أن مستويات الريزستين للأفراد البدينين والأفراد البدينين المصابين بالداء السكري من النمط الثاني كانت زائدة مقارنة مع الأفراد الأسوياء. أظهرت دراستنا أن الريزستين يشكل رابطاً بين البدانة والداء السكري من النمط الثاني.
|
|
Recently, a new adipocytokine called “resistin” has been identified. It is expressed in adipose tissue. Resistin is capable of causing decreased whole-body insulin sensitivity. It was hypothesized that resistin links obesity with diabetes. We determined serum resistin levels of three groups: obese (n=31), obese diabetic type II (n=35) and normal (n=21) subjects by ELISA. Using this assay system we found that resistin levels of obese and obese diabetic type II subjects were high compared with normal subjects. Our study revealed that resistin links obesity to type II diabetes. |
| المقدمة Introduction |
أصبح واضحاً الآن أن النسيج الشحمي يعمل
كعضو صماوي حيث يفرز بروتينات كثيرة (الشكل1) اسـتجابة لمنبهات متنوعـة (1)،
والريزستين resistin من هذه البروتينات التي لها علاقة باستقلاب الغلوكوز والشحم وبالتالي تستطيع التأثير على المقاومة على الأنسولين.
اكتشف الريزستين عام 2001 م، وسمي بهذا الاسم "resistin" بسبب المقاومة على الأنسولين التي يسببها عند الفئران المحقونة به (2، 3).
ينتمي الريزستين إلى عائلة من البروتينات غنية بالسيستئين، يبلغ طول طليعة ببتيد الريزستين عند البشر 108 حمضاً أمينياً والوزن الجزيئي له 12.5 كيلو دالتون (2). يسمى الريزستين أيضاً العامل الافرازي النوعي للنسيج الشحمي adipocyte- specific secretory factor (ADSF) ويسمى أيضاً الموجود في المنطقة الالتهابيةFound in Inflammatory (FIZZ3) .Zone تقع جين الريزستين على الصبغي 19 عند البشر (4).
اقترح التقرير الأولي لـ Steppan et al. أن الريزستين ربما يشكل الرابط بين البدانة والداء السكري 2))، وأظهرت الدراسات في الفئران أن الريزستين يضعف تحمل الغلوكوز وفعل الأنسولين ويثبط تكون الشحوم في خلايا الجرذ المزروعة 3T3-L1. بينما تحسن الأضداد المضادة للريزستين الحساسية على الأنسولين، وقد لوحظت زيادة التعبير الجيني أثناء تمايز الخلية الشحمية 3T3-L1، وبعد تحريض البدانة بحمية عالية الدهون. وأشارت إحدى الدراسات إلى وجود مستويات أعلى من التعبير عن كل من الجين والبروتين في النسيج الشحمي المركزي، مما يدعم دور الريزستين في الربط بين البدانة المركزية والداء السكري (5). يؤدي فرط ريزستين الدم المزمن إلى عدم تحمل الغلوكوز وفرط أنسولين الدم بعد الطعام والمترافق مع تناقص الحساسية على الأنسولين في العضلات الهيكلية والكبد والنسيج الشحمي، لكن هل يحدث تناقص الحساسية على الأنسولين في هذه النسج نتيجة تأثيرات مباشرة للريزستين عليها أم لا.
تبين مؤخراً أنه في الحيوانات معوزة مستقبل البيروكسية المفعل بالتكاثر Peroxisome proliferator-activated receptor γ(PPAR γ) في العضلات الهيكلية، يمكن للمقاومة الأولية على الأنسولين في العضلات أن تؤدي إلى مقاومة ثانوية على الأنسولين في الكبد والنسيج الشحمي، وهناك أمثلة أخرى عن التآثر بين النسج، والذي تؤدي فيه المقاومة الأولية على الأنسولين في نسيج إلى تناقص الحساسية على الأنسولين في نسيج آخر. لذا فمن غير المستبعد إمكان أن تُظهر التأثيرات الأولية للريزستين على نسيج هدفي للأنسولين تأثيرات ثانوية في نسيج آخر (6).
أظهر Rajala وزملاؤه (7)، أن الحقن الوريدي الشديد للريزستين قاد إلى مقاومة كبدية واضحة على الأنسولين، لذا يمكن التخمين أن التأثيرات الأولية للريزستين في إنقاص الحساسية على الأنسولين تحدث في الكبد ومن ثم في الجسم كاملاً، وهذا ما ينتج عنه فرط أنسولين الدم وارتفاع مستويات الأحماض الدسمة الحرة Free Fatty acids FFAs))، وهذه بدورها تؤدي إلى المقاومة على الأنسولين في أنسجة أخرى.
تلقي القياسات الخلوية الضوء على الفعالية الكامنة لفعل الريزستين والتي تشير إلى دور كامن للبروتين كيناز المفعل بـ AMP AMPactivated protein Kinase (AMPK)، حيث أن تفعيل AMPK يحفز إزفاء translocation ناقل الغلوكوز GLUT4 إلى الغشاء البلازمي، وهكذا يحفز قبط الغلوكوز (8). ولوحظ نقص منتظم في فعالية AMPK عندما قيست فسفرة AMPK في الكبد والعضلات والنسيج الشحمي، إلا أنه من المستبعد أن يكون هذا مظهراً معمماً للمقاومة الثانوية على الأنسولين، حيث لم يُسجل نقص في فسفرة AMPK كصفة شائعة لنقص المقاومة على الأنسولين (9، 10)، وهذا يثير احتمالية أن الريزستين يخفض نشاط AMPK مباشرة.
إذاً: إن الآلية التي ينقص بها الريزستين الحساسية على الأنسولين تشمل خفضاً في فعالية AMPK في العضلات الهيكلية والنسيج الشحمي والكبد، وتؤدي هذه الانخفاضات في الحساسية على الأنسولين في النسج إلى عدم تحمل الغلوكوز وفرط أنسولين الدم. |
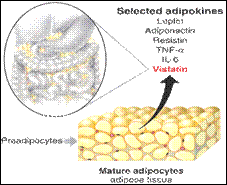
الشكل 1: بعض الأديبوكينات التي يفرزها النسيج الشحمي. |
| المواد والطرق Materials and Methods |
شملت دراستنا 87 فرداً موزعين إلى المجموعات التالية:
- المجموعة الشاهدة (21 فرداً): شملت أفراداً أسوياء ظاهرياً (لا يعانون من البدانة أو الداء السكري ولا يتناولون أية أدوية)، متوسط أعمارهم 40.8 ± 12 عاماً ومتوسط منسب كتلة الجسم BMI لهم 23.35 كغ/ م2.
- مجموعة الأفراد البدينين (31 فرداً): شملت أفراداً أسوياء ظاهرياً ولا يتناولون أياً من خافضات السكر الفموية، متوسط أعمارهم 40 ± 10.9 عاماً ومتوسط منسب كتلة الجسم BMI لهم 36.33 كغ/ م2.
- مجموعة مرضى الداء السكري من النمط الثاني البدينين (35 فرداً): شملت مرضى بدينين مصابين بالداء السكري من النمط الثاني يتناولون على الأقل أحد خافضات السكر الفموية، متوسط أعمارهم 51.7 ± 9.9 عاماً ومتوسط منسب كتلة الجسم BMI لهم 36.74 كغ/ م2.
تم جمع العينات من مراجعي المراكز الطبية التالية: مستشفى المواساة الجامعي ومركز العيادات الشاملة التابع لوزارة الصحة ومستشفى الأسد الجامعي.
أخذت عينات الدم (5 مل دم وريدي على أنبوب جاف) على الريق بعد صيام ليلة كاملة في الفترة مابين الساعة الثامنة والعاشرة صباحاً، ونبذت مباشرة (4000 دورة في الدقيقة مدة 5 دقائق) ووزع المصل الناتج على أربعة أنابيب إيبندورف، في كل أنبوب 500-300 مكل، حفظت العينات في الدرجة - 80 ° م إلى وقت إجراء المقايسات.
أجريت مقايسة الريزيستين باستخدام عتيدة kit Human Resistin ELISA لشركة BioVendor - Czech Republic.
تمت الدراسة الإحصائية باستخدام اختبار Person لدراسة الارتباط واختبار T-Student لمقارنة المتوسطات الحسابية لدى مجموعات الدراسة، وعُدّ الفارقُ معتداً به عند مستوى دلالة P<0.05.
|
| النتائجResults |
تراوحت مستويات الريزستين لدى المجموعة الشاهدة بين 9-1.5 نغ/ مل (المتوسط الحسابي 4.25 نغ/ مل والانحراف المعياري 1.77 نغ/ مل). توزعت القيم توزعاً قريباً من التوزع الطبيعي (الشكل 2).
مجموعة الأفراد البدينين: تراوحت مستويات الريزستين بين 13-1.8 نغ/ مل (المتوسـط الحسابي 5.73 نغ/ مل والانحراف المعياري 2.61 نغ/ مل).
مجموعة مرضى الداء السكري البدينين: تراوحت مستويات الريزستين بين 18-3.1 نغ/ مل (المتوسط الحسابي 7.32 نغ/ مل والانحراف المعياري 3.74 نغ/ مل).
بتطبيق اختبار T-Student لوحظ فارق يعتد به إحصائياً (P<0.05) بين متوسط مستويات الريزستين لدى المجموعة الشاهدة ومتوسط مستويات الريزستين لدى مجموعة مرضى الداء السكري البدينين. كما لوحظ فارق يعتد به إحصائياً P<0.05)) بين متوسط مستويات الريزستين لدى المجموعة الشاهدة ومتوسط مستويات الريزستين لدى مجموعة البدينين. كما لوحظ فارق يعتد به إحصائياً P<0.05)) بين متوسط مستويات الريزستين لدى مجموعة مرضى الداء السكري البدينين ومتوسط مستويات الريزستين لدى مجموعة البدينين (الشكل 3). بدراسة العلاقة بين الريزستين ومنسب كتلة الجسم لدى مرضى السكري البدينين لوحظت بينهما علاقة ارتباط يعتد بها إحصائياً (R = 0.375; P<0.05) ( الشكل4).
|
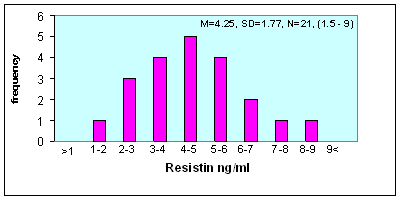
الشكل 2: توزع قيم الريزستين لدى المجموعة الشاهدة.
 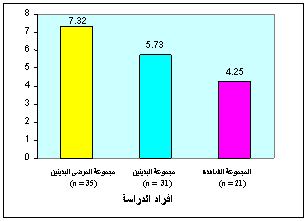
الشكل 3: متوسط تركيز الريزستين لدى مجموعات الدراسة.
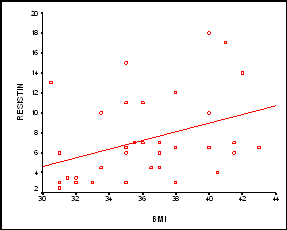
الشكل 4: علاقة ارتباط الريزستين مع منسب كتلة الجسم لدى مرضى الداء السكري البدينين. |
| المناقشةDiscusion |
وجدنا من خلال الدراسة التي أجريناها ارتفاعاً واضحاً في مستويات الريزستين لدى كل من مرضى الداء السكري البدينين والأشخاص البدينين الذين يتجاوز منسب كتلة الجسم (BMI) لديهم 30 كغ/ م2 مقارنة مع أفراد المجموعة الشاهدة حيث كان متوسط قيم الريزستين ± الانحراف المعياري
لدى مجموعة المرضى البدينين 7.32 ± 3.74 نغ/ مل ولدى مجموعة البدينين 5.73 ± 2.61 نغ/ مل ولدى المجموعة الشاهدة 4.25 ± 1.77 نغ/ مل.
توافقت نتائج دراستنا مع نتائج Youn وزملائه (11) عام 2004، حيث وجدوا زيادة في مستويات الريزستين عند مرضى الداء السكري من النمط الثاني. ودراسة Hasegawa G. وزملائه (12)، ومع نتائج عام 2005 حيث وجدوا ارتفاعاً في مستويات الريزستين لدى المرضى المصابين بالداء السكري من النمط الثاني، ومع نتائج دراسة M. S. Burnett وزملائه عام 2006 (13)، التي أظهرت علاقة بين الريزستين والمقاومة على الأنسولين وتعارضت مع نتائج دراسة Nagaev I وSmith U عام 2001 (14)، حيث لم يجدا علاقة بين التعبير عن الريزستين والمقاومة على الأنسولين والداء السكري من النمط الثاني في النسيج الشحمي والعضلات الهيكلية في البشر.
ووجدنا علاقة ارتباط طردية يعتد بها إحصائياً بين الريزستين ومنسب كتلة الجسم ما يعني أن البدانة تترافق مع ازدياد مستويات الريزستين وبالتالي فهي أحد عوامل الاختطار المؤهبة لتطور الداء السكري من النمط الثاني.
|
| الاستنتاج Conclusion |
| إن مستويات الريزستين تكون مرتفعة لدى الأشخاص البدينين والأشخاص البدينين المصابين بالداء السكري من النمط الثاني مما يقترح دوراً محتملاً للريزستين في الربط بين الداء السكري والبدانة. |
| المراجع References |
1.Trujillo M. E. and Adipose P. E.
Tissue-Derived Factors: Impact on Health and Disease.
Scherer Endocr. Rev; 27: 762-778, 2006.
2.Steppan CM. et al.
Phe hormone resistin links obesity to diabetes.
Nature; 409: 307-312, 2001.
3.Steppan CM. et al.
A family of tissue-specific resistin-like molecules.
Proc. Natl. Acad. Sci; 98: 502-506, 2001.
4.Engeli JJ. et al.
Resistin gene expression in human adipocytes is not related to insulin resistance.
Obes Res; 10: 1-5, 2002.
5.McTernan CL, McTernan PG, Harte AL, Barnett AH. and Kumar S.
Resistin central obesity and type 2 diabetes.
Lancet; 35: 46-47, 2002.
6.Hevener AL. et al.
Muscle-specific Pparg deletion causes insulin resistance.
Nat. Med; 9: 1491-1497, 2003.
7.Rajala MW. et al.
Adipose-derived resistin and gut-derived resistin-like molecule–β selectively impair insulin action on
glucose production.
J. Clin. Invest; 111: 225-230, 2003.
8.Yamauchi T. et al.
Adiponectin stimulates glucose utilization and fatty-acid oxidation by activating AMP-activated
protein kinase.
Nat. Med; 8: 1288-1295, 2002.
9.Bergeron R. et al.
Effect of 5-aminoimidazole-4-carboxamide-1-b-D-ribofuranoside infusion on in vivo glucose and lipid
metabolism in lean and obese Zucker rats.
Diabetes; 50: 1076-1082, 2001.
10.Ogden CL, et al.
Epidemiologic trends in overweight and obesity.
Endocrinol Metab Clin North Am; 32: 741-760, 2003.
11.Youn BS, et al.
Plasma resistin concentrations measured by enzyme-linked immunosorbent assay using a newly developed
monoclonal antibody are elevated in individuals with type 2 diabetes mellitus.
J Clin Endocrinol Metab; 89: 150-156, 2004.
12. Hasegawa G., et al.
Increased serum resistin levels in patients with type 2 diabetes are not linked with markers of
insulin resistance and adiposity.
Acta Diabetologica, 42: 104-109, 2005.
13.Burnett M. S., et al.
Cross-Sectional Associations of Resistin, Coronary Heart Disease, and Insulin Resistance.
J. Clin. Endocrinol. Metab. 91: 64-68, 2006.
14.Nagaev I and Smith U.
Insulin resistance and type 2 diabetes are not related to resistin expression in human fat cells or
skeletal muscle.
Biochem Biophys Res Commun; 285:561-564, 2001.
|
| |
| المجلد 4 ,
العدد 6
, جمادى الآخرة 1428 - تموز (يوليو) 2007 |
|
|
|
