| الملخص Abstract |
تظهر لدى أكثر من 70% من مرضى سرطان الثدي نقائل عظمية أثناء تطور المرض. ومن المتوقع أن لبعض واصمات إعادة نموذج العظم الكيميائية الحيوية فائدة في تقييم وتدبير مرضى الخباثات المنتقلة إلى العظم. ترتفع هذه الواصمات بشكل شاذ في دم المريضات المصابات بالمرض الانتقالي العظمي.
تمت في هذه الدراسة مقايسة الببتيد النهائي للنهاية الكربوكسيلية للكولاجين نمط I β-CTX Carboxy terminal telopeptide of collagen type I في المصل 9 الذي ينتج عن تدرك الكولاجين نمط I، عند بعض مريضات مصابات بسرطان الثدي وذلك لتقييم دوره في كشف النقائل العظمية للسرطان.
تمت مقايسة β-CTX المصل عند 39 مريضة مصابة بنقائل عظمية لسرطان الثدي و 89 مريضة سرطان ثدي دون وجود دليل سريري على الإصابة بنقائل عظمية. كانت قيم β-CTX المصل مرتفعة بشكل هام عند مرضى النقائل العظمية مقارنة مع المرضى دون نقائل عظمية.
تقترح نتائجنا أن مقايسة β-CTX المصل مفيدة في كشف النقائل العظمية عند مرضى سرطان الثدي.
|
More than 70% of breast cancer patients have bone metastases.Some markers of biochemical bone remodeling are expected to be useful in assessing and managing patients with malignancies that metastasize to bone. These markers are abnormally raised in the blood of patients with metastatic bone disease. In the present study, serum Carboxy terminal telopeptide of collagen type I (β-CTX) – which is produced by type I collagen degradation -was evaluated to determine its role in detection of bone metastases in breast cancer patients.
Serum β-CTX was assessed in 39 patients with bone metastases from breast cancer and in 89 breast cancer patients without clinical evidence of bone metastases. Serum β-CTX levels were significantly higher in patients with bone metastases than those without bone metastases.
Our results suggest that the measurement of serum β-CTX may be a
useful tool in detection of bone metastases in breast cancer patients
|
| المقدمة Introduction |
يتم تقويض العظم وإعادة بنائه من جديد بشكل مستمر. تُعرف هذه الدورات المتلاحقة بالتقلّب العظمي العام، وفي الحالات الطبيعية تتم موازنة ارتشاف العظم واصطناعه بواسطة الاقتران الاستقلابي metabolic coupling. هناك مظهران لعملية التقلّب العظمي هما تشكل العظم وارتشافه، الخلايا المسؤولة عن تشكل العظم هي بانيات العظم Osteoblasts أما الخلايا المسؤولة عن ارتشاف العظم فهي ناقضات العظم (1)Osteoclasts، تنتج ناقضات العظم بيئة حمضية بواسطة شوارد الهدروجين وهي تحل الكولاجين والمعدن بوساطة إنزيماتها المتخصصة، وبالتالي يتم تشكيل نواتج تحطم الكولاجين:
deoxypyridinoline (d pyr)، terminal telopeptide (NTX) N-، C- terminal telopeptide (β-CTX)
إن حدوث النقائل العظمية مألوف عند مرضى سرطان الثدي حيث تشير بعض التقارير إلى أن نسبة حدوث النقائل العظمية لسرطان الثدي تصل إلى 70% (2).
وتسبب النقائل العظمية غالباً تبدلات عظمية مخربة للعظم تتصف بارتشاف عظمي متسارع. ومن أجل الكشف المبكر عن النقائل العظمية ومتابعة استجابة العظم للعلاج كان ومضان العظم bone Scintigraphy الوسيلة الوحيدة المستخدمة لهذا الغرض، وبما أن النتيجة الإيجابية لومضان العظم تعتمد على كمية النوكليوتيدات المشعة radionucleotide المترسبة في مناطق التشكل والتخرب الجديد فإن ومضان العظم غير نوعي للنقائل العظمية، كما أن تكلفة هذه الطريقة تعد أيضاً واحداً من العيوب التي تحـدُّ من استخدامـه سريرياً (3).
تم حديثاً إدخال واصمات كيميائية حيوية جديدة للتقلّب العظمي وتم تطبيقها على أمراض عظمية متنوعة، ومن بين هذه الواصمات تبدو واصمات الارتشاف العظمي هي الأكثر ملائمة للتطبيق في حال سرطان الثدي (4).
إن الكولاجين نمط I هو البروتين الأكثر توافراً في العظم، حيث يشكل أكثر من 90% من المادة العضوية في العظم (5)، ويتم تشكيل الببتيدات الانتهائية في النهاية الكربوكسيلية للكولاجين نمط I Carboxy terminal telopeptide of type I collgen أثناء تدرك الكولاجين العظمي بوساطة التحول الحال للعظم ويتم تحريرها إلى الدوران (6)، وفي دراستنا تمت مقايسة مستويات β-CTX المصلية عند مجموعة من مريضات سرطان الثدي لديهن نقائل عظمية ومقارنتها مع مجموعة أخرى من مريضات سرطان الثدي دون نقائل عظمية وذلك لتقييم دور β-CTX المصل في كشف النقائل العظمية من سرطان الثدي.
|
| المواد والطرق Materials and Methods |
شملت الدراسة 158 أنثى وُزعن على النحو التالي:
- المجموعة الشاهدة: ضمت 30 أنثى؛
- مجموعة مرضى سرطان الثدي دون نقائل عظمية: ضمت 89 مريضة؛
- مجموعة مرضى سرطان الثدي مع نقائل عظمية ضمت 39 مريضة.
1- المجموعة الشاهدة: شملت 30 أنثى سوية ظاهرياً متوسط أعمارهن 44 ± 9.1 عاماً، وتم اختيار الأفراد الأسوياء من مركز الاعتيان التابع لمختبرات مستشفى الأسد الجامعي عن طريق استجواب المريضات والرجوع إلى تاريخهن الطبي، وقد استبعدت المريضات اللواتي لديهن إصابات ورمية أو المصابات بتخلخل العظام Osteoporosis.
2- مجموعة مرضى سرطان الثدي دون نقائل عظمية: شملت 89 مريضة متوسط أعمارهن 46.51 ± 8.82 عاماً تم تشخيص المرض لديهن بالاعتماد على صورة الثدي الشعاعية (الماموغرام Mammogram) وعلى الخزعة من قبل أطباء أخصائيين في مركز الطب النووي، وقد تم نفي وجود نقائل عظمية بالاعتماد على نتائج ومضان العظم bone scintigraphy والتي تمت قراءتها من قبل أطباء أخصائيين في مركز الطب النووي.
3- مجموعة مرضى سرطان الثدي مع نقائل عظمية: شملت 39 مريضة متوسط أعمارهن 51.2± 10.4 عاماً، وقد تم تشخيص المرض لديهن بالاعتماد على صورة الثدي الشعاعية وعلى الخزعة من قبل أطباء أخصائيين في مركز الطب النووي، كما تم إثبات وجود نقائل عظمية بالاعتماد على نتائج ومضان العظم.
|
| الاعتيان Sampling |
|
جمعت العينات من شعب وعيادات مركز الطب النووي ومستشفى الأسد الجامعي بدمشق. حيث تم بزل جميع عينات الدم من المرضى مابين الساعة العاشرة والساعة الثانية عشرة صباحاً وذلك لإزالة تأثير التغير اليوماوي على واصمات الارتشاف العظمي المدروسة. للحصول على المصل، قمنا باستخدام أنابيب جافة مُخلاة من الهواء Vacutainer، حيث نُبذت العينات بسرعة 4000 rpm لمدة 10 دقائق عند الدرجة 15°م، ووزع المصل في أنابيب صغيرة حفظت في الدرجة - 80°م إلى
حين إجراء المقايسات.
|
| طريقة العمل |
|
تمت مقايسة β-CTX المصل بالاعتماد على المقايسة المناعية باللمعان الكيميائي الكهربائي Electrochemiluminescence) (ECLIA) (Immunoassay والتي تعتمد على مبدأ الشطيرة Sandwish، حيث تستخدم ضدين وحيدي النسيلة، كل منهما يميز ببتيداً خطياً ثمانياً (β 8AA) وبالتالي تقيس هذه الطريقة كمياً جميع شدف الكولاجين نمط I المتدركة والتي تحوي اثنتين من الببتيدات الثمانية المتصاوغة.
|
| النتائج Results |
يبين الجدول 1 متوسطات قيم β-CTX المصل عند مجموعة الأسوياء ومجموعة مرضى سرطان الثدي دون نقائل عظمية ومجموعة مرضى سرطان الثدي مع نقائل عظمية.
وبتطبيق اختبار t- test لحساب الفروقات الإحصائية بين قيم متوسطات β-CTX في المصل في مجموعة مرضى سرطان الثدي دون نقائل عظمية ومجموعة مرضى سرطان الثدي مع نقائل عظمية وبين القيم المشار إليها في مجموعة الأسوياء؛ بينت النتائج عدم وجود فارق معتد به إحصائياً في قيم β-CTX المصل ما بين المجموعة الشاهدة (0.32 ± 0.18) ومجموعة مرضى سرطان
الثدي دون نقائل عظمية ( 0.38± 0.24) حيث كانت P>0.05، (الشكل 1).
بينما كان هناك فارق معتد به إحصائياً في قيم β-CTX المصل ما بين المجموعة الشـاهدة ومجموعة مرضى سرطان الثدي مــع نقائل عظميـة (0.72 ±0.46 ) حيث كانت P< 0.05، (الشكل 2).
كما لوحظ وجود فارق معتد به إحصائياً ما بين قيم β-CTX المصل عند مرضى سرطان الثدي دون نقائل عظمية (0.38 ± 0.24) ومرضى سرطان الثدي مع نقائل عظمية (0.72 ± 0.46) حيث كانت P< 0.05، (الشكل 3).
|
| المناقشة Discussion |
عندما تتشكل النقائل العظمية تقوم الخلايا الورمية بتدمير العظم عبر الإخلال بعملية تمايز ناقضات العظم حيث تسبب إنتاجاً زائداً لها، ويكون الإنتاج الزائد لناقضات العظم شديداً بشكل خاص في سرطان الثدي والرئة، بينما يكون عمل أو نضج بانيات العظم مثبطاً (2)، وهنالك تقارير تشير إلى أن مستوى واصمة الارتشاف العظمي β-CTX يزداد مع تقدم النقائل العظمية من سرطان الثدي (7)، ويتوافق هذا مع نتائج دراستنا حيث وجدنا ارتفاعاً ملحوظاً في قيم β-CTX المصل عند مرضى سرطان الثدي المترافق بنقائل عظمية مقارنة مع قيمه عند مرضى
سرطان الثدي دون نقائل عظمية وذلك بفارق يعتد به احصائياً P<0.05، تتوافق هذه النتائج مع دراسة Oremer GM وزملائه عام 2003 (8)، والتي بينت أنه يمكن استخدام واصمات التقلب ومنها β-CTX في تقييم ومتابعة مرضى الأورام المنتقلة إلى العظم.
ويمكن تفسير ذلك بأن الاستقلاب العظمي عند مرضى السرطان مختلف تماماً عن الأفراد العاديين، حيث يحدث غالباً تفعيل للارتشاف العظمي وذلك بتفعيل ناقضات العظم عن طريق عوامل موضعية Local factors (9)؛ وبالمقابل إن عدم وجود دليل سريري على وجود النقائل العظمية لدى الأسوياء ومرضى سرطان الثدي ـ ومضان العظم سلبي ـ يعني أن الخلايا الورمية لم تصل إلى العظم وبالتالي لا يحدث تفعيل زائد لناقضات العظم ويقتضي هذا بدوره عدم زيادة فعالية الكاتبسين-K المسؤول عن تحرير β-CTX من الكولاجين نمط I-، والذي ينتج بشكل أساسي من ناقضات العظم المفعلة بالإضافة إلى مصدره من الخلايا الورمية الغازية للعظم. وبما أن عدد وفعّالية ناقضات العظم يزداد لدى مرضى سرطان الثدي المترافق بنقائل عظمية فسوف تزداد فعّالية الكاتبسين K cathepsin K. إضافة إلى مصدره من الخلايا الغازية نفسها، وهذا كلّه يفسّر ارتفاع قيم β–CTX لدى مرضى سرطان الثدي المترافق بنقائل عظمية.
تتناقض دراستنا مع دراسة Seibel M.J. وزملائه عام 2002 (10)، والتي بيّنت أنه لا يمكن استخدام واصمات التقلّب العظمي لتشخيص النقائل العظمية
|
الجدول 1: متوسطات قيم β-CTX المصل عند المجموعات المدروسة.
|
الأسوياء |
مرضى سرطان الثدي
دون نقائل عظمية |
مرضى سرطان الثدي
مع نقائل عظمية |
β-CTX (ng/ml) |
0.32 ± 0.18 |
0.38 ± 0.24 |
0.72 ± 0.46 |
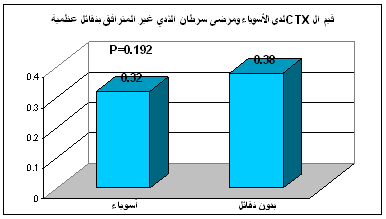
الشكل 1: مقارنة قيم β-CTX المصل عند مرضى سرطان الثدي دون نقائل عظمية مع الأسوياء.
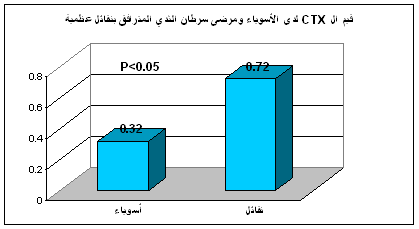
الشكل 2: مقارنة قيم β-CTX المصل عند مرضى سرطان الثدي مع نقائل عظمية مع الأسوياء.
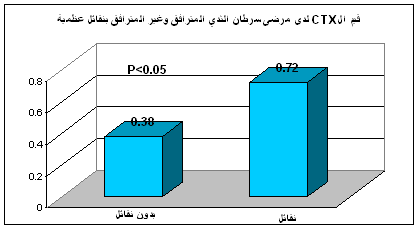
الشكل 3: مقارنة قيم β-CTX المصل عند مرضى سرطان الثدي دون نقائل عظمية مع مرضى سرطان الثدي مع نقائل عظمية.
|
| الاستنتاج Conclusion |
|
يمكن الاستفادة من مستويات β-CTX المصل كواصمة تشخيصية للنقائل العظمية لدى مرضى سرطان الثدي.
|
| المراجع Refrences |
1-Eastell R, Baumann M, Hoyle N, and Wieczorek L.
Bone Markers; 3-7, 2001.
2-Ogata E.
Diagnostic bone Disease Management: ICTP in bone Metastases of Breast Cancer.
Hormones and Markers. 2002
3-Kiuchi K, et al.
Cross- linked collagen C- and N- telopeplides for an early diagnosis of bone metastasis
from breast cancer.
Oncolocy Reports, 9: 595-598, 2002.
4-Koizumi M, Takahashi S. and Ogata E.
Comparison of serum bone resorption markers in the diagnosis of skeletal metastasis.
Anti cancer Res, 23(56): 4095-4099, 2003.
5 Horiguchi T, et al.
Usefulness of serum carboxy- terminal telopeptide of type I Collagen as a marker of bone
metastasis from lung cancer.
Japanese J of Clinical Oncology; 30: 174-179, 2000.
6-Delmas PD.
Biochemical markers of bone turnover.
J Bone Miner Res; 8: S 549-S554, 1993.
7-Coleman RE.
The clinical use of bone resorption markers in patients with malignant bone disease.
Cancer May. 15, 94(10), 2521-2533, 2002.
8-Oremek GM, Weis A. and Sapoutzis N.
Diagnostic value of bone and tumour markers in patients with malignant diseases.
Anticancer Res; 23; 987-990, 2003.
9-Rubens R. and Mundy G.
Cancer and the skeleton, 51-52, 2000.
10-Seibel MJ, Koeller M. and Van der Valden B.
Markers of bone turnover do not predict bone metastases in breast cancer.
Clin Lab; 48(11-12): 583-588, 2002.
|
| |
