| الملخص Abstract |
يُعد التهاب الكبد الفيروسي C مشكلة صحية عالمية. وتشير الإحصاءات إلى وجود حوالي 170 مليون إصابة في العالم.
هدفت الدراسة إلى معرفة تغيرات المستويات المصلية لإنزيم ALT خلال سير الإصابة بالتهاب الكبد C، ودراسة العلاقة بين النمط الجيني للفيروس وتغيرات قيم ALT المصلية.
شملت الدراسة 388 مريضاً بالتهاب الكبد الفيروسي C. تم قياس مستوى ALT المصلي لجميع المرضى لعدة مرات قبل المعالجة وبعدها بالطريقة الحركية باستخدام عتيدة الاختبار لشركة BIOLABO الفرنسية. كما تم تحديد النمط الجيني لـ 266 مريضاً منهم بطريقة INNO-LiPA HCV II لشركة Bayer.
كانت مستويات ALT طبيعية (24.3 ± 7.3 U/L) عند حوالي ربع المرضى (26.5%)، وزائدة بما لا يتجاوز ضعف الحد الأعلى الطبيعي (75 ± 9.8 U/L) عند حوالي نصف المرضى (53.6 %)، وذات زيادة واضحة (122 ± 46.6) عند حوالي 15% فقط من المرضى. مما يدل على أن عدم ارتفاع ALT لا ينفي وجود الإصابة. وأن الارتفاعات البسيطة في مستويات ALT شائعة عند مرضى HCV. وكان متوسط قيم ALT أعلى قليلاً عند مرضى النمط الجيني 1 (58 ± 33.5 U/L) منه عند مرضى النمطين 4 و 5 (50.2 ± 34.1 و 45.9 ± 17.2 على الترتيب). مما يشير إلى عدم وجود ارتباط كبير بين مستويات ALT المصلية وبين النمط الجيني للفيروس، مع ميل أكثر قليلاً للارتفاع في النمط الجيني I.
|
Hepatitis C is a serious global health problem. Worldwide, an estimated 170 million people have been infected with the hepatitis C virus (HCV)
The purpose of this study was to determine the ALT serum variations during hepatitis C disease, and to study the correlation between HCV genotype and ALT serum levels.
The study comprised 388 hepatitis C patients. Serum ALT levels of all patients were measured by kinetic method using BIOLABO kit. HCV Genotyping was performed in 266 patients by INNO-LiPA HCV II method.
ALT was normal in 26.5% of patients, with moderate elevation in 53.6%, and with marked elevation in only 15%, which indicate that normal ALT levels or little elevation is common in HCV infected patients. ALT level in genotype 1 patients (58 ± 33.5 U/L (was higher than genotypes 4 and 5 (50.2 ± 34.1 and 45.9 ± 17.2 U/L respectively) , which indicate that there is no significant relationship between ALT levels and HCV genotype.
|
| المقدمة Introduction |
العامل المسبب للإصابة بالتهاب الكبد C هو فيروس RNA من عائلة الفيروسات المصفرة Flaviviridae، ويتميز الداء بسيره المخاتل، إذ يتطور ببطء وبشكل صامت غالباً لمدة طويلة قد تتجاوز 20 سنة. وتشمل الفحوص المستخدمة في استقصاء التهاب الكبد الفيروسي C المجموعات التالية (5، 6):
1– قياس الإنزيمات الكبدية؛
2– اختبارات كشف أضداد الفيروس؛
3– اختبارات كشف الحمض النووي للفيروس (RT-PCR)؛
4– التنميط الجيني للفيروس؛
5– خزعة الكبد
يُعد ALT (Alanine aminotransferase) ويعرف أيضاً بـ SGPT (Serum glutamate pyruvate transaminase) أهم الإنزيمات الكبدية التي تختبر عادةً عند تقييم المصابين بالتهاب الكبد الفيروسي C وبالتهابات الكبد بشكل عام.
يتراوح المجال الطبيعي لـ ALT بين 1 – 45 وحدة دولية/ ل، وهذا يتغير حسب الطريقة المتبعة. تصل ALT بشكل نمطي إلى ذروة قيمها بعد الظهر، وتكون في أدنى مستوياتها في الليل. ويمكن أن تتغير مستويات ALT في الشخص نفسه بحدود 10–30% بين يوم وآخر. كما يلعب وزن الشخص دوراً في مستوى ALT، فالأشخاص البدينون (ذوو مشعر وزن الجسم BMI المرتفع) يميلون لأن يكون مستوى ALT لديهم أعلى بـ 40-50% من الأشخاص النحيلين. ويمكن أن تنخفض ALT بحدود 20% بتأثير الجهد العنيف. كما تتغير مستويات ALT حسب العمر، فالقيم المرجعية قد لا تنطبق على الأطفال أو على الأشخاص بعمر فوق 60 سنة. ومن ناحية تأثير الجنس على مستوى ALT، فالرجال عادةً لديهم مستوى ALT أعلى من النساء (14).
يمكن أن ترتفـع ALT حتى عشـريـن
ضعفاً عن الطبيعي في التهاب الكبد C الحاد.
وعند المرضى المصابين بالتهاب الكبد C المزمن تكون ALT عادةً مرتفعة ارتفاعاً معتدلاً، وتكون طبيعية عند حوالي ثلث المرضى، في حين أن حوالي 25% فقط من المرضى يكون ارتفاع ALT لديهم بمقدار أكثر من ضعفي الطبيعي. وعلى كل حال، يلاحظ عادةً تغيرات واسعة في قيم ALT خلال متابعة المريض. عند المرضى الذين لديهم ارتفاع في ALT يبقى هذا الارتفاع ثابتاً عند 26% منهم؛ وهناك حوالي 30–40% من الحالات يلاحظ فيها ارتفاعات عرضية من خلال القياس المتكرر على مدى 1–18 شهراً. ويمكن لبعض الأدوية، مثل Antiretroviral أن تزيد ALT، وتعود للانخفاض عند إيقاف هذه الأدوية. تتحرر ALT في الدوران الدموي عندما يصاب الكبد بأذية، وإذا كانت الأذية الكبدية كبيرة وواسعة فلا يعود الكبد قادراً على إنتاج ما يكفي من ALT وبالتالي يمكن أن يبقى مستوى ALT ضمن المجال الطبيعي على الرغم من الأذية الكبدية الفادحة (11).
إن لقيم إنزيمات ALT و AST في الواقع قيمة سريرية محدودة، فيما عدا المتابعة أثناء المعالجة، وعلى الرغم من أن هنالك علاقة بين مستويات الإنزيمات الكبدية وشدة الأذية النسيجية فإن ALT ذات قيمة تنبؤية قليلة (2، 8). فلا يمكن لمستوى ALT أن يتنبأ بتشخيص أو تطور الإصابة بـ HCV، ولكن تراجع مستواها المصلي خلال المعالجة يعد تطوراً إيجابياً. ويعد ارتفاع ALT ذا قيمة تنبؤية عند حدوث تنخر كبدي مهم فقط عندما يتجاوز هذا الارتفاع عشرة أضعاف الطبيعي.
قد تكون تغيرات المستويات المصلية لـ ALT في الالتهاب الحاد من أكثر المظاهر تميزاً. وقد تكون ALT طبيعية مما قد يوحي بالشفاء، ولكن قد يلي ذلك ارتفاع في مستويات ALT مما يشير عندها إلى الإزمان.
يتطور الداء إلى الإزمان عند معظم مرضى التهاب الكبد C (75–85%)، ويستمر ارتفاع مستويات ALT عند حوالي 60–70% من المرضى المزمنين مما يشير إلى تطور الداء الكبدي الفعال. وفي الحالات الباقية (30– 40%) من الحالات المزمنة تبقى مستويات ALT طبيعية (4، 14). وخلال المتابعة المخبرية يمكن أن يشاهد نماذج عديدة من تغيرات ALT، فيمكن أن تبقى طبيعية حتى 12 شهراً حتى في الحالات التي تؤكد فيها التغيرات النسيجية وجود الالتهاب المزمن. وبالتالي فإن قياساً وحيداً لـ ALT لا يكفي لاستبعاد الأذية الكبدية ويجب قياسها بشكل متكرر من أجل تقييم السير السريري والإنذار.
|
| المواد والطرق Materials and Methods |
العينات المرضية:
تم أخذ عينة الدم إما دون مانع تخثر (للحصول على المصل)، أو باستخدام مانع تخثر (للحصول على البلازما)، واستخدم EDTA أو الهيبارين كمانع تخثر. ينبذ الدم ثم يفصل المصل (أو البلازما) وينقل إلى أنبوب منفصل، وإذا لم يُجر الاختبار في حينه يحفظ المصل في الدرجة -20°م إلى حين إجراء الاختبار، مع مراعاة عدم إعادة تجميد العينات بعد إخراجها للعمل عليها واستبعاد العينات المنحلة.
قياس ALT:
أجري قياس ALT عدة مرات (على الأقل ثلاث مرات)، في بداية العلاج وأثنائه وبعد انتهائه.
استخدمت عتيدة معايرة فعالية إنزيم ALT (SGPT)، لشركة BIOLABO الفرنسية.
مبدأ الاختبار:
ALT
L-alanine + α-Ketoglutarate <=> L- glutarate + Pyruvate
LDH
Pyruvate + NADH + H+ <=> Lactate + NAD+
يقوم إنزيم ALT بتحفيز انتقال الزمرة الأمينية من L-alanine إلى α-Ketoglutarate مما يؤدي إلى تشكيل الحمض البيروفي Pyruvate L- glutarate +، وفي مرحلة ثانية يقوم إنزيم LDH بتحفيز إرجاع البيروفات بالتزامن مع أكسدة NADH+ إلى NAD.
يشير معدل تناقص الامتصاص (المقاس في
موجة طولها 340 نم) إلى مدى فعالية ALT (أو تقاس فعالية ALT بقياس معدل تناقص الامتصاص في الموجة 340 نم).
يحضر محلول العمل بمزج 5 أحجام من الكاشف R1 مع حجم واحد من R2، وهذا المزيج ثابت لمدة يومين في الدرجة 20-25°م (درجة حرارة الغرفة)، ولمدة 10 أيام في الدرجة 2-8°م (في البراد).
فعالية ALT في العينة ثابتة لمدة ثلاثة أيام في الدرجة 20-25°م، ولمدة سبعة أيام في الدرجة 2-8°م.
وتبدأ فعالية ALT بالتناقص بعد ثلاثة أيام بمعدل: 10% إذا حفظت بالدرجة 2-8°م و 17% إذا حفظت بالدرجة 15-25°م.
طريقة العمل
يوضع كاشف العمل في الدرجة 37°م قبل العمل، ثم يضاف 100 مكرون من المصل إلى 1 مل من كاشف العمل. يُمزج، ثم يحضن المزيج لمدة دقيقة في الدرجة 37°م، ثم يُقرأ تغير الامتصاص في الدقيقة لمدة ثلاث دقائق، ويحسب متوسط تغير الامتصاص في الدقيقة (ΔA/min). وتحسب فعالية ALT بضرب (ΔA/min) بعامل ضرب معطى مع الطاقم (Factor) وهو يساوي 1745 إذا أجري الاختبار في الدرجة 37°م وبموجة طولها 340 نانومتر، أو باستخدام محلول عياري معروف التركيز كما يلي:

وتعطى النتيجة بـ وحدة/ لتر (U/L).
العوامل المتداخلة في الاختبار:
1- انحلال الدم، حيث تحتوي كريات الدم الحمراء على ALT مما يعطي قيماً مرتفعة بشكل كاذب في حال الانحلال.
2- بعض الأدوية والمواد الأخرى تؤثر في فعالية ALT.
3- بيليروبين الدم إذا كان أكثر من 20 mg/dL.
القيم المرجعية Reference values:
عند الذكور: حتى 42 وحدة دولية / ل
عند الإناث: حتى 32 وحدة دولية / ل. |
| التنميط الجيني لـ HCV |
مبدأ الاختبار Test principle
يسمح اختبار التنميط بتحديد الأنماط الجينية Genotypes الستة الرئيسية لـ HCV وأنماطها الفرعية Subtypes، وتعتمد المقايسة على وجود تغيرات في المنطقة غير المشفرة UTR) 5' (5 ' من جينوم الفيروس للأنماط الجينية المختلفة.
تحتوي عتيدة Kit الاختبار على بادئات Primers مصممة حسب مواضع مختلفة من جينوم HCV، يهجَن الـ DNA المرتبط بالبيوتين والذي نحصل عليه بالتضخيم بالـ PCR-RT للمنطقة 5 'UTR من RNA الفيروس مع مسابير قليلة النكليوتيدات (immobilized oligonucleotide probes)، وترتبط هذه المسابير بشريط من النتروسلولوز بواسطة ذيل على شكل عدة حروف T poly(T) tail نوعية للمنطقة 5 'UTR للأنماط الجينية المختلفة، ثم يغسل الـ DNA الذي لم يهجَن من الشريط، ويربط الناتج المهجن المرتبط بالبيوتين مع الستربتافيدين Streptavidin والموسوم بالفسفتاز القلوية، ويتشكل راسب قرمزي – بني عندما يتفاعل المحلول الملون مع مركب الستربتافيدين الموسوم بالفسفاتاز القلوية، ويظهر الناتج بشكل عصابة band على شريط الاختبار وذلك عندما يحصل تكامل تام بين المسبار probe وبين نواتج PCR المرتبطة بالبيوتين.
يوجد على شريط الاختبار عدة خطوط (21
خطاً)، اثنان للشاهد و 19 خطاً متوازياً تمثل مسابير الـ DNA، وهي نوعية للنمط الجيني.
ويحدد النمط الجيني بمقارنة العصابات المتشكلة على شريط الاختبار مع جدول خاص مرفق مع طاقم الاختبار، ويستنتج النمط الجيني والنمط الفرعي.
|
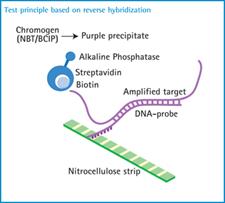
الشكل 1: مبدأ اختبار التنميط الجيني بطريقة INNO-LiPA HCV II. |
| النتائج Results |
دراسة قيم ALT خلال سير الإصابة بـ HCV:
تم قياس مستوى ALT عند 388 مريضاً بالتهاب الكبد الفيروسي C، وذلك بهدف دراسة تغيرات مستويات هذا الإنزيم خلال سير المرض. وأُجري القياس عدة مرات، قبل المعالجة وخلالها، وصُنفت نتائج القياس (مستويات ALT) في أربع فئات:
1. الفئة I: جميع قيم ALT ضمن المجال الطبيعي (أقل من 40 وحدة/ ل) في كل القياسات.
2. الفئة II: ارتفاع قيم ALT في كل القياسات، ولكن دون أن يتجاوز هذا الارتفاع ضعفي الحد الأعلى الطبيعي (41–80 وحدة/ ل).
3. الفئة III: ارتفاع قيم ALT في كل القياسات بمقدار يتجاوز ضعفي الحد الأعلى الطبيعي (< 80 وحدة/ ل).
4. الفئة IV: قيـم ALT متأرجحة ارتفاعـاً
وانخفاضاً في القياسات المتكررة.
وتوزع المرضى حسب نتائج قياسات ALT، مع الأخذ بالاعتبار التصنيف المذكور لمستويات ALT، الشكل 2 و الجدول 1.
|
الجدول 1: توزع مرضى HCV حسب مستويات ALT.
( ALT) الفئة |
العدد |
% |
I |
103 |
26.6 |
II |
208 |
53.60 |
III |
57 |
14.60 |
IV |
20 |
5.2 |
المجموع |
388 |
100 |
الجدول 2: توزع المرضى حسب النمط الجيني لـ HCV N=266)).
النمط الجيني |
العدد |
% |
1 |
8 |
3 |
4 |
246 |
92.48 |
5 |
12 |
4.52 |
المجموع |
266 |
100 |
|
علاقة مستويات ALT مع النمط الجيني:
أجري التنميط الجيني لـ 266 مريضاً من أصل الـ 388 مريضاً الذين أُجري لهم قياس ALT، وكانوا من الأنماط الجينية 1 و 4 و 5. وتوزع هؤلاء المرضى حسب الأنماط الجينية، الشكل 3 والجدول 2:
وكانت تغيرات قيم ALT في مرضى كل نمط جيني كما يلي:
النمط 1 (N=8): متوسط عيار ALT X = 58 ± 33.5 U/L، (الجدول 3).
|
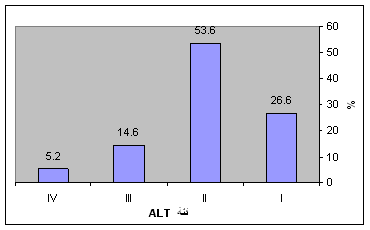
الشكل 2: توزع مرضى HCV حسب مستويات ALT.
الجدول 3: توزع مرضى النمط الجيني I حسب مستويات ALT.
( ALT) الفئة |
العدد |
% |
I |
2 |
25 |
II |
4 |
50 |
III |
2 |
25 |
IV |
- |
- |
المجموع |
8 |
100 |
النمط 4 (N=246): متوسط عيار ALT X = 50.2 ± 34.1 U/L، (الجدول 4).
الجدول 4: توزع مرضى النمط الجيني 4 حسب مستويات ALT .
( ALT) الفئة |
العدد |
% |
I |
74 |
30.08 |
II |
131 |
53.25 |
III |
32 |
13.02 |
IV |
9 |
3.65 |
المجموع |
246 |
100 |
النمط 5 (N=12): متوسط عيار ALT X = 45.9 ± 17.2 U/L، (الجدول 5).
الجدول 5: توزع مرضى النمط الجيني 5 حسب مستويات ALT.
( ALT) الفئة |
العدد |
% |
I |
4 |
33.33 |
II |
7 |
58.33 |
III |
1 |
8.33 |
IV |
- |
- |
المجموع |
12 |
100 |
|
| المناقشة Discussion |
كانت مستويات ALT طبيعية (24.3 ± 7.3 U/L) عند حوالي ربع المرضى (26.5%)، ومرتفعة بما لا يتجاوز ضعفي الحد الأعلى الطبيعي (75 ± 9.8 U/L) عند حوالي نصف المرضى (53.6%)، وذات ارتفاع واضح (122 ± 46.6) عند حوالي 15% فقط من المرضى.
تتوافق هذه النتائج مع نتائج دراسات عديدة، يذكر بعضها أن ALT تكون طبيعية عند 30-40% من مرضى التهاب الكبد C المزمن (1، 10، 16).
|
الجدول 6: مجمل تغيرات قيم ALT حسب النمط الجيني لـ HCV.
النمط الجيني
ALT |
Genotype 1
N=8 |
Genotype 4
N=246 |
Genotype 5
N=12 |
N |
% |
N |
% |
N |
% |
I |
2 |
25 |
74 |
30.08 |
4 |
33.33 |
II |
4 |
50 |
131 |
53.25 |
7 |
58.33 |
III |
2 |
25 |
32 |
13.02 |
1 |
8.33 |
IV |
- |
- |
9 |
3.65 |
- |
- |
|
8 |
100 |
246 |
100 |
12 |
100 |
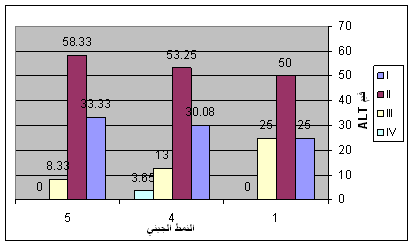
الشكل 3: تغيرات قيم ALT حسب النمط الجيني لـ HCV. |
كما تتوافق إلى حد ما مع دراسة في مصر (Boushara H. 1998) كانت فيها مستويات ALT مرتفعة عند حوالي 87% من المرضى، وطبيعية عند حوالي 13%، ومع دراسة لـ (Greth et al.,1992) ودراسة (Piccinino et al.,1997) كانت مستويات ALT طبيعية في 15-20% من الحالات.
عند دراسة العلاقة بين النمط الجيني وتغيرات مستوى ALT المصلي، كانت تراكيز ALT عند 266 مريضاً ممن أُجري لهم التنميط الجيني. وكانت الأنماط الجينية ومتوسط قيم ALT للمرضى كما يلي:
النمط الجيني 1: 8 مرضى = 3%،
(ALT = 58 ± 33.5 U/L)
النمط الجيني 4: 246 مريضاً = 92.4%، ALT = 50.2 ± 34.1 U/L))
والنمط الجيني 5: 12 مريضاً = 3.09%، (ALT = 45.9 ± 17.2 U/L)
|
| الاستنتاجات |
نستنتج أن مستوى ALT يمكن أن يكون منبئاً بالإصابة بـ HCV في حال الارتفاع، ولكن عدم ارتفاع ALT لا ينفي وجود الإصابة. ويجب النظر بعين الأهمية للارتفاعات البسيطة في مستويات ALT، حيث أنها شائعة عند مرضى HCV.
كما نستنتج أن مستويات ALT كانت طبيعية ALT I عند حوالي ثلث مرضى كل من الأنماط الجينية الثلاثة، وقليلة الارتفاع (ALT II) عند حوالي نصف مرضى كل من الأنماط الجينية المدروسة، وكان متوسط قيم ALT أعلى قليلاً عند مرضى النمط 1 (58 ± 33.5 U/L) منه عند مرضى النمطين 4 و 5 (50.2 ± 34.1 و 45.9 ± 17.2 على الترتيب). مما يشير إلى عدم وجود ارتباط كبير بين مستويات ALT المصلية وبين النمط الجيني للفيروس، مع ميل أكثر قليلاً للارتفاع في النمط الجيني I.
|
| المراجع References |
1-Alter HJ, Purcell RH. and Shih JW.
Detection of antibody to hepatitis C virus in prospectively followed transfusion recipients with acute
and chronic non-A, non-B hepatitis.
N Engl J Med; 321: 1494-1500, 1989.
2-Andriulli A, Festa V, Leandro G. and Rizzetto M.
Usefulness of a liver biopsy in the evaluation of patients with elevated ALT values and serologic
markers of hepatitis viral infection.
Dig Dis Sci; 46:1409-1415, 2001.
3-Boushara H.
Correlation between hepatitis C virus genotypes to treatment with Interferon-alpha.
Cairo university, Egypt 1998.
4-CDC. Recommendations for preventing transmission of infections among chronic hemodialysis patients.
MMWR 50 (No. RR-5):1-43, 2001.
5-David Zakim and Thomas D. Boyer
Hepatology: a textbook of liver disease, 4th ed. Philadelphia: Saunders. 2003.
6-De Medina M. and Schiff ER.
Hepatitis C: diagnostic assays.
Semin Liver Dis, 15: 33-40, 1995.
7-Global surveillance and control of hepatitis C. Report of a WHO Consultation organized in collaboration with the Viral Hepatitis Prevention Board, Antwerp, Belgium.
J Viral Hepat. 6: 35-47, 1999.
8-Haber MM; West AB; Haber AD. and Reuben A.
Relationship of aminotransferases to liver histological status in chronic hepatitis C.
Am J Gastroenterol. 90(8): 1250-1257, 1995.
9-Hui CK, Belaye T, Montegrande K. and Wright TL.
A comparison in the progression of liver fibrosis in chronic hepatitis C between persistently normal
and elevated transaminase.
J Hepatol. 38: 511-517, 2003.
10-Koretz RL, Brezina M. and Polito AJ.
Non-A, non-B posttransfusion hepatitis: comparing C and non-C hepatitis.
Hepatology, 17: 361-365, 1993.
11-Koff JM, Younossi Z, Reddy KR, and Shiffman ML.
Debate: hepatitis C with normal liver enzymes: to treat or not to treat.
Am J Gastroenterol. 99: 972-976, 2004.
12-McCormick SE et al.
Evaluation of Liver Histology, ALT Elevation and HCV RNA Titer in Patients with Chronic Hepatitis C.
Am. J. Gastroenterology, 91(8): 1516-1522, 1996.
13-Nunez M, Rios P, Martin-Carbonero L, Perez-Olmeda M, Gonzalez-Lahoz J, Soriano V.
Role of hepatitis C virus genotype in the development of severe transaminase elevation after the
introduction of antiretroviral therapy.
PMID: 12048364 [PubMed - indexed for MEDLINE].
14-Prati D, Taioli E. and Zanella A.
Updated definitions of healthy ranges for serum alanine aminotransferase levels.
Ann Intern Med. 137: 1-10, 2002.
15-Piccinino et al.
Therapy of hepatitis C: Interferon alfa-n1 trials.
Hepatology, 26, S3 , 96S-100S, 1997.
16-Shakil AO; Conry-Cantilena C. and Alter HJ.
Volunteer blood donors with antibody to hepa-titis C virus: clinical, biochemical, virologic, and histologic features.
Ann Intern Med; 123:330-337, 1995.
17-Younossi ZM, Ong JP, O'Shea R.
Contemporary Diagnosis and Management of Hepatitis C.
Newton PA: Handbooks in Health Care Company, 2003.
|
| |
