| المجلد 4 ,
العدد 6
, جمادى الآخرة 1428 - تموز (يوليو) 2007 |
| |
| الحمة البشرية الصغيرة بي 19 وطرق تشخيصها |
| Human Parvovirus B19 and its Diagnosis |
| د. فرج بارة |
| Faraj Barah |
كلية الصيدلة، جامعة القلمون الخاصة
مقال مرجعي Review article
|
| الملخص Abstract |
| منذ اكتشافها حديثاً، تم ربط الحمة البشرية الصغيرة بي 19 بعدد كبير من الحالات السريرية. تم اثبات الدور الرئيس لهذه الحمة في الحمامى الخمجية، ونوبات نقص تصنيع الكريات الحمر، فقر الدم اللاتنسجي المزمن عند الأشخاص المصابين بعوز مناعي، والاستسقاء الجنيني غير الممنع وتظاهرات مفصلية مختلفة. الغرض من هذه المقالة هو تلخيص المعلومات المتوفرة حالياً عن الحمة البشرية الصغيرة بي 19 من حيث الخصائص العامة، الوبائيات، الآلية الامراضية والمناعة، المظاهر السريرية وطرق العلاج، مع التركيز على طرق التشخيص المخبري المتوفرة حالياً مع ما طرأ عليها من تحديث وتطوير. |
| Since its discovery, human parvovirus B19 has been linked with a broad spectrum of clinical syndromes. An etiological role for the virus has been confirmed in erythema infectiosum, transient aplastic crisis, persistent infection manifesting as pure red cell aplasia in immunocompromised persons, non-immune hydrops fetalis and arthritis. The purpose of this review is to summarize present knowledge of human parvovirus B19, its known general characteristics, epidemiology, pathogenesis and immunity, clinical manifestations and treatment, with focus on the available and latest developments in laboratory diagnosis of its infections. |
| تم اكتشاف الحمة البشرية الصغيرة بي 19 (Human parvovirus B19) أو الفيروس B19، والتي تعد العامل الممرض الوحيد للبشر ضمن مجموعة الحمات الصغيرة Parvoviruses، عام 1975 صدفة في مصل شخص لا يحمل أية أعراض سريرية أثناء تقييم بعض طرق الكشف عن العامل الأسترالي (1). ومن ثم، سمح تطوير الطرق المصلية لمعايرة أضداد الحمة البشرية الصغيرة بي 19 من نمط IgM بإثبات أن هذه الحمة هي العامل الرئيس المسبب للحمامى الخمجية Erythema infectiosum أو ما يعرف بطب الأطفال بالمرض الخامس Fifth disease (2)، كما تم الربط بين الإصابة بالحمة البشرية الصغيرة بي 19 ونوب نقص تصنيع الكريات الحمر Hypoplastic crisis عند الأطفال المصابين بفقر الدم المنجلي (3). حالياً، تُعد الحمة البشرية الصغيرة بي 19 العامل المسبب للعديد من المظاهر السريرية والتي تضم، إضافة لما سبق ذكره، فقر الدم اللاتنسجي المزمن Chronic pure red cell aplasia عند الأشخاص المثبطي المناعة (4)، الاستسقاء الجنيني غير الممنع Non-immune hydrops fetalis (5، 6)، تظاهرات مفصلية مختلفة (7، 8)، إضافة إلى تظاهرات سريرية عديدة لم يتم التأكد بعد من تورط الحمة المباشر في التسبب بها. لقد أدت القفزات السريعة في الطرق المناعية والجزيئية إلى دراسة هذه الحمة بشكل مفصل وزيادة المعلومات المتوفرة عنها من حيث الخصائص، والوبائيات، والآلية الامراضية والمناعة، والمظاهر السريرية، التشخيص المخبري وطرق العلاج والتي سنقوم بتفصيلها في هذا المقال. |
| صفات الحمات الصغيرة Parvoviruses ودورة التضاعف Replication Cycle |
تضم مجموعة الحمات الصغيرة حمات صغيرة جداً لا تتجاوز أبعادها 18-26 نانومتراً وهذا ما يفسر الاسم اللاتيني Parvum والذي يعني الصغير (9). لا تحوي الحمات الصغيرة على غلاف بينما تعد محيفظتها النووية ذات تناظر مكعبي تحوي على سطحها 60 وحدة شكل. يبلغ الوزن الجزيئي للجزيئة الكاملة 5.6x106 دالتون ويشكل منها البروتين %70 والمجين %30 (10). يتكون مجين الحمة من خيط سلبي أحادى الطاق من الحمض الريبي النووي DNA بوزن جزيئي 1.8x106 دالتون، وبطول تقريبي قدره 5600 نيكليوتيد. تم تحديد متوالية الاسس Basis sequence والخريطة الجينية Genetic map في أوائل التسعينات (11).
بعد الامتزاز adsorption في مستقبلات خلية الثوي المعروفة باسم المستضدات P (12)، ينفذ الفيريون Virion ويتحرك إلى النواة حيث يحدث التضاعف Replication. يملك مُجين الـ DNA مفرد الخيط عروة بشكل ملقط الشعر عند كل من نهايتيه تؤمن مناطق مضاعفة الخيط ليبدأ DNA بوليميراز الخلية باصطناع المُجينات الجديدة (13). يتم اصطناع mRNA الفيروسي بواسطة RNA بوليميراز الخلية من الـ DNA مضاعف الخيط المتوسط. تتجمع الفيريونات البنات في النواة. يحدث تضاعف الحمة البشرية الصغيرة بي 19 عندما تكون الخلية في الدور S وهذا يوضح تضاعف الفيروس في سليفات الكريات الحمر وليس في الكريات الحمر الناضجة (10).
|
| الوبائيات Epidemiology |
|
إن أخماج الحمة البشرية الصغيرة بي 19 واسعة الانتشار وتصيب كافة الأعمار وغير محددة بفصل أو شهر معين من السنة. تنتقل الحمة البشرية الصغيرة بي 19 بشكل أساسي بواسطة المفرزات التنفسية كما يمكن أن تنتقل عبر الدم ومشتقاته، إضافة إلى انتقالها من الأم الحامل إلى جنينها. يرتفع معدل الإصابة بالحمة البشرية الصغيرة بي 19 كل 4-6 سنوات في المناطق الباردة وكل 3-4 سنوات في المناطق الدافئة. الإنسان هو المستودع الطبيعي للحمة ولا تعد الحيوانات مصدراً للإصابة.
|
| الآلية الامراضية والمناعة
Pathogenicity and Immunity |
|
تصيب الحمة البشرية الصغيرة بي 19 بشكل رئيسي نمطين من الخلايا هما سليفات الكريات الحمر (الآرومات الحمر) في نقي العظم وهي المسؤولة عن فقر الدم اللاتنسجي، والخلايا البطانية في الأوعية الدموية وهي المسؤولة جزئياً عن الطفح المرافق للحمامى الإنتانية. يعود السبب في هذه الانتقائية لوجود المستقبل الرئيسي للحمة البارفوية البشرية بي 19 على سطح هذه الخلايا (12). تساهم أيضا المعقدات المناعية المؤلفة من الفيروس والأضداد IgM و IgG في الآلية الإمراضية للطفح المرافق للحمامى الإنتانية وفي التهاب المفاصل المشاهد عند بعض البالغين المصابين بالحمة البشرية الصغيرة بي 19 (10). تؤمن الإصابة مناعة دائمة مدى الحياة. في حين يتظاهر الاستسقاء الجنيني غير الممنع بشكل وذمة كتلية Massive edema عند الجنين تكون تالية لقصور القلب الاحتقاني الناتج عن فقر دم شديد بسبب موت أرومات الكريات الحمر المصابة عند الجنين (10).
|
| المظاهر السريرية
Clinical Manifestations |
الحُمامى الخمجية (المرض الخامس)
Erythema infectiosum (Fifth disease)
وصف هذا المرض منذ القرن التاسع عشر، ولكن ربطه بالحمة البشرية الصغيرة بي 19 حديث العهد ويرقى إلى العقدين الأخيرين (2). في ربع الحالات تكون الإصابة تحت سريرية، أما في معظم الحالات (75%) فتظهر الإصابة السريرية بعد فترة حضانة قد تمتد إلى 3 أسابيع. تتظاهر الأعراض الأولى بارتفاع حرارة بسيط، مع صداع، وآلام في الحلق وسيلان انف. بعد أسبوع تظهر الأعراض الوصفية المتمثلة بطَفَح جلدي بُقَعي حُمَامي لمّاع Maculopapular rash والذي يبدأ بالوجه وتحديداً على الخدين (يعرف بمتلازمة الوجنة المصفوعة Slapped cheek syndrome) (الشكل 1) ثم ينتقل بعد 4 أيام إلى العنق ثم الأطراف، وهذا الطفح يختفي خلال أسبوع دون أن يترك أثراً أو ندبات، ويمكن للطفح أن يعاود خلال الأيام أو
الأسابيع التالية بتحريض عوامل مختلفة مثل التعرض للشمس، التمارين الرياضية، والكَرْب النفسي والاستحمام (14). ينتشر هذا المرض عند الأطفال بين عمر 4-14 سنة. تعد هذه الإصابة حميدة وغالباً ما تشاهد نهاية الشتاء وبداية الربيع.
|
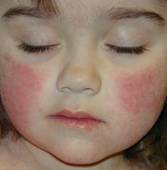
الشكل 1: متلازمة الوجنة المصفوعة
Slapped cheek syndrome |
| نوبات نقص تصنيع الكريات الحمر
Hypoplastic crisis |
|
إن إصابة البالغين الأسوياء بالحمة البشرية الصغيرة بي 19 سيؤدي إلى انحلال طلائع الكريات الحمر ولكن دون أن يؤدي إلى مظاهر سريرية ملحوظة، ولكن عند الأشخاص الذين يعانون من خلل في إنتاج عناصر الدم حيث يكون عمر الكريات الحمر قصيراً، ستؤدي الإصابة بهذه الحمة إلى نوبات فقر دم ملحوظ يترافق مع نشاط الحمة التكاثري. تظهر نوبات نقص تصنيع الكريات الحمر عادة عند الاشخاص المصابين بفقر دم انحلالي مزمن مثل فقر الدم المنجلي (3)، فقر الدم بعوز الحديد (15)، والثلاسيمية بيتا المتوسطة (16)، حالات فقدان الدم (17)، حالات زرع الكلى وزرع نقي العظم (18،19)، وعلى الرغم من ذلك، فقد أظهرت عدة تقارير حصول نوبات نقص تصنيع الكريات الحمر عند بعض الأشخاص الأسوياء (20).
|
| فقر الدم اللاتنسجي المزمن
Chronic pure red cell aplasia |
|
يمكن أن يلاحظ فقر دم مزمن عند الأشخاص المصابين بعوز مناعي وراثي أو مكتسب، لأن عدم وجود رد الفعل المناعي الكاف لدى هؤلاء سيؤدي إلى حدوث فقر الدم المزمن مع معاودة الخمج بهذه الحمة، وإن معالجة فقر الدم هذا يكون بنقل الدم للمريض بشكل دوري ومنتظم. أظهرت الدراسات حدوث فقر الدم اللاتنسجي المزمن المرتبط بالإصابة بالحمة البشرية الصغيرة بي 19 عند المرضى المصابين بالـ HIV (21)، مرضى سرطانات الدم (22)، مرضى زرع الأعضاء مثل مرضى زرع نقي العظم (23).
|
| الاستسقاء الجنيني غير الممنع
Non-immune hydrops fetalis |
|
تم الربط للمرة الأولى بين الاستسقاء الجنيني وموت الجنين وحدوث الإجهاض من جهة وبين الإصابة بالحمة البشرية الصغيرة بي 19من جهة أخرى عام 1984 (5). إن إصابة المرأة الحامل بالحمة البشرية الصغيرة بي 19 لأول مرة خلال فترة الحمل ستؤدي إلى إصابة الجنين بفقر دم نتيجة لانحلال طلائع الكريات الحمر في كبد الجنين وذلك يمكن أن يؤدي إلى موته بنسب تتراوح بين 2-10% (24). تحدث معظم الإصابات الخطرة خلال الثلث الثاني من الحمل عندما يزداد إنتاج الكريات الحمر عند الجنين وفي الوقت نفسه لا يمتلك الجنين قدرة كافية لانتاج الأضداد اللازمة لإيقاف الإصابة. بوصول الحمل إلى الثلث الثالث، يمتلك الجنين القدرة الكافية لانتاج الأضداد اللازمة لإيقاف الإصابة مما يفسر ندرة احتمال الاستسقاء الجنيني وحدوث الإجهاض خلال هذه الفترة (9). لم يثبت حتى الآن، أن الحمة البشرية الصغيرة بي 19 يمكن أن تسبب التشوهات الخلقية عند الجنين وإن كان هناك بعض الحالات القليلة التي تم نشرها مؤخراً (25).
|
| المظاهر المفصلية
Arthropathy syndromes |
|
تعد هذه المظاهر من أهم اختلاطات الإصابة بالحُمامى الخمجية. تشاهد غالباً عند النساء بنسب قد تصل إلى 80% (26) وتكون بشكل التهاب مفاصل متعدد ثنائي الجانب يبدأ بمفاصل اليد ثم الركبة ثم العمود الفقري ولا يؤدي هذا الالتهاب إلى تخريب المفاصل ويتحسن المريض خلال أسبوعين وحتى شهرين.
|
| التشخيص المخبري
Laboratory diagnosis |
الزرع على المستنبتات الخلوية: نظراً لأن الحمة تدخل فقط إلى الخلايا الحاوية على المستقبلات المعروفة باسم المستضدات P فإن ذلك أدى إلى عدم النجاح في زرع الحمة في المستنبتات الخلوية التقليدية غير الحاوية على هذه المستقبلات (مثل خلايا كلية القرد وخلايا Hela ) (27). تم مؤخراً وبنجاح زرع الحمة على خلايا خاصة مثل خلايا نقي العظم البشرية، خلايا الكبد للجنين البشري وخلايا الحبل السري للجنين البشري وإن كانت هذه الطرق للأبحاث فقط ولم تجد طريقها إلى الاستخدام المخبري الروتيني بعد (27).
الكشـف عن الأضـداد: يعد البحث حاليـاً عن
أضداد الحمة البشـرية الصغيرة بي 19 من
نمط IgM الأساس في التشخيص حيث يؤكد وجود إصابة حديثة في حين أن البحث عن الأضداد من نمط IgG والتي تشاهد في مصول المصابين لسنوات عديدة بعد الشفاء يستخدم في الاستقصاءات الوبائية. يمكننا أيضا استخدام اختبار الـ IgG Avidity والذي يمكن الاستفادة منه في التفريق بين الإصابة القديمة والإصابة الحديثة. تتوفر حالياً العديد من العتائد kits التجارية لكشف ومعايرة أضداد الحمة البشرية الصغيرة بي 19 من نمطي IgM/IgG تعتمد في مبادئها على طريقة المعايرة بالامتزاز المناعي المرتبط بالإنزيم (ELISA) (العتائد التجارية: Human Parvovirus B19 IgM ELISA MRL Diagnostics, Parvo B19 IgM EIA Biotrin International/SYNCOR Ltd, Ideia Parvovirus B19-IgM DAKO, Parvoscan-B19 EURO Diagnostica)، طريقة الكشف بتفاعل التألق المناعي اللامباشر (IFA) (العتائد التجارية: Parvo B19 IgM IF Biotrin International/ SYNCOR Ltd) وطريقة الكشف بتفاعل النقطة الغربية (Westren blot) (العتائد التجارية:Recomblot parvovirus B19 IgM/IgG Mikrogen) وقد قامت العديد من الدراسات بالمقارنة بينها (28-30) حيث وجد أن أكثرها حساسية (نسبة 91%) هو عتيدة Parvo B19 IgM EIA Biotrin International/SYNCOR Ltd وأكثرها نوعية (نسبة 94%) هو عتيدة Ideia Parvovirus B19-IgM DAKO. تجدر الإشارة أنه لا يمكن الكشف عن أضداد الحمة البشرية الصغيرة بي 19 عند الأشخاص المصابين بعوز مناعي على الرغم من وجود الحمة في دمائهم وذلك لعدم تصنيع هذه الأضداد.
الكشف عن المستضدات: تم النجاح مؤخراً في إنتاج أضداد وحيدة النسيلة monoclonal antibodies يمكن استخدامها للكشف عن بروتينات المحيفظة النووية للحمة. إلى الآن، يعد الكشف عن المحيفظة النووية للحمة في المصل من الطرق غير الحساسة بما يكفي لاعتمادها في الاستخدام المخبري الروتيني. بدلا من ذلك، تم استخدام الأضداد وحيدة النسيلة في تطوير طريقة Immunohistochemistry يمكن استخدامها للكشف عن مكان توضع المحيفظة النووية ضمن الأنسجة المصابة وذلك لأغراض البحث العلمي.
هذا وتعد مقايسة DNA الحمة من أدق واحدث طرق التشخيص للبحث عن الحمة البشرية الصغيرة بي 19 وذلك بالبحث عن الحمض الريبي النووي DNA في مصل المريض. يتوفر حالياً اختبارات عدة لكشف أو معايرة مجين الحمة البشرية الصغيرة بي 19 منها تفاعل التهجين الموضعي In situ Hybridisation (31)، تفاعل سلسلة البوليميراز على مرحلتين (العشي) Nested polymerase chain reaction، تفاعل التهجين الموضعي المترافق مع تفاعل سلسلة البوليميراز In situ PCR وتفاعل سلسلة البوليميراز بالوقت الحقيقي Real Time polymerase chain reaction (32، 33) (الكيتات التجارية: LightCycler® - Parvovirus B19 Quantification Kit Roche Diagnostics, RealArt Parvo B19 LC PCR Artus). تجدر الإشارة أن تفاعل سلسلة البوليميراز يجب أن يتم على مرحلتين لتعزيز حساسية الاختبار حتى 1-10 نسخ من مجين الحمة. وعلى الرغم من ارتفاع ثمن هذه الاختبارات فإنها تعد الوسيلة الوحيدة لتأكيد الإصابة بالحمة البشرية الصغيرة بي 19 عند الأشخاص المصابين بعوز مناعي وغير القادرين على تصنيع الأضداد.
|
| العلاج Treatment |
|
حتى تاريخه، لا توجد معالجة نوعية للإصابة بالفيروس بي 19، حيث يعتمد العلاج حاليا على التخفيف من الأعراض (10). إن الإصابة بالحمى الحمامية لا يتطلب عادة أي معالجة أما بالنسبة للمظاهر المفصلية فان استخدام العقاقير المضادة للالتهاب غير الستيروئيدية يخفف بشكل واضح من الأعراض (10). إن علاج نوبات نقص تصنيع الكريات الحمر عند الأشخاص المصابين بفقر دم انحلالي مزمن يتطلب نقل الدم للمريض، أما عند مرضى فقر الدم اللاتنسجي المزمن فإن نقل الدم للمريض بشكل دوري ومنتظم يعد أمراً أساسياً في التخفيف من الأعراض، وقد تبين مؤخراً أن إعطاء جميعة المصول البشرية المناعية وريدياً قد يكون ذا فائدة عند هؤلاء المرضى (10). إن تأكيد إصابة المرأة الحامل بالحمة البشرية الصغيرة بي 19 للمرة الأولى خلال فترة الحمل يتطلب مراقبة دقيقة للجنين بوساطة التصوير بالأمواج فوق الصوتية لمعرفة مدى الاستسقاء الجنيني غير الممنع الذي يمكن أن يكون قد وصل له الجنين، وقد تبين أن إعطاء جميعة المصول البشرية المناعية وريدياً قد يكون ذا فائدة في هذه الحالات.
|
| المراجع |
1-Cossart YE, Field AM, Cant B. and Widdows D.
Parvovirus-like particles in human sera.
Lancet, 1:72-73, 1975.
2-Anderson MJ, Jones SE, Fisher-Hoch SP, Lewis E, Han SM, Bartlett CLR, Cohen BJ, Mortimer PP. and
Pereira MS.
Human parvovirus: The cause of erythema infectiosum (fifth disease)?
Lancet, 2:1378, 1983.
3-Pattison JR, Jones SE, Hodgson J, Davis LR, White JM, Stroud CE. and Murtaza L.
Parvovirus infections and hypoplastic crisis in sickle-cell anaemia. Lancet, 1:664-665, 1981.
4-Kurtzman G, Frickhofen N, Kimball J, Jenkins DW, Nienhuis AW. and Young NS.
Pure red-cell aplasia of 10 years' duration due to persistent parvovirus B19 infection and its cure
with immunoglobulin therapy.
New England Journal of Medicine, 321:519-523, 1989.
5-Brown T, Anand A, Ritchie LD, Clewley JP. and Reid TM.
Intrauterine parvovirus infection associated with hydrops fetalis. Lancet, 2:1033-1034, 1984.
6-Knott PD, Welply GA. and Anderson MJ.
Serologically proved intrauterine infection with parvovirus.
British Medical Journal, 289:1660, 1984.
7-Naides SJ.
Parvovirus B19 infection.
Rheumatic Diseases Clinics of North America, 19: 457-475, 1993.
8-Nocton JJ, Miller LC, Tucker LB. and Schaller JG.
Human parvovirus B19-associated arthritis in children.
Journal of Pediatrics, 122:186-190, 1993.
9-Barah F, Vallely PJ, Cleator GM. and Kerr JR.
Neurological manifestations of human parvovirus B19 infection.
Reviews in Medical Virology, 13:185-199, 2003.
10-Berns KI. Parvoviruses
In Fields Virology, Fields BN, Knipe DM, Howley PM (eds). Lippincott-Raven: Philadelphia, 2173-2197, 2001.
11-Deiss V, Trastchin J-D, Weitz M, and Siegl G.
Cloning of the human parvovirus B19 genome and structural analysis of its palindromic termini.
Virology, 175:247–254, 1990.
12-Brown KE, Anderson SM. and Young NS.
Erythrocyte P antigen: cellular receptor for B19 parvovirus.
Science, 262:114-117, 1993.
13-Astell CR.
Terminal hairpins of parvovirus genomes and their role in DNA replication.
In Handbook of parvoviruses, Tijssen P (ed), CRC Press, Boca Raton, Florida, 59-80, 1990.
14-Broliden K, Tolfvenstam T. and Norbeck O.
Clinical aspects of parvovirus B19 infection.
Journal of Internal Medicine, 260: 285-304, 2006.
15-Lefrère JJ. and Bourgeois H.
Human parvovirus associated with erythroblastopenia in iron deficiency anaemia.
Journal of Clinical Pathology, 39:1277-1278, 1986.
16-Brownell AI, McSwiggan DA, Cubitt WD. and Anderson MJ.
Aplastic and hypoplastic episodes in sickle cell disease and thalassaemia intermedia.
Journal of Clinical Pathology, 39:121-124, 1986.
17-Frickhofen N, Raghavachar A. and Heit W.
Human parvovirus infection. New England Journal of Medicine, 314:646, 1986.
18-Liang TB, Li DL, Yu J, Bai XL, Liang L, Xu SG, Wang WL, Shen Y, Zhang M. and Zheng SS.
Hypoplastic crisis due to parvovirus B19 infection after liver transplantation: A case report and review of the literature.
World Journal of Gastroenterology, 13:2007-2010, 2007.
19-Plentz A, Hahn J, Holler E, Jilg W. and Modrow S.
Long-term parvovirus B19 viraemia associated with hypoplastic crisis after allogeneic bone marrow transplantation.
Journal of Clinical Virology, 3:16-19, 2004.
20-Osaki M, Matsubara K, Iwasaki T, Kurata T, Nigami H, Harigaya H. and Baba K.
Severe aplastic anaemia associated with human parvovirus B19 infection in a patient without any underlying disease.
Annals of Haematology, 78:83-86, 1999.
21-Florea AV, Ionescu DN. and Melhem MF.
Parvovirus B19 infection in the immunocompromised host.
Archives of Pathology and Laboratory Medicine, 131:799-804, 2007.
22-Sharma P, Singh T, Mishra D. and Gaiha M.
Parvovirus B-19 induced acute pure red cell aplasia in patients with chronic lymphocytic leukemia.
Hematology, 11:257-259, 2006.
23-Schleuning M, Jager G, Holler E, Hill W, Thomssen C, Denzlinger C, Lorenz T, Ledderose G, Wilmanns W. and Kolb HJ.
Human parvovirus B19-associated disease in bone marrow transplantation.
Infection, 27:114-117, 1999.
24-Gratacos E, Torres PJ, Vidal J, Antolin E, Costa J, Jimenez de Anta MT, Cararach V, Alonso PL. and Fortuny A.
The incidence of human parvovirus B19 infection during pregnancy and its impact on perinatal outcome.
J Infect Dis, 171:1360-1363, 1995.
25-Pitchaipillai S, Kelsey P. and Haeney M.
Persistent pure red cell aplasia due to parvovirus B19 infection in a patient with Turner's syndrome.
Clinical and Laboratory Haematology, 28:347-350, 2006.
26-Schmid S, Bossart W, Michel BA. and Bruhlmann P.
Outcome of patients with arthritis and parvovirus B19 DNA in synovial membranes.
Rheumatology International, 27:747-751, 2007.
27-Siegl G. and Cassinotti P.
Parvoviruses. In: Collier L, Balous A, Sussman M (Eds), Topley & Wilson’s Microbiology and Microbial Infection, Vol.1, 9th Ed., Bath Press, Avon, Great Britain, 261-279, 1998.
28-Bruu AL. and Nordb? SA.
Evaluation of five commercial tests for detection of immunoglobulin M antibodies to human parvovirus B19.
Journal of Clinical Microbiology, 33:1363-1365, 1995.
29-Sloots T. and Devine PL.
Evaluation of four commercial enzyme immunoassays for detection of immunoglobulin M antibodies to human parvovirus B19.
European Journal Clinical Microbiology and Infectious Diseases, 15:758-761, 1996.
30-Tolfvenstam T, Ruden U. and Broliden K.
Evaluation of serological assays for identification of parvovirus B19 immunoglobulin M.
Clinical and Diagnostic Laboratory Immunology, 3:147-150, 1996.
31-Bonvicini F, Filippone C, Manaresi E, Gentilomi GA, Zerbini M, Musiani M. and Gallinella G.
Peptide nucleic acid-based in situ hybridization assay for detection of parvovirus B19 nucleic acids.
Journal of Clinical Chemistry. 52:973-978, 2006.
32-Harder TC, Hufnagel M, Zahn K, Beutel K, Schmitt HJ, Ullmann U. and Rautenberg P.
New LightCycler PCR for rapid and sensitive quantification of parvovirus B19 DNA guides therapeutic decision-making in relapsing infections.
Journal of Clinical Microbiology, 39: 4413-4419, 2001.
33-Hokynar K, Norja P, Laitinen H, Palomaki P, Garbarg-Chenon A, Ranki A, Hedman K, Soderlund-Venermo M.
Detection and differentiation of human parvovirus variants by commercial quantitative real-time PCR tests.
Journal of Clinician Microbiology, 42:2013-2019, 2004.
|
| |
| المجلد 4 ,
العدد 6
, جمادى الآخرة 1428 - تموز (يوليو) 2007 |
|
|
|
