| المجلد 4 ,
العدد 7
, رمضان 1428 - تشرين الأول (أكتوبر) 2007 |
| |
| عامل النمو البطاني الوعائي عند مرضى الفَشَل الكُلْوِي المزمن |
Vascular Endothelial Growth Factor
in Chronic Renal Failure Patients
|
| د. خالد حسن |
| Khaled Hasan |
| كلية الطب، جامعة دمشق |
| الملخص Abstract |
| تُعد الوفيات بالمَرَاضة القلبية الوعائية سبباً رئيساً للموت عند المصابين بالفَشَل الكُلْوِي المزمن. ويُعد عامل النمو البطاني الوعائي إحدى الوسائط التي تكتنف تكوّن الأوعية. كما تقترح البيانات الحديثة وجود توازن بين عوامل النمو التي تؤثر على اكتمال البطانة الوعائية. إنَ الهدف من هذه الدراسة تقويم تبدلات عامل النمو البطاني الوعائي الذي يلعب دوراً هاماً في تكوّن الأوعية، عند مرضى الفَشَل الكُلْوِي المزمن. تم قياس عامل النمو البطاني الوعائي البلازمي باستخدام المقايسة المناعية لعامل النمو البطاني الوعائي. كذلك تم قياس الكرياتينين، وشحوم الدم عند 21 مريضاً مُصاباً بالفَشَل الكُلْوِي المزمن و 21 من الأشخاص الأصحاء كمجموعة شاهد. تبين هذه الدراسة عدم وجود فرق يُعتد به إحصائياً في المستويات البلازمية لعامل النمو البطاني الوعائي (P = 0.23) عند مرضى الفَشَل الكُلْوِي المزمن مقارنة مع الأشخاص الأصحاء، ولم يكن هناك علاقة يٌعتد بها إحصائياً بين عامل النمو البطاني الوعائي والكرياتينين عند المرضى (P = 0.81) مقارنة مع الأشخاص الأصحاء (P = 0.56). تبين هذه الدراسة أيضاً أن المستوى البلازمي لعامل النمو البطاني الوعائي VEGF كان طبيعياً عند مرضى الفَشَل الكُلْوِي المزمن. |
| Cardiovascular morbidity and mortality are the leading cause of death in chronic renal failure. Vascular endothelial growth factor (VEGF) is one of the mediators that involve angiogenesis. More recent data suggest that the balance between these growth factors may affect vascular endothelial integrity. The aim of this study is to assess VEGF, which it plays an important role in angiogenesis, in patients with chronic renal failure. Plasma level of VEGF has been measured by using human VEGF immunoassay. Creatinine, blood lipid profiles were measured in 21 patients with chronic renal failure and 21 normal control subjects. There was no significant difference in plasma VEGF level (P = 0.23) between patients with chronic renal failure compared with normal control subjects and the relationship between VEGF and creatinine was not significant difference in patients (P = 0.81) and in healthy controls (P = 0.56). Plasma VEGF level is normal in patients with chronic renal failure. |
| المقدمة Introduction |
|
عامل النمو البطاني الوعائي بروتين سُكَّرِي دوراني مكون للأوعية، يُعزز نمو الأوعية الدموية كاستجابة على نَقْصُ التَّرْوِيَة والمنبهات الأخرى. تتضمن أسرة عامل النمو البطاني الوعائي (VEGF): الـ VEGF-A، الـ VEGF-B، الـ VEGF-C، الـ VEGF-D، الـ VEGF-E، وعامل النمو الصفيحي placental growth factor (PlGF). يرتبط عامل النمو البطاني الوعائي A و C مع مستقبل الـ VEGF-2 وهو مستقبل تيروزين كيناز موجود في الخلايا البطانية والسَلَفية البطانية. ينبه عامل النمو البطاني الوعائي تكوّن الأَوعِيَة إضافة إلى أنه يزيد الخلايا السَلَفية البطانية (1). كما أنه يُحرض على هجرة الخلايا البطانية وتكاثرها والبدء بتكوّن أوعية دموية كاستجابة على المنبهات مثل نَقْصُ التَّأَكْسُج والإصابة النسيجية (1، 2).
تقترح الدراسات وجود دور هام لعامل النمو البطاني الوعائي في الفيزيولوجيا المرضية لأمراض القلب والأوعيـة (3). وهي تبين وجود ارتفاع مستوى عامل النمو البطاني الوعائي البلازمي عند مرضى فرط ضغط الدم (4) والسكري (5) إذ ترتبط مستوياته البلازمية المرتفعة مع درجة سوء الوظيفة البطانية (6). تفترض هذه الدراسة وجود ارتفاع في المستويات البلازمية لعامل النمو البطاني الوعائي عند مرضى الفَشَل الكُلْوِي المزمن وفيما إذا كان للمعالجة الدوائية المستعملة تأثير على هذا العامل.
|
| المواد والطرق Materials and Methods |
تم الحصول على المتطوعين، من المرضى من عيادة أمراض الكلية، والأصحاء من موظفي مستشفى المواساة في دمشق. استخدمت المقايسة المناعية لقياس عامل النمو البطاني الوعائي VEGF البلازمي (وفق أنظمة R&D الأوروبية)، كذلك تم قياس الكرياتينين (كواصم للأذية الحادثة بوظيفة البطانة الوعائية) وشحوم الدم وعلاقتهما مع عامل النمو البطاني الوعائي عند 21 مريضاً بالفَشَل الكُلْوِي المزمن و 21 من الأشخاص الأصحاء كمجموعة شاهد.
اختبرت هذه الفرضية بدراسـة تصالبيـة
cross-sectional study عند الأشخاص
الأصحاء مُقارنة مع المرضى المُصابين بالفَشَل الكُلْوِي المزمن. تمت الدراسة على 21 مريضاً مصاباً بالفَشَل الكُلْوِي المزمن، و 21 شخصاً سليماً. استُبعد المرضى المصابون بحوادث وعائية حادة مثل السكتة الدماغية أو احتشاء عضلُة القلب أو الذبحة اللامستقرة كما تبين الجداول 1 و 2 و 3. شملت معايير الاستبعاد الأخرى مرضى الكبد والأورام والالتهاب وذلك من خلال أخذ القصة المرضية بعناية والفحص الفيزيائي والاختبارات المخبرية الاعتيادية. شملت مجموعة الشاهد أشخاصاً أصحاء من موظفي المستشفى وأقرباء المرضى. كان غالبية المرضى يتناولون مثبطات الإنزيم المحول للأنجيوتنسين، أو حاصرات أقنية الكالسيوم، أو حاصرات بيتا الأدرينرجية.
تم قياس كل من الطول والوزن ومنسب كتلة الجسم وضغط الدم وشحوم الدم. كذلك أخذت عينات الدم الوريدي بوساطة بزل الوريد ثم أخضعت للتنبيذ بالدرجة +4 °م لمدة عشرين دقيقة أخذت البلازما وخُزنت بدرجة –70 °م من أجل تحليل العينة. بعد إنهاء جمع العينات تم قياس عامل النمو البطاني الوعائي VEGF بمقايسة امتزازية مناعية مرتبطة بالإنزيم المرتبط enzyme-linked immunosorbent assay باستخدام عتائد تجارية commericial kits وكواشف (R&D Systems, Abingdon, Oxon, UK) كما وصفتها دراسة سابقة (10).
|
| التحليل الإحصائي Statistical analysis |
|
عولجت البيانات باستخدام برنامج إحصائي الـ (Stat View 5.0 software SAS Institute). عرضت جميع البيانات بالمتوسط ±الانحراف المعياري. استخدم اختبار مان واتني Mann-Whitney tests لتقييم الفروقات المعتد بها إحصائياً بين مجموعتي الدراسة، وكذلك استخدم اختبار فيشر Fisher’s لتقويم احتمال وجود علاقات يُعتد بها بين المُتغيرات.
|
| النتائج Results |
|
يظهر الجدول 1 مجموعات الأدوية المستخدمة عند مرضى الفَشَل الكُلْوِي المزمن. يبيّن الجدول 2 الجنس، والعمر، والوزن، والطول ومنسب كتلة الجسم عند الأشخاص الأصحاء مقارنة مع المصابين بالفَشَل الكُلْوِي المزمن. أعطيت القيم بالمتوسط ± الانحراف المعياري (mean ± SEM). يبيّن الجدول 3 مجموعة المتغيرات عند الأشخاص الأصحاء والمصابين بالفَشَل الكُلْوِي المزمن. أعطيت القيم بالمتوسط ± الانحراف المعياري (mean ± SEM). أعطيت قيم P باستخدام اختبار مان واتني Mann-Whitney Test الإحصائي لدراسة المتغيرات عند الأصحاء مقارنة مع مرضى الفَشَل الكُلْوِي المزمن.
|
| المناقشة Discussion |
|
لم يكن هناك فرق يُعتد به إحصائياً هام بين المجموعتين في ضغط الدم الانقباضي (P = 0.91) والانبساطي (P = 0.26) وفي كوليستيرول الدم (P = 0.16) والبروتيـن
الشحمي المنخفض الكثافة LDL (P = 0.90).
لم تظهر المستويات البلازمية لعامل النمو البطاني الوعائي VEGF (P = 0.23) فرقاً يُعتد به إحصائياً عند مرضى الفَشَل الكُلْوِي المزمن مقارنة مع الأشخاص الأصحاء من مجموعة الشاهد وذلك باستخدام اختبار مان واتني Mann Whitney test (الشكل 1) وكذلك لم يكن هناك علاقة يُعتد بها بين عامل النمو البطاني الوعائي والكرياتينين عند مرضى الفَشَل الكُلْوِي المزمن (P = 0.81) وكذلك عند الأشخاص الأصحاء (P = 0.56) (الشكل 2).
|
الجدول 1: مجموعات الأدوية المستعملة عند مرضى الفَشَل الكُلْوِي المزمن.
عدد مرضى الفَشَل الكُلْوِي المزمن المستعملين للدواء |
اسم المجموعة الدوائية المستعملة |
10 |
أدوية حاصرة لأقنية الكالسيوم |
5 |
حاصرات بيتا الأدرينرجية |
2 |
حاصرات ألفا الأدرينرجية |
5 |
مثبطات إنزيم التحول |
| 7 |
مُدرات بولية |
8 |
ستاتينات |
2 |
أدوية مُضادة للسكري |
الجدول 2: الجنس، والعمر، والوزن، والطول ومنسب كتلة الجسم عند الأشخاص الأصحاء مقارنة مع المصابين بالفَشَل الكُلْوِي المزمن. أعطيت القيم بالمتوسط ± الانحراف المعياري (mean ± SEM ).
| قيمة P value |
الانحراف المعياري |
مرضى الفَشَل الكُلْوِي المزمن |
الانحراف المعياري |
الأشخاص الأصحاء |
المُتغيرات |
- |
- |
15/6 |
- |
12/9 |
الجنس (ذكر/أنثى) |
0.92 |
10.3 |
66.9 |
6.5 |
68.8 |
العمر (سنة) |
- |
- |
0/15 |
- |
0/20 |
التدخين (نعم/لا) |
0.41 |
0.08 |
1.69 |
0.11 |
1.7 |
الطول (متر) |
0.49 |
14.3 |
75.8 |
12.6 |
72.9 |
الوزن (كغ) |
0.92 |
0.89 |
27 .9 |
0.74 |
25 .8 |
منسب كتلة الجسم (كغ/م2) |
الجدول 3: مجموعة المتغيرات عند الأشخاص الأصحاء والمصابين بالفَشَل الكُلْوِي المزمن. أعطيت القيم بالمتوسط ± الانحراف المعياري (mean ± SEM ). أعطيت قيمP باستخدام اختبار مان واتني Mann-Whitney Test الإحصائي لدراسة المتغيرات عند الأصحاء مقارنة مع مرضى الفَشَل الكُلْوِي المزمن.
قيمة
P value |
الانحراف المعياري |
مرضى الفَشَل الكُلْوِي المزمن
(No. 21) |
الانحراف المعياري |
الأشخاص الأصحاء
(No. 21) |
المُتغيرات |
0.0001> |
29.3 |
276.9 |
17.8 |
86.5 |
كرياتينين
(مكرومول/ ل) |
0.16 |
1.0 |
5.04 |
1.1 |
5.58 |
كوليستيرول
(ميلي مول/ ل) |
0.007 |
1.15 |
2.08 |
0.61 |
1.21 |
ثلاثي الغليسريد
(ميلي مول/ ل) |
0.007 |
0.38 |
1.2 |
0.5 |
1.6 |
HDL
(ميلي مول/ ل) |
0.91 |
0.9 |
2.85 |
0.94 |
3.4 |
LDL
(ميلي مول/ ل) |
0.23 |
1.83 |
3.11 |
1.16 |
2.33 |
عامل النمو البطاني الوعائي
VEGF (pg/ml) |
0.91 |
5.45/3.52 |
139/82 |
3.82/2.37 |
/83 131 |
ضغط الدم الانقباضي/ الانبساطي ملم زئبق |
0.46 |
18 |
76 |
9.9 |
73.1 |
سرعة القلب
(ضربة/ دقيقة) |
|
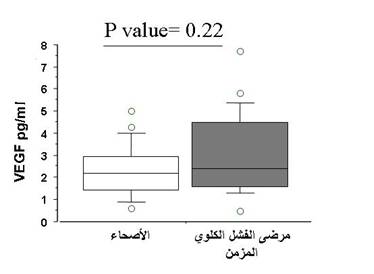
الشكل 1: قيم عامل النمو البطاني الوعائي عند مرضى الفَشَل الكُلْوِي والأصحاء.
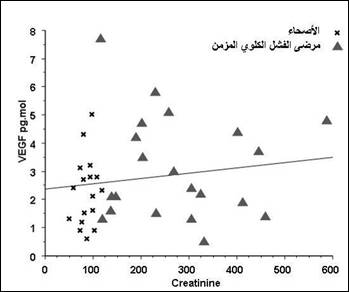
الشكل 2: علاقة عامل النمو البطاني الوعائي مع الكرياتينين عند مرضى الفَشَل الكُلْوِي (P = 0.81 ) مقارنة مع الأصحاء (P = 0.56 ).
|
تُظهر هذه الدراسة تناقصاً إحصائياً لا يعتد به في المستوى البلازمي لعامل النمو البطاني الوعائي VEGF عند المصابين بالفَشَل الكُلْوِي المزمن مُقارنة مع الأصحاء. لم يظهر من هذه الدراسة وجود علاقة هامة بين المعالجة الدوائية التي يستعملها مرضى الفَشَل الكُلْوِي المزمن مع المستوى البلازمي لعامل النمو البطاني الوعائي. إن تدهور الوظيفة الكُلْوِية من خلال مراقبة الكرياتينين لم يُظهر أيضاً اختلافاً في قيم عامل النمو البطاني الوعائي البلازمية.
تظهر الدراسات أن سوء الوظيفة الكُلْوِية يُُسبب تسارعاً في التَصَلُّب العَصيدِيّ (7)، الذي يُعد سبباً لزيادة المَراضَة والوفيات القلبية الوعائية عند المصابين بالفَشَل الكُلْوِي المزمن (8). لم تُستقص الآلية المستبطنة لتسارع التَصَلُّب العَصيدِيّ واعتلال تكوّن الأَوعِيَة عند هؤلاء المرضى على الرغم من أن هذه الظاهرة قد عُللت جزئياً بالانتشار العالي لعوامل الاختطار عند المصابين بالفَشَل الكُلْوِي المزمن (مثل فرط ضغط الدم، والسكري، وفرط كوليستيرول الدم).
يعد حمض النِّتْرِيك عاملاً هاماً يتوسط تكوّن الأَوعِيَة، حيث بينت الدراسات التجريبية أنَ عامل النمو البطاني الوعائي ينبه تحرر أُكسيد النِّتْرِيك من الشريان الأبهر الصدري. يعمل عامل النمو البطاني الوعائي على التنظيم الأعلى upregulates لإنزيم اصطناع أُكسيد النِّتْرِيك الـ NOS (9). إنَ الحَضْن المُسْبَق preincubation مع ل- أَرْجينين (L-arginine) يزيد من إطلاق أُكسيد النِّتْرِيك الأساسي والمُنبه بعامل النمو البطاني الوعائي (10).
يعد عامل النمو البطاني الوعائي العامل الأهم في تكوّن الأوعية الدموية وذلك على مستوى الكُبيبات الكُلْوِية. يُعرف عامل النمو البطاني الوعائي VEGF كعامل تكاثر وبقاء للخلايا البطانية الوعائية، فهو يمتلك دوراً ديناميكياً هاماً في تنظيم تكوّن الأوعية من خلال مُستقبلاته النوعية في الخلايا البطانية الوعائية (11).
تلعب الأذية البطانية دوراً هاماً في الأمراض التي تصيب الكلية وينظر إليها كعامل هام في ترقي المرض الكُلْوِي. تشير الدراسات الحديثة كذلك إلى وجود سوء في عود تكوّن الأوعية الدموية الشعرية عند مرضى الفَشَل الكُلْوِي، الذي من الممكن أن يترافق مع استمرار تكاثر الميزانشيم الكبيبي مما ينتج عنه تطور تصلب الكُبيبات وسوء وظيفة الكلية (12).
تتضمن الآليات المُحتملة التي تبدل بيولُوجْية تكوّن الأوعية:
• الشدة التأكسدية oxidative stress المُفْرِطة التي تُثبط تمايز سليفة الخلايا البطانية إلى خلايا بطانية ناضجة وتُساهم أيضاً في سوء إصلاح البطانة الوعائية المُصابة (13).
• نقص في إنتاج أُكسيد النِّتْرِيك عند المصابين بالفَشَل الكُلْوِي المزمن (14، 15).
تُعد البطانة الوعائية مصدراً رئيساً لإنتاج عوامل التكوّن الوعائي، وبما أنَ الفَشَل الكُلْوِي المزمن يترافق غالباً بسوء وظيفة البطانة الوعائية، لذا يعتقد بوجود سوء في تكوّن الأوعية الدموية عند هؤلاء المرضى. لذا تهدف المعالجة الحديثة إلى تنبيه نمو أوعية دموية جديدة في الأعضاء المُصابة بنقص التروية كما في القلب عند البالغين حيث تُحسن من إرواء العضلة القلبية ووظيفتها. يزداد عدد العوامل المكونة للأوعية المستعملة في التجارب السريرية عند الإنسان، وذلك باستخدام استراتيجيات مختلفة تتضمن الحَقن الوريدي، والحَقن داخل الشريان الأكليلي intracoronary، الحَقن داخل التَّأمور، والحقن داخِلَ عَضَلَة القَلْب (16).
|
| الاستنتاجات |
تبين هذه الدراسة عدم وجود فرق إحصائي يعتد به في المستوى البلازمي لعامل النمو البطاني الوعائي الدموي بين مجموعة المُُصابين بالفَشَل الكُلْوِي المزمن مقارنة مع الأصحاء. يُفسر ذلك بأن سوء البطانة الوعائية المُشارك للأمراض المُسببة للفَشَل الكُلْوِي المزمن أدى إلى تنظيم أعلى مُعاوض
لمُستقبلات عامل النمو البطاني الوعائي.
تبيّن هذه الدراسة أيضاً عدم تأثير المعالجة الدوائية المستعملة من قبل المرضى في سياق البحث (مُحصرات بيتا الأدرينرجية، ومُُحصرات قنوات الكالسيوم، ومثبطات الإنزيم المحول للأنجيوتنسين). تتوجه الدراسات المستقبلية حالياً نحو التطبيقات العلاجية لعوامل التكوّن الوعائي في الأمراض التي تتصف بسوء وظيفة البطانة الوعائية ونقص التروية.
|
| المراجع References |
1-Yancopoulos G, Davis S, Gale NW, et al.
Vascular-specific growth factors and blood vessel formation.
Nature, 407: 242-248, 2000.
2-Hanahan D.
Signaling vascular morphogenesis and maintenance.
Science, 277: 48-50, 1997.
3-Felmeden DC, Blann AD. and Lip GYH.
Angiogenesis: basic patho-physiology and implications for disease.
Eur Heart J; 24:586-603, 2003.
4-Felmeden DC, Spencer CG, Belgore FM, Blann AD, Beevers DG. and Lip GY.
Endothelial damage and angiogenesis in hyper-tensive patients: relationship to cardiovascular risk factors and risk factor management.
Am J Hypertens, 16:11-20, 2003.
5-Hovind P, Tarnow L, Oestergaard PB. and Parving HH.
Elevated vascular endothelial growth factor in type 1 diabetic patients with diabetic nephropathy.
Kidney Int; 75: S56-S61, 2000.
6-Noon JP, Walker BR, Webb DJ, Shore AC, Holton DW, Edwards HV and Watt GC.
Impaired microvascular dilatation and capillary rarefaction in young adults with a predispositin to high blood pressure.
J Clin Invest. 99(88): 1873-1879. 1997.
7-Blann AD, Belgore FM, McCollum CN, Silverman S, Lip PL. and Lip GY.
Vascular endothelial growth factor and its receptor, Flt-1, in the plasma of patients with coronary or peripheral atherosclerosis, or
type II diabetes.
Clin Sci (Lond), 102:187-194, 2002.
8-Bro S, Bentzon JF, Falk E, Andersen CB, Olgaard K. and Nielsen LB.
Chronic renal failure accelerates atherogenesis in apolipoprotein e-deficient mice.
J Am Soc Nephrol. 14: 2466-2474, 2003.
9-Ishimura E, Shoji T, Emoto M, Motoyama K, Shinohara K, Matsumoto N, Taniwaki H, Inaba M. and Nishizawa Y.
Renal insufficiency accelerates
atherosclerosis in patients with type 2 diabetes mellitus.
Am J Kidney Dis; 38: S186-S190. 2001.
10-van der Imanishi T, Hano T, Matsuo Y. and Nishio I.
Oxidized low-density lipoprotein inhibits vascular endothelial growth factor-induced endothelial progenitor cell differentiation.
Clin Exp Pharmacol Physiol. 30: 665-670, 2003.
11-Ferrara N, Gerber HP. and LeCouter J.
The biology of VEGF and its receptors.
Nat Med; 9: 669-676, 2003.
12-Shimizu A, Kitamura H, Masuda Y, Ishizaki M, Sugisaki Y. and Yamanaka N.
Rare glomerular capillary regeneration and subsequent capillary regression with endothelial cell apoptosis in progressive
glomerulonephritis.
Am J Pathol; 151: 1231-1239, 1997.
13-Boaz M, Matas Z, Biro A, Katzir Z, Green M, Fainaru M. and Smetana S.
Serum malondialdehyde and prevalent cardiovascular disease in hemodialysis.
Kidney Int; 56: 1078-1083, 1999.
14-MacAllister RJ, Whitley GS. and Vallance P.
Effects of guanidino and uremic compounds on nitric oxide pathways.
Kidney Int; 45: 737-742, 1994.
15-Vallance P, Leone A, Calver A, Collier J. and Moncada S.
Accumulation of an endogenous inhibitor of nitric oxide synthesis in chronic renal failure.
Lancet, 339: 572-575, 1992.
16-Freedman SB. and Isner JM.
Therapeutic angiogenesis for coronary artery disease.
Ann Intern Med; 136: 54-71, 2002.
|
| |
| المجلد 4 ,
العدد 7
, رمضان 1428 - تشرين الأول (أكتوبر) 2007 |
|
|
|
