| المجلد 4 ,
العدد 7
, رمضان 1428 - تشرين الأول (أكتوبر) 2007 |
| |
| تأثير العلاج بحاصر الكلس أملوديبين Amlodipine على البيلة الألبومينية الصغرية لدى مرضى الداء السكري النمط 2 طبيعيي التوتر الشرياني |
| Effect of Amlodipine Treatment on Microalbuminurea in Type 2 Diabetic Normotensive Patients |
| د. نجات صنيج* ود. جهاد حربالي** |
| Najat Sneig and Jehad Harbal |
| *كلية الطب، **كلية الصيدلة، جامعة دمشق |
| الملخص Abstract |
هدف هذه الدراسة معرفة تأثير العلاج بحاصر الكلس أملوديبين Amlodipine على البيلة الألبومينية الصغرية Microalbuminurea (MAU) لدى مرضى الداء السكري النمط الثاني طبيعيي التوتر الشرياني (ضغط الدم).
شملت الدراسة 200 مريض لديهم سكري نمط 2 والتوتر الشرياني لديهم سوي مع وجود بيلة ألبومينية صغرية لديهم، تراوحت أعمارهم ما بين 40 – 70 سنة، قسم المرضى إلى مجموعتين، شملت كل مجموعة 100 مريض، المجموعة الأولى هي مجموعة المرضى والمجموعة الثانية هي مجموعة الشاهد. في مجموعة المرضى كان عدد الذكور 61 والإناث 39، وضمن مجموعة الشاهد كان عدد الذكور 63 والإناث 37.
عرفت البيلة الألبومينية الصغرية بأنها معدل طرح الألبومين في البول بين 20–200 مكغ/ د، كان المرضى يعالجون بخافضات سكر الدم الفموية.
تمت مقايسة البيلة الألبومينية الصغرية في البدء وبعد 12 شهراً من العلاج بالأملوديبين Amlodipine عند مجموعة المرضى. وعند مجموعة الشاهد، تمت مقايسة الـ MAU في البدء وبعد 12 شهر بدون أن يعالجوا بالأملوديبين Amlodipine.
لوحظ عند مرضى الدراسة نقص واضح في متوسط قيم الـ MAU من 53.236 مكغ (20.5 – 190.8 مكغ/ د) عند البدء إلى 32.394 مكغ/ د (0.5–99.5 مكغ/ د) بعد 12 شهر وكان الفارق معتداً به إحصائياً (> P 0.05). أما عند مجموعة الشاهد فلم يكن هناك نقص في قيمة الـ MAU بعد سنة من الزمن فعند البدء كانت الـ MAU 54.91 مكغ/ د (21.38- 191.81)، وأصبحت بعد سنة 54.83 مكغ/ د (22.181–192.27 مكغ/ د) (P < 0.05 ).
لم يلاحظ تبدل واضح في التوتر الشرياني عند مجموعة المرضـى تحت العـلاج بالأملوديبين
Amlodipine (P < 0.05). كما كانت التبدلات في كل من كرياتينين المصل، والكوليستيرول، و TG، و BMI طفيفة جداً (P < 0.05).
انحصرت التأثيرات الجانبية عند مجموعة المرضى في الصداع، التشنج العضلي، الألم البطني، تسرع القلب، وذمة الكاحل، وكانت بسيطة وغير معرقلة لخطة العلاج. وكنتيجة لذلك تبين لنا بأن الأملوديبين Amlodipine له تأثير خافض لمعدل طرح الألبومين في بول مرضى الداء السكري النمط 2 الذين لديهم توتر شرياني طبيعي وينعكس هذا بالتالي على التخفيف من عقابيل اعتلال الكلية السكري.
|
The aim of this study to asses the effect of calcium-antagonist (Amlodipine) on Microalbuminuria (MAU) in DM type-2 normotensive patients. The duration of the study was 12 months. The study included 200 DM type-2 normotensive patients, with Microalbuminuria, the age ranged between 40 to 70 years, the patients divided two groups. Each group included 100 patients, the first group was the group of patients and the second was the control group. In the study group was (61 male, 39 female).
MAU was defined as urinary albumin exertion between 20-200 mg/min.
The patients were treated by oral hypoglycemic drugs. MAU was measured at the beginning of the treatment with amlodipine and at the end of the 12 months treatment in the study group, in the control study MAU was measured at the beginning of the study and after 12 months without treating with Amlodipine.
There was clear reduction in the mean value of the MAU in the study group from 53.236 mg/min (205-190.8 mg/min) at the start of the treatment to 32.394 mg/min (0.5-99.5 mg/min) after 12 months of (P<0.05).
In the control group, there was no reduction in MAU value after one year of time. MAU was at the start 54.91 mg/min (21.39-197.81 mg/min), and after one year MAU was 54,83 mg/min (22.181-192.27) (P>0.05).
There was no clear changes in the blood pressure in the study group under the treatment with Amlodipine (P>0.05).
No clear changes were noted in the levels of plasma creatinine, cholesterol, T.G, BMI (body mass index) and HbA1c in two groups.
The side effects of amlodipine were headache, muscle spasm, abdominal pain, Tachycardia, ankle edema, these side effects of did not affect the treatment plan.
Conclusion: amlodipine clearly reduces urinary albumin excretion in type 2 diabetic normotensive patients and as sequence reduces complications of diabetic nephropathy.
|
| المقدمة Introduction |
|
إن الداء السكري النمط الثاني مشكلة تنمو باطراد في كل العالم بشكل، تقريباً 45% من هؤلاء المرضى سيتطور لديهم مرض كلوي سكري (1-8).
بعد ظهور البيلة البروتينية يبدأ GFR بالتناقص، حيث أنه بعد 10 سنوات يصل العديد من المرضى إلى مرحلة الفشل الكلوي ويحتاجون إلى الديال أو الزرع الكلوي (9–13)، يمكن التنبؤ ببدء اعتلال الكلية السكري غالباً بعد ظهور أو اكتشاف كميات صغيرة من الألبومين في البول وهي ماتسمى: microalbuminurea وتعرف بأنها معدل طرح الألبومين بالبول بمقدار 20–200 مكغ/د، مثل هذه الكميات الصغيرة من البروتين لا يمكن أن تكتشف بتقنيات كيميائية حيوية روتينية بل تحتاج إلى طرق مخبرية أكثر حساسية مثل المقايسة المناعية الشعاعية radioimmunoassay. ومعدل حدوث هذه البيلة لدى مرضى NIDDM هو 20–40% (14-17) ولها أهمية تنبؤية كمشعر لزيادة الإمراضيات ومعدل الوفيات بالمرض القلبي الوعائي (18)، فكلما شخصت مبكراً كانت الفرصة أفضل لإيقاف تطور المرض أو على الأقل إبطائه. أبدت دراسات عديدة نقصاً في البيلة الألبومينية الصغرية microalbuminurea لدى مرضى NIDDM ولديهم فرط توتر شرياني معالجين بالعوامل الخافضة للتوتر الشرياني. وبالتالي أدى إلى إنقاص microalbuminurea. فالعلاج الخافض للتوتر الشرياني المُطبّق أظهر نقصاً في معدل الوفيات والحاجة إلى زرع الكلية (19) وأبدت دراسات عديدة طويلة الأمد بأن حاصرات ACE (Converting Enzyme Angiotensin) لها تأثير مفيد في الوقاية وعلاج اعتلال الكلية السكري لدى الإنسان (20-23)، وكثير من الأبحاث والدراسات أيضاً تناولت تأثير حاصرات الكلس calcium antagonists في الوقاية والعلاج من اعتلال الكلية السكري عند مرضى الداء السكري النمط الثاني مرتفعي التوتر الشرياني وطبيعيي التوتر الشرياني. ندرس في هذا البحث تأثير حاصر الكلس Amlodipine على معدل إفراز بيلة الألبومين الصغرية في البول لدى مرضى الداء السكري النمط 2 طبيعيي التوتر الشرياني.
|
| المواد والطرق Materials and Methods |
شملت الدراسة 200 مريضاً لديهم داء سكري نمط ثاني مع توتر شرياني طبيعي وكان لدى الجميع بيلة ألبومينية صغرية.
قسم المرضى إلى مجموعتين، المجموعة الأولى 100 مريض وهي مجموعة الدراسة التي وضعت تحت العلاج بـ 5 ملغ أملوديبين يومياً، والمجموعة الثانية 100 مريض هي مجموعة الشـاهد حيث تركـت دون علاج، استغرقت الدراسة مدة سنة كاملة.
عرفت microalbuminurea (MAU) بأنها معدل طرح الألبومين بين 20-200 مكغ/ د.
- تمت مراقبة الضغط الشرياني خلال الدراسة لدى كلا المجموعتين عند 0-3-6-9-12 شهر
- تبدي الجداول من 1 إلى 4 الملامح السريرية والكيميائية الحيوية عند البدء وبعد العلاج بالـ Amlodipine لمدة 12 شهراً لدى مجموعة المرضى ومقارنتها مع مجموعة الشاهد.
- شروط القبول في البحث والإسقاط منه مبينة بالجدول 5.
- وافق جميع المرضى على الاشتراك بالدراسة.
وكانت الدراسـة عبارة عن اختبار تأثير الـ
Amlodipine على MAU لدى مرضى الداء السكري النمط 2 طبيعيي التوتر الشرياني ومقارنة النتائج مع نتائج مجموعة الشاهد.
الدراسة الإحصائية:
الطريقة الإحصائية المتبعة للمقارنة هي اختبار T -Test وPairt -Test.
|
| النتائج Results |
انسحب من الدراسة 6 من مجموعة المرضى، خمسة منهم بسبب عدم الالتزام بالعلاج وذلك بعد شهرين من بدء الاختبار، ومريض واحد بسبب إصابته باحتشاء عضلة قلبية بعد 3 أشهر من البدء واستمر في الدراسة 94 مريضاً، أما عدد مجموعة الشاهد فبقي العدد كاملاً حتى نهاية الدراسة.
لدى مجموعة المرضى لوحظ نقص واضح في معدل طرح الألبومين بالبول AER بعـد
العلاج لمدة 12 شهراً بالـ Amlodipine إذ تراجعت القيمة الوسطية للـ microalbuminurea من 53.236 مكغ/ د (معدل 20.5-190.8 مكغ/ د) إلى 32.394 مكغ/ د (معدل 0.5–99.5 مكغ/ د) في نهاية الاختبار (>P 0.05)، (الشكل 1).
عند مجموعة الشاهد لم يكن هناك تبدل واضح وملموس في قيمة MAU، إذا كانت MAU في البدء 54.91 مكغ/ د وبعد 12 شهراً كانت 54.83 مكغ/ د (< P 0.05)، وهذا واضح في الشكل 2.
بلغ عدد المرضى الذين تراجعت لديهم قيمة الـ microalbuminurea ضمن مجال الحدود الطبيعية 58 مريضاً (61.7%) من أصل 94 مريضاً، ما تبقى من المرضى وعددهم 36، تحسنت لديهم قيم الـ microalbuminurea ولكنها لم تعد إلى القيمة الطبيعية. ولم يتعد أي مريض من هذه المجموعة قيمة MAU فوق 100 مكغ/ د، (الجدول 3).
- نجد لدى مجموعة الشاهد أن عدد الأفراد بقي صفر ضمن مجموعة MAU الطبيعية، وازدادت نسبة المرضى مع الذين لديهم MAU فوق 100 مكغ/ د، (الجدول 3).
يبين الشكل 2:
- القيمة المتوسطة لكل من الضغط الانقباضي والانبساطي عند البدء وبعد 3، 6، 9 و 12 شهراً، لم يحدث فيها تبدل ملحوظ لدى مجموعتي المرضى والشاهد، وهذا واضح في الشكل 3 لمجموعـة المرضى والشكل 4 لمجموعة الشاهد.
- لم يرتبط انخفاض AER بقيم كل من الكوليستيرول، وثلاثيات الغليسريد، والبوتاسيوم، والكرياتينين، وخضاب الدم الغلوكوزي ومشعر كتلة الجسم BMI حيث لم تلاحظ تبدلات هامة في هذه القيم، (الجدول 2).
- يبين الجدول 4 التأثيرات الجانبية التي ذكرت من قبل المرضى في أي وقت خلال فترة الدراسة والتي لم تتطلب إيقاف العلاج ولا أي تعديل في جرعته.
|
الجدول 1: خصائص مجموعتي الدراسة (المرضى والشاهد).
|
التوزع الإحصائي لمرضى الدراسة عند البدء |
مجموعة الشاهد |
عدد المرضى |
100 |
100 |
الجنس M/ F |
39/ 61 |
37/ 63 |
العمر (سنة) |
40 - 70 |
37- 69 |
مدة الداء السكري (سنة) |
5 - 10 |
5 - 10 |
الضغط الشرياني (ملمز) |
الانقباضي (وسطياً) |
112.9 ± 2.2 |
120.8 ± 1.8 |
الانبساطي (وسطياً) |
78.6 ± 1.1 |
67.9 ± 1.1 |
الجدول 2: تأثيرات المعالجة بالأملوديبين Amlodipine على التبدلات الاستقلابية والسريرية.
|
البدء (وسطيا ً) |
بعد 12 شهر (وسطياً) |
المرضى |
الشاهد |
المرضى |
الشاهد |
الكوليستيرول (مغ/ د.ل) |
243.4 |
244.2 |
245.1 |
244.2 |
ثلاثيات الغليسريد (مغ/ د.ل) |
211.1 |
210.1 |
210.7 |
210.1 |
البوتاسيوم (ممول/ ل) |
4.27 |
4.3 |
4.19 |
4.2 |
كرياتينين المصل (مغ/ د.ل) |
1.06 |
1.08 |
1.08 |
1.07 |
الخضاب الغلوكوزي (% ) |
9.6 |
9.1 |
9.1 |
9.3 |
BMI M
كغ/ م2 F |
30 |
30.1 |
30 |
30.3 |
29 |
29.2 |
29 |
29..2 |
لم تلاحظ تبدلات هامة بين البدء وعند نهاية الدراسة (P < 0.05).
الجدول 3: معدل طرح الألبومين في البول لدى مجموعتي الدراسة.
|
مجموعة المرضى |
مجموعة الشاهد |
معدل طرح الألبومين بالبول (ملغ/ د) |
عدد المرضى عند البدء |
عدد المرضى بعد 12 شهر |
عدد الأفراد عند البدء |
عدد المرضى بعد 12 شهر |
< 0 > |
0 |
(%61.7) 58 |
0 |
(%) 0 |
100 - 20 |
88 |
(%38.3) 36 |
80 |
(%8.7) 70 |
200 - 100 |
6 |
(%) 0 |
20 |
(%15) 30 |
الجدول 4: التأثيرات الجانبية للمعالجة بالأملوديبين، ونسبة الأفراد المتأثرين بها.
التأثيرات الجانبية |
N = 20/94 |
% |
صداع (%) |
10 |
10.6 |
ألم بطني (%) |
4 |
4.2 |
تشنج عضلي (%) |
3 |
3.2 |
تسرع قلب (%) |
2 |
2.1 |
وذمة كاحل (%) |
1 |
1 |
الجدول 5: شروط القبول والإسقاط من الدراسة.
* شروط القبول
- قصة داء سكري نمط 2 ما بين 5 – 10 سنوات؛
- العمر بين 40 – 70 سنة؛
- Microalbuminurea .
* شروط الإسقاط
- فرط توتر شرياني؛
- كرياتينين المصل < mg/dl 2.5؛
- قصة حادث وعائي دماغي أو احتشاء عضلة قلبية؛
- قصور قلب احتقاني؛
- سوء وظيفة الكبد؛
- حالة معوية معدية أو جراحية تتداخل بامتصاص الدواء؛
- الحاجة إلى تناول واحد من الأدوية التالية:
-
حاصرات الخميرة ACE ؛
- ديجيتال؛
- أدوية مضادة لاضطراب النظم؛
- أدوية نفسية.
|
|
| المناقشة Discussion |
تعد زيادة إفراغ الألبومين في البول عامل خطر للإصابة بالاعتلال الكلوي والمرض القلبي الإكليلي لدى مرضى الداء السكري من النمط 2 (24-27). يمكن تعديل هذا العامل الذي أو إبعاده عندما يكون بمرحلة مبكرة أي مرحلة MAU، وتتم السيطرة عليه عن طريق السيطرة على العوامل المهيئة له مثل الضغط الدموي المرتفع، والضبط السيئ لسكر الدم، التدخين (28، 29).
أما من حيث السيطرة على الضغط الدموي المرتفع، فيمكن تحقيقها بكثير من الأدوية على رأسها حاصرات إنزيم أنجيوتنسين (30-32) وحاصرات قناة الكلس Non-Dihydropyridine مثل الأملودبين (33). السؤال هنا: هل تؤدي هذه الأدوية إلى تراجع MAU بتأثيرها الخافض للتوتر الشرياني أم بتأثيرها المباشر على الكبب الكلوية بغض النظر عن تأثيرها الخافض للتوتر الشرياني؟
الحقيقة أن الكثير من الدراسات تناولت موضوع العلاج بحاصرات الإنزيم وبينت تأثيره الإيجابي على MAU لدى مرضى DM Type-2 سواء مرتفعي أو طبيعيي التوتر الشرياني، أما الدراسات التي تناولت موضوع حاصرات الكلس فهي أقل ولازالت تبحث بموضوع تأثير حاصر الكلس على MAU.
نذكر منها هنا دراسة Marval (34) حيث دُرس فيها تأثير Valsartan أو Amlodipine الإيجابي على تراجع MAU يعود إلى خفض التوتر الشرياني أم إلى تأثير مباشر على الكلية. شملت هذه الدراسة 332 مريضاً بداء السكري نمط ثاني لديهم MAU سواء لديهم أو ليس لديهم ارتفاع توتر شرياني. وزع المرضى عشوائياً إلى مجموعة وضعت على 80 ملغ / يوم Valsartan أو 5 ملغ/ يوم Amlodipine لمدة 24 أسبوع.
كانـت النتيجـة أن كـلاً من Valsartan
و Amlodipine خفضا MAU بشكل مماثل في كلا المجموعتين مرتفعي التوتر الشرياني وطبيعيي التوتر الشرياني، ولم يكن هناك أي فارق إحصائي بينهما، يبين هذا أن هناك تأثيراً دوائياً مباشراً لكل من Valsartan و Amlodipine على الكلية بشكل غير مرتبط بالتوتر الشرياني.
جاءت نتائج دراستنا متطابقة مع دراسة Marval حيث حصلنا تحت تأثير العلاج بـ 5 ملغ Amlodipine على تأثير إيجابي من حيث خفض قيم MAU (>P 0.05) وذلك مقارنة مع مجموعة الشاهد التي بقيت عندها MAU كما هي.
لدى مرضى DM Type-2 نخلص إلى القول أن Amlodipine له تأثير واق على الكلية قد يكون بسبب تأثيره المباشر بخفض الضغط داخل الكبب الكلوية بغض النظر عن تأثيره على الضغط الشرياني.
|
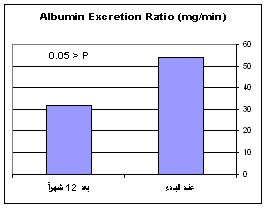
الشكل 1: نسب إفراغ الألبومين (مغ/ د) لمجموعة المرضى.
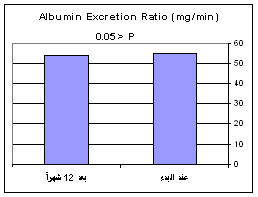
الشكل 2: متوسط نسبة إفراغ الألبومين (مغ/ د) لدى مجموعة الشاهد.
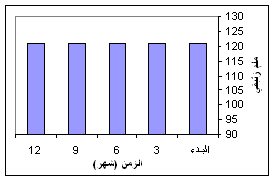
الشكل 3: تأثير العلاج بالـ Amlodipine في مجموعة المرضى خلال 12 شهر على الضغط الدموي.
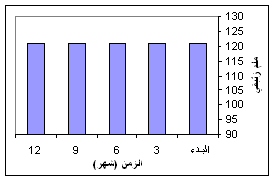
الشكل 4: تأثير العلاج بـ Amlodipine في مجموعة الشاهد خلال 12 شهر على الضغط الدموي.
أعطيت معطيات الشكلين 3 و 4 كقيمة متوسطة.
|
| المراجع References |
1-Maki DD; Ma JZ; Louis TA. and Kasiske BL.
Long-term effects of antihypertensive agents on proteinuria and renal function.
Arch Intern Med; 155: 1073-1080, 1995.
2-Parving H.H, Anderson AR, Smidtum and Svendsen PA.
Early aggressive antihypertensive treatment reduces rate of decline in kidney function in diabetic
nephropathy.
Lancet, l: 1175-1179, 1983.
3-Bakris G.
Hypertension in diabetic patients. An overview of intervention studies of preserve renal function.
Am J Hypertens, 6: 140-147, 1993.
4-Viberti GC and Wiseman MJ.
The Kidney in diabetes: significance of the early abnormalities.
Clin Endocrinol Metab; 15: 753-782, 1986.
5-Mogensen CE; Schmitz A. and Christensen CK.
Comparative renal patho-physiology relevant to IDDM and NIDDM patients.
Diabetes Metab Rev; 4: 453-483, 1988.
6-Friedman R. and Gross J.
Evolution of glomerular filtration rate in proteinuric NIDDM patients.
Diabetes, 14: 355-359, 1991.
7-Hebert LA; Bain RP; Verme D; Cattran D; whitter FC; Tolchin N; et al.
Remission of nephrotic range proteinuria in type I diabetes.
Kidney Int; 46: 1688-1693; 1994.
8-Ritz E; Hasslacher C. and Mann J.
Rational drug treatment of the hypertensive diabetic with nephropathy.
J Diabet Complications, 2: 171-174, 1988.
9-The 1993 USRDS Annual data Report: incidence and causes of treated ESRD.
Am J Kidney Dis; 22 (2): 38-45, 1993.
10-Raine AEG.
Epidemiology, development and treatment of end-stage renal failure in type II (non-insulin-dependent) diabetic patients with
proteinuria. 43:1046-1051, 1994.
11-Bjork S. and Blohme G.
Early treatment can improve prognosis in diabetic nephropathy.
Lakartidningen. 18; 95(47): 5326- 5334, 1998.
12-Bakker AJ.
Detection of microalbuminuria. Receiver operating Characteristic curve analysis favors albumin to creatinine ratio over albumin
concentration.
Acp J Club. 131 (2): 47, 1999.
13-Villarosa IP. and Bakris GL.
The appropriate blood pressure control in diabetes (ABCD) trial human hypertension. 12 (9): 653-655, 1998.
14-Yudkin JS; Forrest RD. and Jackson CA.
microalbuminuria as a predictor of vascular disease in non-diabetic subjects islington diabetes survey.
Lancet, 530-532, 1988.
15-Damsgaard EM; Froland A; Jorgensen OD. and Mogensen CE.
As a predictor of increased mortality in elderly people.
Br Med J; 300: 297-300, 1990.
16-Mogensen CE.
Microalbuminuria predicts clinical proteinuria and early mortality in maturity onset diabetes.
N Engl J Med; 310: 356-360, 1984.
17- Almdal T; Norgaard K; Fledt-Rasmueeen B. and Deckert T.
The predictive value of Micro –
albuminuria IDDM.
ACP J Club. 121 (1): 25, 1994.
18-Beilin J; Stanton RG; McCann VJ; Knuiman MW. and Divitini ML.
Microalbuminuria in type II Diabetes: an independent predictor of cardiovascular mortality.
Aust NZ J Med; 26(4): 519-525, 1996.
19-Bakris GL.
Effect of diltiazem lisinopril on massive proteinuria associated with diabetes mellitus.
Ann Inter Med; 112: 707-708, 1992.
20-Bakris GL; Copley B; Vicknair N. and Leurgans S.
Long term follow-up of patient with type II diabetes randomized to ACE inhibitors, calcium antagonists or both (abstract).
J AM Soc Nephrol; 6: 446, 1995.
21-Taft JL; Nolan CJ; Yeung SP; Hewiston TD. and Martin FIR.
Clinical and histological correlation of decline in renal function in diabetic patients with proteinuria.
Diabetes Care, 14:1046-1105, 1994.
22-Lewis EJ; Hunsicker LG; Bain RP; Rohde RD
For the collaborative study group: the effect of angiotensin converting enzyme inhibition on diabetic nephropathy.
Engl Med; 329: 1456-1462, 1993.
23-Scheen AJ.
Clinical study of the month. The CAPPP study: the Captopril prevention project.
Rev Med liege, 54(3): 197-199, 1999.
24-Bakris GL.
Blood pressure control and progression of diabetic nephropathy: are all antihypertensive drugs created equal?
Kidney, 3: 61-62, 1994.
25-Praving HH. and Rossing P.
The use of antihypertensive agents in prevention and treatment of diabetic nephropathy.
Curr Opin Nephrol hypertens, 3: 292-300, 1994.
26-Sano T et al.
Effects of long-term enalapril treatment on persistent micro-albuminuria in well-controlled hypertensive and normotensive NIDDM
patients.
Diabetes Care, 17: 420-442, 1994.
27-Crimi S; Cipolli D; Infantone F; Infantone L. and lunette M.
Microalbuminuria and severity of diabetic retinopathy in type I diabetic patients: association and relationship with some risk factors.
Diabetes Metal; 21 (6): 440-445. 1995.
28-Melbourne diabetic nephropathy study group. Comparison between perindopril and nifedipine in hypertensive and normotensive diabetic
patients with microalbuminuria.
Br Med J; 302: 210-216, 1991.
29-Viberti G; Mogensen CE; Groop LC. and Pauls JF.
Effect of captopril on progression to clinical proteinuria in patients with insulin-dependent diabetes mellitus and microalbuminuria.
European Microalbuminuria Captopril Study Group.
J Am Med Assoc; 271: 275-279, 1994.
30-Rudberg S; Aperia A; Freyschuss U. and Persson B.
Enalapril reduces micro-albuminuria in young normotensive type 1 (insulin-dependent) diabetic patients irrespective of its hypertensive effect.
Diabetologia, 33: 470-476, 1990.
31-Marre M. et al.
Converting enzyme inhibition and kidney function in normotensive diabetic patients with persistent microalbuminuria.
Br Med J, 294: 1448-1452, 1987.
32-Lewis EJ; Hunsicker LG; bain RP. and Rohde RD.
For the collaborative study group: the effect of angiotensin converting enzyme inhibition on diabetic nephropathy.
Engl J Med; 329: 1456-1462, 1993.
33-Slataper R; Mcknair N; Sadler R. and Bakris GL.
Comparative effects of different antihypertensive treatments on progression of diabetic renal disease.
Arch Inter Med; 153: 973-980. 1993.
34-Tatti P; Pahor M; Byington RP; Di Mauro P; Guarisco R. and Strollo F.
Outcome results of the Fosinopril versus Amlodipine cardiovascular events randomized trial (FACET) in patients with hypertension and NIDDM.
Diabetes care. 21 (4): 597-603, 1998.
35-Parving HH; sterby OR; Anderson PW. and Hsueh WA.
Diabetic nephropathy.
In the Kidney, 5th edition. Edited by Brenner BM. Philadelphia: Saunders 1864-1892, 1996.
36-Bakris GL. and Williams B.
ACE inhibitors and calcium antagonists alone or combined: is there a difference on progression of diabetic renal disease?
J Hypertens, 13 (2): 95-101, 1995.
37-Marre M; chatellier G; Leblanc H; Guyenne T-T; Ménard J. and Passa P.
Prevention of diabetic nephropathy with enalapril in normotensive diabetics with microalbuminuria.
BMJ; 297: 1092-1095, 1988.
38-Bj?rck S; mulec H; Johnson SA; Nordén G. and Aurell M.
Renal protective effect of enalaprll in diabetic nephropathy.
BMJ; 304: 339-343, 1992.
39-Viberti G. and Wheeldon NM.
Microalbuminuria reduction with valsartan (MARVAL) study investigators.
Circulation, 106 (6): 643-645, 2002.
|
| |
| المجلد 4 ,
العدد 7
, رمضان 1428 - تشرين الأول (أكتوبر) 2007 |
|
|
|
