| الملخص Abstract |
المعالجة الجينية Gene therapy عبارة عن إصلاح الفقد الوظيفي للجينات عن طريق إيصال الجينات السليمة إلى النسج البشرية، أو بمعنى أخر التعبير عن الجين العلاجية Therapeutic gene في النسيج المستهدف لتحقيق الفائدة. تسمح إضافة المعلومات الوراثية بهذه الطريقة للخلايا أن تقوم بوظيفتها بشكل مناسب كما يمكن أن يتم إنقاص أو إزالة علامات وأعراض المرض.
تحمل المعالجة الجينية الأمل بشفاء العديد من الأمراض الوراثية. مع فعالية المعالجة الجينية في إزالة ومنع الأمراض الوراثية، فان المعالجة الجينية يمكن تسميتها بالعامل الطبي الإعجازي الفعال. لإنجاز المعالجة الجينية يجب توافر متطلبين: أولهما تنسيل الجين المصاب، أي تحديد تسلسله وتوصيف تنظيمه بشكل كافٍ؛ وثانيا إيجاد ناقل Vector مناسب لإيصال النسخة الجيدة من الجين المصاب. وتشكل الفيروسات حالياً الناقل الأكثر شيوعاً؛ والتي تعدل وراثياً لتحمل الـ DNA الطبيعي للإنسان.
إن فعالية المعالجة الجينية لإحداث ثورة طبية يُعد مثيراً؛ والتوقعات بالمعالجة ومنع الأمراض تعد مشجعة.
|
| Gene therapy is correcting functional gene loss by delivering genes to human tissues or simply expression of a therapeutic gene in target tissue to achieve benefit. The added genetic information would allow these cells to function properly and might reduce or eliminate the signs or symptoms of the disease. Human gene therapy holds great promise for the cure of many genetic diseases. With its potential to eliminate and prevent hereditary diseases, gene therapy is potential medical miracle-worker. In order to achieve cure using gene therapy, there are two requirements. First, the affected gene must be cloned, its sequence determined and its regulation adequately characterized. Second, a suitable vector for the delivery of good copy of the affected gene must be available. Currently, the most common vector is a virus that has been altered to carry normal human DNA. Gene therapy's potential to revolutionize medicine in the future is exciting, and its expectations for curing and preventing diseases is encouraging. |
| المقدمة Introduction |
تُعد الجينات Genes المحمولة على الصبغيات الوحدات الوظيفية الأساسية للوراثة وهي عبارة عن أجزاء من الحمض الريبي النووي المنزوع الأكسجين Deoxy-ribonucleic acid (DNA) (الشكل 1).
يشتمل المخزون الوراثي للإنسان ما بين 100,000-50,000 جين ترمز من خلال التسلسل النوعي لوحداتها البنائية (النوكليوتيدات Nucleotides) التعليمات التي تسمح للخلايا باصطناع بروتينات نوعية مثل الإنزيمات Enzymes. عندما تتبدل الجينات فان البروتينات التي ترمزها تصبح معطوبة وغير قادرة على القيام بوظائفها الطبيعية مما يؤدي إلى ظهور ما يدعى بالاضطرابات المورثية Genetic disorders.
المعالجة الجينية عبارة عن معالجة تجريبية تتضمن إدخال المادة الوراثية (DNA أو RNA) في خلايا الشخص المصاب لمعالجة المرض.
تطبق المعالجة الجينية حالياً من خلال الدراسات السريرية (الدراسات البحثية على الإنسان) للعديد من الأمراض الوراثية والأنماط المختلفة من السرطان (الجدول 1) وهي غير مطبقة حالياً خارج مجال تلك الدراسات.
إن التقدم الكبير في فهم طبيعة الجينات والمقدرة على التلاعب (المنابلة) Manipulating بها قد مكن العلماء من استبدال المادة الوراثية المعيبة Defective genetic material بالمادة الوراثية الطبيعية Normal genetic information بغاية مقاومة الأمراض (وخصوصاً الأمراض الوراثية)، أو علاجها أو منع حدوثها وهذا ما يعرف بالمعالجة الجينية Gene therapy.
تُعد المعالجة الجينية ثورة في علم الطب حيث أن التقدم في مجال المعالجة الجينية يمكن أن يسمح للأطباء بمعالجة الأمراض عن طريق إيقاف عمـل الجين المعيب أو إيقاف نمو الأورام السرطانية أو عن طريق تنشيط
الجسم على إنتاج البروتينات الأساسية مثل الإنزيمات التي لا تسمح الجينات المعيبة بإنتاجها.
يتنبأ العديد من الأطباء بأن هذا النوع من المعالجة يمكن أن يبدل الممارسة الطبية من ممارسة تعتمد على المعالجة Treatment-based practice إلى ممارسة تعتمد على منع حدوث المرض Prevention-based practice، كما ويأمل الباحثون بأنه وفي السنوات القادمة سوف يكون لكل مرض جيني معالجة جينية بحيث يمكن لهذا النوع من المعالجة أن يصبح آخر طرق المعالجة التي يحتاج إليها الجنس البشري.
|
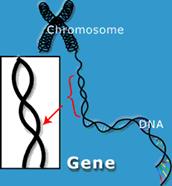
الشكل 1 : رسم تخطيطي يظهر الجين وعلاقته بالبنية الحلزونية المضاعفة للـ DNA والصبغي.
الجدول 1 : بعض من الأمراض الوراثية التي يمكن معالجتها جينياً.
| Genetic defect |
Disease |
- Absence of clotting factor VIII |
- Hemophilia A |
- Defective chloride channel protein |
- Cystic fibrosis |
- Defective muscle protein (dystrophin) |
- Muscular dystrophy |
- Defective beta globin chain |
- Sickle-cell disease |
- Absence of clotting factor IX |
- Hemophilia B |
- Any one of several genes fail to make a protein essential for T and B cell function |
- Severe combined immunodeficiency (SCID) |
|
| النواقل في المعالجة الجينية Vectors in gene therapy |
|
لا يمكن بشكل عام إدخال الجينات الطبيعية مباشرة في DNA خلايا الأشخاص المرضى ليتم استبدال الجينات السوية بالجينات المعيبة المسببة للمرض بالجينات السوية وإنما يجب إيصال هذه الجينات إلى الخلايا باستخدام نواقل أو ما يعرف بالـ Vectors، والتي تقوم بإيصال جين المعالجة Therapeutic gene إلى الخلايا المستهدفة.
إن نواقل الجينات الأكثر استخداماً في المعالجة الجينية هي عبارة عن فيروسات معدلة وراثيا لتحمل الـ DNAالبشري السوي وهي تملك قدرة فريدة بالتعرف على خلايا معينة ومن ثم إدخال الـ DNA الخاص بها إلى تلك الخلايا. تملك الفيروسات القدرة على محفظة Encapsulating وإيصال جيناتها إلى الخلايا البشرية بطريقة إمراضية، حيث استفاد العلماء من الميزة السابقة من خلال التلاعب (المنابلة) بالجينوم Genome الفيروسي بإزالة الجينات المسببة للمرض وإدخال الجينات العلاجية (الشكل 2).
|
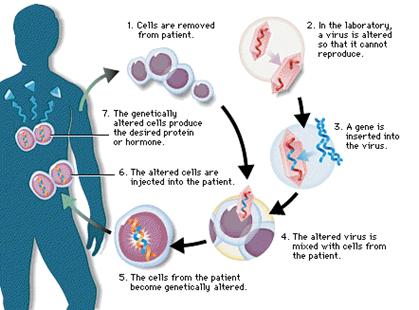
الشكل 2 : استخدام الفيروسات كنواقل للجينات في المعالجة الجينية. |
| من الأنواع الفيروسية التي تستخدم كنواقل في المعالجة الجينية: |
1- الفيروسات العكسية Retroviruses:
صنف من الفيروسات قادر على اصطناع
DNA مضاعف الطاق Double-stranded DNA اعتباراً من ذخيرته الوراثية والتي هي عبارة عن RNA يمكن دمجه في صبغيات الخلايا المضيفة Host cells.
يُعد فيروس نقص المناعة البشري Human immunodeficiency virus (HIV) أحد أنواع الفيروسات السابقة.
2- الفيروسات الغديةAdenoviruses :
صنف من الفيروسات ذخيرته الوراثية عبارة عن DNA مضاعف الطاق. تسبب هذه الفيروسات أخماجاً رئوية، معوية وعينية عند البشر. نعد الفيروسات المسببة للزكام الشائع Common cold أحـد أنواع الفيروسـات
السابقة (الشكل 3).
في هذه الطريقة يُغرز جين المعالجة في الناقل المستخدم لإدخال جين المعالجة في الخلية البشرية. إذا كانت المعالجة ناجحة فان جين المعالجة سوف يقوم بترميز اصطناع البروتين الوظيفي.
3- الفيروسات المرتبطة بالغدية Adeno-associated viruses:
صنف من الفيروسات الصغيرة ذخيرته الوراثية عبارة عن DNA وحيد الطاق Single-stranded DNA. تملك هذه الفيروسات القدرة على غرز Insertion مادتها الوراثية في موقع نوعي من الصبغي التاسع عشر.
|
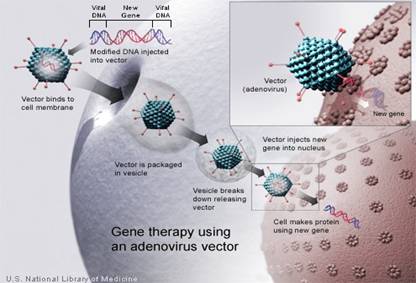
الشكل 3 : المعالجة الجينية باستخدام الفيروسات الغدية Adenovirus كنواقل. |
4- فيروس العُقبولة البسيط Herpes simplex viruses:
صنف من الفيروسات ذخيرته الوراثيـة عبارة عن
DNA مضاعف الطاق. تملك الفيروسات السابقة القدرة على خمج أنواع معينة من الخلايا. النمط 1 من هذه الفيروسات Herpes simplex virus type 1 عبارة عن عوامل إمراضية شائعة تسبب عند البشر ما يدعى بالقرحات الباردة Cold sores.
تختلف الفيروسات المستخدمة كنواقل في المعالجة الجينية في طريقة نقلها لجينات المعالجة إلى الخلايا الهدف وكذلك في أي من الخلايا سوف تؤثر وفيما إذا كانت ستحدث تبدلاً دائماً أو مؤقتاً في الـ DNA الخلوي وعليه فإن الباحثين يمكن أن يستخدموا نواقل مختلفة اعتمادا على ميزات ومتطلبات الدراسة.
بالإضافة إلى استخدام الفيروسات كنظم لإيصال جينات المعالجة في المعالجة الجينية فهناك طرق لا فيروسية تستخدم من أجل الهدف وهي تتمثل في:
1- الإدخال المباشر لـ DNA المعالجة في الخلايا الهدفية.
تُعد الطريقة السابقة ذات محدودية بحيث يمكن استخدامها فقط لإيصال جينات المعالجة إلى نسج معينة وهي تتطلب كميات كبيرة من
الـ DNA.
2- استخدام جزيئات من طبيعة شحمية ذات
لب مائي Aqueous core تدعى بالجسيمات الشحمية (الليبوزومات) تحمل جين المعالجة وتكون قادرة على إدخال الـ DNA المعالجة من خلال غشاء الخلية الهدف (شكل 4).
3- إيصال DNA المعالجة الجينية إلى الخلايا الهدف من خلال الربط الكيميائي لـ DNA المعالجة إلى جزيئات يمكن لها الارتباط بمستقبلات نوعية للخلايا بحيث يجري بعدها عملية ابتلاع DNA المعالجة من خلال غشاء الخلية وبالتالي يمر إلى داخل الخلية الهدف.
|
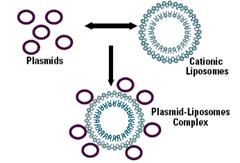
شكل 4 : استخدام الجسيمات الشحمية كنواقل لا فيروسية للجينات في المعالجة الجينية. |
| أنماط المعالجة الجينية
Types of gene therapy
|
1- المعالجة الجينية خارج الأحياء
Ex vivo gene therapy
في بعض الاختبارات السريرية المتعلقة بالمعالجة الجينية يتم عزل الخلايا الهدف من دم المريض أو من نقي العظام Bone marrow في مخابر تخصصية ثم تعرض هذه الخلايا فيما بعد إلى الفيروسات الحاملة لجين المعالجة المطلوب بحيث يمكن لهذه الفيروسات أن تدخل إلى الخلايا، ومن ثم تقوم بغرز الجين العلاجي المطلوب ضمن الخلايا الهدف. إن الحصول على بروتينات وظيفية طبيعية من خلال تطبيق هذه الطريقة يمكن الخلية من استعادة حالتها الطبيعية. يتم فيما بعد تنمية الخلايا السابقة ومن ثم إعادتها للمريض عن طريق الحقن الوريدي.
يدعى النمط السابق من المعالجة الجينية بالمعالجة الجينية خارج الأحياء ex vivo gene therapy حيث يتم نمو الخلايا خارج الجسم ومن ثم يتم إدخال جين المعالجة المطلوب في هذه الخلايا وهي خارج الجسم.
استخدم المعالجة الجينية خارج الأحياء للمرة الأولى عام 1995 لمعالجة طفل مصاب بعوز مناعي وراثي ناجم عن عوز إنزيم Adenosine deaminase (ADA) الذي يُعد ضرورياً للجملة المناعيةImmune system حيث يعاني الأطفال المصابون بهذا العوز الإنزيمي من عوز مناعي خطير ويكونوا عرضة للإصابة بأخماج خطيرة مهددة للحياة. على الرغم من إمكان معالجة المرض السابق باستخدام دواء يدعى PEG-ADA، إلا أن هذا الدواء مكلف جداً ويجب أن يؤخذ بالحقن الوريدي طوال الحياة. استخدمت التقنية السابقة من المعالجة الجينية أيضا لمعالجة الأطفـال والبالغيـن المصابيـن بارتفـاع الكوليستيرول المصلي.
|
2- المعالجة الجينية في الأحياء
In vivo gene therapy
تستخدم في دراسات أخرى تتعلق بالمعالجة الجينية نواقل الجينات والتي هي عبارة عن فيروسات أو جسيمات شحمية Liposomes لإيصال الجين المطلوب إلى جسم المريض. يدعى المعالجة الجينية بهذه الطريقة بالمعالجة الجينية في الأحياء in vivo gene therapy حيث أن نقل جين المعالجة إلى الخلايا يتم في جسم المريض.
استخدمت هذه الطريقة في معالجة الأشخاص المصابين بالتليف الكيسي Cystic fibrosis وهو مرض ينجم من طفرات تصيب الجين CFTR وهو الجين المرمز لقنوات الكلور Chloride-channel gene حيث يتم إيصال الجين المطلوب باستخدام النواقل الفيروسية وغير الفيروسية.
لا تستهدف المعالجة الجينية استبدال الجين المعيب بل تستهدف الحصول على البروتين المرمز من قبل الجين الطبيعي وهو يتمثل بالإنزيم الفعال في عوز ADA، وبالمستقبلات السوية الوظيفية في فرط الكوليستيرول المصلي العائلي، والقنوات الشاردية في التليف الكيسي. إذا تم إيصال البروتين المطلوب إلى النسج الهدفية فليس هناك حاجة لاستبدال الجين المعيب ولكن المشكلة التي تعترض ذلك هي المكان الذي يجب أن يصل إليه البروتين والذي يمكن أن يكون حيزاً خاصاً أو غشاء خاصاً لخلايا من نمط خاص.
هناك القليل من البروتينات التي يمكن أن تعطى بهدف المعالجة الجينية وهي تتضمن الأنسولين، عامل التخثر الثامن Coagulation factor VIII، عامل التخثر التاسع Coagulation factor IX، عامل تنشيط مستعمرة المحببات Granulocyte colony-stimulating factor (G-CSF)، عامل تنشيط مستعمرة المحببات والبلاعم الكبيرة Granulocyte-macrophage colony-stimulating factor (GM-CSF)، مولد الحمر Erythropoietin، وهرمون النمو Growth hormone والتي يمكن إعطاؤها بالحقن البسيط.
إن طريقة تقديم البروتينات السابقة أقل فعالية من فعالية الدور الذي يقوم به البروتين الذي ينتج فيزيولوجيا في النسج النوعية.
|
| المخاطر المترافقة مع المعالجة الجينية
Risks are associated with gene therapy
|
1- طبيعة البقيا قصيرة الأمد للمعالجة الجينية
Short-lived nature of gene therapy
قبل أن تصبح المعالجة الجينية وسيلة الشفاء الدائمة لأية حالة مرضية فإن DNA المعالجة المدخل إلى الخلايا الهدفية يجب أن يبقى فعالاً وعلى الخلايـا الحاويـة على DNA المعالجة أن تتمتع بفترة بقيا طويلة.
إن المشاكل في DNA المعالجة المدخل في الجينوم وفي طبيعة الانقسام السريع للعديد من الخلايا يمنع المعالجة الجينية من تحقيق فوائد طويلة الأمد بحيث يجب على المريض أن يخضع لاحقاً للعديد من محاولات المعالجة الجينية. لا ينبغي لجين المعالجة أن يدخل في موقع خاطئ من الـ DNA لئلا يحدث حالة سرطانية أو طفرات ضارة تصيب الـ DNA.
يمكن لـ DNA المعالجة أن يدخل في الخلايا التكاثرية (النطاف والبيوض) Reproductive cells مع إمكانية حدوث تبدلات يمكن أن تنتقل للأجيال اللاحقة. كما يمكن للجينات المدخلة أن تخضع لحالة من فرط التعبير Over expression بحيث تملك البروتينات المشفرة من قبل هذه الجينات والمنتجة بكميات كبيرة تأثيرات ضارة.
2- الاستجابة المناعية Immune response
تهاجم الأجسام الغريبة والمدخلة إلى النسج البشرية من قبل الجهاز المناعي وعليه تحمل المعالجة الجينية إمكانية تنشيط الجهاز المناعي مع حدوث مخاطر تنقص من فعالية المعالجة الجينية.
3- مشاكل النواقل الفيروسية Problems with viral vectors
على الرغم من كون الفيروسات تمثل النواقل المختارة في المعالجة الجينية فإنها تمثل مشاكل للمريض من حيث إمكان تحريضها للاستجابات الالتهابية، المناعية والسمية. بالإضافة لذلك، هناك مخاطر من أن تسترد الفيروسات قابليتها لإحداث المرض حالما تدخل الجسم عدا عن قابلية الفيروسات لخمج الخلايا السليمة بالإضافة للخلايا المصابة.
4- الاضطرابات متعددة الجين Multigene disorders
تُعد الاضطرابات الوراثية التي تنشأ من طفرات تصيب جين مفرد المرشحة للعلاج الجيني ولسوء الحظ فإن البعض من أكثر الاضطرابات شيوعاً مثل الأمراض القلبية، ارتفاع ضغط الدم، مرض الزهايمر Alzheimers disease ، التهاب المفاصل Arthirits والداء السكري Diabetes عبارة عن أمراض مسببة من قبل تأثيرات مشتركة من التبدلات في العديد من الجينات، وعليه فإن هذه الاضطرابات متعددة العوامل بشكل فعال باستخدام المعالجة الجينية.
|
| المخاطر التي ينبغي التغلب عليها قبل أن تصبح المعالجة الجينية تقنية شائعة لمعالجة الأمراض |
1- إيجاد طرق أكثر فعالية لإيصال الجينات إلى الجسم، وهذا يتطلب تطوير نواقل يمكن حقنها في المريض والتأكد من وصول هذه النواقل إلى الخلايا الهدفية.
2- يجب التأكد من أن النواقل المستخدمة ستقوم بإيصال جينات المعالجة إلى كل خلية من الخلايا الهدفية.
3- يجب إيجاد الطريقة التي تضمن إيصال جين المعالجة إلى الموقع الصحيح من DNA المريض.
على الرغم من أن العلماء يعملون بجد لإيجاد حلول فعالة لهذه المشاكل إلا أنه من المستحيل التنبؤ عن الوقت اللازم الذي سيستغرقه الحصول على مثل هذه الحلول.
|
| الاعتبارات الأخلاقية والاجتماعية لاستخدام المعالجة الجينية Ethical and social considerations for using gene therapy |
إن الاعتبارات الأخلاقية والاجتماعية لاستخدام المعالجة الجينية تتمثل بتلك التي تواجه عند تطوير أية تقنية جديدة فعالة يمكن أن تعد بالكثير ولكن يمكن أن تسبب ضرراً كبيراً إذا تم تطبيقها بعيداً عن الحكمة.
تركز المعالجة الجينية حالياً على تصحيح العيوب الجينية وعلاج الأمراض المهددة للحياة. في المستقبل وعندما تصبح تقنية المعالجة الجينية بسيطة وسهلة المنال فإن المجتمع بحاجة إلى التعامل مع هذه القضية المعقدة وخصوصاً فيما يتعلق بإمكان إحداث تبديل جيني يطال الخلايا التكاثرية للإنسان كالنطاف مما يعطي إمكانية نقل التبديل الجيني
المحدث إلى الأنسال المتعاقبة. العقبة الأخرى تتعلق بفعالية المعالجة الجينية لتحسين مقدرات الإنسان مثل الذاكرة Memory والذكاء. وعلى الرغم من أن مثل التبدلات السابقة المحدثة بالمعالجة الجينية قد تكون ذات فائدة إلا أن المشاكل المحتملة والتي يمكن أن تنتج تقلق العديد من العلماء.
|
| الاستنتاج Conclusion |
|
المعالجة الجينية طريقة حديثة سوف تبدل من الممارسة الطبية عما هي علية اليوم. إن اكتشاف المزيد من الجينات ومعرفة وظائفها يجعل فعالية هذه الطريقة غير محدودة. إن الحقائق المتعلقة بمستقبل البشرية مخبأة في الذخيرة الوراثية الخاصة بنا، وكلما تم فهم حقائق هذه الذخيرة الوراثية فإن حياتنا سوف تتبدل دائماً بحيث يمكن القول أن قدرنا متعلق بجيناتنا وليس كما كان يظن البعض أنه متعلق بالنجوم.
|
| المراجع References |
1-http://www.cancer.gov/publication
2-http://www.fda.gov/fdac/features/ 2000/5000-gene.html
3-http://en.wikipedia.org/gene-therapy
4-http://en.wikipedia.org/wiki/Gene
5-https://cissecure.nci.nih.gov/ livehelp/welcome.asp
|
| |
