يُعد التهاب المفاصل الرثياني من أكثر الأمراض المفصلية حدة وأكثرها تخريباً، وهو يتصف مصلياً بوجود عدد كبير من الأضداد الذاتية ذات نوعيات مستضد مختلفة تتفاوت ألفتها وحساسيتها من الناحية التشخيصية.
تستعرض هذه المقالة خصائص الأضداد الذاتية الرئيسة في التهاب المفاصل الرثياني مع تسليط الضوء على أكثرها إفادة من الناحية التشخيصية. إضافة لذلك، يقدم التفهم العميق للأضداد الذاتية لالتهاب المفاصل الرثياني معرفة هي أكثر وضوحاً عن التطورات الأساسية لتطور هذا المرض على المستوى الخلوي والجزيئي.
يعد التهاب المفاصل الرثياني المرض الأكثر حدة وتخريباً من بين أمراض المفاصل الأخرى، وتصل الإصابة به إلى ما يقارب 1% من البالغين في العالم. كما أنه المرض الجهازي الذاتي المناعة الأكثر شيوعاً وهو يتصف بوجود ذاتية متباينة في المصل والسائل المفصلي. وهذا ما يميز التهاب المفاصل الرثياني عن أمراض مفصلية أخرى كالتهاب المفاصل الصدافي والتهاب المفاصل الارتكاسي أو العظمي، التي نادراً ما تكشف فيها ظاهرة المناعة الذاتية. لقد كان العامل الرثياني RF أول عامل تفاعلي ذاتي يكتشف في مصول مرضى التهاب المفاصل الرثياني، وتبين لاحقاً أنه ضد ذاتي نوعي للغلوبولين G (IgG). ومنذ الوصف الأول للعامل الرثياني على يد Emil Waaler سنة 1940 فقد تم اكتشاف أعداد إضافية كثيرة من الأضداد الذاتية في مصول المرضى المصابين بالتهاب المفاصل الرثياني. أما أهداف هذه الأضداد الذاتية فمتنوعة إلى حد بعيد وتتضمن بروتيناً مولداً للغراء Collagen إلى جانب البروتينات السيترولينية Citrullinated proteins كالفيبرين Fibrin و الفيمنتين Vimentin (القائمة 1). ومن بين الأضداد التي يمكن الكشف عنها في مصول مرضى التهاب المفاصل الرثياني أضداد البروتين السيترولينيAnti-citrullinated protein antibodies (ACPA)) الأكثر نوعية لهذا المرض، في حين أنه يمكن الكشف في أمراض ثانية وحتى في الأشخاص الأصحاء عن جميع الأضداد الأخرى، ومن ضمنها العامل الرثياني. ومع ذلك يبقى العامل الرثياني الأكثر استعمالاً في علم المصول كواصم لمرض التهاب المفاصل الرثياني ويعد أحد المقاييس السبعة المصنفة لهذا المرض من قبل المجمع الأمريكي للرثويات ARC. وعلى الرغم من ذلك فإنه من غير الممكن استعمال معظم هذه الأضداد في الأغراض التشخيصية وإنما تستخدم للمساهمة في وصف المسارات المرضية لالتهاب المفاصل الرثياني كالتهاب الغشاء الزليلي المزمن والائتكال.
|
القائمة 1: مستضدات ذاتية ذات صلة بقدرتها على التسبب بمرض التهاب المفاصل الرثياني.
المستضد |
الضد |
- الغلوبولين المناعي G |
- العامل الرثياني |
- البروتينات السيترولينية |
- أضداد البروتين السيتروليني، أضداد الببتيدات السيترولينية الحلقية (الفيبرين، الفيمنتين، الفيلارغين) |
- نووي مغاير المنشأ |
- أضدادRA33 البروتين النووي الريبي |
- الكولاجين II |
- أضداد الكولاجين |
- بروتينات الصدمة الحرارية |
- أضداد BiP ، أضداد hsp90 |
- غلوكوز-6- فسفات ايزوميراز |
- أضداد غلوكوز-6- فسفات ايزوميراز |
|
| العوامل الرثيانية RF |
مجموعة من الأضداد الذاتية من نوع IgM و IgM و IgA وهي تتفاعل مع الجزء Fc من الغلوبولين المناعي G (IgG). ويعد الغلوبولين المناعي M (IgM) النمط الأساسي فيما بينها، إلا أن المركبين IgA-RF وIgG-RF موجودان أيضاً في مصل وفي السائل المفصلي لدى مرضى التهاب المفاصل الرثياني، ومن الممكن أن يساهما في إضافة معلومات تشخيصية. هنالك طرق مختلفة لمقايسة العامل الرثياني، منها طرائق التراص كاختبار Waaler-Rose التقليدي وطريقة العكر باستعمال أشعة ليزر وطريقة ELISA التي تقدم الوسيلة للتميز بين أصناف العوامل الرثيانية.
تُعد الزيادات المؤقتة في مركب IgM-RF
جزء من الاستجابة المناعية الطبيعية والملاحظة بشكل عام خلال الحالات الالتهابية، ومن الأرجح أن يكون سبب تشكله رد فعل لوجود مركبات مناعية تحتضن مستضدات جرثومية. لذلك نشاهد وجود مركب IgM-RF ذي ألفة خفيفة في 10-15% من الأشخاص الأصحاء (ظاهرياً). بالمقابل فإن استمرار وجود تركيز مرتفع من مركب IgM-RF وبشكل مزمن (مترافقة مع وجود أصناف من IgG وIgM) هي صفة لظاهرة التهاب المفاصل الرثياني، وقلما وجدت في حالات مناعة ذاتية أخرى. يمكن الكشف عن وجود مركب IgM-RF في 60-80% من مرضى التهاب المفاصل الرثياني المثبت مرضهم. في حين أن انتشاره في المراحل الأولى من مرض التهاب المفاصل الرثياني يكون منخفضاً إلى حد بعيد. كذلك لا يُعد مركب IgM-RF نوعياً لمرض التهاب المفاصل الرثياني، حيث يمكن كشفه وبتراكز عالية في مرض متلازمة ثغرن Sjogren`s) syndrome) البدائي أو في وجود الغلوبولينات البردية في الدم Cryoglobulinaemia، وأيضاً في أمراض رثيانية أخرى وبتراكيز منخفضة. ومن الملاحظ أن ألفة العامل الرثياني لمرض التهاب المفاصل الرثياني تزداد بشكل ملحوظ مع التراكيز العالية منه ويُعد RF>50 وحدة دولية / مل RF50)) نوعياً لمرض التهاب المفاصل الرثياني (القائمة 2). ومع ذلك يوجد RF50 في حوالي 50% من المرضى في مراحلهم الأولى في الوقت الذي لم يحقق فيه بعد المعيار التشخيصي (القائمة 3). ومن الممكن وجود جميع أصناف العامل الرثياني في المراحل الأولى من المرض وأيضاً، كما أن هناك إمكان لظهور هذا العامل بمرحلة تسبق ظهور المرض بعدة سنوات. ومن الملفت للنظر اعتبار عدة دراسات أن مركب IgA-RF هو الواصم الأكثر نوعية في التهاب المفاصل الرثياني مقارنة مع الأصناف IgM وIgG-RF. والأهم من ذلك هي قيمة التكهن عند وجود تركيز مرتفع من مركب IgM-RF ومركـب IgA-RF، بسـبب
ترافقهما مع الحالات الحادة لالتهاب المفاصل الرثياني كالتآكلات الشعاعية وسرعة تقدم المرض إلى حد ما (2، 3، 5).
|
القائمة 2: حساسية ونوعية العامل الرثياني IgM للمرضى المثبت إصابتهم بمرض التهاب المفاصل الرثياني.
التشخيص |
RF>20U/ml |
RF50
RF>50 U/ml) ) |
التهاب المفاصل الرثياني |
66%* |
46% |
متلازمة ثغرن |
62% |
52% |
داء الذأب الحمامي |
27% |
10% |
تصلب الجلد |
44% |
89% |
التهاب جلدي عضلي/متعدد |
18% |
0% |
التهاب مفصل ارتكاسي |
10% |
4% |
التهاب عظمي مفصلي |
25% |
4% |
أشخاص أصحاء (كمجموعة مراقبة) |
13% |
0% |
نسبة الحساسية لالتهاب المفاصل الرثياني المثبت |
66% |
46% |
نسبة النوعية لالتهاب المفاصل الرثياني المثبت |
78% |
88% |
* تمت معايرة العامل الرثياني بطريقة العكر في مصول أكثر من 300 مصاب بأنواع مختلفة من أمراض التهاب المفاصل وكذلك في 30 أناس أصحاء كمجموعة مراقبة.
* نسبة المرضى ذوي النتائج الايجابية.
القائمة 3: القيم التشخيصية للعامل الرثياني وأضداد البروتين السيتروليني وأضداد RA33 في المرضى المصابين بالمراحل الأولى لالتهاب المفاصل الرثياني. كان قد تمت معايرة العامل الرثياني بطريقة العكر وأضداد البروتين السيتروليني (أضداد- (CCP بطريقة ELISA وأضداد RA33 بطريقة التبقع المناعي، وذلك في مجموعة من 200 مريض مصاب بالتهاب المفاصل الرثياني، ولم يتم معالجتهم بعد، وبزمن يقل عن 3 أشهر (8). كان قد تم تشخيص التهاب المفاصل الرثياني في 102 مريضاً وكان 98 منهم قد أصيبوا بالتهاب المفاصل الرثياني كالتهاب مفصل ارتكاسي والتهاب عظمي مفصلي والتهاب مفصل غير متمايز. لقد بينا بالجدول التالي كلاً من أضداد البروتين السيترولينية (أضداد-CCP ) والعامل الرثياني < 50 وحدة دولية/مل حساسية ونوعية مع قيم تكهن ايجابية عالية لالتهاب المفاصل الرثياني، بينما أثبتت قيم عامل رثياني > 50 وحدة دولية/ مل قيم تشخيصية منخفضة. كذلك كان هنالك توافق يعتد به بين أضداد البروتينات السيترولينية والعامل الرثياني 50 (p<0.0001 )، بينما لم تترافق أضداد RA33 مع أي ضد يصف فئة من المرضى الذين يعانون من المرض بشكل معتدل نسبياً.
|
الحساسية % |
النوعية % |
قيم تكهن ايجابية % |
العامل الرثياني ( < 20 وحدة دولية/مل) |
55 |
89 |
84 |
العامل الرثياني 50 ( < 50 وحدة دولية/مل) |
45 |
96 |
92 |
أضداد البروتين السيتروليني (أضداد-CCP ) |
41 |
98 |
96 |
أضداد RA33 |
28 |
90 |
74 |
|
| أضداد البروتين السيتروليني (ACPA) |
من أهم الاكتشافات العلمية المثيرة خلال العقد الماضي في حقل الأضداد الذاتية هو التعرف في مصول المرضى المصابين بالتهاب المفاصل الرثياني على أضداد ذاتية نوعية لحواتم epitopes المستضد التي تحوي الحمض الاميني السيتروليني النادر الوجود والمستحدث مابعد ترجمة المعلومات بنزع الأمين من الحمض الأميني الأرجينين بوساطة الإنزيم الأرجينين ثنائي الأمين (الشكل 1).
وبشكل عام فان الأضداد الذاتية التي تتعرف على الأجزاء السيترولينية ذات الفاعلية المناعية تسمى أضداد البروتين السيتروليني Anti-citrullinated protein antibodies (ACPA). وقد تم التعرف على الجزء السيتروليني الأول ذي الفاعلية المناعية في الفيلارغين Filarggin وهو عبارة عن بروتين موجود حصرياً في خلايا الظهارة الصدفية. ومن الملفت للنظر أن البروتين فيلارغين يشكل الهدف لأضداد الكيراتين والتي سبق ووصفت بنوعيتها العالية لمرض التهاب المفاصل الرثياني (6). وبما أن الفيلارغين غير متوفر في المفصل لذلك فإنه يمثل مستضداً كتفاعل تبادلي، بدلاً من أن يكون المركب الأساسي المستهدف من قبل أضداد البروتين السيتروليني. ان أحد المستضدات الملفتة للنظر هي الفيبرين وطليعته الفيبرينوجين، بعد أن أثبت وجود أشكال سيترولينية لهذه البروتينات في الأنسجة الزليلية لمرضى التهاب المفاصل الرثياني أو التهاب مفاصل أخرى. ويبدو أن الفيبرينوجين السيتروليني هو المستضد القاهر المستهدف في خلية B في معظم مرضى التهاب المفاصل الرثياني والمثبت مرضهم. وهنالك أيضا اهتمام ببروتين الهيكل الخلوي المسمى فيمنتين Vimentin، والموجود بأشكال سيترولينية متشابهة. من الممكن معايرة أضداد البروتين السيتروليني بطريقة الـ ELISA وباستعمال بروتينات سيترولينية كالفيلاغرين والفيمنتين أو الفيبرينوجين أو ببتيدات سيترولينية كمستضد. تتم المعايرة الأكثر انتشاراً في الوقت الحاضر باستعمال ببتيد سيتروليني حلقي (Cyclic citrullinated peptide (CCP))؛ ويشار إلى تركيز أضداد البروتين السيتروليني باستعمال هذه الطريقة لأضداد الببتيدات السيترولينية الحلقية (Anti-CCP antibodies) (ويوجد في الأسواق عدة مصنعين لها).
لقد ثبت في الوقت الحاضر، أن أضداد البروتين السيتروليني ACPA هي الأضداد النوعية والواصم المصلي لمرضى التهاب المفاصل الرثياني. علاوة على ذلك، وكما هو الحال مع العامل الرثياني، فإنها موجودة مع بداية مسار المرض وقد يسبق وجودها بدء الحالة السريرية. إن نوعية أضداد البروتين السيتروليني لمرض التهاب المفاصل الرثياني لا تقل عن 95% وتقارن حساسيتها بالعوامل الرثيانية وقد تبلغ الـ 75%. ومع ذلك وكما هو الحال مع العوامل الرثيانية فان الحساسية منخفضة في بداية مرض التهاب المفاصل الرثياني وتتراوح بين 40% و 55% (القائمة 3). ولقد أثبتت عدة دراسات وجود علاقة متبادلة يعتد بها بين وجود أضداد البروتين السيتروليني وتطور المرض شعاعياً (التلف العظمي). علاوة على ذلك فقد وجد توافق يعتد به بين أضداد البروتين السيتروليني ومرض التهاب المفاصل الرثياني المترافق مع الأليلات) HLA-DR" جزء المستضد المشترك ذات فاعلية مناعية") (الحاتمة المشتركةthe shared epitope). إن الأشخاص إيجابيي المصول لأضداد البروتين السيتروليني والحاملين لجزء المستضد المشترك ذي الفاعلية المناعية، هم بشكل خاص في وضع عالي الاختطار لنشؤ أشكال حادة من التهاب المفاصل الرثياني. وهكذا تُعد أضداد البروتين السيتروليني في الوقت الحاضر من أهم الأضداد كواصم للـ RA وتُعد معايرته ذات فائدة بشكل خاص للمرضى الذين يعانون من بدء التهاب مفصل في وقت لم يحقق فيه بعد المعايير السريرية الواصمة للمرض.
|
| أضداد RA33 الذاتية Anti-RA-33 autoantibodies |
|
تستهدف هذه الأضداد البروتين النووي الريبي مغاير المنشأ hnRNP)) A2 المرتبط بسلسلة متعددة في ما بعد الاستنساخ وتتضمن ربط ما قبل الرنا المرسال mRNA ونقله وترجمته. ومن الملفت للنظر التعبير المفرط للبروتين الريبي مغاير المنشأ في التهاب النسيج الزليلي (تركيز عالٍ) في حين وجد انخفاض كبير لهذا التعبير في المفصل الطبيعي (2).
|
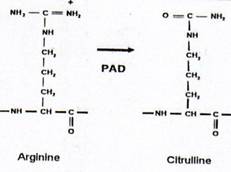
الشكل 1. نزع الأمين (سيترلنة) من الارجينين بواسطة الإنزيم أرجينين ثنائي الأمين (PAD) . تحويل الأرجينين إلى سيترولين إنزيمياً، هو تعديل ما بعد ترجمة المعلومات حيث يتم تبديل الشحنة الكهربائية والخصائص العضوية للبروتينات. تلاحظ هذه العملية بشكل عام في بروتينات الهيكل الخلوي كالكيراتين الخلوي والفيمنتين أو الفيلارغين وكذلك في بروتينات أخرى ويبدو أنها تمثل آلية ضبط عامة تحدث بشكل خاص خلال عملية موت الخلية المبرمج. |
| من الممكن معايرة أضداد RA33 باستعمال عتائد متوفرة تجارياً وبتطبيق مبدأ ELISA أو بطريقة التبصيم المناعي Immunoblotting الأكثر حساسية والمقتصر استعمالها على عدة مخابر تخصصية. لا توجد هذه الأضداد إلا عند حوالي ثلث مرضى التهاب المفاصل الرثياني، لذا تعد أقل شيوعاً من العامل الرثياني أو أضداد البروتين السيتروليني ولكن تكمن أهميتها أنه من النادر وجودها في التهابات مفصلية أخرى كالالتهاب العظمي المفصلي والتهاب مفصل ارتكاسي والتهاب الفقار أو التهاب المفاصل الصدافي (1، 2). ومن الممكن أيضاً وجود هذه الأضداد لدى مرضى داء الذأب الحمامي (SLE) أو لدى مرضى النسيج الضام، حيث نجد مشاركة مميزة بين هذه الالتهابات وأضداد Sm (anti-Sm) وأضداد RNP U1 (anti-RNP U1) غير المستهدفين في التقصي عن التهاب المفاصل الرثياني. تتصف أضداد RA33 بنوعية تصل إلى 90% في التهاب المفاصل الرثياني وهي أقل نوعية بالمقارنة مع نوعية أضداد البروتين السيتروليني و RA50 ولكنها أفضل بكثير مقارنة بتركيز عامل رثياني منخفض (RA<50 IU/ml). وكما هو الحال مع أضداد البروتين السيتروليني والعوامل الرثيانية فان أضداد RA33 موجودة أيضاً في المراحل الأولى من المرض (القائمة 3). وبسبب عدم وجود ترابط بين هذه الأضداد من جهة وأضداد البروتين السيتروليني والعوامل الرثيانية من جهة أخرى لذلك تعتبر أضداد RA33 واصماً جديداً ومفيداً خاصة عندما يكون ناتج معايرة أضداد البروتين السيتروليني والعوامل الرثيانية سلبياً. علاوة على ذلك فانه لا يوجد ترابط بين هذه الأضداد والحالة المتقدمة من المرض شعاعيا ولكن يبدو أنها مفيدة في تمييز المرضى ذوي التكهن الايجابي. |
أضداد أخرى
أضداد ضد الكولاجين
Anti-collagen antibodies |
|
توجد أضداد ضد الكولاجين II في السائل الزليلي لمرضى التهاب المفاصل الرثياني ومن المحتمل أن يكون منشؤها موضعياً ضمن المفصل. وعلى الرغم من إمكان تحريض حدوث التهاب مفصل رثياني في سلالات فئران قابلة له، وذلك بتمنيعها بالكولاجين II لكن يبدو أن البينة ضعيفة، لأن أضداد الكولاجين الذاتية تلعب دوراً في توليد التهاب المفاصل الرثياني عند الإنسان. لقد بينت تقارير عدة وجود أضداد ضد الكولاجين في مرضى التهاب المفصل الرثياني بنسبة تتراوح بين 30-70% ويبدو واضحاً ارتفاع تركيز هذه الأضداد في المراحل الأولى من المرض وتناقصها مع تقدم المرض. كذلك لم تجد معظم الدراسات ترابطاً يعتد به بين المناعة الذاتية للكولاجين II ودوام التهاب المفاصل الرثياني وفعاليته وحدته. وبسبب ما ذكر أعلاه وقلة نوعية هذه الأضداد لمرض التهاب المفاصل الرثياني فقد اعتبرت غير مفيدة كواصمات تشخيصية.
|
| أضداد بروتينات الصدمة الحرارية Antibodies to heat shock proteins |
عندما تتعرض الخلية لضائقة ما، فإنها تنتج بشكل مستحدث نوعاً من البروتينات تسمى "بروتينات الصدمة الحرارية" وهي تعمل على
حماية الخلايا من الأذية وخطر الموت المبكر. ومن المعلوم أن هذه البروتينات النبيلة تفرز حتى في الخلايا الجرثومية أيضاً. تعد هذه البروتينات من أكثر البروتينات المهيمنة مناعيا كمستضدات جرثومية. وهذا ما وجه إلى قدرتها على إحداث المرض بتفاعلات تبادلية تحدث في سياق الالتهابات. من الممكن إيجاد أضداد بروتينات الصدمة الحرارية، والتي يعبر عنها بشكل كبير في خلايا المفصل الملتهب، في عدد من الحالات المرضية وكذلك لدى الأصحاء أيضاً. ولا تظهر هذه الأضداد أية نوعية لأي مرض ما على الرغم من ارتفاع تركيزها في مصول مرضى الالتهاب الرثياني مقارنة مع مرضى الالتهاب العظمي، لذلك لا تعد أضداد بروتينات الصدمة الحرارية ذات قيمة تشخيصية. أما من ناحية أخرى فقد تساهم بروتينات الصدمة الحرارية في عملية توليد مرض التهاب المفاصل الرثياني بفعل تنشط خلايا T التي تستهدف هذه البروتينات. وما يبدو ملفتا للنظر وأن يكون ذا فائدة هو طبيعة نشاط خلايا T الذاتي لبروتينات الصدمة الحرارية (كمضاد التهاب و/ أو كمثبط مناعي) حيث ترافق وجود خلايا T الناشطة هذه لدى الأطفال الذين يعانون من التهاب مفصل فتوي مزمن مع إنذار أفضل. وبالاعتماد على هذه النتائج والملاحظات المستقاة من نماذج التهاب المفصل عند الحيوان فقد تم اقتراح بروتينات الصدمة الحرارية لتلعب دور مراقب للنظام المناعي في الأمراض الالتهابية.
|
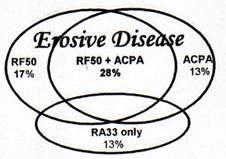
الشكل 2: الترافقات بين RF50 وأضداد البروتين السيتروليني وأضداد RA33 في المراحل الأولى لمرضى التهاب المفاصل الرثياني. تداخل يعتد به بين RF50 وأضداد البروتين السيتروليني (p<0.0001 )، ويتزامن حدوثهما في 28% من المرضى. وهكذا، وعلى الرغم من وجود RF50 في 45% من المرضى ووجود أضداد البروتين السيتروليني في 41% من المرضى، إلا أن 58% قد أظهروا نتائج ايجابية لـ RF50 أو لأضداد البروتين السيتروليني؛ إلا أن لدى هؤلاء المرضى نسبة عالية الخطورة لنشؤ مرض ائتكالي. لم يتم الكشف عن أضداد RA33 إلا في 13% من المرضى الذين لديهم مرض معتدل الشدة مع تكهن ايجابي بحدوث المرض. تم التكيف بهذه المعلومات من Nell et al (8). انظر أيضا القائمة 3. |
| أضداد الغلوكوز-6- فسفات ايزوميراز GPI))Antibodies of glucose-6-phosphate isomerase |
|
يعد الإنزيم غلوكوز-6- فسفات ايزوميراز عالي الثباتية وحال للسكر. وقد صُنف على أنه مستضد ذاتي مولد للالتهاب الرثياني في نموذج الفأر KRNxNOD حيث يحرض مستقبل الخلية الثانية المتحولة جينيا التهاب مفصل مشابهاً جداً لالتهاب المفصل عند الإنسان (11). زيادة على ذلك فقد تم تحريض التهاب مفصل بتمنيع سلالات فأر قابلة بالإنزيم غلوكوز-6- فسفات ايزوميراز (12). وعلى الرغم من وجود أضداد لهذا الإنزيم في المصول والسوائل المفصلية لمرضى التهاب المفاصل الرثياني إلا أن نسبة هذه الأضداد تبقى متدنية وغير نوعية لهذا المرضى. ولكن من الطريف وجود هذه الأضداد وبتواتر عالٍ في مرضى التهاب المفصل الرثياني الذين يعانون من المظاهر الخارجية للمفصل Felty`s syndrome وهذا ما قد يؤشر إلى قدرة هذه الأضداد لأن تلعب دوراً مرضياً عند الإنسان.
|
| القيمة التشخيصية للأضداد الذاتية |
|
لقد برهنت أضداد العامل الرثياني وأضداد البروتين السيتروليني وأضداد RA33 من بين الأضداد المذكورة عن قيمتها التشخيصية في مرض التهاب المفاصل الرثياني. ولقد حدد في هذه المقالة الحساسية العالية التي يلعبها كل من أضداد البروتين السيتروليني والعامل الرثياني RF50(RF>50 IU/ml) في مرض التهاب المفاصل الرثياني وكذلك القيمة التكهنية حيث أن وجودهما المبكر يترافق بشكل ملحوظ مع تطور التاكلات العظمية. ونشاهد من ناحية أخرى أن أضداد RA33 تترافق مع المرض المعتدل ذي الإنذار الحميد نسبياً. إن أضداد البروتين السيتروليني وRF50 يترابطان بقوة بينما تظهر أضداد RA33 بشكل مستقل (الشكل 2). لذلك ينصح بمعايرات متتالية لكل من أضداد العامل الرثياني (IgM) وأضداد البروتين السيتروليني وأضداد RA33 في التشخيص الروتيني كخطة فعالة بكلفة مقبولة.
|
| اعتبارات مرضية |
على الرغم من الأبحاث الكثيفة لسنين عديدة فانه لم يفهم بعد وبشكل كامل تفاعلات الأضداد الذاتية في نشؤ مرض التهاب المفاصل الرثياني. ان البحث عن مستضدات من الممكن أن تسبب أو تعدل المرض قد أدى إلى تعيين مستضدات ذاتية جديدة وإلى تصنيف الاستجابات المناعية الذاتية الموجهة لهذه المستضدات. فنجد بالنسبة للعوامل الرثيانية أن معظم هذه الاستجابات ليست نوعية بشكل خاص لالتهاب المفاصل الرثياني، وبالمقابل نجد أن أضداد البروتين السيتروليني موجودة تقريباً بشكل حصري في مرض التهاب المفاصل الرثياني وتشكل أفضل الأضداد الذاتية نوعية لهذا المرض والتي تم التعرف عليها حتى الآن. ومع ذلك فانه لم يفهم بعد بشكل كلي الدور المرضي لأضداد البروتين السيتروليني. ولقد تم الافتراض بأن الارتباط بالأماكن المستهدفة (الفبرينوجين على سبيل المثال) في النسيج المفصلي له تأثيرات في المرحلة ما قبل الحالة الالتهابية بسبب تشكل المركب المناعي وبالتالي حث خلايا B و T. ومن الأرجح أن لا تكون هذه الآلية إلا عملية حفاظ ذاتي مسؤولة عن الحالة المزمنة (4، 7). وبما أن ترسب الفبرين يحدث بعد بدء الالتهاب المفصلي فانه من الممكن أن تكون البروتينات السيترولينية قد تم حثُها مبدئيا بسبب وجود مستضد آخر كالفيمنتين السيتروليني ومن ثمَّ تتفاعل بشكل تبادلي مع الفبرين السيتروليني. أما بالنسبة للمستضدات المفصلية النوعية كالكولاجين (11) فإن العمليات الالتهابية والمخربة سوف تؤدي إلى تحرير كمية وافرة من مواد تنتهي بمناعة ذاتية في المريض عن طريق عملية البلعمة. ذلك أن الخلايا البالعة في هذه الحالة تقدم نفسها كمستضد خلوي. قد تنتج تفاعلات مناعة ذاتية لبروتينات أخرى بسبب التعبير المفرط فيه وتعديل ما بعد ترجمة المعلومات والتصنيع الشاذ لمستضدات أحدثت وتم الحفاظ عليها في بيئة ما قبل الحالة الالتهابية وضمن المفصل كما هو ملاحظ مع بروتينات الصدمة الحرارية أوhnRNP-A2 (RA33).
وهكذا وبالاعتماد على الخلفية البيئية (HLA-DR والسيتوكينات ... الخ( فإنه من الممكن أن ينشأ ازدياد في عدد تفاعلات المناعة الذاتية خلال مجرى المرض وبطريقة ما يساهم الجميع في فيزيولوجية مرض التهاب المفصل الرثياني.
طبعاً لا يمكن بعد الآن النظر إلى أضداد المناعة الذاتية جميعها على أنها مجرد ظاهرات عابرة ملفتة للنظر وأنه من الممكن الاستفادة من بعضها كواصمات تشخيصية.
أن تعيين مستضدات ذاتية جديدة وخاصة البروتينات السيترولينية وتخصيص العمليات الخلوية والجزيئية وتأسيس التفاعلات المناعية الذاتية المرضية ضدها قد قدم رؤية جديدة لعملية نشؤ التهاب المفصل الرثياني. ستؤدي بالنهاية عملية فهم تطور المرض إلى إمكانية نشوء مفاهيم جديدة للمعالجة وبالتالي قد يسمح بمعالجة المرض في مراحله الأولى بفعالية أكبر حيث أن فرص إيقاف عملية تطور المرض تكون في أوجها مما قد يؤدي إلى وضع المرض في حالة خمود كاملة.
|
| المراجع |
1-Steiner G. and Smolen J.
Arthritis Res Ther, 4 2: S1-5, 2002.
2-Steiner G. In: Hochberg MC, Silman AJ, Smolen JS, Weinblatt ME. and Weisman MH.
editors. Rheumatology.
3-Dorner T et al.
Curr Op Rheum, 16(3): 246-253, 2004.
4-Vossennar ER. and van Venrooij WJ.
Arthritis Res Ther, 6(3): 107-111, 2004.
5-Scott DL.
Rheumatology, 39: 124-129, 2000.
6-Youinou P. and Serre G.
Int Arch Allergy Immunol, 107(4): 508-518, 1995.
7-Vincent C et al.
Autoimmunity, 38(1): 17-24. 2005.
8-Nell V. et al.
Ann Rheum Dis, 64(12): 1731-1736, 2005.
9-Panayi GS. and Corrigall VM.
Autoimmunity Reviews, 5(2): 140-142, 2006.
10-Van Eden W.
Human Immunology, 67(6): 446-453, 2006.
11-Benoist C. and Mathis D.
Arthritis Res Ther, 2(2): 90-94, 2000.
12-Kamradt T & Schubert D.
Arthritis Res Ther, 7(1): 20-28, 2005.
|
| |
