| المجلد 4 ,
العدد 8
, ذو الحجة 1428 - كانون الثاني (يناير) 2008 |
| |
|
دراسة مخبرية لتبدلات الفاعلية الإنزيمية للـ cdc25C في سرطان المبيض
|
| Laboratory Study of the cdc25C Enzymatic Activity Alterations in Ovarian Cancer |
| د. رانيا توما* و د. ماتياس مونتنار** |
| Toma R. and Montenar M* |
| *كلية الطب، جامعة دمشق -**كلية الطب، جامعة السارلاند، ألمانيا |
| الملخص Abstract |
يعد سرطان المبيض واحداً من أكثر الأورام المسببة للوفيات بين الخباثات التي تصيب النساء، وتعتمد المعالجة الحالية على المعالجة الكيميائية المتكاملة مع المعالجة الإشعاعية وأكثر العوامل استخداماً في المعالجة الكيميائية هي الباكليتاكسيل paclitaxel والايرينوتويكان irinotecan والسيسبلاتين cisplatin.
هناك منظم للدورة الخلوية يدعى الفسفاتاز cdc25C له دور مهم في تحريض العبور من G2 إلى M (G2/M). علاوة على ذلك، فإن الأدوية القاتلة للخلايا المستخدمة لعلاج سرطان المبيض تستهدف مرحلة العبور G2/M ولذلك فقد قمنا بدراسة تبدلات فاعلية الـ cdc25C بتأثير الأدوية الباكليتاكسيل والجيمسيتابين gemcitabine، واستخدمنا في الدراسة سلاسل خلوية لسرطان المبيض هي OV-MZ-32 و OvBH-1 و OvCBM.
إن وظائف الـ cdc25C بالنقاط الحاجزية للدورة الخلوية يتم تنظيمها بعدة آليات منها تنظيم الفاعلية الإنزيمية. كان هناك تناقص واضح في فاعلية الفسفاتاز بعد معالجة خلايا OV-MZ-32 بالجيمسيتابين ولأن فاعلية الـ cdc25C الفسفاتازية ضرورية لتقدم الدورة الخلوية، فإن معطيات دراستنا الحالية تشير إلى أن معالجة هذه الخلايا السرطانية على الأقل بالجيمسيتابين قد أظهرت أن الجيمسيتابين يعمل كمثبط لمرحلة العبور G2/M للدورة الخلوية.
|
Ovarian cancer is one of the highest fatality tumours among the gynaecologic malignancies. Current treatment based on chemotherapy complemented with radiotherapy. The most frequent agents used in chemotherapy are paclitaxel, irinotecan and cisplatin.
One of cell cycle regulators, namely phosphatase cdc25C has an important role in promoting G2/M transition. Furthermore, the cytostatica which are used for the treatment of ovarian cancer target the G2/M transition and therefore the phosphatase enzymatic activity cdc25C alterations after treatment with gemcitabine and paclitaxel were analyzed, we used in this study ovarian cancer cell lines which
are OV-MZ-32, OvBH-1 and OvCBM.
The cell cycle checkpoint functions of cdc25C are regulated by many mechanisms, one by regulating its enzymatic activity. There was a considerable decrease in the phosphatase activity after treatment of OV-MZ-32 cells with gemcitabine. Since the cdc25C phosphatase, activity is necessary for the cell cycle progression the present data indicate that the gemcitabine treatment of at least these cells acts as an inhibitor of the G2/M transition of the cell cycle.
|
| المقدمة Introduction |
يعد سرطان المبيض المسؤول عن أعلى نسبة للوفيات (غالباً المرتبة الرابعة) من بين كل الإصابات الورمية عند النساء. وهو يمثل تحدياً جراحياً كبيراً حيث أنه يتطلب معالجات واسعة. وتعد السرطانات البشروية أكثر سرطانات المبيض شيوعاً وهي ذات إنذار سيء لأنها عادة لا عرضية؛ لذلك تراجع المريضات بمرحلة متقدمة في أكثر من ثلثي الحالات بعد أن تكون الانتقالات قد حدثت (6، 18، 25). تزداد الإصابة بسرطان المبيض مع تقدم العمر وإن خطر نشوئه خلال حياة المرأة هو 1/70 (6، 26، 19، 22). يبين الجدول 1 تصنيفاً لسرطانات المبيض (25).
تشـاهد أكـثر من 80% من سـرطانات
المبيض البشروية عند النساء ما بعد سن الإياس وذروة حدوث هذه الآفة هي بعمر 62 سنة، في حين أنه قبل عمر 45 سنة تعد هذه الأورام غير شائعة نسبياً. وتحدث بنسبة أقل من 1% من سرطانات المبيض البشروية قبل عمر 21 سنة، لم تحدد بعد قيمة وفائدة الواصمات الورمية والتصوير بالأمواج فوق الصوتية في استقصاء سرطانات المبيض البشروية بشكل واضح في الدراسات المستقبلية. لقد تبين أن معايرة CA125 يساهم في الكشف المبكر لسرطانات المبيض البشروية (8). وبغض النظر عن حساسية هذا الفحص، فإن CA125 يستطيع أن يكشف 50% من المريضات المصابات بالمرحلة I
كما أظهرت الدراسات أن معايرة مستويات CA125 في المصل تفيد في التفريق بين الكتل السليمة والكتل الخبيثة (12). |
الجدول 1: تصنيف سرطانات المبيض.
أولاً- سرطانات المبيض البشروية 90% |
المصلية 75% |
المخاطية 20% |
المشبهة ببطانة الرحم 2% |
رائق الخلايا 1% |
ورم برونر 1% |
البشروية المختلطة |
كارسينوما غير متمايزة |
ثانياً- سرطانات المبيض غير البشروية 10% |
خباثات الخلايا المنتشة |
خباثات الحبال الجنسية |
كارسينوما انتقالية |
الساركوما |
أورام خلايا شحمية |
|
يتضمن الانتقال من الطور 2G إلى طور الانقسام الخيطي أكثر التبدلات الشكلية والوظيفية عمقاً التي تحدث في حياة الخلية. يجري تنظيم الدخول للانقسام الخيطي بوساطة شبكة من الكينازات البروتينية والفسفاتازات المنبهة والمثبطة مسبوقة بتشكل المعقدcdk1-cyclinB1. حيث تعد الـ cdk1 (Cyclin dependent kinase) القوة الدافعة للدخول إلى طور الانقسام الخيطي، تتفعل الـ cdk1-cyclin B1 بوساطة فسفاتاز بروتينية تدعىcdc 25C خلال الطور الأول من الانقسام الخيطي. وهي التي تزيل جذر الفسفات المثبط وتطلق بدء الانتقال من الطورG2 إلى الطور M للانقسام الخيطي. يؤمن هذا بفضل شبكة من الفعاليات التثبيطية والتنشيطية تعطينا عدة طرق لإطالة أمد هذا الانتقال من G2 إلى M، فيما إذا اكتشفت الخلية وجود أذية بالكروموزومات لأن الانقسام في هذه الحالة يمكن أن يؤدي إلى موت الخلية أو السرطان (2، 3).
cdc25 هي بروتينات مراقبة الدورة الخلوية وهي إنزيمات فسفاتاز بروتينية تيروزينية، تنظم العبور من G2 إلى M، وهذه الإنزيمات عائلة مؤلفة من ثلاثة أنواع هي cdc25A، cdc25B وcdc25C (7، 10، 16، 29). يمكن التمييز فيما بينها حسب توضعها في الخلية وغزارتها وفاعليتها في الدارة الخلوية وماذا تستهدف من إنزيمات CDKs (9، 13). وهذه الإنزيمات متماثلة بنسبة 50% على مستوى سلسلة الأحماض الأمينية فيها (5، 13). ويتم تنظيم هذه الإنزيمات بالفسفرة التنبيهية والتثبيطية وتبدلات مواضعها داخل الخلوية (3، 27).
تلعب cdc25s دوراً مفتاحياً في تكامل الإشارات النوعية للمراقبة الحاجزية استجابة لأذية DNA والأذية بالأشعة المؤينة أو الـ U.V أو مثبطات التضاعف في مراحل الدورة الخلوية (13، 17).
تكون الـ cdc25C غير فعالة نسبياً أثناء طور الراحة لسببين الأول فسفرتها على الثمالة serine 216 مما يخلق مواقع ارتباط لبروتين يدعى 3-3- 14 (21، 23) تعدل التوضع تحت الخلوي لـ cdc25C، ويعد هذا إشارة هامة لاحتباس cdcd25C ضمن الهيولى (14، 15، 27، 28). ويبدو أن هذا الارتباط يثبط دخول الـ cdc25C للنواة، وبالتالي تراكمه في الهيولى.
تقوم السبل الكيميائية الحيوية المسماة بالنقطة الحاجزية أو حاجز التفتيش checkpoints بتنظيم العبور بين مراحل الدارة الخلوية (11، 24، 30). حيث تراقب النقاط الحاجزية المسؤولة عن ضرر DNA سلامة الخلايا، وتكبح الخلايا ذات الـ DNA المخرب أو المتضاعف جزئياً من التقدم ضمن الدارة في المراحل المتأخرة من الطور G1 أو G2 وذلك بطريقة تمكن إما من إصلاح التخرب الحاصل أو أن تخضع الخلية لنظام موت خلوي مبرمج عن طريق الانتحار الخلوي (1، 20).
تقوم المعالجة الحالية لسرطان المبيض على إشراك الجراحة مع المعالجة الكيميائية، يمكن استعمال إما المعالجة الكيماوية المفردة أو المشتركة. يمكن القول بشكل عام أن السرطانات المبيضية تختلف بحساسيتها تجاه المعالجة الكيميائية حتى لو تماثلت تشريحياً (4). بما أن الكارسينومات المبيضية تبدي اختلافات في الحساسية الدوائية، فقد عالجنا خلايا سرطان المبيض بالأدوية المطبقة عادة لكارسينوما المبيض وهي باكليتاكسيل وجيمسيتابين.
استناداً إلى ما ورد أعلاه فقد رأينا أنه من المفيد دراسة تبدلات الفاعلية الإنزيمية للـ cdc25C في خلايا سرطان المبيض تحت تأثير الأدوية القاتلة للخلايا.
|
| المواد والطرق Materials and Methods |
من أجل هذا النموذج من التحاليل استخدمنا سلالات خلوية لسرطان المبيض مؤسسة حديثاً هي OV-MZ-32، OvBH-1 وOvCBM. ونبين فيما يلي صفات هذه الخلايا ومصدرها (الجدول 2).
من أجل مقايسة الفاعلية الإنزيمية للـ cdc25C قمنا أولاً بترسيب الإنزيم بطريقة الترسيب المناعي للبروتين.
فبعد أن عالجنا الخلايا بالأدوية، قمنا باستخلاص خلاصة الخلايا مستخدمين دارئة الانحلال. ثم حضرنا مزيج السيفاروز 50%عن طريق مزج السيفاروز A البروتيني مع السيفاروز CL-4B وهو المزيج الخاص بالترسيب المناعي للبروتين، واستخدمنا الضد الموجه ضد النهاية الأمينية للـ cdc25C لهذه الغاية، وحصلنا على البروتينات النقية (إنزيم الـ cdc25C) لاستخدامه في تجربة مقايسة الفاعلية الإنزيمية.
بعد ترسيب البروتين أضفنا 20 مكمول من ثنائي سلفات الفلوروسيئين (FDP) و110 مكل من دارئة مقايسة الفسفاتاز (50 ممول تريس HCl pH, = 8.0 ,1 ممول DTT) إلى 40 مكل من البروتين المترسب. إن FDP سوف يتحول إلى FMP بتأثير الفسفاتاز وبعد ذلك يمكن قياس الفلوروسيئين بوساطة GeNios، لمعرفة فاعلية الفسفاتاز كل ثلاث دقائق خلال ساعتين في البروتين المناعي المترسب ((cdc25C قبل معالجة الخلايا بالأدوية القاتلة للخلية وبعدها.
بالإضافة لذلك تم إجراء اختبار توصيم ويسترن على عينات الترسيب المناعي وما قبل الترسيب المناعي باستخدام الضد النوعي للـ cdc25C (H-6)، للتأكد من كمية بروتين الـ cdc25C. تم تظهير العلامات باستخدام الضد الثانوي ضد الأرنب المقترن بـ POD وجملة Lumilight. استخدم الضد النوعي ضد GAPDH كمراقبة للتحميل.
|
الجدول 2: صفات ومصادر السلالات الخلوية لسرطان المبيض المستخدمة في الدراسة.
OV-MZ-32 |
serous human ovarian adenocarcinoma cell line, these cells carry a 13-bp deletion from codon 314 to codon 318 of the p53 gene |
I.B. Runnebaum, Freiburg |
OvBH-1 |
temperature-sensitive ovarian clear carcinoma cell line, with a wild type p53 |
A. Harlozinska-Szmyrka, J. Bar; Breslau |
OvCBM |
|
A. Harlozynska-Szmyrka, J. Bar, Breslau |
|
| النتائج والمناقشة Results and Discussion |
تكون الفاعلية الإنزيمية للـ cdc25C منخفضة خلال الطور البيني، وتزداد بحدة عند نقطة العبور G2/M، وإن تبدل هذه الفاعلية هو واحد من الآليات التي ينظم بها الـ cdc25C تقدم الدورة الخلوية. لذلك أردنا معرفة تأثير الأدوية على فاعلية الفسفاتاز للـ cdc25C. بعد زرع الخلايا 24 ساعة، عولجت بـ 100 نانومول جيمسيتابين، 100
نانومول باكليتاكسيل أو مزيج منهما لمدة 24 ساعة. تم جمع الخلايا واستخدام 2-3 ميلي غرام بروتين من الخلاصة الخلوية لترسيب الـ cdc25C، باستخدام الضد الموجّه ضد النهاية الأمينية؛ تم استخدام هذا الضد لأن منطقة تعرف الضد على السلسلة عديدة الببتيد للـ cdc25C بعيدة عن موقع الفاعلية. تم حل الراسب المناعي في دارئة اختبار الفسفاتاز، وقياس فاعلية الفسفاتاز لل cdc25C باستخدام جهاز Genios spectra fluor plus (الشكل 1).
تم بعدها حساب ميل ت الفاعلية بالدقيقة كما يظهر في الشكل 2.
كما يبدو في الأشكال 1 و 2، كانت فاعلية الـ cdc25C في عينات الترسيب المناعي أعلى منها في عينات ما قبل الترسيب المناعي مما يؤكد أن الاختبار كان بحق دقيقاً. أدت معالجة خلايا OV-MZ-32 لمدة 24 ساعة بـ 100 نانومول جيمسيتابين إلى تناقص فاعلية الفسفاتاز للـ cdc25C خلال 120 دقيقة من القياس، بينما لم يكن للباكليتاكسيل أي تأثير، لم يعط المزيج من 100 نانومول جيمسيتابين و 100 نانومول باكليتاكسيل تأثيراً إضافياً مقارنة بالجيمسيتابين لوحده. لم تؤثر معالجة خلايا OvBH-1 بـ 100 نانومول جيمسيتابين، 100 نانومول باكليتاكسيل أو المزيج منهما لمدة 24 ساعة على فاعلية الفسفاتاز للـ cdc25C. ازدادت
فاعلية الفسفاتاز للـ cdc25C في خلايا OvCBM بعد معالجتها لمدة 24 ساعة بـ 100 نانومول جيمسيتابين، بينما لوحظ تناقص في الفاعلية بعد معالجة الخلايا بـ 100 نانومول باكليتاكسيل. أدت المعالجة بمزيج الدوائين أيضاً إلى تناقص الفاعلية، ولكن كان
التأثير أقل من الباكليتاكسيل لوحده.
كما يبدو في الشكل 3، كانت كمية بروتين الـ cdc25C في عينات الترسيب المناعي تقريبا متساوية، ولم يتواجد البروتين في عينات ما قبل الترسيب المناعي.
يتضح لنا من النتائج أعلاه أن معالجة الخلايا OV-MZ-32 بالباكليتاكسيل لوحده لم يكن له تأثير على فاعلية cdc25C، لكن عندما عولجت هذه الخلايا بالجيمسيتابين أو بالاشـتراك بين الباكليتاكسيل والجيمسيتابين سوياً فإن فاعلية الـ cdc25C قد تناقصت بشكل واضح، أما فاعلية cdc25C في الخلايا OvBH-1 فلم يطرأ عليها أي تبدل بعد المعالجة، في حين أنه في الخلايا OvCBM ازدادت فاعلية الـ cdc25C بعد معالجتها بالجيمسيتابين وتناقصت بعد معالجتها بالباكليتاكسيل أو بكلي الدوائيين معاً.
من الواضح أن هناك أكثر من آلية واحـدة لتنظيم فاعلية cdc25C ومنها: فسفرة الـ cdc25C عند السيرين 216 بوساطة كيناز النقطة الحاجزية ChK1، وارتباط الـ cdc25C بالـ p53، والتقويض السريع له عند المرحلة M من الدورة الخلوية. يمكن القول من خلال هذه النتائج أن الجيمسيتابين كعامل علاجي جديد وفعال مقترح لمعالجة سرطان المبيض يؤدي بعد علاجه لخلايا سرطان المبيض إلى تخفيض فاعلية الـ cdc25C وتثبيط مرحلة العبور G2/M مما يقود بالتالي إلى إيقاف الدورة الخلوية وحدوث الموت الخلوي المبرمج في الخلايا السرطانية.
|
|
|
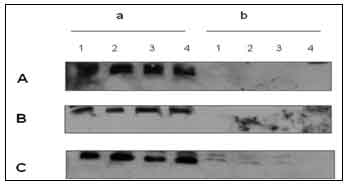
الشكل 3: اختبار توصيم ويسترن على عينات الترسيب المناعي (a) ما قبل الترسيب المناعي (b) للـ cdc25C كمراقبة لفاعلية الفسفاتاز. عولجت الخلايا بـ 100 نانومول جيمسيتابين (السلسلة 2)، 100 نانومول باكليتاكسيل (السلسلة 3) أو المزيج منهما (السلسلة 4)؛ الخلايا الغير معالجة (السلسلة 1). تم ترسيب الـ cdc25C بالضد ضد النهاية الأمينية، ثم التأكد من كمية الـ cdc25C باختبار توصيم ويسترن واستخدام الضد النوعي للـ cdc25C (H-6). (A) OV-MZ-32؛ (B) OvBH-1؛ (C) OvCBM.
|
| المراجع References |
1-Arellano M. and Moreno S.
Regulation of cdk/cyclin complexes during the cell cycle.
Int. J. Biochem. Cell Biol, 29, 4, 1997.
2-Barth H; Hoffmann I; Klein S; Kaszkin M; Richards J. and Kinzel V.
Role of cdc25C phosphatase in the immediate G2 delay induced by the exogenous factors epidermal growth factor and phorbolestes.
J. of cellular physio. 168: 1996.
3-Bureik M; Rief N; Drescher R; jungbluth A; Montenarh M. and Wagner P.
An additional transcript of the cdc25C gene from A431 cells encodes a functional protein.
Int. J. oncology, 17, 1251-1258, 2000.
4-Buttitta F; Marchetti A; Gadducci A. et al.
p53 alterations as predictive of chemoresistance and aggressiveness in ovarian carcinomas: a molecular and immunohistochemical study.
Br. J. Cancer. 75 (2), 1997.
5-Cans C; Ducommun B. and Baldin V.
Proteasome-dependent degradation of human cdc25B phosphatase.
Molecular Biology reports, 26, 1999.
6-Clark TG; Stewart ME; Altman DG; Gabra H. and Smyth JF.
A prognostic model for ovarian cancer.
Br J Cancer. 28, 85 (7), 2001.
7-Eckstein J.W.
cdc25 as a potential target of anticancer agents.
Inves. New Drugs, 18, 2000.
8-Einhorn N; Sjovall K; Knapp RC; Hall P; Scully RE; Bast RC Jr. et al.
A prospective evaluation of serum
CA125 levels for early detection of ovarian cancer.
Obstet Gynecol, 80: 14-18, 1992.
9-Ferguson AM; White LS; Denovan PJ. and Piwnica-Worms H.
Normal cell cycle and checkpoint responses in mice and cell lacking cdc25B and cdc25C protein phosphatases.
Mol Cell Boil; 25 (7), 2005.
10-Galaktionor K; Lee A.K. et al.
cdc25 phosphatase as potential Human oncogenes.
Scince, 269, 1995.
11-Graves PR; Yu L; Schwarz JK. et al.
The Chk1 protein kinase and the cdc25C regulatory pathways are targets of the anticancer agent UCN-01.
J. Boil. Chem. 25; 275(8), 2000.
12-Hacker NF; Berek JS. and Lagasse LD.
Gastrointestinal operations in gynecologic oncology.
In: Knapp RE, Berkowitz RS, eds. Gynecologic Oncology. 2nd ed. New York: McGraw-Hill, 361-375, 1993.
13-Hoffman Ingrid.
The role of cdc25 phosphatase in cell cycle checkpoints.
Protoplasma, 211, 2000.
14-Hutchins J.R.A; Hughes M. and Clarke P.R.
Substrate specificity determinants of the checkpoint protein kinase Chk1. FEBS letters, 466, 2000.
15-Kino T; Gragerov A; Valentin A. et al.
Vpr protein of human immunodeficiency virus type 1 binds to 14-3-3 proteins and facilitates complex formation with cdc25C: implications for cell cycle arrest.
J virol. 79(5), 2005.
16-Krause K; Hugwitz U; Wasner M. et al.
Expression of the cell cycle phosphatase cdc25C in down-regulated by the tumor suppressor protein P53 but not by P73.
Bioch. And biophys. Res. Com. 284, 2001.
17-Kristjansdottir K. and Rudolph J.
cdc25 phosphatase and cancer. Chemistry and Biology, 11, 2004.
18-MoBus V; Gerhanzg C.D; Press U; Moll R. et al.
Morphological, immunohisto-chemical and biochemical characterization of 6 newly established Human ovarian carcinoma cell lines.
Int. J. Cancer: 52, 76-84, 1992.
19-Moss C. and Kaye SB.
Ovarian cancer; progress and continuing controversies in management.
Enz J cancer, 38(13), 2002.
20-Motoyama N. and Naka K.
DNA damage tumor suppressor gene and genomic instability.
Current opinion in Genetics and development. 14, 2004.
21-Niida H; Banerjee B. et al.
Specific role of Chk1 phosphorylations in cell survival and checkpoint activation.
Mol. Cell Biol; 22, 2007.
22-Parker SL; Tong T; Bolden S. and Wingo PA.
Cancer statistics, 1996. CA-Cancer J Clin 65: 5-27, 1996.
23-Peng C.Y; Graves P.R. et al.
Mitotic and G2 checkpoint control: regulation of 14-3-3 protein binding by phosphorylation of cdc25C on serine-216.
Science. 277, 1997.
24-Roshak A.K; Capper E.A. et al.
The human polo-like kinase, PLK, regulates cdc2/cyclin B through phosphorylation and activation of the cdc25C phosphatase cellular.
Singnalling, 12, 2000.
25-Saga Y; Suzuka M; Machida S. et al.
Establishment of a new cell line (TAYA) of clear cell adenocorcinoma of the ovary and its radiosensitivity.
Oncology, 62. 2002.
26-Schuijer M. and Berns E.M.J.J.T
P53 and ovarian cancer.
Human mutation, 21, 2003.
27-Schwindling SL; Noll A; Montenarh M. and G?tz C.
Mutation of a Ck2 phosphorylation site in cdc25C impairs importin ?\? binding and results in cytoplasmic retention.
Oncogene, 23, 2004.
28-Stavidi E.S. et al.
Substitutions that compromise the ionizing radiation induced association of p53 with 14-3-3 proteins also compromise the ability of p53 to induce cell cycle arrest.
Cancer Res; 61(19), 2001.
29-St Clair S; Goino L; Varmeh-Ziaie S; Resnick-Silverman L; Liu WJ; Padi A; Dastidar J; DaCosta A; Mattia M. and Manfredi JJ.
DNA damage-induced downregulation of cdc25c is mediated by p53 via two independent mechanisms: one involves direct binding to the cdc25C promoter.
Mol. cell. 3; 16(5): 725-736, 2004.
30-Suganuma M; Kawabe T; Hori H. et al.
Sensitization of cancer cells to DNA damage-induced cell cycle G2 checkpoint abrogation.
Cancer Research, 59, 5887-5891, 1999.
|
| |
| المجلد 4 ,
العدد 8
, ذو الحجة 1428 - كانون الثاني (يناير) 2008 |
|
|
|
