| المجلد 4 ,
العدد 9
، ربيع الأول 1429 – نيسان (إبريل) 2008 |
| |
| نفاد الخلايا البائية: معالجة جديدة لأمراض المناعة الذاتية |
| B cell Depletion: a Novel Therapy for Autoimmune Disease |
| د. سمعان سمعان و أ.د. اميل شاهين |
| Samaan S. and Chahine E. |
| كلية الصيدلة – جامعة دمـشق |
| تنجم أمراض المناعة الذاتية عن فقدان التحمل الفيزيولوجي physiological tolerance لمكونات الذات self components؛ إذ يعتبر جهاز المناعة، المستضدات الذاتية auto antigens غريبةً مما يقدح آليات رد عدة تتواسطها بصورة خاصة اللمفاويات التائية T lymphocytes. بالمعنى الواسع، تظل هذه النظرية مقبولة ومقنعة، إلا أن أعمالاً بحثية حديثة نسبياً؛ سلطت الضوء على دورٍ محتمل تلعبه اللمفاويات البائية B lymphocytes في الفيزيولوجيا المرضية physiopathology لأمراض المناعة الذاتية ومن هنا تأتي فكرة إيجاد معالجات جديدة مضادة للمفاويات البائية. |
| المناعة الذاتية واللمفاويات البائية: رؤية جديدة Autoimmunity and B lymphocytes: New Vision |
| بينت الدراسـات وجود اسـتعداد جيـني
genetic susceptibility عند بعض الأفراد للإصابة بأمراض المناعة الذاتية وهو أمر يتعلق بتبدلات variations في الجينات المكودة للجزيئات الناظمة لعمل الجملة المناعية كالسيتوكيناتcytokines ومكونات المتممة complement components وصولاً إلى جزيئات معقد التوافق النسيجي الكبيرmajor histocomptability complex (MHC) ومثالها شيوع الإصابة بالتهاب المفاصل الروماتويدي rheumatoid arthritis عند الأفراد ذوي النمط HLA-DR4 [27]. إلا إن عدم تطابق نسب احتمال إصابة التوائم الحقيقية بأمراض المناعة الذاتية يبرز دور عوامل البيئة في سببيات etiology هذه الأمراض لذا تركزت جهود الباحثين، خلال سنوات، لكشف ماهية العوامل القادحة triggering factors فظهرت العدواءات الفيروسية viral infections كعوامل محتملة [5] وكان أن تبين تورط اللمفاويات البائية في أمراض المناعة الذاتية المتواسطة بالأضداد antibodies mediated AID وذلك لأنها خلايا مقدمة للمستضدات Antigen presenting cells مما يعني أنها قد تسهم في كسر تحمل الذات عبر تنشيط اللمفاويات التائية المتجاوبة مع الذات auto reactive T cells [21] والتي أفلتت من عملية الانتقاء السلبي negative selection، في غدة التوتة thymus gland، الآلية الكفيلة بحذف كل اللمفاويات التائية التي تبدي مستقبلاتها ألفةً لمستضدات الذات. إذن، ترسل اللمفاويات البائية إشارات signals إلى التائية والتي بدورها تسعفها helping عبر إيتاء السيتوكينات cytokines delivery وربائط السطوح الخلوية cell-surface ligands. فهذا التآثرinteraction ، يمثل عروة تلقيم راجع إيجابي positive-feedback loop [12] من منظور أن اللمفاوية البائية تنشط التائية وهذه الأخيرة تعود لتحفز نضج وتمايز الأولى (الشكل 1). كما أن اللمفاويات البائية طلائع البلازماويات plasmocyte precursors المنتجة للأضداد الذاتية الممرضة pathogenic auto antibodies والتي كان دورها قد تبين، منذ زمن، في أمراض المناعة الذاتية النوعية بعضو معين organ specific AID كما في بعض حالات قلة الصفيحات thrombocytopenia حيث ثبت أن الأضداد الذاتية تحرض تدمير الصفيحات [31]. وحتى عقدين من اليوم، لم يقترح أحد أن للمفاويات البائية دوراً في أمراض المناعة الذاتية الجهازية systemic AID إلى أن قدم أطباء الروماتزم rheumatologists ، عبر مشاهداتهم السريرية، أدلةً لا تبرئها.
أوضح Maccioni استناداً إلى أعمال Mathis، أن سلالات من فئران غير بدينة مصابة بالسكري non obese diabetic mice (NOD) تُطَور تلقائياً spontaneously التهاب مفاصل روماتويدي [18] وأن حقن مصول sera هذه الفئران في حيوانات التجربة كفيل بقدح التهاب المفاصل عندها؛ مما يقترح أن اللمفاويات البائية تنتج، في شروط معينة، أضداداً ذاتية ممرضة ذات وظائف التهابية قوية. إلا أن مزيداً من الاستقصاء ما يزال مطلوباً لتبيان الدور الحقيقي للمفاويات البائية في أمراض المناعة الذاتية عبر ما تخلقه من أضداد، فعدا عن العوامل الروماتويدية Rheumatoid factors، أضداد الدنا الذاتية anti-DNA auto antibodiesوأضداد النوى الذاتية anti-nuclear auto antibodies لا نستبعد وجود أضداد ذاتية أخرى، غير محددة الهوية بعد، تمتلك القدرة على تفعيل آليات مناعية ممرضة. ذاك في ظل قناعة أن الأضداد الذاتية ملازمةٌ لأمراض المناعة الذاتية. وربما يكون أحد البراهين على ذلك، دراسة Chan على فأرة MRL/lpr المعدلة جينياً لتنتج لمفاوياتها البائية أضداداً ذاتية متورطة في قدح الذئبة lupus عند هذه الفأرة [10].
|
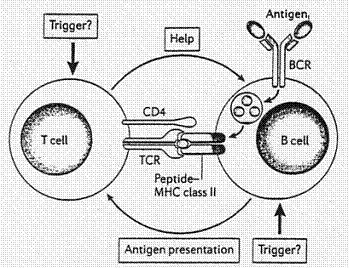 الشكل 1: عروة تآثرات اللمفاوية البائية والتائية: تنشيط متبادل.
الشكل 1: عروة تآثرات اللمفاوية البائية والتائية: تنشيط متبادل. |
| التاريخ الطبيعي للمفاوية البائية B-cell natural history |
|
تنشأ اللمفاوية البائية من الخلية الجذعية متعددة القدرات pluripotent stem cell في نقي العظام وتخضع لمراحل عدة من النضج والتنشيط مهاجرةً عبر الدم إلى المناطق حول الجريبية perifollicular ومراكز الإنتاش والذاكرة germinal and memory centers في العقد اللمفية lymph nodes أو الطحال، لتعود مجدداً إلى نقي العظام منهيةً حياتها كبلازماوية ناضجة مفرزة للأضداد antibody secreting plasmocyte[8]. تشكل اللمفاويات البائية حوالي 5 إلى 15 بالمائة من لمفاويات الدم الجائل وتحديدها سهل عبر ما تحمله على سطوحها من جزيئات صفوف التمايز class of differentiation (الشكل 2) أو جزيئات الغلوبولينات المناعية immunoglobulin molecules كجزيئات IgM التي تزواج سلاسل بروتينية سكرية glycoprotein chains مشكلةً معقداً يمثل مستقبلاً للمستضدات antigens receptors يعرف بمعقد الخلايا البائية المستقبل للمستضدات B cell antigen Receptor (BCR). تتأتى نوعية هذه المستقبلات من عمليات إعادة الترتيب جينية genetic rearrangement، تطال الجينات المكودة للسلاسل الثقيلة والخفيفة heavy and light chains للغلوبولينات المناعية، في مرحلة الخلية البائية غير الناضجة immature B-cell، فيكون
لكل نسيلة clone من اللمفاويات البائية نوعية وحيد ومتفردة one and unique specificity وهي عمليات محكومة بشكل وثيق بوجود خلايا سدوية لا لمفاوية non lymphoid stromal cells تقدم للمفاوية ما يلزمها من عوامل نمو لا غنىً عنها للتمايز، سواءً في كبد الجنين أو نقي العظام عند البالغ. ولكونها عملياتٍ تبادلية وعشوائية alternative and random نجد أن قانون الاحتمال يفرض، وببساطة، أن تتولد نسائل ذات مستقبلات شديدة الألفة لمستضدات الذات.
|
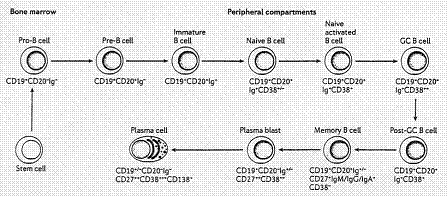
الشكل 2: تطور اللمفاوية البائية: مراحل النضج تبعاً للمواضع التشريحية وواصمات السطوح الخلوية.
|
| اللمفاويات البائية وتحمل الذات B-cell and self tolerance |
|
يمكن للعضوية أن تتخلص من اللمفاويات البائية المتجاوبة مع الذات في مراحل عدة من أطوار تمايزها عبر مرورها بنقاط فحص checkpoints أولها في نقي العظام، إذ تعاني اللمفاويات البائية تغييراً في نوعية مستقبلاتها (BCR) ما شأنه أن يقلل من ألفتها لمستضدات الذات [27]. فإن أفلتت وتمكنت من الوصول إلى الدم المحيطي؛ تؤول إلى حالة من العطالة anergy مما يمكن حذفها بسرعة وفاعلية. إلا أن ما يتبقى منها بعد عمليات الانتقاء السلبي هذه، يهاجر مع اللمفاويات البائية الطبيعية إلى أعشاشها الطبيعية حيث تُضمن البُقيا survival عبر إيتاء إشارات تتواسطها ربائط السطوح الخلوية وعوامل ذوابة soluble factors كالعامل المنشط للخلايا البائية من عائلة العوامل الناخرة للورم B-cell activating factor from TNF family (BAFF) [12] وهو سيتوكين ذو سويات مصلية مرتفعة عند حوالي %25 من مرضى الذئبة [19]، ومن الجدير بالذكر أن تأثيراته لا تنحصر باللمفاويات البائية فقط، بل تتعداها إلى التائية إذ تبين أنه يسرع من تمايزها إلى خلايا تائية مستفعلة effector T-cell، يرفع في نواها التعبير عن الجين الورمي Bcl2 المضاد للاستموات apoptosis [22] ويزيد من إنتاجها للسيتوكينات الالتهابية inflammatory cytokines مما قد يكون سبباً في كسر تحمل الذات [15]. ومن النظريات في هذا المجال، أن ذهب بعضهم للقول أن تراكم دنا الخلايا المستموتة apoptotic cell derived DNA ينشط الخلايا المتغصنة شبه المصورية plasmacytoid dendritic cells (pDCs) بتواسط مستقبلات TLR9 محرضاً نضجها وتآثرها في عرى تنشيط اللمفاويات البائية والتائية [20] إذ أن الارتباط المشارك co-ligation لهذه المستقبلات مع BCR كفيل بقدح إشارات إيجابية للبقيا والتمايز [16] وأخيراً، أذكر أن TLR9 متورط في أشكال وخيمة severe forms من الذئبة الجهازية عند بعض نماذج التجربة الفأرية [12].
|
| استهداف جزيئات CD20 CD20 molecules targeting |
جاء اختيار صف التمايز CD20 هدفاً منطقياً، في المعالجات المضادة لللمفاويات البائية، كونه واصماً marker شديد النوعية لها ويُعبر عنه بكثافة، نسبياً، على سطوحها، بدءاً من طليعة الخلايا البائية pre-B وحتى مراحل نضجها المتأخر كما أنه يغيب عن سطوح الخلايا الجذعية المولدة للدم hematopoietic stem cells. نعرف، منذ ثمانينات القرن الماضي، أن لطليعة رنا مرسال Pre-mRNA الجين MS4A1 (الفرد الأول من تحت عائلة الجزيئات المجتازة للغشاء في أربع مجالات Membrane-Spanning 4 domains subfamily A, member 1 ) المكود للجزيئة CD20 (والتي تعرف أيضاً بالمستضد B1) ثلاثة أنماط من التضفير التبادلي alternative splicing تفضي إلى ثلاثة رنوات مرسالة مختلفة إلا أنها تترجم جميعها إلى البروتين نفسه مما يوحي بمصونيته [29] فهو بروتين غير مغلكز non glycosylated ذيله داخل الخلوي غني بثمالات السيرين والثريونين وبمواضع فسفرة phosphorylation عدة تتآثر وكينازات kinases من عائلة src [11] ونظراً لبنيته المشابهة للأقنية الشاردية ion channel، يحتمل أنه يلعب دوراً في تنظيم الدفق الكلسي عبر الغشاء الخلوي للمفاوية البائية مما يعني تحكمه بصورة غير مباشرة بالدارة الخلوية cell cycle إذ أن ارتفاع تركيز الكالسيوم داخل الخلية يعجل عبورها من طور الراحة G0 إلى الطور G1 [28].
انتقلت فكـرة نـفاد اللمفاويـات البائية من
النظرية إلى التطبيق في عام 1997، فـكان
Rituximab (MabThera; F. Hoffman-La Roche Ltd. and Rituxan; Genetech Inc.) الضد الخيمري أحادي النسيلةchimeric monoclonal antibody المضاد لجزيئات CD20 أول العوامل النافدة depleting agents والذي كانت إدارة الغذاء والدواء الأمريكية FDA قد رخصت استعماله لتدبير اللمفوما البائية الجريبية اللا هودجكينية follicular non Hodgkin B-cell lymphoma. أما في إطار المناعة الذاتية؛ فقد كانت أولى استخداماته عند مرضى التهاب المفاصل الروماتويدي المعند على المعالجة بأضداد العامل الناخر للورم anti-TNF therapy [30].
|
| آليات التأثير Mechanism of action |
تتألف جزئية الضد Rituximab من المناطق المتغايرة variable regions لضد فأري murine antibody مضاد لجزيئة CD20 البشرية، مصهورة fused مع الشدفة الثابتة Fc لسلسلة ثقيلة بشرية human heavy chain من نمط IgG1 مزاوجةٍ لسلسلة خفيفة كابا k. تم انتقاء الجزء Fc من IgG1 لقدرته على تثبيت المتممة complement fixation وقدح آليات السمية الخلوية المعتمدة على الأضداد ADCC (Antibody Dependant Cell mediated Cytotoxicity) وبصورة مبسطة، يمكن أن نحصي ثلاث آليات تأثير (الشكل 3):
أولاً: الاستموات apoptosis، إذ لا يحرض Rituximab الاستموات عبر سبيل العامل الناخر للورم أو سبيل تآثرات Fas/Fas L؛ إنما عبر سبيل متقدري mitochondrial way بتواسط السيتوكروم cytochrome c وتنشيط إنزيمات الكاسباز caspase 3 [26] أما في الزروعات الخلوية للمفوما بوركيت Burkitt lymphoma، فقد تبين أنه يخفض سويات التعبير عن Bcl2 عبر التصنيع الموضعي للانترلوكين العاشر IL-10 [2].
ثانياً، السمية الخلوية المعتمدة على المتممة (CDC) Complement-Dependant Cytotoxicity وذاك ثابت في المختبر in vitro [6] عبر انحلال الخلية cell lysis من خلال تفعيل المتممة بالسبيل التقليدي المحرض من الجزء Fc للضد؛ أما في الحي in vivo، فما تزال الأمور مثار جدل سيّما وأن ارتباطها والحالة السريرية غير واضح فضلاً عن الآثار غير المرغوبة الناجمة عن تفعيل المتممة وتعقيد آلياتها الناظمة (مستقبلات السطوح الخلوية، العوامل المسرعة accelerating factors، بروتينات كيناز والطوف الشحمي lipid raft) [11].
أخيراً، السمية الخلوية المعتمدة على الأضداد ADCC، والتي تتواسطها عدة أنماط خلوية كالوحيدات، البالعات الكبيرة، الخلايا القاتلة الطبيعية NK cells وحتى عديدات النوى عبر مستقبلات خاصة على سـطوحه تبدي
ألفة عالية للشدفة Fc من الضد. ومن الجدير بالذكر هنا، أن التبدلات الفردانية individual variations لهذه المستقبلات قد يلعب الدور الأساس في تعديل فاعلية المعالجة [4] إضافة إلى البيئة السيتوكينية (IL-2، IL-12، IL-15) التي بإمكانها زيادة الفاعلية السامة للخلايا. وهناك آليات أخرى اقترحت لكن لا أدلة كافية تدعمها لذا أُعرض عن ذكرها.
|
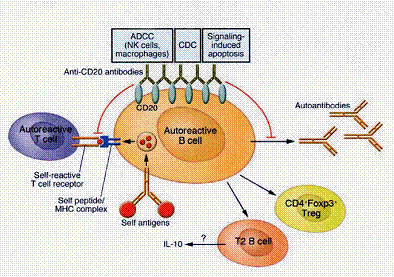
الشكل 3 : آليات تأثير أضداد CD20 على اللمفاوية البائية وفرضية Hu : تخلق جمهرات من لمفاويات منظمة بائية وتائية.
|
| تطبيقات Applications |
جاء Rituximab، محرك التقدم الحاصل في مجال المعالجات المضادة لللمفاويات البائية، ثمرة دراساتٍ في علوم الأورام والدمويات ومؤخراً الروماتزم، فقد أظهر نجاعته في تدبير بعض أمراض المناعة الذاتية عبر تخليص العضوية من نسائل اللمفاوية البائية المتجاوبة مع الذات عادماً دورها كخلية مقدمة للمستضدات؛ والأهم، أنه يقطع حلقة تضاعف الجواب المناعي مخفضاً إنتاج الأضداد الذاتية الممرضة وقد يعود ذلك لاستهدافه بلازماوياتٍ إيجابية CD20 تختص حصرياً بإنتاج IgM (العامل الروماتويدي كما سيمر لاحقاً)، إذ أن أكثر من %20 من البلازماويات التي عزلت من دماء بالغين أصحاء تعبر بشكل متغاير عن الجزيئة CD20 على سطوحها ولعل هذه الجمهرة الصغيرة من اللمفاويات المتمايزة تنتمي إلى خلايا أقل نضجاً كأرومات البلازماويات plasmoblastes [26].
أخص الجزء الأخير من المقال؛ للحديث عن آخر المقاربات التجريبية لمعالجة الداء السكريّ من النمط الأول، نموذج أمراض المناعة الذاتية المتواسطة باللمفاويات البائية والتائية معاً وبعض أهم تطبيقات Rituximab السريرية في تدبير أمراض المناعة الذاتية كالتهاب الحويضة والكلية الغشائي والتهاب المفاصل الروماتويدي.
|
| الداء السكريّ من النمط الأول Type 1 diabetes |
من الثابت اليوم، أنه مرض مناعي ذاتي بان فيه الدور المركزي لللمفاويات التائية التي عزلت من ارتشاحات وحيدة النوى mononuclear infiltrates، من جزر بنكرياسية لبشر وفئران مصابين بالداء السكري، لكنها لم تكن وحدها بل رافقتها بالعات وخلايا NK ولمفاويات بائية على السواء [3] إلا أن إثبات دور هذه الأخيرة في آلية المرض الجزيئية لم يكن بالسهولة ذاتها. نعلم بوجود أضداد ذاتية نوعية بجزر لانغرهانس Langerhans islets specific antibodies تستهدف مستضدات ذاتية رئيسية كإنزيم Glutamic acid decarboxylase (GAD) والأنسولين Insulin وهي واصمات تشخيصية ممتازة فقد أوضح Greeley أنها تلعب دوراً في تطور المرض عند فئران NOD لكنه، وبالمقابل، لاحظ أن الداء السكري لا يمكن قدحه عند الفئران عبر نقل هذه الأضداد [14].
قدم Hu اقتراحاً مثيراً للاهتمام، بنتيجة دراسته على سلالة من فأرة NOD معدلة جينياً لتعبر عن جزيئة CD20 البشرية، بأن المعالجة بأضداد anti-CD20 تحفز تخلّق جمهرات من لمفاويات منظمة تائية CD4+CD25+Foxp3+ Treg وبائية type 2 B cell (الشكل 3) ربما تغير بعض الآليات التنظيمية للداء السكري[9] إذ أن اللمفاوية البائية المنظمة من النمط الثاني type 2 B cell تنتج الأنترلوكين العاشر IL-10 والذي من شأنه أن يخفف شدة مرض المناعة الذاتية. إلا أن ما يبدو منطقياً أكثر، هو توليف معالجات جديدة نافدة للمفاويات التائية والبائية معاً ومن الجدير بالذكر هنا أن أعمالاً سريرية تجريبية clinical experimental trials قيد التقييم حالياً [32].
|
| التهاب الحويضة والكلية الغشائي مجهول السببIdiopathic Membranous Glomerulonephritis |
نشرت الجمعية الأمريكية لعلم الكلى nephrology عام 2003، نتائج دراسة رائدة قيمت فاعلية Rituximab في تدبير التهاب الحويضة والكلية الغشائي مجهول السبب [24]، فقد أخضع ثمانية مرضى لأربع جرعات أسبوعية (375 ملغ/م2) فكان أن انخفضت بنتيجتها البيلة البروتينية proteinuria بمقدار %66 خلال سنة وسجل ارتفاع الألبومين albumin بمقدار %41. كما لوحظت حالتا شفاء تامتان، إلا أنّ محدودية هذه الدراسة تكمن في عدد المرضى القليل وقصر مدة متابعتهم نسبياً، كما يعيبها عدم تبيان منافع Rituximab الزائدة عند إشراكه مع كابحات المناعة immunosupressors العلاج التقليدي لهذا الداء (فعل تآزري مع القشرانياتcorticoids مثلاً).
وقد وجد Rituximab مكانةً في تدبير أدواء الكلية الثانوية secondary nephrosis (مضاعفات الذئبة) إذ أنّ إيتاءه مع cyclophosphamide ضبط تظاهرات الذئبة عند خمسٍ من الحالات المدروسة بدليل تراجع البيلة البروتينية وانخفاض سويات أضداد الدنا المصلية serum anti-DNA antibodies [4]. بالمختصر نجد أن Rituximab علاج واعد لأدواء الكلية بأشكالها المعندة على العلاجات التقليدية بالأدوية الكابحة للمناعة ومثالها النموذجي المتلازمة الكلائية nephritic syndrome [1].
|
| التهاب المفاصل الروماتويدي
Rheumatoid arthritis |
جاءت الفكرة، بالأساس، من ملاحظات الباحثين حول تحسّن الحالة السريرية لمرضى التهاب المفاصل المصابين بلمفوما عولجت بأضداد CD20 [23]، وأظهرت نتائج دراستين الأولى على 22 مريضاً والثانية على خمسة، أنّ إشراك Rituximab مع cyclophosphamide والكورتيزونات يبدو فاعلاً، إذ ثبت أن السويات المصلية للأضداد الذاتية، بصورة خاصة العوامل الروماتويدية وأضداد anti-CCP، تنخفض بصورة ذات دلالة (تحديداً الأضداد من نمط IgG وIgA)، بينما لا تتغيّر سويات أضداد الجراثيم [7]؛ وأنّ اللمفاويات البائية تعاود الظهور تدريجياً في الدم المحيطي بعد ثمانية أشهر وسطياً، مما يعني ارتفاع سويات الأضداد الذاتية مجدداً والنكس خلال 18 إلى 20 شهراً. والمثير، أن دراسات أخرى ترفض أن تفسر فاعلية Rituximab بانخفاض السويات المصلية للأضداد الذاتية فقط. فبحسب هذه الدراسات [12] لا ترتبط التظاهرات السريرية، حصرياً، بسويات الأضداد، مستندةً إلى حقيقة أن الأضداد الذاتية لم تختفي تماماً في الحالات التي لمس فيها التحسن، لكنها ومع إقرارها بالدور الذي تلعبه اللمفاويات البائية في إمراضية التهاب المفاصل، تقترح وجود أنماط خلوية ملحقة accessory cell types تساهم في تقديم المستضدات للمفاويات التائية المتجاوبة مع الذات. ولا بدّ من التنويه أن Rituximab يبدي فاعليته القصوى عند إشراكه مع Methotrexate دون إغفال الآثار الجانبية غير المرغوبة لهذه التوليفة والتي تتجلى في العدواءات الوخيمة severe infection كذات الرئة القصبية [25].
ومن أمراض المناعة الذاتية الأخرى التي يمكن أن يكون Rituximab أملاً في تدبيرها؛ أذكر الوهن العضلي الوبيل myasthenia gravis، التصلب المتعدد multiple sclerosis، الذئبة الجهازية الحمامية والقائمة تطول.
|
| تحمل المعالجة والآثار الجانبيةTherapy tolerance and side effects |
|
يبدو أن Rituximab جيد التحمل عموماً حتى عند المرضى مثبطي المناعة [13]، ويمكن تلخيص آثاره غير المرغوبة بتفاعلات أرجية allergic reactions متجاوبة والمعالجة بالكورتيزون، إضافةً إلى الحمى وانخفاض التوتر الشرياني بفعل دفق السيتوكينات المتحرر نتيجة انحلال الخلايا المتواسط بالأضداد. إلا أن انعكاسه على عمل الجملة المناعية ككل هو ما يجدر ملاحظته؛ فعدا عن ضعف المناعة الخلطية humoral immune system في الاستجابة للقاحات vaccines، وتأثر المناعة الخلقية innate immunity سلبياً؛ فإن Rituximab يزيد من التأهب للإصابة بالعدواءات الانتهازية opportunistic infections وبصورة خاصة الفيروسية منها؛ إذ تم تسجيل حالات إعادة تنشيط reactivation فيروس التهاب الكبد البائي Hepatitis B virus [17].
|
| خاتمة Conclusion |
|
يمثل Rituximab أملاً في تدبير أمراض المناعة الذاتية بعد أن ظلت علاجاتها التقليدية تقوم على ضبط تنشيط اللمفاويات التائية. فقد جاء ثورةً في مجال المعالجات الحيوية biotherapy ليقلب المفاهيم والممارسات وذلك باستهداف اللمفاويات البائية وحدها. فبعد أن اقتصر استعماله على حالات محددة من اللمفوما؛ نرى اليوم كماً هائلاً من الدراسات تشيد بفاعليته في طيف واسع من أمراض المناعة الذاتية. إلا أن المأمونية safity تظل المشكلة الأهم التي تواجهه ككل مقاربة علاجية جديدة فهي وببساطة كالعملة، ذات وجهين.
|
| المراجعReferences |
1-Ahmed MS, Wong CF. Rituximab and nephrotic syndrome: a new therapeutic hope? Nephrol Dial Transplant. 2008 Jan; 23(1):11-7.
2-Alas S, Ng CP, Bonavida B. Rituximab modifies the cisplatin-mitochondrial signaling pathway, resulting in apoptosis in
cisplatin-resistant non-Hodgkin's lymphoma. Clin Cancer Res. 2002 Mar; 8(3):836-45.
3-Anderson MS, Bluestone JA. The NOD mouse: a model of immune dysregulation. Annu Rev Immunol. 2005;23:447-85. Review.
4-Anolik JH, Campbell D, Felgar RE, Young F, Sanz I, The relationship of FcgammaRIIIa genotype to degree of B cell depletion by
rituximab in the treatment of systemic lupus erythematosus. Arthritis Rheum. 2003 Feb; 48(2):455-9.
5-Bach JF. Infections and autoimmunity, Rev Med Interne. 2005 Oct;26 Spec No 1:32-4
6-Bellosillo B, Villamor N, L?pez-Guillermo A, Marcé S, Complement-mediated cell death induced by rituximab in B-cell
lymphoproliferative disorders is mediated in vitro by a caspase-independent mechanism involving the generation of reactive oxygen
species. Blood. 2001 Nov 1; 98(9):2771-7.
7-Berentsen S, Ulvestad E, Gjertsen BT, Hjorth-Hansen H, Rituximab for primary chronic cold agglutinin disease: a prospective study of
37 courses of therapy in 27 patients. Blood. 2004 Apr 15;103(8):2925-8.
8-Bohnhorst J?, Bj?rgan MB, Thoen JE, Natvig JB, Thompson KM. Bm1-Bm5 classification of peripheral blood B cells reveals circulating
germinal center founder cells in healthy individuals and disturbance in the B cell subpopulations in patients with primary Sj?gren's
syndrome. J Immunol. 2001 Oct 1;167(7):3610-8.
9-Bour-Jordan H, Bluestone JA. B cell depletion: a novel therapy for autoimmune diabetes? J Clin Invest. 2007 Dec;117(12):3642-5.
10-Chan OT, Hannum LG, Haberman AM, Madaio MP, Shlomchik MJ. A novel mouse with B cells but lacking serum antibody reveals an
antibody-independent role for B cells in murine lupus. J Exp Med. 1999 May 17;189(10):1639-48.
11-Cragg MS, Morgan SM, Chan HT, Morgan BP, Filatov AV, Complement-mediated lysis by anti-CD20 mAb correlates with segregation into
lipid rafts. Blood. 2003 Feb 1;101(3):1045-52.
12-Edwards JC, Cambridge G. B-cell targeting in rheumatoid arthritis and other autoimmune diseases. Nat Rev Immunol. 2006
May;6(5):394-403. Review.
13-Fakhouri F et al, Le Rituximab dans les maladies auto-immunes: un nouvel espoir? Flammarion Médecine-Sciences, Actualités
Néphrologiques 2004.
14-Greeley SA, Katsumata M, Yu L, Eisenbarth GS, Moore DJ, Goodarzi H, Barker CF, Naji A, Noorchashm H. Elimination of maternally
transmitted autoantibodies prevents diabetes in nonobese diabetic mice. Nat Med. 2002 Apr;8(4):399-402.
15-Groom J, Mackay F. B cells flying solo. Immunol Cell Biol. 2008 Jan;86(1):40-6
16-Leadbetter EA, Rifkin IR, Hohlbaum AM, Beaudette BC, Chromatin-IgG complexes activate B cells by dual engagement of IgM and
Toll-like receptors. Nature. 2002 Apr 11;416(6881):603-7.
17-Looney RJ, Srinivasan R, Calabrese LH. The effects of rituximab on immunocompetency in patients with autoimmune disease. Arthritis
Rheum. 2008 Jan;58(1):5-14.
18-Maccioni M, Zeder-Lutz G, Huang H, Ebel C, Mathis D. Arthritogenic monoclonal antibodies from K/BxN mice. J Exp Med. 2002 Apr
15;195(8):1071-7.
19-Mackay F, Silveira PA, Brink R. B cells and the BAFF/APRIL axis: fast-forward on autoimmunity and signaling. Curr Opin Immunol. 2007
Jun;19(3):327-36. Review
20-Marshak-Rothstein A. Toll-like receptors in systemic autoimmune disease. Nat Rev Immunol. 2006 Nov;6(11):823-35. Review
21-Mihaylova N, Voynova E, Tchorbanov A, Nikolova M, Michova A, Todorov T, Srebreva L, Taskov H, Vassilev T. Selective silencing of
disease-associated B-lymphocytes by chimeric molecules targeting their Fc gamma IIb receptor. Int Immunol. 2008 Feb;20(2):165-75.
22-Ng LG, Sutherland AP, Newton R, Qian F, Cachero TG, Scott ML, et al. B cell-activating factor belonging to the TNF family (BAFF)-R
is the principal BAFF receptor facilitating BAFF costimulation of circulating T and B cells. J Immunol. 2004 Jul 15;173(2):807-17.
23-Protheroe A, Edwards JC, Simmons A, Maclennan K, Selby P. Remission of inflammatory arthropathy in association with anti-CD20
therapy for non-Hodgkin's lymphoma. Rheumatology (Oxford). 2007 Apr;46(4):563-4.
24-Ruggenenti P, Chiurchiu C, Brusegan V, Rituximab in idiopathic membranous nephropathy: a one-year prospective study. J Am Soc
Nephrol. 2003 Jul; 14(7):1851-7.
25-Shaw T, Quan J, Totoritis MC. B cell therapy for rheumatoid arthritis: the rituximab (anti-CD20) experience. Ann Rheum Dis. 2003
Nov;62 Suppl 2:ii55-9. Review.
26-Sibilia J et Sordet C, Le Rituximab: une biothérapie originale dans les maladies auto-immunes, Encyclopédie Orphanet, Avril 2004
27-Stastny P. Association of the B-cell alloantigen DRw4 with rheumatoid arthritis. N Engl J Med. 1978 Apr 20;298(16):869-71
28-Tedder TF, Engel P. CD20: a regulator of cell-cycle progression of B lymphocytes. Immunol Today. 1994 Sep;15(9):450-4. Review
29-Tedder TF, Klejman G, Schlossman SF, Saito H. Structure of the gene encoding the human B lymphocyte differentiation antigen CD20
(B1). J Immunol. 1989 Apr 1;142(7):2560-8.
30-Thatayatikom A, White AJ. Rituximab: a promising therapy in systemic lupus erythematosus. Autoimmun Rev. 2006 Jan;5(1):18-24.
31-Wang L, Li Y, Hou M. Idiopathic thrombocytopenic purpura and dysmegakaryocytopoiesis. Crit Rev Oncol Hematol. 2007 Nov;64(2):83-9.
Review.
32-Web site of the Immune Tolerance Network; http://www.newonsetdiabetes.org/trials.html.
|
| |
| المجلد 4 ,
العدد 9
، ربيع الأول 1429 – نيسان (إبريل) 2008 |
|
|
|
