| الملخص Abstract |
| تُُعد الفَيروسَةُ العَجَلِيَّة السبب الأكثر شيوعاً للالتهاب المعدي المعوي عند الرضع والأطفال دون سن الخامسة من العمر. وهي تسبب وفيات أكثر من 800 ألف طفل سنوياً حول العالم، أغلبها ناجم عن التجفاف بسبب الإسهال الذي يؤدي إلى خسارة في البروتينات والتي منها α-1AT المقاوم للتدرك الهضمي، وقد تم اكتشاف الفَيروسَةُ العَجَلِيَّة من قبل العالم Bishop عام 1973.
درسنا في هذا البحث نسبة الإصابة بالفَيروسَةُ العَجَلِيَّة عند الأطفال دون سن الثانية، ومقايسة Fα-1AT (الألفا-1 أنتي تربسين البرازي) ومعرفة متوسط قيمة Fα-1AT لديهم.
جرى استقصاء الإصابة بالفَيروسَةُ العَجَلِيَّة لدى 200 طفل مصاب بالإسهال من مراجعي مستشفى الأطفال، ومقايسة Fα-1AT عند الأطفال المصابين بها.
تمت مقايسة Fα-1AT لدى 100 طفل سوي ممن يقل عمرهم عن السنتين (كمجموعة شاهدة).
كانت مستويات Fα-1AT مرتفعة بشكل ملحوظ عند الأطفال المصابين بالفَيروسَةُ العَجَلِيَّة مقارنة مع الأطفال الأسوياء.
تقترح نتائجنا أن مقايسة Fα-1AT هي طريقة مفيدة وآمنة لكشف الإصابة بالفَيروسَةُ العَجَلِيَّة لدى الأطفال.
|
| Rotavirus is the most common cause of sever gastroenteritis in infants and young children under five years old .It causes the death of over 800,000 children every year worldwide .Most of these cases because of the dehydration. The diarrhea causes protein loss (such as Aα-1AT, which is resistant to digestion degradation). Rotavirus was known for the first time by Bishop in 1973.
In this study, we studied the rate of rotavirus infected under 2 years children and evaluated these children's Fα-1AT mean.
Rotavirus was investigated in 200 children with diarrhea. Fα-1AT was assessed in 100 healthy children less than 2 years. Fα-1AT levels were significantly higher in patients with rotavirus than those healthy.
Our results suggest that the Fα-1AT assay is useful and safe method to detect rotavirus in children.
|
| المقدمة Introduction |
| 1- الفَيروسَةُ العَجَلِيَّة Rotavirus |
أحد أفراد عائلة Reoviridae وتسبب الفَيروسَةُ العَجَلِيَّة التهاباً معدياً معوياً ويُطلَق على إصابتها عدة أسماء منها الإسهال الطفولي وإسهال الشتاء وأنفلونزا المعدة.
وتسميتها روتا باللغة اللاتينية يعني شكل الدولاب أو العجلة وذلك بسبب شكله بالمجهر الإلكتروني (الصورة 1)(13-17).
ولما كان الفيروس موجوداً بسلالات مختلفة (سبع مجموعات مصلية A → G، ثلاث منها تصيب البشر A، B، C وأكثرها انتشاراً A) فقد يصاب الطفل الواحد بأكثر من مرة واحدة، ولكن الإصابة الأولى تكون الأكثر حدة أما الإصابات التالية فتكون تحت حادة. (4، 7، 9، 12). |
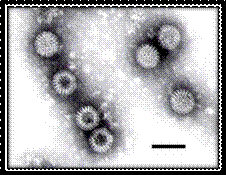
الشكل 1: الفَيروسَةُ العَجَلِيَّة بالمجهر الالكتروني. |
2- الإمراضية:
عندما تصل الفيروسات إلى الأمعاء الدقيقة تقوم باستهداف الخلايا المعوية الناضجة في الجزء العلوي والأوسط من الزغابات المعوية فتخمجها مؤدية إلى الإسهال وتميل الفَيروسَةُ العَجَلِيَّة إلى غزو الخلايا الهدف بطريقتين:
أ- الدخول المباشر والاندماج مع الخلية enterocyte؛
ب- الالتقام الخلوي المعتمد على أيونات الكالسيوم Ca2+.
تؤدي الإصابة بالفَيروسَةُ العَجَلِيَّة إلى تبدلات بنيوية في البطانة المعوية، فيتغير شكل الزغابات خلال 24 ساعة من الإصابة من الشكل العمودي إلى الشكل المكعبي، حيث تصبح الزغابات قصيرة ومائلة، وتكون هذه التبدلات أكثر خطورة في الأجزاء العلوية من الأمعاء الدقيقة، وقد يحدث التهاب بسيط أو لا يحدث التهاب، وتتعلق شدة التبدلات الحاصلة بشدة المغص الحاصل (5، 11، 15).
3- آلية الإصابة بالإسهال:
هناك عدة آليات مقترحة تُفسر حدوث الإسهال نتيجة الإصابة بالفَيروسَةُ العَجَلِيَّة نذكر أهمها
1- إنقاص السطح الفعال: حيث تحدث تعرية للزغيبات المعوية مع تسـطيح أو تقصيـر
أو ضمور في الزغابات بسبب غزوها بالفَيروسَةُ العَجَلِيَّة وقد يسبب فقر دم موضعي.
2- خلل وظيفي في الامتصاص: يحدث تثبيط في تركيز إنزيمات الديسكاريداز مما يؤدي إلى خلل في النقل المشارك للغلوكوز والصوديوم ونقص فعالية مضخة الصوديوم والبوتاسيوم وبالتالي نقص امتصاص السكريات وحدوث إسهال حلولي.
3- خلل امتصاص ناجم عن الأذى الخلوي: يحدث توذم للمتقدرات وانتفاخ في الشبكة الهيولية الداخلية وتتحطم خلايا المعي المسماة الـ enterocyte وتتعطل آلية إعادة امتصاص الماء.
4- تأثيرات سـمية لبروتين NSP4: حيـث
يعمل البروتين كذيفان داخلي مسبباً الإسهال لزيادة إفراز أيونات الكلوريد المعتمدة على أيونات الكالسيوم.
5- استثارة الجملة العصبية الداخلية: إثارة الإفراز المعوي للسوائل والكهارل، إثارة الحركة المعوية التي تفضي إلى إنقاص زمن النقل المعوي مما يفعل المنعكسات الإفرازية للجهاز العصبي الداخلي المعتمدة على أيونات الكالسيوم.
6- تبدل النفوذية البطانية: تحدث زيادة في النفوذية الخلوية وذلك بإضعاف الوصلات المحكمة بين الخلايا حيث يحدث ارتشاح في الخلايا.
تفرز الخلايا enterocyte السليمة اللاكتاز في الأمعاء الدقيقة وقد يكون عدم تحمل اللاكتوز ناجماً عن عوز اللاكتاز الذي هو علامة من علامات الإصابة بالفَيروسَةُ العَجَلِيَّة (2، 3، 18).
|
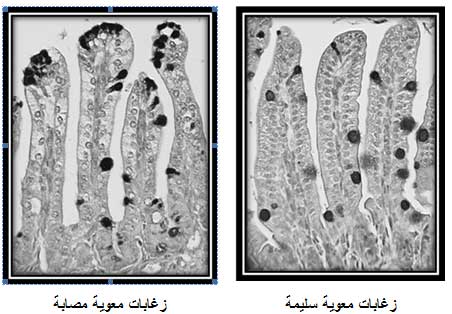 |
4- العلامات الحيوية:
يُلاحظ لدى فحص مصل المصاب بالفَيروسَةُ العَجَلِيَّة أن تراكيز الصوديوم طبيعية بينما يُلاحظ ارتفاع بسيط إلى معتدل في يوريا المصل ووجود حماض استقلابي خفيف. كما لوحظ نقص متزايد في البروتين والكلوريد وهذا ناجم عن الإسهال طويل المدى. ويمكن قياس خسارة البروتين الحاصلة بقياس خسارة ألفا-1 أنتي تربسين، حيث أنه من أكثر مثبطات البروتياز وفرة في البلازما البشرية، وهو الأكثر مقاومة للتحلل بعمليات الهضم، وذلك بتكوينه معقدات ثابتة مع الإنزيمات الهاضمة دون أن يعاد امتصاصه. وثباتيته هذه تجعله مناسباً لتحديد كمية البروتين التي فُقدت بسبب الإصابة بالفَيروسَةُ العَجَلِيَّة. (20-22).
|
| المواد والطرق Materials and Methods |
جرت في دراستنا مقايسة مستويات Fα-1AT عند مجموعة أطفال مصابين بالفَيروسَةُ العَجَلِيَّة ومقارنتها مع مجموعة أطفال أسوياء، وذلك لتقييم دوره في تشخيص الإصابة بالفَيروسَةُ العَجَلِيَّة.
1- المجموعة الشاهدة: تم فحص 100 طفل سوي ممن لا يعانون من أية أعراض هضمية، أو حمى، وتتراوح أعمارهم بين 4 أشهر وعامين.
2- مجموعة المرضى: جرى فحص200 طفل مصاب بالإسهال من مراجعي مستشفى الأطفال في أوقات مختلفة من العام، خلال عامي 2006 و 2007 ثم أجري اختبار الفيروسة لديهم.
كانت النتائج ايجابية لدى 34 طفلاً بينما كانت سلبية لدى 166 طفلاً أي أن نسبة الإصابة 17% عند الأطفال ما بين 4-24 شهراً.
|
طريقة العمل:
1- استخدمت عتائد ROTA-CHECK-1 لشركة VEDA. LAB. الفرنسية، تعتمد هذه العتيدة على طريقة الإستشراب المناعي السريع Rapid Flow Chromatographic Test، للكشف عن الفَيروسَةُ العَجَلِيَّة في البراز. ترتبط الأضداد متعددة النسائل بالبروتين NSP3 الفيروسي، والمرتبطة بصباغ على جزيئات الـ Colloidal Gold بمستضدات الفَيروسَةُ العَجَلِيَّة (في حال وجودها) مكونة معقد ضد- مستضد وهذا المعقد يعطي لونا زهرياً على شكل شريط، أما في حال غياب الفَيروسَةُ العَجَلِيَّة فلا يظهر لون في النافذة B ويكمل مزيج التفاعل جريانه ليصل إلى النافذة C (المراقبة)، وعندها يرتبط معقد الأضداد مع الصباغ بالكاشف في النافذة C منتجاً شريطاً زهرياً يؤكد على سلامة وظيفة الكاشف.
2- مقايسة الألفا-1 أنتي تربسين البرازي في كل من الأسوياء والمرضى، باسـتخدام عتيدة
Nor Partigen α-1 Antitrypsin لشركة Dade Behring الألمانية وبطريقة الانتشار المناعي، وهي طريقة كمية تعتمد على السماح للمستضدات بالانتشار من البئر خلال طبقة رقيقة من الآغار الحاوي على الأضداد لمدة كافية للسماح لجميع المستضدات بالارتباط، والمسافة النهائية التي تصل إليها حلقة الانتشار تتناسب طرداً مع كمية المستضدات الموجودة؛ وبقياس هالة الانتشار بوساطة عدسة خاصة Mgnifying lens، يتم معرفة قيم تركيز α-1 أنتي تربسين البرازي باستخدام الجدول المعياري. (6-10).
تحضير عينة البراز لتصبح جاهزة للحقن في بئر الانتشار المناعي:
1- جرى أخذ 1 غ من العينة بعود خشبي بدقة ولصعوبة هذا الأمر استخدم ميزان لوزن الأنبوب وهو فارغ ومن ثم وهو مليء حتى نصل إلى 1 غ براز.
2- تم تمديد العينة إلى 5 مل بوساطة مصل فيزيولوجي NaCl %0.9، ومن ثم التحريك جيداً بالعود الخشبي.
3- رج الأنبوب لمدة ساعة كاملة على جهاز خاض كهربائي يضمن رج ومزج العينة بشكل جيد حتى يجري استخلاص كامل α-1 AT، بجعل السائل يتحرك كأنه في دوامه.
4- جرى تنبيذ الأنبوب الحاوي على العينة لمدة 20 دقيقة كي نحصل على طاف رائق، وإذا لم يتحقق ذلك بعد 20 دقيقة نعيد التنبيذ حتى نحصل على سائل رائق نستطيع أخذ كمية منه بالممص.
5- تم استخدام مرشحة بأبعاد مسامية 0.45 µm لمنع مرور أي جسم ذي حجم كبير، ذلك أن البراز مليء بالألياف وغيرها، مما يمنع الحصول على هالة انتشار وهذا مثبت من خلال تجربتنا، فعندما لم نستخدم الترشيح لم نحصل على أية هالة (1).
|
| النتائج Results |
| يبين الجدول 1 متوسطات قيم FA-1AT لدى كل من الأسوياء والأطفال المصابين بالفَيروسَةُ العَجَلِيَّة.
وبتطبيق اختبار Mann Whiteny لحساب الفروقات الإحصائية بين قيم متوسطات FA-1AT لدى كل من الأسوياء 0.84587)±0.592356 mg/dl) والمرضى (ذكوراً وإناثاً)، بينت النتائج وجود فارق معتد به إحصائياً في قيم FA-1AT مابين المجموعة الشاهدة (0.84587±0.592356 mg/dl) ومجموعة المصابين بالفَيروسَةُ العَجَلِيَّة (1.75405±1.320711 mg/dl) حيث كانت p<0.0001.
بينما لا يوجد فارق معتد به إحصائياً في قيم
FA-1AT مابين مجموعة الذكور (2.01942±1.514063 mg/dl) ومجموعة الإناث (1.223667±3.53 mg/dl)، حيث كانت الـ p=0.1635.
|
| المناقشة Discussion |
|
هناك عدة دراسات عن الفَيروسَةُ العَجَلِيَّة وعلاقتها مع عيار الألفا-1 أنتي تربسين البرازي، منها دراسة ماكي ووايزمان وهي متوافقة مع نتائجنا كما يوجد دراسات عن الفَيروسَةُ العَجَلِيَّة في سورية.
عندما تهاجم الفيروسة بطانة الزغابات المعوية في الثلثين العلويين من الأمعاء الدقيقة، والتي لها دور في هضم السكريات وامتصاص السوائل، يحدث خلل في حلمهة السكريات وخسارة كبيرة في سوائل الأمعاء، وعند تقصي مصل المصابين بالفَيروسَةُ العَجَلِيَّة لوحظ نقص شديد في البروتين والكلوريد، وذلك ناجم عن الإسهال طويل الأمد.
الألفا-1 أنتي تربسين من البروتينات المفقودة
وهو من أكثر مثبطات البروتياز وفرة في البلازما البشرية، وهو الأكثر مقاومة للتحلل بعمليات الهضم، وذلك بتكوينه معقدات ثابتة مع الإنزيمات الهاضمة دون أن يعاد امتصاصه، وهذه الثباتية تجعله مناسباً لتحديد كمية البروتين الذي تم خسارته بسبب الإصابة بالفَيروسَةُ العَجَلِيَّة.
يتوافق هذا مع نتائج دراستنا، حيث وجدنا ارتفاعاً ملحوظاً في قيم FA-1AT عند المصابين بالفَيروسَةُ العَجَلِيَّة مقارنة مع الأسوياء بفارق يعتد به إحصائياً p<0.0001، وتتوافق هذه النتائج مع دراسة Maki وزملائه و Weizman وزملائه، فقد كانت نتائج الأطفال المصابين بالفَيروسَةُ العَجَلِيَّة 2.25±1.51 mg/ml أما نتائج الأسوياء فكانت 1.02±0.73 mg/ml، والتي بينت أنه يمكن استخدام مقايسة FA-1AT كطريقة آمنة ومفيدة في تشخيص إصابة الأطفال بالفَيروسَةُ العَجَلِيَّة (16).
|
الجدول 1: متوسطات قيم FA-1AT لدى المجموعات المدروسة.
|
الأسوياء (mg/dl ) |
المصابين بالفَيروسَةُ العَجَلِيَّة (mg/dl ) |
تركيز FA-1AT |
0.845 ± 0.59 |
1.75 ± 1.320711 |
الجدول 2: متوسطات قيم FA-1AT لدى الذكور والإناث.
|
الذكور المصابين (mg/dl ) |
الإناث المصابين (mg/dl ) |
تركيز FA-1AT |
2.019±1.51 |
3.53 ± 1.22 |
|
| الإستنتاج Conclusion |
شمل البحث 100 طفل سوي و 200 طفل مصاب بالإسهال، منهم 34 طفلاً مصاباً بالفَيروسَةُ العَجَلِيَّة من مراجعي مستشفى الأطفال:
- قيمة ألفا-1 أنتي تربسين السوية هي 0.84 mg/ml بانحراف معياري 0.59.
- قيمة ألفا-1 أنتي تربسين عند المصابين بالفَيروسَةُ العَجَلِيَّة هي 1.754059 mg/ml بانحراف معياري 1.320711.
- هناك فارق إحصائي بين قيم الألفا-1 أنتي تربسين البرازي لدى الأسوياء والمرضى، مما يجعل لمقايسة ألفا-1 أنتي تربسين البرازي قيمة في تشخيص الفَيروسَةُ العَجَلِيَّة.
- كانت نسبة الذكور المرضى أكثر بقليل من نسبة الإناث (44، 56% على الترتيب)، ولا يوجد فارق إحصائي بين قيم ألفا-1 أنتي تربسين البرازي عند كل من الذكور والإناث المرضى، أي لا علاقة للجنس بقيم ألفا-1 أنتي تربسين البرازي.
- الفئة العمرية المتناولة في البحث سواء للأسوياء أو للمرضى هي ما بين 3 أشهر وحتى السنتين.
- يمكن الاستفادة من مقايسة FA-1AT كطريقة يمكن تطويرها لكشف إصابة الأطفال بالفَيروسَةُ العَجَلِيَّة.
|
| المراجع References |
1-Lopez A; Hinojosa J; Miralles A; Primo J. and Bermudez J.D.
Digestive Diseases and Sciences, 39, 3, 507-512, 1994.
2-Anthony ID; Bullivant S; Dayal S; Bellamy AR. and Berriman JA.
Rotavirus spike structure and polypeptide composition.
J Virol; 65(8): 4334-4340, 1991.
3-Arya SC.
Rotaviral infection and intestinal lactase level.
J. Infect. Dis; 150 (5): 791, 1984.
4-Bartlett AV III, Bednarz-Prashad AJ; DuPont HL. and Pickering LK.
Rotavirus gastroenteritis.
Annu Rev Med; 38: 399-415, 1987.
5-Boshuizen J.A; Reimerink J.H.J; Korteland-van Male A.M; Van Ham V.J.J; Koopmans M.P.G; Büller H.A; Dekker J. and Einerhand A.W.C.
Changes in small intestinal homeostasis, morphology, and gene expression during rotavirus infection of infant mice.
J. Virol; 77: 13005-13016, 2003.
6-Brandt CD; Kim HW; Rodriguez WJ; Thomas L; Yolken RH; Arrobio JO; Kapikian AZ; Parrott RH. and Chanok RM.
Comparison of direct electron micro-scopy, immune electron microscopy, and rotavirus enzyme-linked immunosorbent assay for detection of gastroenteritis viruses in children.
J Clin Microbiol, 1981;13:976-981
7-Braz J.
Microbiol. 37 no.4 So Paulo 2006.
8-Charles MD; Holman RC; Curns AT; Parashar UD; Glass RI. and Bresee JS.
Hospitalizations associated with rotavirus gastroenteritis in the United States, 1993–2002.
Pediatr Infect Dis J; 25: 489-493, 2006.
9-Dennehy Penelope
Lecture, 4, 2004.
10-Fernandes J.V.
Rotavirus detection in feces of children with acute diarrhea.
J. Ped; 4: 300-304, 2000.
11-Greenberg HB; Clark HF. and Offit PA.
Rotavirus pathology and pathophysiology.
Curr. Top. Microbiol. Immunol; 185: 255-83, 1994.
12-Gurwith M; Wenman W; Hinde D; Feltham S. and Greenberg H.
A prospective study of rotavirus infection in infants and young children.
J Infect Dis; 144: 218-224, 1981.
13-Ho MS; Glass RI; Pinsky PF. and Anderson LJ.
Rotavirus as a cause of diarrheal morbidity and mortality in the United States.
J Infect Dis; 158: 1112-1116, 1988.
14-Kilgore PE; Holman RC; Clarke MJ. and Glass RI.
Trends of diarrheal disease-associated mortality in U.S. children, 1968 through 1991.
JAMA, 274: 1143-1148, 1995.
15-Lundgren O. and Svensson L.
Pathogenesis of rotavirus diarrhea.
Microbes Infect, 3(13): 1145-1156, 2001.
16-Maki M; Harmoinen A; Vesikari T. and Visakorpi JK.
Fecal excretion of alpha-1-antitrypsih in acute diarrhoea.
Arch Dis Childh; 57: 154-5, 1982.
17-Malek MA; Curns AT; Holman RC.
Diarrhea- and rotavirus associated hospitalizations among children less than 5 years of age: United States, 1997 and 2000.
Pediatrics, 117: 1887-1892, 2006.
18-Walderhaug M.
Rotavirus U.S. food and drug administration January 1992
19-Parashar UD; Hummelman EG; Bresee JS. and Miller MA.
Glass RI Global illness and deaths caused by disease in children.
Emerg Infect Dis; 9: 565-572; 2003.
20-Umesh D. Parashar, Joseph S. Bresee, Jon R. Gentsch and Roger I.
Glass Emerging infections diseases. 4, 4, 1998
21-Weizman Zvi, Binsztok Mauricio, Fraser Drora, Deckelbaum Richard J. and Granot Esther
Journal of Clinical Gastroenterology. 34(4):427-429, April 2002
22-Widdowson MA; Bresee JS; Gentsch JR. and Glass RI.
Rotavirus disease and its prevention.
Curr Opin Gastroenterol. 21(1): 26-31, 2005.
|
| |
