| المجلد 5 ,
العدد 2
, محرم 1430 - كانون الثاني (يناير) 2009 |
| |
| تقصي فقر الدم الناجم عن الأمراض المزمنة (ACD) لدى مرضى السل |
| Investigation of anemia of chronic diseases (ACD) in patients with tuberculosis |
| د. فراس دياب حاج محمد*، أ.د. خليل القوتلي* و أ.د. آصف ديوب** |
| Haje Mohamad FD; Kowatli Kh. and Diab A. |
* كلية الصيدلة، ** كلية الطب، جامعة دمشق
*Faculty of Pharmacy, **Faculty of Medicine, Damascus University |
| الملخص Abstract |
الأهداف: هدفت هذه الدراسة إلى استقصاء فقر الدم الناجم عن الأمراض المزمنة لدى مرضى السل، بالاعتماد على مقايسة مستقبل الترانسفيرين الذواب.
المواد والطرق: أجريت الدراسة على 41 مريضاً بداء السل، حيث تم تقسيمهم تبعاً لقيم الهيموغلوبين، مناسب الكريات الحمر، الحديد، السعة الكلية الرابطة للحديد، الفيريتين، ومستقبل الترانسفيرين الذواب، إلى زمر حسب نوع فقر الدم المرافق في حال وجوده. كما تم انتقاء 21 شخصاً سليماً استخدموا كمجموعة شاهدة لمقارنة المتثابتات المدروسة.
النتائج: أظهرت دراستنا أن نسبة مرضى السل الذين يعانون من فقر الدم الناجم عن الأمراض المزمنة بلغت 54% كسبب وحيد لفقر الدم، و 15% مختلطاً مع فقر الدم الناجم عن عوز الحديد، فيما بقي 31% من المرضى لم تظهر لديهم موجودات مخبرية تشير إلى تطور فقر الدم الناجم عن الأمراض المزمنة.
الاستنتاج: تترافق الاستجابة المناعية الشديدة التي يبديها الجسم تجاه العدوى بعصيات السل مع تطور فقر الدم الناجم عن الأمراض المزمنة بنسبة مرتفعة لدى هؤلاء المرضى، كما توصي دراستنا بالاستفادة من مقايسة مستقبل الترانسفيرين الذواب الذي يمكن تقصيه مخبرياً بسهولة كمعيار لتمييز فقر الدم الناجم عن الأمراض المزمنة عن فقر الدم الناجم عن عوز الحديد.
|
Objectives: This study aimed to investigate anemia of chronic diseases (ACD) in patients with tuberculosis by depending on soluble transferrin receptor (sTfR) assay.
Materials and Methods: This study was carried on 41 tuberculosis patients, divided according to the levels of hemoglobin, erythrocyte Indices, Iron, total iron binding capacity, ferritin, and soluble transferrin receptor, to subgroups depending on the type of the associated anemia. 21 healthy persons were selected and served as control group for
comparison the studied parameters.
Results: Our study showed that 54% of tuberculosis patients suffer from anemia of chronic diseases (ACD) as a unique cause of anemia, and 15% suffer from combination of both anemia of chronic diseases (ACD) and iron deficiency anemia (IDA), while 31% do not exhibit any laboratory findings that indicate to the development of (ACD).
Conclusion: The severe immune response against the infection by tuberculosis Bacilli associate with the development of anemia of chronic diseases (ACD) in high rate in tuberculosis patients. Our study encourages the utilization of soluble transferrin receptor (sTfR) as simply measurable parameter to the differential diagnosis between anemia of chronic diseases (ACD) and iron deficiency anemia (IDA).
|
| المقدمة Introduction |
يحتل فقر الدم الناجم عن الأمراض المزمنة Anemia of Chronic Diseases (ACD) المرتبة الثانية من حيث الشيوع بين أنواع فقر الدم عامة، حيث يشاهد ACD بين المرضى ذوي الفعالية المناعية المزمنة أو حتى الحادة منها (1). ويلاحظ هذا النمط من فقر الدم لدى مرضى المناعة الذاتية والعداوى المزمنة والأورام (2).
تشمل الاضطرابات الأهم في حالة ACD كلاً من: تثبيط تكاثر وتمايز الخلايا السلف الحمر والاستجابة الكليلة لـلإريثروبويتين EPO واضطرابات استتباب الحديد، وبصورة أقل تقاصر مدة حياة الخلية الحمراء (3).
تؤثر السيتوكينات على نمو الخلايا السلف الحمر إما بتثبيطها بصورة مباشرة، أو من خلال تحريض آلية الاستماتة (3). كما تثبط السيتوكينات IL-1 و TNF-α بشكل مباشر التعبير عن EPO في الزجاج. يمكن أن يعزى هذا الأمر جزئياً على الأقل، إلى إنتاج متواسط بالسيتوكينات لأشكال فعالة من الأوكسجين التي تؤثر بدورها على ألفة الارتباط لعوامل الانتساخ المحرضة للإريثروبويتين، كما أنها تخرب الخلايا المنتجة لـ EPO (1).
إن اضطراب استتباب الحديد علامة مميزة للإصابة بفقر الدم الناجم عن الأمراض المزمنة، ومردّ ذلك إلى زيادة قبط الحديد والاحتفاظ به في خلايا الجملة الشبكية البطانية، مما يؤدي إلى تحويل الحديد من الدوران إلى مواقع التخزين، والحد من مقدار الحديد المتوفر للخلايا الحمر السلف، وبالنتيجة افتقار عملية تكون الدم إلى الحديد اللازم لاكتمالها (1).
يمكن أن تتأثر مدة حياة الكريات الحمر في ACD. حيث تؤدي زيادة عملية بلعمة الكريات الحمر إلى تقاصر نصف عمر الكرية الحمراء عن معدلها الطبيعي، وذلك كنتيجة محتملة للضرر الناجم عن تأثير السيتوكينات والجذور الحرة على الكريات الحمر (3).
يكون فقر الدم في ACD متغير الشدة، حيث يعاني المرضى عادة من فقر دم خفيف إلى متوسط الشدة (4). كما تنخفض مستويات الحديد المصلية ومستويات الترانسفيرين، في الوقت الذي تكون فيه نسبة إشباع الترانسفيرين طبيعية عادة وهو ما يميز ACD عن فقر الدم الناجم عن عوز الحديد IDA. نظراً لكون الفيريتين أحد متفاعلات الطور الحاد فإن قيمه التي تكون عادة طبيعية أو مرتفعة في ACD تصبح ذات قيمة ضعيفة كمؤشر على مخازن الحديد في حالات الالتهابات المزمنة. كما أن التدمير الذي يمكن أن يتعرض له نسيج الكبد أو الطحال كنتيجة للمرض البدئي قد يكون مسؤولاً عن تحرير كميات كبيرة نسبياً من الفيريتين إلى الدوران (4). نظراً لكون التمييز بين ACD وفقر الدم الناجم عن عوز الحديد IDA مهماً من الناحية السريرية وصعباً نوعاً ما، فقد اعتمد البعض على استخدام مقايسة مستقبل الترانسفيرين الذواب Soluble Transferrin Receptor (sTfR) للتمييز بين الحالتين، والمبدأ الحيوي في ذلك أنه في حالات عوز الحديد تزداد كثافة مستقبلات الترانسفيرين الموجودة في غشاء الخلية، وتكون النتيجة أن الأشكال المقتطعة من مستقبل الترانسفيرين الذواب sTfR تظهر بتراكيز متزايدة في المصل (5). إلا أنه وبالمقابل يعتقد البعض بأن sTfR لا تقدم فائدة أكبر من TIBC (6). يُعتقد الآن بأن النسبة بين sTfR ولوغاريتم الفيريتين (أو ما يسمى منسب مستقبل الترانسفيرين الذواب – الفيريتين sTfR-Ferritin Index) يمكن أن يكون وسيلة أفضل للتمييز بين ACD و IDA (7).
يعد السل الداء الأكثر تسبباً بحالات وفاة ناجمة عن الإصابة بعدوى وحيدة في العالم (8)، تعد الاستجابة المناعية والوقائية التي يبديها الثوي ضد المتفطرات السلية معقدة ومتعددة الأوجه، حيث تتداخل فيها العديد من مكونات النظام المناعي، ففي حالة عدم التعرض السابق للعصية السلية تلعب عملية البلعمة وما يرافقها من إفراز لـ IL-12، الدور البدئي في رد الفعل المناعي (9). يُعد السل مثالاً تقليدياً ونموذجياً عن الإمراضيات التي تقوم فيها المناعة الخلوية بتحمل العبء الأكبر من المهمة الدفاعية، حيث تقوم الخلايا التائية CD4 و CD8 بإفراز السيتوكينات المتداخلة في استجابة الثوي ضد السل (10).
|
| المواد والطرق Materials and Methods |
أجريت الدراسة على 41 مريضاً مشخصاً سريرياً، وشعاعياً، ومخبرياً بإجراء فحص إيجابي للقشع مرتين على الأقل، من مراجعي مركز مكافحة السل في مدينة دمشق )عدد الذكور 22 وعدد الإناث 19)، تراوحت أعمارهم بين 16-71 سنة، بمتوسط عمر قدره 35.65 سنة، مدة الإصابة لا تقل عن شهرين، وذلك قبل تناول الأدوية الخاصة بالسل. وتمت مقارنة القيم الناتجة مع قيم مجموعة شاهدة تضم 21 متطوعاً من الأصحاء ظاهرياً ومخبرياً تراوحت أعمارهم بين 18-60 سنة بمتوسط عمر قدره 32.8 سنة، 18 ذكراً و 3 إناث، لا سكريين وغير مصابين بالمرض، أو أية أمراض أخرى إضافة إلى عدم تناول أية أدوية. ومن الناحية المخبرية يتمتعون بقيم ضمن المجالات المرجعية للتعداد الكلي للعناصر الدموية CBC، وقيم هيموغلوبين تتراوح بين 13.5-16 غ/ دل للذكور و 13.2-14.1 غ/ دل للإناث. وكانت قيم البروتين المتفاعل C (CRP) لديهم جميعاً 5 ملغ/ دل فما دون.
تم جمع 4 مل من الدم في أنبوب حاوٍ على EDTA بهدف إجراء تعداد كامل لخلايا الدم مع الشبكيات والمناسب الدموية، و 10 مل من الدم في أنبوبين جافين تم تنبيذهما بسرعة 3000 دورة/ دقيقة وتوزيع المصل الناتج على خمسة أنابيب ايبندورف حفظت بدرجة حرارة -80°م.
وقد أجريت في هذه الدراسة كل من المقايسات التالية:
- المتثابتات الدموية: تمت المقايسة باستخدام عينات دم مسحوبة على EDTA على جهاز CELL-DYN3700 لشركة Abbott Diagnostics.
- مقايسة الحديد والسعة الكلية الرابطة للحديد TIBC: تمت المقايسة باستخدام عتيدة لشركة Medichem تعتمد طريقة Nitro-PAPS.
- مقايسة الفيريتين: تمت المقايسة باستخدام عتيدة لشركة ROCHE تعتمد على طريقة المقايسة المناعية باللمعان الكيميائي الكهربائي (ECLIA) Electro-chemiluminescence immunoassay، وذلك باستخدام جهاز Elecsys 2010.
- مقايسة مستقبل الترانسفيرين الذواب (sTfR): تمت المقايسة بمقياس الكدر بالجزيئات المحفزة Particle-enhanced nephelometry باستخدام عتيدة وجهاز خاص بشركة DADE BEHRING.
- مقايسة البروتين الإرتكاسي (C) مرتفع الحساسية CRP-HS: تمت المقايسة باستخدام عتيدة لشركة Medichem تعتمد طريقة عكرية مناعية وبوساطة جهاز HITACHI 902.
وقد تم الاعتماد على الخوارزمية المبينة في الشكل 1، لتحديد نمط فقر الدم المرافق للسل في حال وجوده.
|
| النتائج والمناقشة Results and Discussion |
يمكن وبالاعتماد على الخوارزمية الواردة في الشكل 1 وبالاستناد إلى قيم الهيموغلوبين، الحديد، السعة الكلية الرابطة للحديد، الفيريتين، ومستقبل الترانسفيرين الذواب تقسيم مرضى السل إلى أربع زمر هي:
1- زمرة مرضى السل الذين يعانون من فقر الدم الناجم عن العدوى المزمنة ACD.
2- زمرة مرضى السل الذين يعانون من فقر دم ناجم عن عوز الحديد IDA.
3- زمرة مرضى السل الذين يعانون من فقر دم مختلط ACD + IDA.
4- زمرة مرضى السل الذين لم يتطور لديهم فقر دم Non Anemic.
وقد تمت مقايسة مستقبل الترانسفيرين الذواب لـ 9 مرضى كانت قيم الحديد لديهم سوية أو منخفضة بين 14.2 و 49 مكغ/ دل، وقيم TIBC لديهم سوية بين 259-345، وتراوحت قيم الفيريتين بين 48.2 و 123 نغ/ مل، واعتماداً على النتائج المسجلة وبحساب القيمة sTfR/log Ferritin تم تقسيم مجموعة المرضى إلى قسمين:
القسم الأول: بلغ عدده 3 مرضى كانت قيمة sTfR/log Ferritin لديهم أقل من 0.8 وتم إدراجهم ضمن زمرة مرضى السل المترافق بـ ACD.
القسم الثاني: بلغ عددهم 6 مرضى كانت قيمة sTfR/log Ferritin لديهم أكثر من 1.4، حيث تم تصنيفهم كزمرة مرضى السل المترافق بـ ACD و IDA مختلط.
يظهر الجدول 1 قيم المتثابتات المختلفة لدى مرضى كل من الزمر الأربعة والمجموعة الشاهدة مقدمة بشكل المتوسط الحسابي، الانحراف المعياري والوسطي.
أظهرت النتائج أن عدد مرضى السل الذين يعانون من فقر الدم الناجم عن الأمراض المزمنة ACD بلغ 28 مريضاً (أي بنسبة 69% من مجموع المرضى)، حيث بلغ عدد المرضى الذين يعانون من فقر الدم الناجم عن الأمراض المزمنة ACD كسبب وحيد لفقر الدم 22 مريضأ (54%)، و 6 مرضى (15%) مختلطاً مع فقر الدم الناجم عن عوز الحديد IDA، فيما بقي 10 مرضى (31% من المرضى) لم تظهر لديهم موجودات مخبرية تشير إلى تطور ACD. يظهر الشكل 2 النسبة المئوية لكل من الزمر الأربعة بين مرضى السل.
|
الجدول 1: قيم المتثابتات المختلفة لدى مرضى كل من الزمر الأربعة والمجموعة الشاهدة مقدمة بشكل المتوسط الحسابي، الانحراف المعياري والوسطي. (106x *)
Control
n= 21 |
Non anemic n=10 |
ACD+IDA
n= 6 |
IDA
n= 3 |
ACD
n= 22 |
Parameter |
Median |
Mean ± SD |
Median |
Mean ± SD |
Median |
Mean ± SD |
Median |
Mean ± SD |
Median |
Mean ± SD |
|
27 |
32.85 ± 13.18 |
35 |
38.8 ± 15.78 |
26 |
30.5 ± 11.38 |
15 |
18 ± 6.08 |
36 |
37.3 ± 16.68 |
Age
years |
14.1 |
14.40 ± 0.84 |
14.9 |
14.3 ± 1.12 |
11.85 |
11.88 ± 1.21 |
10.8 |
11.53 ± 1.53 |
12.45 |
12.13 ± 1.7 |
Hb
g/dl |
4.66 |
4.71 ± 0.32 |
5.005 |
5.19 ± 0.55 |
4.68 |
4.81 ± 0.35 |
5.02 |
5.13 ± 0.28 |
4.67 |
4.53 ± 0.57 |
RBC
*106 |
90.4 |
90.19 ± 2.84 |
85.3 |
84 ± 8.72 |
75.95 |
77.33 ± 2.82 |
72.1 |
72.9 ± 5.94 |
83.35 |
81.98 ± 7.24 |
MCV
fL |
30.25 |
30.2 ± 1.26 |
27.6 |
27.69 ± 3.22 |
24.7 |
24.66 ± 1.35 |
21 |
22.6 ± 3.85 |
26.45 |
27.1 ± 4.29 |
MCH pg/cell |
33.25 |
33.29 ± 0.61 |
32.65 |
32.58 ± 1 |
31.95 |
31.88 ± 1.03 |
29.3 |
30.83 ± 2.83 |
31.9 |
32.99 ± 3.99 |
MCHC g/dl |
85.1 |
87.85 ± 32.54 |
78 |
83.63 ± 28.97 |
24 |
31.4 ± 17.65 |
25 |
21.2 ± 8.46 |
26 |
29.8 ± 13.74 |
Fe
?g/dl |
311 |
325.24 ± 28.3 |
361 |
345.6 ± 49.7 |
319.5 |
306.6 ± 78.03 |
432 |
405.7 ± 57.2 |
305.5 |
296.7 ± 77.7 |
TIBC ?g/dl |
164 |
173 ± 37.35 |
148 |
191 ± 137.12 |
83.5 |
85.66 ± 37.37 |
27 |
35.33 ± 21.7 |
267.5 |
349.5 ± 257 |
Ferritin ng/ml |
1.6 |
2.3 ± 1.48 |
25.25 |
40.58 ± 56.26 |
72 |
69.78 ± 50.4 |
54.8 |
50.66 ± 20.5 |
81.9 |
82.16 ± 58.4 |
CRP
mg/l |
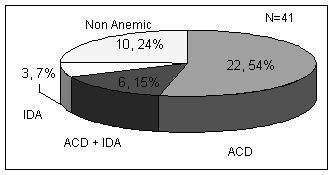
الشكل 2 : النسبة المئوية لكل من الزمر الأربعة لحالة فقر الدم بين مرضى السل.
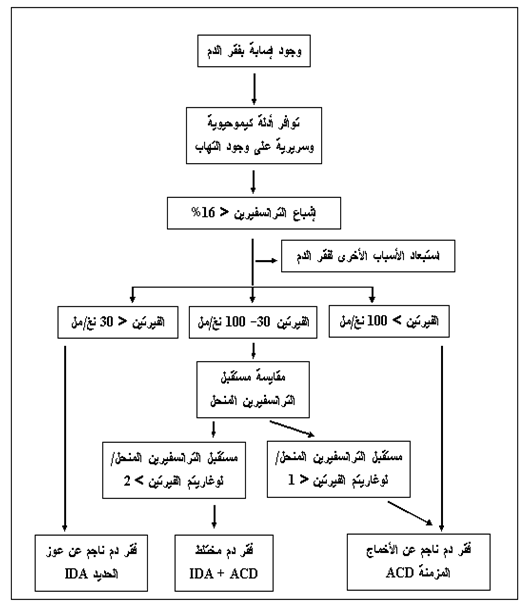
الشكل 1 : الخوارزمية المتبعة في تحديد فقر الدم الناجم عن الأمراض المزمنة وتمييزه عن فقر الدم الناجم عن عوز الحديد (1) .
|
| الاستنتاج Conclusion |
| تترافق الاستجابة المناعية الشديدة التي يبديها
الجسم تجاه العدوى بعصيات السل مع تطور ACD بنسبة مرتفعة بلغت 69%، الأمر الذي يتطلب مراقبة المتثابتات الدموية لدى مرضى السل لتحديد تطور ACD في مراحل مبكرة. كما ننصح بالاستفادة من مقايسة مستقبل الترانسفيرين الذواب sTfR إلى جانب مقايسة مستويات كل من الحديد والسعة الكلية الرابطة للحديد والفيريتين، للتشخيص التفريقي بين فقر الدم الناجم عن الأمراض المزمنة ACD وفقر الدم الناجم عن عوز الحديد IDA، نظراً لإمكان إجراء هذه المقايسة بسهولة باستخدام طرق وأجهزة متاحة، مما قد يخفف من ضرورة اللجوء إلى إجراءات فحص نقي العظم المتبعة لدراسة توافر الحديد في النقي.
|
| المراجع References |
1-Weiss G. and Goodnough LT.
Anaemia of chronic disease.
New England Journal of Medicine, 352; 1011-15, 2005.
2-Turgeon ML.
Hypochromic anemias and disorders 0f iron metabolism.
in "Clinical Hematology Theory and Procedures", 4th, 140, pub. Lippincott Williams &Wilkins,Philadelphia, 2004.
3-Katodritou E. and Christakis J.
Recent advances in the pathogenesis and management of anaemia of chronic disease.
Haematology, 9(1): 45-55, 2006.
4-Schrier S.L.
Anemia of chronic disease (anemia of chronic inflammation). 2006.
5-Fitzsimons EJ; Houston T. and Munro R.
Erythroblast iron metabolism and serum soluble transferrin receptor values in the anemia of rheumatoid arthritis.
Arthritis Rheum, 47: 166, 2002.
6-Wians Jr; Urban. JE; Keffer JH. and Kroft SH.
Discriminating between iron deficiency anemia and anemia of chronic disease using traditional indices of iron status vs transferrin receptor concentration.
American Journal of Clinical Pathology, 115: 112, 2001.
7-Desai S.P.
Approach to patient with anemia.
in "Clinician's Guide to Laboratory Medicine. 3rd, 33-35, Lexi-Comp Inc, Cleveland, 2004.
8-Finch R.G; Moss P; Jeffries D.J. and Anderson J.
Infectious diseases, tropical medicine and sexually transmitted diseases.
in "Clinical Medicine",ed. Kumar P. and Clark M., 5th ,81-89, pub. Saunders, 2003.
9-Bosio CM; Gardner D. and Elkins KL.
Infection of B celldeficient mice with CDC1551, a clinical isolate of Mycobacterium tuberculosis: delay in dissemination and development of lung pathology.
Journal of Immunology, 164: 6417-25, 2000.
10-Raja A.
Immunology of tuberculosis.
Indian Journal of Medicine, 120: 213-222, 2004.
|
| |
| المجلد 5 ,
العدد 2
, محرم 1430 - كانون الثاني (يناير) 2009 |
|
|
|
