| المجلد 5 ,
العدد 2
, محرم 1430 - كانون الثاني (يناير) 2009 |
| |
| الأضداد وحيدة النسيلة ثنائية النوعية:
أدوية المستقبل كعوامل علاجية جديدة للسرطان |
| Bispecific Monoclonal Antibodies:
Drugs of Feature as New Therapeutic Agents for Cancer |
| د. ماهر المقداد Maher Al-Mokdad |
| كلية الصيدلة، جامعة حلب، حلب، سورية |
| Faculty of Pharmacy, Aleppo University, Aleppo, Syria |
| الملخص Abstract |
| الأضداد وحيدة النسيلة ثنائية النوعية عبارة عن جزيئات كبرية مفردة ثنائية الوظيفة الغيرية، ذات ارتباط متصالب مع نوعي ارتباط مختلفين موجودين في جزيء مفرد. تستطيع الأضداد وحيدة النسيلة ثنائية النوعية من خلال كونها مقترنات حيوية مثالية الارتباط بشكل نوعي مع اثنتين من الجزيئات المختلفة دون الحاجة إلى اقتران كيميائي. ونتيجة لهذه الخاصة الفريدة تمتلك الأضداد وحيدة النسيلة ثنائية النوعية تطبيقات سريرية واسعة في المجالات المناعية والحيوية المختلفة كعوامل استهدافية للتشخيص المناعي في الأحياء وفي المختبر، وفي المعالجة ولتطوير المقايسات المناعية. أبدت الأضداد ثنائية النوعية أنها واعدة لدرجة كبيرة في استهداف الخلايا المستفعلة ذات السمية الخلوية، وإيصال المواد الفعالة إشعاعياً، والذيفانات والأدوية ذات السمية الخلوية إلى أهداف نوعية، وخاصة الخلايا الورمية. حيث يمكن اعتبار الأضداد وحيدة النسيلة ثنائية النوعية أحد نظم إيتاء الدواء التي تملك فعالية كبيرة كصنف جديد من معالجات السرطان الفعالة. |
| Bi-specific monoclonal antibodies (Bi-MAbs) are unique macromolecular hetero-bi-functional cross-linkers with two different binding specificities within a single molecule. As ideal bio-conjugates, they can specifically glue any two different molecules together without the need for chemical conjugation. With this unique feature, they have great clinical applications in various biological and immunological fields as targeting agents for in vitro and in vivo immuno-diagnosis and therapy, and for improving immunoassays. They have shown great promise for targeting cytotoxic effectors cells, delivering radio-materials, toxins or cytotoxic drugs to specific targets, particularly tumor cells. Bi-specific monoclonal antibodies considered to be one of drugs delivery systems, which have great potential as new class of effective cancer therapeutics |
| المقدمة Introduction |
على الرغم من إمكان المعالجة الناجحة للسرطان باستخدام الطرق التقليدية إلا أنه ما تزال هناك خطورة عالية لعودة حدوث المرض من جديد (1). لا يعد الورم الأولي Primary tumor هو المشكلة الرئيسة في العلاج، وإنما الخلايا الورمية المنتشرة والتي ما تزال عيوشة Viable وتستطيع بالتالي الهجرة في جسم المريض مسببة بعد سنوات نقائل Metastases غير قابلة للعلاج أو عودة الورم الأصلي، لذلك يعد عاملاً مهماً ضمان إزالة الخلايا الورمية المتبقية بشكل نوعي وفعال لمنع نكس Relapse المرض (1).
يشكل كذلك فقدان نوعية المعالجة بالعوامل الكيميائية أو المعالجة بالأشعة Radiotherapy عقبة رئيسية للمعالجة الفعالة للسرطان (2). تترافق غالباً طرق معالجة السرطان، مثل المعالجة الكيميائية، باستخدام العوامل السامة للخلايا والمعالجة بالأشعة والتي تستهدف الخلايا السرطانية بآليات مختلفة مع حدوث سمية وخيمة للمرضى المعالجين (2).
|
| الأضداد وحيدة النسيلة
Monoclonal antibodies
|
استخدمت الأضداد وحيدة النسيلة Monoclonal antibodies (mab) على نطاق واسع في الطب للتشخيص والمعالجة والوقاية من المرض (3، 4). تتضمن الآليات المستفعلة Effectors mechanisms لتدمير الخلايا الهدف بوساطة الأضداد: تنشيط جملة المتممة Complement activation، واستدعاء الخلايا الفعالة خلوياً، بالإضافة إلى تسميم الخلايا المعتمد على الأضداد (ADCC) Antibody-dependant cellular cytotoxicity. على الرغم من فعالية هذه الوظائف الفعالة الطبيعية فإن استعمال الأضداد وحيدة النسيلة لوحدها لم يحقق تدميراً كافياً للخلايا الورمية الهدف. بناء على ما تقدم فقد تم بذل جهود عديدة لزيادة كفاءة Efficiency هذه الأضداد عن طريق ربط جزيئات الأضداد هذه بمواد مختلفة كالذيفانات Toxins الجرثومية أو النباتية، والمواد المشعة Radio-materials، والأدوية السامة للخلايا Cytotoxic drugs (5) (الشكل 1). تشتق هذه الكواشف بشكل رئيسي من الاقتران المباشر للأضداد مع المركبات المستفعلة بوساطة طرق متميزة عديدة من الاقتران التكافؤي. تستعمل العديد من المقترنات المناعية Immunoconjugates من أجل التشخيص والمعالجة النوعية، والنتائج كانت مشجعة.
تم اقتراح طريقة بديلة لاستهداف الورم وذلك عن طريق نظام توزيع متعدد المراحل Multistage delivery system (الشكل 1). يستند هذا النظام إلى حقيقة كون الأضداد التي ترتبط بشكل غير نوعي، غالباً عبر الجزء
القابل للتبلر FC، تتم إزالتها من الجسم بشكل أسرع من تلك التي ترتبط بشكل نوعي مع الأورام الهدف. يستلزم هذا النظام وجود كواشف تستطيع الارتباط بشكل نوعي مع كل من الهدف والمركب المستفعل. تتمثل الكواشف السابقة بالأضداد وحيدة النسيلة ثنائية النوعية (Bi-MAbs) Bi-specific monoclonal antibodies.
|
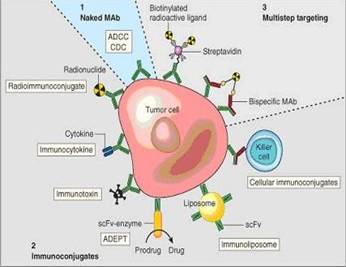
الشكل 1 : الأشكال المختلفة لاستخدام الأضداد وحيدة النسيلة في القضاء على الخلايا الورمية. |
| الأضداد وحيدة النسيلة ثنائية النوعية
Bi-specific monoclonal antibodies
|
الأضداد وحيدة النسيلة ثنائية النوعية عبارة عن جزيئات لا يمكن إنتاجها إلا في مخابر تخصصية وهي تملك القدرة على تمييز أكثر من بروتين يوجد على سطح الخلايا المختلفة.
تم إنتاج الأضداد ثنائية النوعية بصورة رئيسية بطريقتين. تعتمد الطريقة الأولى على دمج صفين خلويين منتجين للأضداد، وتعتمد الطريقة الثانية على الربط الكيميائي لجزيئتين ضديتين أو مشتقاتهما. يشار عادة إلى الأضداد المنتجة بهاتين التقنيتين باسم الأضداد الهجينة Hybrid antibodies، والمقترنات الغيرية Heterocongugates على التوالي (6-9).
ظهرت حديثاً طريقة ثالثة لإنتاج الأضداد وحيدة النسيلة ثنائية النوعية عن طريق الهندسة الوراثية Genetic engineering (10).
تعمل الأضداد وحيدة النسيلة ثنائية النوعية كوسائط لإعادة استهداف المواقع المترافقة مع المرض disease-associated sites من قبل الآليات المستفعلة (11).
تتألف الأضداد وحيدة النسيلة ثنائية النوعية من ذراعين رابطتين للمستضد Antigen-binding arms مختلفتين، تكون من خلالهما قادرة على الارتباط بشكل متزامن (متواقت) إلى الخلايا المستفعلة ذات السمية الخلوية عن طريق مستقبل مثل CD3 وإلى الخلايا الهدف باستخدام مستقبل مثل CD19، وتستطيع مباشرة تواسط قتل الخلايا الهدف بإعادة استهداف وتنشيط الخلايا المستفعلة (الشكل 2).
إن مقدرة الأضداد وحيدة النسيلة والتي تملك نوعية للورم وللمستقبل CD3 على تواسط قتل الخلايا الورمية عن طريق تنشيط الخلايا التائية T cells قد جرت ملاحظته في العديد من التجارب التي أجريت في الزجاج In vitro (12). إضافة إلى ذلك فان البقيا survival طويلة الأمد للجرذان المصابة باللمفوم Lymphoma قد جرت ملاحظته بعد العلاج باستخدام الأضداد وحيدة النسيلة ثنائية النوعي (13) .
تملك الأضداد ثنائية النوعية موقعين رابطين للمستضد نوعيين ومختلفين، الأول للمستضد المترافق مع الورم (الذراع الرابطة للهدف Target binding arm)، والآخر للمركب المستفعل (الذراع الرابطة للمستفعل Effector binding arm) والذي يتم من خلاله تحفيز الاستجابة المضادة للورم من خلال الخلايا المناعية الفعالة مثل اللمفاويات التائية السامة للخلايا Cytotoxic T-lymphocytes (CTLs)، الخلايا القاتلة الطبيعية Natural killer (NK) والبالعات الكبيرة Macrophages أو من خلال تحفيز استجابة مناعية جهازية Systemic immune response ضد الهدف (14، 15).
تمكن الميزة السابقة من تطوير استراتيجيات علاجية غير ممكنة باستخدام الأضداد وحيدة النسيلة التقليدية Conventional monoclonal antibodies (5).
|

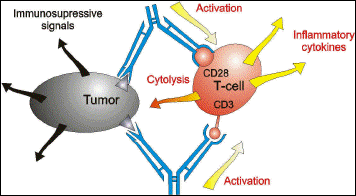
الشكل 2: استهداف الخلايا المستفعلة والخلايا الورمية من قبل الأضداد وحيدة النسيلة ثنائية النوعية. |
تظهر الخلايا القاتلة الطبيعية Natural killer (NK) والخلايا التائية الموجهة من قبل الأضداد ثنائية النوعية لاستهداف الخلايا الورمية التي تعبر عن المستضد المرافق للورم tumor-associated antigen (TAA) إشارات متعددة للتنشيط تتضمن: التكاثر Proliferation، إفراز السيتوكين Cytokine secretion، رفع تنظيم Upregulation البيبتيدات السامة للخلايا Cytotoxic peptides والإنزيمات وإحداث انحلال فعال للخلايا الورمية في الزجاج (16).
تسمح البنية ثنائية الذراع للأضداد وحيدة النسيلة ثنائية النوعية أيضاً بربط عامل علاجي مثل الدواء، الذيفان، الإنزيم أو مادة فعالة إشعاعيا بأحد الذراعين بينما تسمح بمعالجة السرطان باستهداف الخلايا الورمية بشكل نوعي من قبل الذراع الثانية (15).
من أجل الاستهداف النوعي، يتم توجيه الأضداد وحيدة النسيلة ثنائية النوعية أولاً إلى منطقة الورم من خلال نوعيتها للورم وبعد وقت مناسب لتصفية الأضداد المرتبطة بشكل غير نوعي، يعطى المركب المستفعل بشكل منفصل حيث يتم التعرف عليه عن طريق الخاصية النوعية الثانية للأضداد الهدف، مما يؤدي إلى توضعه بصورة نوعية في موقع الورم. يقلل هذا النظام من سمية المعالجة ويزيد من جودة Quality صورة الورم نظراً لكون المركب المستفعل غير المقترن ذا عمر نصفي في الجسم أقل من العمر النصفي لمعقدات الأضداد- العامل المستفعل المقترنة بشكل مباشر.
يتمثل التأثير الأول للمعالجة بالأضداد وحيدة النسيلة ثنائية النوعية بتوجيه قتل الخلايا الهدف عن طريق إعادة توجيه السمية الخلوية للخلايا المستفعلة. يعد التأثير السابق تأثيراً منفعلاً Passive effect وهو يتوقف حالما تجري تصفية الأضداد وحيدة النسيلة ثنائية النوعية من الجسم.
يؤدي التنشيط الدقيق للخلايا المستفعلة إلى تحرر جزيئات إشارة Signal molecules موجهة إلى الخلايا المناعية Immune cells الأخرى منبهة إياها إلى الحالة الخطيرة. يستمر الجهاز المناعي بالتفاعل حتى بعد إزالة الأضداد وحيدة النسيلة ثنائية النوعية المحفزة حيث يعد مثل هذا التأثير تأثيرا فعالا Active effect (الشكل 3).
يمكن تطوير الأضداد ثنائية النوعية لتصبح قادرة ليس على جذب الخلايا التائية فقط، وإنما أيضاً الخلايا الإضافية Accessory cells إلى الخلايا الورمية حيث يتم تنشيطها بحيث تخضع الخلايا الورمية الهدف إلى عمليات تحطيم متنوعة Destructive processes وبالتالي الموت نتيجة لذلك (17). بالإضافة إلى ذلك تخضع المادة الورمية إلى عمليات عديدة بعد دخولها إلى داخل الخلايا المناعية بحيث يتم عرضها بعد ذلك إلى الجـهاز المنـاعي على
سـطح الخلايا العارضة للمستضدات Antigen-presenting cells (APC) (18).
على الرغم من النوعية الحصرية Exclusive specificity والألفة العالية للأهداف المطلوبة بحيث يمكن اعتبار الأضداد وحيدة النسيلة ثنائية النوعية صنفاً جديداً واعداً من معالجات السرطان (19-24)، إلا أن الوصول إلى تقدم نهائي باتجاه معالجة سريرية حقيقية لم يحدث بعد.
|
الشكل 3 : آليات القضاء على الخلايا الورمية من قبل الأضداد وحيدة النسيلة ثنائية النوعية.
|
| المراجع References |
1-Riesenberg R; Buchner A; Polhla H. and Lindhofer H.
Lysis of prostate carcinoma cells by trifunctional bispecific antibodies ( EpCAM x CD3).
Journal of Histochemistry and Cytochemistry; 49: 911-918, 2001.
2-Lu D; Zhang H; Koo H; Tonra J; Balderes P; Prewett M. et al.
A fully human recombinant IgG-like bispecific antibody to both the epidermal growth factor receptor and the insulin-like growth factor receptor for enhanced antitumor activity.
J Biol Chem., 280(20): 19665-19672, 2005.
3-Payne WJ; Marshall DL; Shockley RK. and Martin WJ.
Clinical laboratory applications of monoclonal antibodies.
Clin Microbiol Rev., 1(3): 313–329, 1988.
4-Rosen ST; Winter JN. and Epstein AL.
Application of monoclonal antibodies to tumor diagnosis and therapy.
Annals of Clinical and Laboratory Science, 13(3): 173-184, 1983.
5-Songsivilai S. and Lachmann PJ.
Bispecific antibody: a tool for diagnosis and treatment of disease.
Clin Exp Immunol; 79 (3): 315-321, 1990.
6-Graziano RF. and Guptill P.
Chemical production of bispecific
antibodies.
Methods Mol Biol., 283: 71-85, 2004.
7-Segal DM. and Bast JEGB.
Production of Bispecific Antibodies.
Current protocols in immunology., 2003.
8-Kontermann RE.
Recombinant bispecific antibodies for cancer therapy. 26 (1): 1-9, 2005.
9-Jantscheff P; Winkler L; Karawajew L; Kaiser G; B?ttger V. and Micheel B.
Hybrid hybridomas producing bispecific antibodies to CEA and peroxidase isolated by a combination of HAT medium selection and fluorescence activated cell sorting.
Journal of immunological methods, 163: 91-97, 1993.
10-Kontermann RE; Volkel T. and Koren T.
Production of Recombinant Bispecific Antibodies.
Antibody Engineering: Methods and Protocols, 248: 227-242, 2003.
11-Kontermann RE.
Recombinant bispecific antibodies for cancer therapy.
Acta Paharmacologica Sinica; 26 (1): 1-9, 2005.
12-Gilliland LK; Clark MR; and Waldmann H.
Universal bispecific antibody for targeting tumor cells for destruction by cytotoxic T cells.
Proc Natl Acad Sci USA., 85: 7719-7723, 1988.
13-Gross-Hovest L; Brandl M; Dohelsten M; Kalland T; Wilmanns W. and Jung G.
Tumor-growth inhibition with bispecific antibody fragments in a syngeneic mouse melanoma model: The role of targeted T-cell co-stimulation via CD28.
International Journal of Cancer; 8 (1): 138-144, 1999.
14-Aramwit P; Liu X; Cong X; Lam L. and Cao Y.
Bispecific antibodies as emerging pharmaceuticals for tumor immunotherapy.
Drug Fut; 30 (10): 1013-, 2005.
15-Cau Y. and Laura L.
Bispecific antibody conjugates in therapeutics.
Advanced Drug Delivery Reviews; 55: 171-197, 2003.
16-Renner C. and Pfreundschuh M.
Tumor therapy by immune recruitment with bispecific antibodies.
Immunol Rev; 145: 179-209, 1995.
17-Zeidler R; Reisbach G; Wollenberg B; Lang S; Chaubal S; Schmitt B. and Lindhofer H.
Simultaneous activation of T cells and accessory cells by a new class of intact bispecific antibody results in efficient tumor cell killing.
J Immunol; 163:1246-1252, 1999.
18-Zeidler R; Mysliwietz J; Csanady M; Walz A; Ziegler I; Schmitt B; Wollenberg B. and Lindhofer H.
The Fc-region of a new class of intact bispecific antibody mediates activation of accessory cells and NK cells and induces direct phagocytosis of tumour cells.
Br J Cancer; 83: 261-266, 2000.
19- Weiner GJ. and De Gast GC.
Bispecific monoclonal antibody therapy of B-cell malignancy.
Leukemia and Lymphoma; 16: 199-207, 1997.
20-Drakeman DL; Fanger MW. And Wallace PK.
Bispecific antibodies for the treatment of tumours and infectious diseases.
Expert Opinion on Investigational Drugs; 6 (9):1169-1178, 1997.
21-Repp P; Van Ojik HH; Valerius T; Groenegen G; Wieland G; Oetzel C. et al.
Phase I clinical trial of the bispecific antibody MDX-H210 (anti-Fc RI x anti-HER-2/?neu) in combination with Filgrastim (G-CSF) for treatment of advanced breast cancer.
British Journal of Cancer; 89: 2234-2243, 2003.
22-Renner C. and Pfreundschuh M.
Tumor therapy by immune recruitment with bispecific antibodies.
Immunol Rev., 145: 179-209, 1995.
23-Lum LG. and Sen M.
Activated T-cell and bispecific antibody immunotherapy for high-risk breast cancer. Acta Haematol., 2001: 130-136, 2001.
24-Hartmann F; Renner C; Jung W, DaCosta L; Tembrink S; Held G. et al.
Anti-CD16/CD30 Bispecific Antibody Treatment for Hodgkin’s Disease.
Clinical Cancer Research., 7: 1873-1881, 2001.
|
| |
| |
| المجلد 5 ,
العدد 2
, محرم 1430 - كانون الثاني (يناير) 2009 |
|
|
|
