| المجلد 5 ,
العدد 3
, ربيع الثاني 1430 - نيسان (أبريل) 2009 |
| |
| دراسة مستويات اليوروتنسين II في الداء الكلوي في مرحلته النهائية وارتباطه بالببتيد الدماغي المدر للصوديوم كواصم للفشل القلبي |
| Study of Urotensin II Levels in End-Stage Renal Disease; and its Correlation with Brain Natriuretic Peptide as a Heart Failure Marker |
| د. رشا بشور*، أ.د. عدنان الصباغ** و أ.د. فايزة القبيلي* |
| Bachour R*; Al-Sabbagh A** and Al-Quobaili F* |
*كلية الصيدلة، جامعة دمشق. **كلية الطب البشري، جامعة دمشق
*Faculty of Pharmacy, Damascus University
**Faculty of Medicine, Damascus University
|
| الملخص Abstract |
الخلفية: اليوروتنسين Urotensin II II(UTN) عبارة عن ببتيد حلقي محفوظ بشكل كبير عبر الأنواع. يملك هذا الببتيد تأثيرات معقدة على الجهاز القلبي الوعائي والتي تعتمد على السرير الوعائي، والجرعة، والنوع. يرتفع التركيز البلازمي لهذا الببتيد في عدّة حالات مرضية من ضمنها الفشل الكلوي المزمن Chronic kidney failure (CKF)، والداء الكلوي في مرحلته النهائية End-Stage Renal Disease (ESRD)، ومازال غير واضح ما إذا كانت المستويات المرتفعة للـ UTN تلعب دوراً سامّاً أو صائناً للأوعية. تكون المضاعفات القلبية الوعائية معمّمة في الـ ESRD، مما يجعل هذه الحالة طرازاً طبيعياً مفيداً لتحري علاقة اليوروتنسين II بهذه المضاعفات.
الطرق: قمنا في هذه الدراسة بتعيين مستويات الـ UTN البلازمية عند مجموعتين من الأفراد: مجموعة مرضى الديال الدموي (54 فرداً)، ومجموعة الأصحاء من فئة عمرية مماثلة لمجموعة المرضى (34 فرداً)، باستخدام طريقة المقايسة المناعية الإنزيمية EIA. ثم قمنا باستقصاء العلاقة بين المستويات البلازمية للـ UTN والمستويات البلازمية للببتيد الدماغي المدرّ للصوديوم Brain Natriuretic Peptide (BNP)، كمؤشر للفشل القلبي ومنبئ للمضاعفات القلبية الوعائية عند هؤلاء المرضى.
النتائج: كانت المستويات البلازمية للـ UTN مرتفعة لدى مرضى الديال الدموي (8.22±5.98 نغ/مل) مقارنة مع المجموعة الشاهدة (3.77±2.42 نغ/مل). كما تبين أن الـ UTN مرتبط بعلاقة عكسية مع الـ BNP (r = - 0.42).
الاسـتنتاج: يمكن أن تشير هذه العلاقة العكسـية إلى أن انخفاض الـ UTN، عند ارتفاع عوامل
الاختطار القلبية، يمكن أن يكون استجابة تنظيمية مضادّة هادفة إلى تخفيف الأذية القلبية الوعائية، أو أن الـ UTN نفسه يلعب دور عامل محصّن.
|
Background: Urotensin II (UTN) is a cyclic peptide, which is highly conserved across species. This peptide has complex effects on the cardiovascular system, which depends on vascular bed, dose, and species. The plasma concentration of this peptide is increased in a variety of human disease states including Chronic Kidney Failure (CKF), and End-Stage Renal Disease (ESRD), and it’s still unclear whether high plasma UTN levels play a vasculotoxic or vasculoprotective role. Cardiovascular (CV) complications are pervasive in ESRD, which makes it a useful natural model to explore the relationship between UTN and CV complications.
Methods: In this study we determined plasma UTN levels of two groups of subjects: hemodialysis patients (n=54), and age matched healthy subjects (n=34), using Enzyme Immunoassay (EIA) method. Then we investigated the relationship between plasma UTN and plasma Brain Natriuretic Peptide (BNP), which is a strong biochemical indicator of heart failure, and a predictor of CV complications in those patients.
Results: Plasma UTN was significantly higher in hemodialysis patients (8.22±5.98 ng/ml) than in healthy subjects (3.77±2.42 ng/ml), and UTN was inversely related to BNP (r = - 0.42).
Conclusion: UTN down-regulation in the presence of high CV risk factors could be a counter-regulatory response aimed to mitigating CV damage, or that UTN itself acts as a protective factor.
|
| المقدمة Introduction |
يقوم الجهاز البولي بعدة وظائف هامة وضرورية من أجل الحفاظ على الوظيفة الفيزيولوجية الطبيعية للإنسان. ويعد الجهاز الرئيسي لطرح فضلات الجسم الاستقلابية وتنظيم طرح الماء والأملاح من الجسم. يستخدم مصطلح الفشل الكلوي Renal Failure بشكل أساسي لوصف فشل الوظيفة الاطراحية للكليتين، والذي يؤدي إلى احتباس الفضلات الآزوتية الناجمة عن الاستقلاب، وقد تصاب وظائف كلوية أخرى بالفشل كوظيفة تنظيم السوائل والشوارد والوظيفة الغدية الصماوية، ويقسم الفشل الكلوي إلى نوعين: حاد Acute، ومزمن Chronic.
يعرّف الفشل الكلوي المزمن بأنه تدهور لا عكوس في الوظيفة الكلوية، يتطور على مدى سنوات، ويمر بعدة مراحل انتهاءً بالداء الكلوي بمرحلته النهائية End-Stage Renal Disease، عندما يصبح معدّل الرشح الكبيبي Glomerular Filtration Rate (GFR) أقل من 10 مل/د/1.73 م2 (حيث المعدل الطبيعي حوالي 120 مل/د/1.73 م2)، وهنا تصبح المعالجة المعيضة (الديال أو الزرع) ضرورية.
يسبب الفشل الكلوي المزمن واليوريميا اضطراب جميع وظائف الجسم، وتعد الاضطرابات القلبية الوعائية أكثر الاضطرابات شيوعاً لدى مرضى الفشل الكلوي المزمن والداء الكلوي بمرحلته النهائية (ESRD)، كما تعد الأمراض القلبية الوعائية السبب الرئيسي للموت عند مرضى الديال الدموي (1).
اليوروتنسين II ببتيد وصفه بيرن وزملاؤه (2) بيولوجياً لأول مرة سنة 1967. وقد عزل لأول مرة من سمك القوبيون Goby fish من الـ Urophysis وهو الجزء الهرموني العصبي من الجهاز الإفرازي العصبي الذّنبي المميز لمجموعة الأسماك العظمية (3). يشتقّ اليوروتنسين II من طليعة ببتيدية أكبر، وهي سليفة طليعة اليوروتنسين II (pre-pro-UTN)، والتي ترمّزها جين مفردة. جرى التعرف على طليعتين عند البشر، إحداهما مكونة من 124 حمضاً أمينياً والأخرى مكونة من 139 حمضاً أمينياً، وينتج عن انشطار كل منهما بالتحلل البروتيني سلسلة مفردة مكونة من 11 حمضاً أمينياً هي اليوروتنسين II، الذي يتصف بوجود جسر ثنائي الكبريت بين ثمالتي السيستئين 5 و10 مشكلاً حلقة سداسية الببتيد في النهاية الكربونية، هذه الحلقة محفوظة عبر الأنواع ابتداءً من الأسماك إلى البرمائيات فالثدييات وهذا يدل على أن معظم الخصائص الوظيفية للـ UTN تكمن في هذه الحلقة (4، 5) (الشكل 1).
|
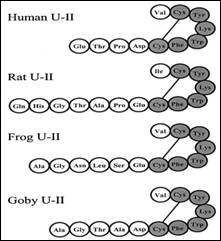
الشكل1: تتالي الأحماض الأمينية لسلسة الـ UTN الببتيدية حيث تظهر الحلقة المحفوظة عبر الأنواع ابتداءً من الأسماك إلى البرمائيات فالثدييات.
|
جرى مؤخراً التّعرف عليه على أنه ببتيد ذو فعالية وعائية عند الثدييات والذي يؤدي فعله عبر الارتباط بالمستقبل (orphan G-protein-coupled receptor 14)، وتبين أن للـ UTN تأثيراً قوياً مضيّقاً للأوعية (حوالي 8-110 أضعاف قوّة الـ endothelin -1) والذي يشهد على الأهمية الكامنة لهذا الببتيد في الفيزيولوجيا القلبية الوعائية (6). كما ظهر هذا الفعل المضيّق في عدّة دراسات أخرى أجريت على عدّة أنواع من الشرايين المعزولة من أنواع متعددة ومجردة من البطانة (7-9). كما ظهر أن للـ UTN أيضاً فعلاً موسّعاً وعائياً معتمداً على البطانة (10).
أما بالنسبة للتأثيرات الوعائية للـ UTN في الحيّ in vivo، فقد كانت نتائج الحقن داخل الوريد intravenous (IV) عند الجرذ، والقرد، والإنسان متباينة بين توسع وعائي (12، 11)، وتضيّق وعائي (7، 13)، وعدم حصول أي تأثير (14، 15). وكان تأثير حقن الـ UTN وريدياً على القلب هو خفض قلوصيّة البطين الأيسر وانخفاض ضغط دم مرافق عند القرد (16)، والجرذ (12، 17، 18).
ويشير هذا إلى أنّ تأثيرات هذا الببتيد على الجهاز القلبي الوعائي هي أكثر تعقيداً مما تم تصوّره سابقاً، وتعتمد على كل من السرير الوعائي، والجرعة، والنّوع.
أما بالنسبة للتأثيرات المركزية للـ UTN (أي نتيجة الحقن داخل بُطينات الدماغ) intracerebroventricular (ICV) فكانت عكس تأثيرات الحقن الوريدي، حيث نتج ارتفاع ضغط دم معتمد على الجرعة، وازدياد معدل ضربات القلب في كل من الجرذ (19) والخروف (20)، كما ازدادت قلوصية العضلة القلبية، والنتاج القلبي، وتدفق الدم في كل من الشريان التاجي، والكلوي، والمساريقي، والحرقفي. كما لوحظ أيضاً حدوث فرط غلوكوز الدم وارتفاع مستويات الأدرينالين البلازمية ومستويات هرمون الـ ACTH والإيبينفرين (20، 21). وهذا يدل على أن الـ UTN يفعل مركزياً بتعديل الوظيفة القلبية الوعائية عن طريق تنبه السبيل الكظري الودّي (الشكل 2). وقد أظهرت الدراسات ارتباط المستويات البلازمية للـ UTN بعدّة حالات مرضية، حيث لوحظ ارتفاع مستوياته البلازمية في الفشل القلبي (22-24)، وفرط ضغط الدم (25)، والتصلب العصيدي (26)، والاعتلال الكلوي (27)، والداء السكري نمط II (28).
|
| المواد والطرق Materials and Methods |
شملت دراستنا 88 فرداً موزعين إلى مجموعتين:
- مجموعة مرضى يجرون معالجة منتظمة بالديال الدموي regular dialysis treatment (RDT) 2-3 مرات أسبوعياً منذ 6 أشهر على الأقل (متوسط فترة الـ RDT: 60 شهراً، المجال: 6-228 شهراً). بلغ عدد أفرادها 54 مريضاً (24 ذكراً و30 أنثى). تراوحت أعمارهم بين 40-83 عاماً (المتوسط الحسابي ± الانحراف المعياري: 57.6 ± 11.6).
ـ المجموعة الشاهدة: شملت هذه المجموعة أفراداً أسـوياء ظاهـرياً لا يعانون أمـراض مشـخصة (كلوية أو قلبية وعائية). وقد جرى
انتقاؤهم بعد التأكد من نتائج تحاليلهم الروتينية وقياس الضغط الدموي. بلغ عددهم 34 فرداً (22 ذكراً و12 أنثى) وكانوا من فئة عمرية متقاربة مع الفئة العمرية لمجموعة المرضى، حيث تراوحت أعمارهم بين 40-70 عاماً (المتوسط الحسابي ± الانحراف المعياري: 52.8 ± 7.9).
تم الحصول على عينات المرضى من قسم الكلية الصناعية في كل من مستشفى الأسد الجامعي والمواساة، بينما أخذت عينات المجموعة الشاهدة من متطوعين أصحاء ظاهرياً.
أخذت عينات دم مرضى الديال الدموي صباحاً (بين 7-8 صباحاً) بعد صيام طوال الليل، وذلك في اليوم التالي لفترة عدم إجراء الديال (أي قبل البدء بالجلسة التالية)، وذلك من أجل تخفيف تأثير التبدلات الدورانية لحجم سوائل الجسم على أجهزة الضبط القلبي الوعائي. أخذت العينات على أنبوبين أحدهما جاف (للحصول على المصل من أجل التحاليل الروتينية) والآخر حاو على مضاد تخثر EDTA (للحصول على البلازما لمعايرة كل من UTN و BNP)، حيث كانت أنابيب الـ EDTA مبرّدة عند وضع العينة، ثم وضعت مباشرة على الثلج، وتم تنبيذها خلال نصف ساعة بمنبذة مبردة بالدرجة -4°م بسرعة 4000 rpm لمدة 5 دقائق. وزّع كل من البلازما والمصل في أنابيب إيبندروف وحفظت في المجمّدة بالدرجة -80°م إلى حين إجراء المعايرة.
أجريت مقايسة كل من الـ UTN، والـ BNP بطريقة الـ EIA باستخدام عتائد لشركة Phoenix Pharmaceuticals, USA، والتي تعتمد على مبدأ المقايسة المناعية الإنزيمية التنافسية. جرت الدراسة الإحصائية باستخدام اختبار T-Student لمقارنة المتوسط الحسابي للـ UTN بين مجموعتي الدراسة، وعدّ الفارق معتداً به عند مستوى دلالة p<0.05 ، واختبار Pearson لدراسة علاقة الارتباط بين المتثابتات المدروسة.
|
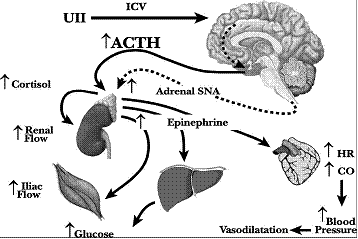
الشكل 2: التبدلات القلبية الوعائية والهرمونية عقب حقن الـ UTN داخل البطين المخي في الخروف المخدّر، الخط المنقط يشير إلى التبدلات الإفتراضية. SNA: sympathetic nerve activity .
|
| النتائج Results |
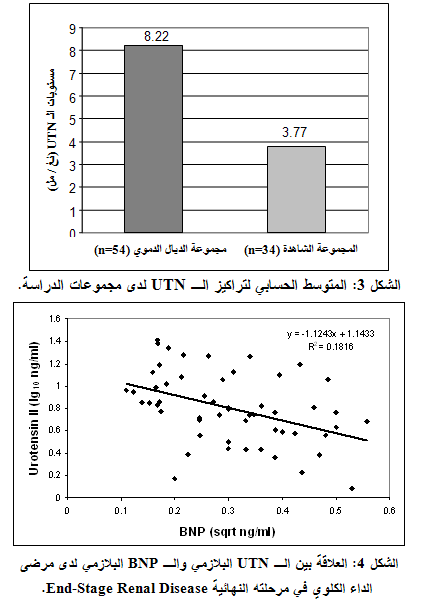
كانت المستويات البلازمية للـ UTN لدى مجموعات الدراسة كالتالي: المجموعة الشاهدة (المتوسط ± الانحراف المعياري = 3.77 ± 2.42 نغ/مل)، مجموعة مرضى الديال الدموي (المتوسط ± الانحراف المعياري = 8.22 ± 5.98 نغ/مل). وبتطبيق اختبار T-Student لوحظ ارتفاع يعتد به إحصائياً في متوسط مستويات الـ UTN البلازمية لدى مجموعة المرضى مقارنة بالمجموعة الشاهدة (p<0.001) (الشكل3).
وكانت المستويات البلازمية للـ BNP لدى مجموعات الدراسة كالتالي: المجموعة الشاهدة (المتوسط ± الانحراف المعياري = 0.045 ± 0.026 نغ/مل)، مجموعة مرضى الديال الدموي (المتوسط ± الانحراف المعياري = 0.105 ± 0.077 نغ/مل). وبتطبيق اختبار T-Student لوحظ ارتفاع يعتد به إحصائياً في متوسط مستويات الـ BNP البلازمية لدى مجموعة المرضى مقارنة بالمجموعة الشاهدة
(p<0.001).
وبدراسة علاقة الارتباط بين الـ UTN والـ BNP عند مجموعة المرضى بواسطة اختبار Pearson لاحظنا وجود ارتباط عكسي يعتد به إحصائياً (r = - 0.42, p<0.005 ) (الشكل4).
|
| المناقشة Discussion |
وجدنا من خلال دراستنا زيادة واضحة في المستويات البلازمية للـ UTN لدى مرضى الداء الكلوي في مرحلته النهائية مقارنة مع المجموعة الشاهدة، ويمكن أن يعود سبب هذه الظاهرة إلى انخفاض الإطراح الكلوي للـ UTN ، أو ارتفاع الاصطناع الكلوي له، حيث أن الـ UTN ببتيد واسع الانتشار ويعبّر عنه في أنسجة متعددة (الكليتين، القلب، البطانة الوعائية)(29)، أو للسببين السابقين معاً.
ظهر ارتباط عكسي بين الـ UTN والـ BNP والذي يعد مؤشراً حيوياً قوياً للفشل القلبي ومنبئاً عن المضاعفات القلبية الوعائية عند هؤلاء المرضى (30)، وبالتالي يمكن أن يدل انخفاض تركيز الـ UTN، عند ارتفاع عوامل الاختطار القلبية، إلى أنه استجابة معاكسة هادفة إلى تخفيف الأذية القلبية، أو أن الـ UTN نفسه يلعب دور عامل محصّن، وبالتالي فإن المرضى الذين لديهم الـ UTN مرتفع هم نسبياً محصنون وعائياً.
توافقت نتائج دراستنا مع نتائج Totsune K وزملائـه عام 2001، حيث كانت المستويات
البلازمية للـ UTN لدى المصابين بخلل وظيفي كلوي حوالي ضعفين إلى ثلاثة أضعاف مستوياته عند الأصحاء (27)، وكذلك مع نتائج Mallamaci F وزملائه عام 2005، حيث كانت هناك علاقة عكسية بين المستويات البلازمية للـ UTN والعوامل الهرمونية العصبية لدى مرضى الـ ESRD (31)،
ومع نتائج المجموعة نفسها عام 2006، حيث
كانت هناك علاقة عكسية بين الـ UTN ومتثابتات التصلب العصيدي والتفعيل البطاني لدى مرضى الـ ESRD (32)، ومع نتائج Zoccali C وزملائه عام 2006، حيث كان الـ UTN أخفض لدى مرضى الـ ESRD الذين يعانون من حوادث قلبية وعائية، وبالتالي كان منبئاً عكسياً للحوادث القلبية الوعائية عند هؤلاء المرضى (33)، ومع نتائج دراسة Zoccali C وزملائه عام 2008، حيث كانت النتائج داعمة لنظرية أن الـ UTN عامل محصن قلبي لدى مرضى الـ ESRD (34)، ومع نتائج دراسة Ravani P وزملائه عام 2008، حيث كان ارتفاع الـ UTN منبئاً لانخفاض اختطار الموت لأسباب قلبية وغيرها من الأسباب الأخرى لدى مرضى الـ ESRD (35).
|
 |
| المراجع References |
1-Haslett C; Chilvers E.R; Hunter J.A. and Boon N.A.
Davidson’s Principles and Practice of Medicine.
19th ed. Churchill Livingstone, 2002.
2-Bern H.A; Pearson D; Larson B.A. and Nishioka R.S.
Neurohormones from fish tails: the caudal neurosecretory system. I. "Urophysiology" and the caudal neurosecretory system of fishes.
Recent Prog. Hormone Res; 41: 533-552, 1995.
3-Bern H.A. and Lederis K.
A reference preparation for the study of active substances in the caudal neurosecretory system of teleosts.
J Endocrinol; 45:11-12, 1969.
4-Maguire J.J. and Davenport A.P.
Is urotensin-II the new endothelin?
Br J Pharmacol; 137: 579-588, 2002.
5-McDonald J; Batuwangala M. and Lambert D.G.
Role of urotensin II and it’s receptor in health and disease.
J Anesth; 21:378-389, 2007.
6-Douglas S.A; Sulpizio A.C; Piercy V; Sarau H.M; Ames R.S; Aiyar N.V; Ohlstein E.H. and Willette R.N.
Differential vasoconstrictor activity of human urotensin-II in vascular tissue isolated from the rat, mouse, dog, pig, marmoset and cynomolgus monkey.
Br J Pharmacol; 131: 1262-1274, 2000.
7-Ames R.S; Sarau H.M; Chambers J.K; Willette R.N; Aiyar N.V; Romanic A.M. and Louden C.S.
Human urotensin-II is a potent vasoconstrictor and agonist for the orphan receptor GPR14.
Nature, 401: 282-286, 1999.
8-Maguire J.J; Kuc R.E. and Davenport A.P.
Orphan-receptor ligand human urotensin II: receptor localization in human tissues and comparison of vasoconstrictor responses with endothelin-1.
Br J Pharmacol. 131: 441-446, 2000.
9-Gibson A.
Complex effects of Gillichthys urotensin II on rat aortic strips.
Br J Pharmacol. 91: 205-212, 1987.
10-Stirrat A; Gallagher M; Douglas S.A; Ohlstein E.H; Berry C. and Kirk A.
Potent vasodilator responses to human urotensin-II in human pulmonary and abdominal resistance arteries.
Am. J. Physiol. Heart Circ. Physiol. 280: 925-928, 2001.
11-Gibson A; Wallace P. and Bern H.A.
Cardiovascular effects of urotensin II in anesthetized and pithed rats.
Gen. Comp. Endocrinol. 64: 435-439, 1986.
12-Gardiner S.M; March J.E; Kemp P.A; Davenport A.P. and Bennett T.
Depressor and regionally-selective vasodilator effects of human and rat urotensin II in conscious rats.
Br. J. Pharmacol; 132: 1625-1629, 2001.
13-Bohm F. and Pernow J.
Urotensin II evokes potent vasoconstriction in humans in vivo.
Br. J. Pharmacol. 135: 25-27, 2002.
14-Affolter J.T; Newby D.E; Wilkinson I.B; Winter M.J; Balment R.J. and Webb D.J.
No effect on central or peripheral blood pressure of systemic urotensin II infusion in humans.
Br J Clin Pharmacol. 54: 617-621, 2002.
15-Wilkinson I.B; Affolter J.T; de Haas S.L; Pellegrini M.P; Boyd J; Winter M.J; Balment R.J. and Webb D.J.
High plasma concentrations of human urotensin II do not alter local or systemic hemodynamics in man.
Cardiovasc. Res; 53: 341-347, 2002.
16-Zhu Y.Z; Wang Z.J; Zhu Y.C; Zhang L; Oakley R.M. and Chung C.W.
Urotensin II causes fatal circulatory collapse in anesthesized monkeys in vivo: a 'vasoconstrictor' with a unique hemodynamic profile.
Am J Physiol Heart Circ Physiol. 286: 830-836, 2004.
17-Hassan G.S; Chouiali F; Saito T; Hu F; Douglas S.A. and Ao Z.
Effect of human urotensin-II infusion on hemodynamics and cardiac function.
Can J Physiol Pharmacol. 81: 125-128, 2003.
18-Gendron G; Gobeil F.J.R; Belanger S; Gagnon S. and Regoli D.
Urotensin II-induced hypotensive responses in Wistar–Kyoto (Wky) and spontaneously hypertensive (Shr) rats.
Peptides. 26: 1468-1474, 2005.
19-Lin Y; Tsuchihashi T; Matsumura K; Abe I. and Iida M.
Central cardiovascular action of urotensin II in conscious rats.
J Hypertens. 21: 159-165, 2003.
20-Watson A.M; Lambert G.W. Smith K.J. and May C.N.
Urotensin II acts centrally to increase epinephrine and ACTH release and cause potent inotropic and chronotropic actions.
Hypertension. 42: 373-379, 2003.
21-Hood S.G; Watson A.M. and May C.N.
Cardiac actions of central but not peripheral urotensin II are prevented by beta-adrenoceptor blockade.
Peptides. 26: 1248-1256, 2005.
22-Richards A.M; Nicholls M.G; Lainchbury J.G; Fisher S. and Yandle T.G.
Plasma urotensin II in heart failure.
Lancet. 360: 545-546, 2002.
23-Russell F.D; Meyers D; Galbraith A.J; Bett N; Toth I; Kearns P. and Molenaar P.
Elevated plasma levels of human urotensin-II immunoreactivity in congestive heart failure.
Am J Physiol Heart Circ Physiol; 285: 1576-1581, 2003.
24-Kruger S; Graf J; Kunz D; Stickel T; Merx M.W; Hanrath P. and Janssens U.
Urotensin II in patients with chronic heart failure.
Eur J Heart Fail; 7: 475-478, 2005.
25-Cheung B.M; Leung R; Man Y.B. and Wong L.Y.
Plasma concentration of urotensin II is raised in hypertension.
J Hypertens. 22: 1341-1344, 2004.
26-Bousette N; Patel L; Douglas S.A; Ohlstein E.H. and Giaid A.
Increased expression of urotensin II and its cognate receptor GPR14 in atherosclerotic lesions of the human aorta.
Atherosclerosis. 176: 117-123, 2004.
27-Totsune K; Takahashi K; Arihara Z; Sone M; Satoh F. and Ito S.
Role of urotensin II in patients on dialysis.
Lancet, 358: 810-811, 2001.
28-Totsune K; Takahashi K; Arihara Z; Sone M; Murakami O. and Ito S.
Elevated plasma levels of immunoreactive urotensin II and its increased urinary excretion in patients with Type 2 diabetes mellitus: association with progress of diabetic nephropathy.
Peptides. 25: 1809-1814, 2004.
29-Matsushita M; Shichiri M; Imai T; Iwashina M; Tanaka H; Takasu N. and Hirata Y.
Co-expression of urotensin-II and its receptor (GPR14) in human cardiovascular and renal tissues.
J Hypertens. 19: 2185-2190, 2001.
30-Zoccali C; Mallamaci F; Benedetto F.A; Tripepi G; Parlongo S. and Cataliotti A.
Cardiac natriuretic peptides are related to left ventricular mass and function and predict mortality in dialysis patients.
J Am Soc Nephrol. 12: 1508-1515, 2001.
31-Mallamaci F; Cutrupi S; Pizzini P; Tripepi G. and Zoccali C.
Urotensin II in end-stage renal disease: an inverse correlate of sympathetic function and cardiac natriuretic peptides.
J Nephrol. 18: 727-732, 2005.
32-Mallamaci F; Cutrupi S; Pizzini P; Tripepi G. and Zoccali C.
Urotensin II and biomarkers of endothelial activation and atherosclerosis in end-stage renal disease.
Am J Hypertens. 19: 505-510, 2006.
33-Zoccali C; Mallamaci F; Tripepi G; Cutrupi S; Pizzini P. and Malatino L.
Urotensin II is an inverse predictor of incident cardiovascular events in end-stage renal disease.
Kidney Int. 69: 1253-1258, 2006.
34-Zoccali C; Mallamaci F; Benedetto F. A; Tripepi G; Pizzini P; Cutrupi S. and Malatino L.
Urotensin II and cardiomyopathy in end-stage renal disease.
Hypertension. 51: 326-333, 2008.
35-Ravani P; Tripepi G; Pecchini P; Mallamaci F; Malberti F. and Zoccali C.
Urotensin II is an inverse predictor of death and fatal cardiovascular events in chronic kidney disease.
Kidney Int. 73: 95-101, 2008.
|
| |
| المجلد 5 ,
العدد 3
, ربيع الثاني 1430 - نيسان (أبريل) 2009 |
|
|
|
