| تتصف الخلية السرطانية بنموها وانقسامها غير المضبوطين، فانقسامها الفوضوي يولّد ملايين الخلايا التي تشكل بمجموعها ورماً tumor تفقد خلاياه تخصصها، وبانفلات بعضها من الكتلة الورمية تنتج النقائلmetastasis . من الثوابت عند دارسي بيولوجيا الخلية السرطانية، خصائصٌ تميزها وتساعد على فهمها ولعل أهمها هو استحالتها الخبيثة malignant transformation وهو مجموعة صفات أولها كونها تتحدر من نسيلة خلوية واحدة one cellular clone وثانيها التخلد Immortality، إذ لا تحد انقساماتها بعدد، كما أنها تفقد القدرة على إيقاف تضاعفها عند تماسها بسواها، حيث تتراكب مكونةً بؤراً صغيرة شاذة شكلياً. |
| دورة الخلية Cell cycle |
| تُقسم دورة حياة الخلية cell cycle إلى أربعة أطوار يضاف إليها طور السكون ويظهر تنظيمها معقداً جداً بسبب شلالات من التفاعلات الحيوية المترابطة والتي يصعب تحديد نقطة بدئها. وبشكل تخطيطي مبسط، يمكن القول أن الانقسام الفتيلي mitosis يُسبق بالأطوار G1، والتصنيع S والتهيؤ للانقسام G2. حيث تقوم الخلية، بعد عملية مضاعفة الدنا DNA كاملاً، بمراكمة المواد الضرورية لإنتاج خليتين بنتين. تنظم دورة الخلية من قبل بروتينات كيناز المتعلقة بالسيكلين cycline-dependant protein kinase أو Cdk، وهي خاضعة لتأثير عوامل النمو والجينات الورمية oncogenes والجينات الكابحة للورم. |
| الدُغما (المُسَلّحة) القديمة Ancien Dogma |
|
يمكن أن نربط السرطان بعدد من المسببات كخلل التوازن في عمل الهرمونات (سرطانات الثدي)، أو التشعيع الناتج عن الشمس (سرطان الجلد) أو المصادر الإشعاعية (سرطانات الدم)، أو التدخين (سرطان الرئة) أو التعرض لمركبات كيميائية مسرطنة لأسباب مهنية أو لكونها تستخدم كمضافات غذائية. إلا أن قلة من السرطانات البشرية ترتبط بفيروسات منها فيروسات دنوية DNA viruses مثل فيروس التهاب الكبد البائيHBV في السرطانات الكبدية، فيروس EBV في لمفومة بيركيت Burkitt، والفيروسات الغدية Adenoviruses وفيروسات الورم الحليمي Papilomaviruses في سرطان عنق الرحم. وفي العام الفائت أعلن عن اكتشاف فيروس مسرطن جديد هو الفيروسة التورامية لخلية مركل Merkel cell polyomavirus (12). ومن فيروسات الرنا الورمية RNA oncoviruses لا نجد سوى الفيروسات القهقرية Retroviruses مثل HTLV-1/2 التي سجل تسببها لحالات من الإبيضاض واللمفومة عند الأسيويين. وعلى الرغم من أن العديد من فيروسات هذه العائلة تحمل في مجينها جينات ورمية كفيلة بإحداث أورام عند أثويائها الطبيعيين natural hosts لم تسجل إلى الآن حالات أظهرت فيها قدرتها على توليد ورم عند البشر. ومع أن تعريفاً واضحاً يلخص السرطان هو الانقسامات المتسارعة غير المنضبطة للخلايا، إلا أننا لم نفهم السبب المؤدي إلى هذه الانقسامات، والذي ربما يكمن في تفعيل طلائع الجينات الورمية proto-oncogenes، وهي الفرضية التي منحت صاحبيها Bishop & Varmus جائزة نوبل عام 1989.
|
| نظرة وراثية A genetic view |
|
تملك جميع الثدييات وحتى الأوالي protozoa من حقيقيات النوى Eucaryotes في الحالة الطبيعية جينات تسمى طلائع الجينات الورمية Proto-oncogenes (من اليونانية Protos أي البدء أو الطليعة precursor وonkos أي الكتلة) ترمّز لبروتينات عدة لم تُعرف كلها بعد لكنها تلعب دوراً فيزيولوجياً هاماً في ما يتعلق بالنمو والتمايز الخلوي. وعلى الرغم من وجود نظائر فيروسية لهذه الجينات، لا ينبغي الاعتقاد أن طلائع الجينات الورمية التي نملكها في دنانا our DNA قد أتتنا من الفيروسات؛ فهي خلوية في أصلها، مما يفسح المجال لفرض أننا نحن قد نكون أورثنا بعض الفيروسات قدرتها المسرطنة.
من وجهة نظر مدرسية قديمة نسبياً، أمكن القول أن الجينات الورمية تحتل من حيث الفعالية المرتبة العليا في سببيات etiology تنشؤ السرطان، فمن خلال نواتجها البروتينية الورمية تتحكم هذه العائلة الجينية بالتفاعلات الكيميائية الحيوية المسيطرة على دورة حياة الخلية. وبنتيجة تأثيراتها يستحيل على الخلية أن تظل هامدة فتنحو نحو الانقسام والتضاعف. في البدايات الأولى ظن الكثر أن الطفرات المفعلة لانتساخ هذه الجينات تخضع لقوانين مندل في توصيفه للألِّيلين allele الصاغر recessiveوالسائد dominant. لكن الأمور ليست بهذه البساطة فمع تنوع المعارف اليوم لا يمكن أن نوجز سببيات السرطان في سياق ضيق كهذا، فليس السرطان ناتج تفعيل جينات ورمية وحسب! ومن الجدير بالذكر أننا نعلم اليوم بوجود عشرات من الجينات الورمية في حين وُصّفت بضعة جينات أخرى تعاكسها من حيث الفعل هي الجينات الكابحة للورم.
|
| الجينات الورمية Oncogenes |
|
نحصي ست عائلات، مترابطة نسبياً، صنفت فيها الجينات الورمية وفقاً لطبيعة الوظائف الفيزيولوجية للبروتينات التي ترمّزها تسهيلاً لدراستها (الجدول 1). فمن عائلة عوامل النمو Growth factors family هنالك البروتين c-sis الخلوي ونظيره الفيروسي v-sis المسؤول عن داء الغرن sarcoma عند القرود وهما يشابهان في تتالي أحماضهما الأمينية السلسلة ? لعامل النمو المشتق من الصفيحات Platelet derived growth factor (PDGF)، مما يمكنهما من التثبت على مستقبلاته الخلوية فيفعلان إنزيمات التيروزين كينازTyrosine kinases مطلقين شلالات من الفسفرة المنشطة، وتبين أن أورام الساركومة العظمية osteosarcomas والأورام الدبقية gliomae (الأكثر شيوعاً بين أورام الجملة العصبية المركزية CNS) تعبر بإفراط عن البروتين c-sis، مما يوجب إيضاح دوره في هذه الأنماط الورمية. ومن أشهر مستقبلات عوامل النمو التي تتمتع بفاعلية التيروزين كيناز ذات البنية المصونة والتي صنفها الباحثون في تسعة صفوف المستقبل neu (HER2) أو البروتين الورمي c-erb B2 وهو مستقبل عامل التمايز neu Neu Differentiation Factor الذي بات دوره الآن واضحاً في العديد من سرطانات الثدي. وعند الحديث عن الجينات الورمية لا يجب ذكر البروتين G الصغير ras (Small protein G ras) الذي وجد مفرط النشاط في أكثر من %80 من السرطانات المدروسة.
|
| تفعيل طليعة الجين الورمي
Proto-oncogene activation |
|
قد يكون التفعيل كمياً أو كيفياً وفي كلتا الحالتين يمكن إيجازه بمسبباته التقليدية، وهي من حيث الأهمية؛ أولاً، الطفرات mutations بأنواعها. ثانياً، الإزفاءات الصبغية translocations. فمثلاً، ينجم ابيضاض الدم النقوي المزمنChronic Myeloid Leukemia عن ما يعرف بصبغي فيلاديلفيا Philadelphia chromosome، الناتج عن إزفاء 22/9، وقد وصفت هذه الحالة للمرة الأولى عام 1960 إذ يؤدي الإزفاء إلى تشكيل جين خيمري chimeric gene (5'-bcr/abl-3') يرمّز بروتيناً خيمرياً يزن KDa 210 يمتلك فعالية TK أكبر من التي لـ bcr وحده، كما أن حلول الببتيد المُرمّز من bcr مكان النهاية الأمينية N-terminal للبروتين المُرمّز من abl قد زاد من فعاليته، على اعتبار أنه يملك أساساً المتوالية المسؤولة عن قدرته المفسفرة (انظر الشكل 4). ثالثاً، غرز مُحضِّض أو مجين فيروسي Insertion of Viral Promoter or viral genome وهي آلية فيروسات الرنا الورمية في إحداث الورم عند ثويِّها إلا أن مثالاً أكثر إثارة للفضول هو تجارب Fischer في المعالجة الجينية gene therapy لتدبير عوز المناعة المركب الوخيم المرتبط بالصبغي الجنسي X - combined severe immune deficiency X linked المعروف بداء الصبي الفقاعة bubble boy disease بتقانة تُداوِل في المختبر in vitro الخلايا الجذعية المولدة للدم Hematopoietic stem cells المختزعة من نقي العظام بفيروسات قهقرية Retroviruses والتي تحمل في مجائنها المستحالة نسخة سليمة من الجين IL2RG المرمّز للمتوالية غاما المشتركة لمستقبلات الانترلوكين الثاني IL2. فكان أن غرز الناقل المستخدم مجينه في سوية محضض طليعة الجين الورمي LMO2 أدى إلى تكاثر غير مضبوط لنسيلة واحدة من اللمفاويات التائية الناضجة، مما أسفر عن إصابة ثلاثة أطفال - من أصل عشرة أخضعوا للمعالجة الجينية - بالإبيضاض leukemia. رابعاً وأخيرا،ً التضخيم الجيني Gene amplification، إذ يمكن أن ينسب إلى فرط التعبير عن طليعة جين ورمي بشري بوجود عدة نسخ منه في الخلية ذاتها. فالخط الخلوي HL60 المأخوذ من سرطانة نقوية لمفاوية بشرية يحوي في مجينه عدة نسخ من الجين الورمي myc. وقد بينت الأبحاث أن فرط التعبير عن الجين c-erb-B2 مرتبط بسرطانة الثدي سيئة الإنذار bad prognosis ولا نهمل أن الإفراط كماً في نسخ mRNA لجين ورمي أمر ملحوظ، على الرغم من وجود نسخة واحدة فقط من الجين.
|
| الجينات الكابحة للورم
Tumor Suppressor Genes |
|
يتبين من اسمها أنها تعاكس وظيفياً الجينات الورمية، وهي على خلافها أيضاً فأثرها المحدث للسرطان - إن كانت طافرة لوحدها في غياب أي تفعيل لجين ورمي- مرهون بتطفر الألليلين معاً (نسختا الجين المحمولتان على صبغيين قرينين)، ومن هنا تتأتى ندرة السرطانات الناجمة عن خلل وراثي في الجينات الكابحة للورم. ضمن هذا المفهوم اقترح Alfred Knudson (9، 10)، من خلال دراسته لحالات من أورام الأرومات الشبكية Retinoblastoma عند الأطفال، فرضية "الضربتين" Two-hit hypothesis حيث أن حدثاً واحداً Single event ليس كافياً لتخليق الورم، إنما لا بد أن تراكم الخلية حدثاً ثانياً تكون نتيجته خبن التعبير عن الجين المضاد للورم، فالحدث الأول قد يطرأ على الخلية الجسدية somatic cell بعد الولادة أو على الخلية المنتشة germinal cell أثناء التخلق (المضغي) embryogenesis (الشكل 1). ومن حيث الوظيفة تلخص فعاليات البروتينات المرمّزة من هذه الجينات، من جهة، في كبت التعبير عن الجينات المفتاح لتأمين استمرارية الدورة الخلوية فيُجهض الانقسام قبل أن يبدأ ومن جهة أخرى، يساهم في قدح برامج الاستماتة الخلوية عند اللزوم.
|
الجدول 1: تصنيف مبسط للجينات الورمية في ست عائلات وأشهر الأمثلة عن كل منها.
أمثلة |
الصنف Category |
c-Sis |
عوامل نمو Growth factors |
مستقبل عامل النمو الأدمي Epidermal growth factor receptor
مستقبل عامل النمو البطاني الوعائي Vascular endothelial growth factor receptor
المستقبل HER2/neu |
مستقبلات التيروزين
Receptor tyrosine kinases |
الجين Abl في ابيضاض الدم النقوي المزمن نتيجة إزفاء فيلادلفيا |
كينازات التيروزين السيتوبلازمية
Cytoplasmic tyrosine kinases |
الكينازات المتعلفة بالسيكلين Cyclin-dependent kinases |
كينازات السيرين والثريونين السيتوبلازمية cytoplasmic kinases Serine/Threonine |
البروتينRas |
Regulatory GTPases |
الجين myc |
عوامل تنسخ Transcription factors |
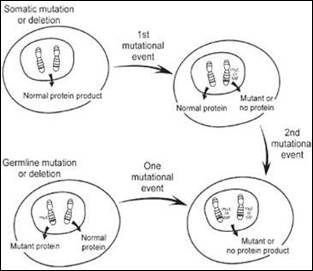
الشكل 1 : نظرية الضربتين: كي يتعطل عمل الجين الكابح للورم كلياً لا بد من أن تراكم الخلية حدثين معاَ يطالان كلتا النسختين من الجين.
|
| مثالان تعليميان Tow didactic examples |
|
لم تتوقف إلى اليوم الأعمال البحثية الساعية إلى تحديد الجينات التي يشتبه بكونها كابحة للورم، فكان أولها على الإطلاق Rb الذي اسنتسخه Friend عام 1986 (9) ومنذ ذلك الحين تتالت الدراسات لكشف النقاب عن أوجه فعالياته العدة؛ فالجينRb ، وُجد طافراً في ورم الأرومات الشبكية Retinoblastoma الشائع بنسبة 1 إلى 20000 طفل عالمياًَ، وهو ينجم عن تكاثر غير مضبوط للأرومات الشبكية cells Retinoblaste التي يفترض أن تتوقف عن التكاثر بعد تمايزها إلى مخاريط، لكن في حالة الورم فإنها تتكاثر بشكل هائل لتصل إلى الدماغ مسببةً الوفاة. يتوضع الجين Rb على الذراع الطويل للصبغي 13 (13q14)، وكان أول جين مضاد للورم يُوصّف ويعزل. وهو يرمّز للبروتين (p105) Rb، نووي التوضع والذي له المقدرة على تثبيط الانقسام الخلوي عبر إيقاف الدورة الخلوية. ومن الجدير بالذكر أن شذوذات أخرى للجين Rb تصاحب أنماطاً معينة من السرطانات مثل الغرن العظمي Osteosarcoma، وسرطانة الثدي والرئة.
|
| آلية عمل الجين Mechanism of action Rb |
يربط البروتين Rb بحالته غير المفسفرة عامل الانتساخ E2F، الذي يحفز انتساخ الجينات المتحكمة بعملية اصطناع الإنزيمات الضرورية للانقسام الخلوي مثل dihydrofolate reductase (DHFR)، thymidine kinase (ThK)، thymidylate synthase (TS)، polymerase DNA، cycline dependant kinase (Cdk)، (Cdc2) cycline A dependant kinase والعامل E2F نفسه. إن ارتباط Rb غير المفسفر بالعامل E2F يمنع هذا الأخير من لعب دور المنشط لانتساخ الجينات المرمزة للإنزيمات المذكورة أعلاه، وبالمقابل عندما يكون البروتين مفسفراً ينفصل عن العامل E2F ليصبح عندئذ فعالاً (الشكل 2).
إن فسفرة phosphorylation البروتين Rb تجري بتأثير بروتينات كيناز Cdk4 و Cdk7 المتعلقة بـ cycline D بالإضافة إلى Cdk2 المتعلق بـ cycline E ونظراً لأن لهذه الجينات دوراً حتمياً في فعالية البروتين Rb ولتورطها في نظم دورة الخلية فقد اقترح Sherr عام 1996 أن كل سرطان (أو افتراضياً كل سرطان all or virtually all) يعاني خللاً في سبيل Rb (10).
|
| البروتين p53 protein p53 |
في البدايات الأولى، وفي عام 1979 تحديداً، ظن مكتشفوا ذلك البروتين أنه منتج من قبل جين ورمي خلوي نظراً لكونه عامل انتساخ، لكن تبين لاحقاً دوره المركزي في إجهاض الاستحالة الورمية وأنه، مع الأسف، شديد التطفر في العديد من السرطانات البشرية.
يتوضع الجينTP53 على الذراع القصير للصبغي 17 وهو يرمّز البروتين p53 والذي يعد المفتاح لعدة آليات خلوية تحارب السرطان، فهو يتثبت على الدنا بشكل مربوع متجانس homotetramer ممارساً فعله كعامل انتساخ له أثره في مقاومة الخلية للعديد من إشارات الكرب stress signals، وفي ما يلي تعداد لبعض فعالياته (3): أولاً، يحفز انتساخ الجين p21 المرمّز للبروتين p21 (لا يجب الخلط بينه وبين البروتين p21 المرمّز من الجين الورمي ras. وللبروتين p21 أسماء مختلفة مثل WAF-1, CIP-1) الذي يثبط عدداً من السيكلينات والبروتينات كيناز المتعلقة بها، وبصورة خاصة Cdk-2 المسؤول عن انتقال دورة الخلية من الطور G1 إلى S عدا عن تآثره في تفعيل انتساخ العديد من الجينات فتثبيطه يعني لهذه الجينات حجبها وبالتالي توقف النمو الخلوي ودخول الخلية في حالة من الهجوع senescence أو حتى التأهب للاستماتة apoptosis. ثانياً، يكبح انتساخ الجينات المثبطة لعملية موت الخلية apoptosis، كما يكبح c-fosو c-myc وهي بدورها عوامل انتساخ لها بنية أصبع الزنك Zinc finger، والبروتينات الورمية المقاومة لأدوية متعددة MDR1 ( multi-drug resistance oncoprotein)، ثالثاً، يحفز انتساخ الجين Mdm2 المُرمز لإنزيم نووية هي رابطة الأُبيكيتين ubiquitine ligase Mdm2 التي تتآثر مع البروتين p53 وتثبطه فهي تعد بمثابة منظم سلبي لعمله.
لعل أشهر متلازمة تتضح فيها نتائج تطفير الجينTP53 المأساوية على العضوية هي متلازمة لي فروميني Li-Fraumeni syndrome والتي تتصاحب باختطار مرتفع نسبياً لتطوير سرطانات الثدي والأغران وأورام القولون الغدية وكما سنرى لاحقاً فالسرطان ليس حصيلة ازدياد مجرد في معدل الولادات الخلوية cell birth rate فحسب، بل هو تناقص معدل الاستماتة أيضاً والعامل الأكبر في قدح هذه الآلية هو الجينTP53 .
|
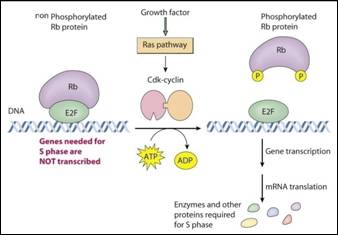
الشكل 2 : ارتباط فعالية Rb بشكله غير المفسفر، حيث يفعل التعبير عن إنزيمات طور التصنيع S بتحريره عامل الأنتساخ.
|
| تصنيف جديد New classification |
النظرة الحالية للجينات الكابحة للورم أكثر شموليةً مما كانت عليه منذ عقدين؛ فيمكننا تصنيفها اليوم إلى صنفين؛ أولاً، حرس البوابات gates keepers اصطلاحاً لجينات نقاط الفحص الخلوية cell check points الناظمة للانقسام والاستماتة، ومثالها الأشهر الجين APC الطافر في ورم القولون. وثانياً، جينات الرعاية care takers تعبيراً عن جينات نُظُم ترميم الدنا DNA repair، وهنا لا بد من التوسع قليلاً فهذا الصنف لم ينل حقه بعد من الدعاية والإشهار، فهو العامل الأول في سبيل معقد من عمليات حيوية تلعب دوراً محورياً في صيانة الكمال المجيني genome integrity. منذ حوالي عقود ثلاثة ربط الباحثون فكرة وجود استعداد وراثي للإصابة بالسرطان وجينات الرعاية، فالبيئة وما تحمله من ملوثات كيميائية ومواد مشعة قادرة على إلحاق أذيات بالدنا الخلوي DNA damage قد تكون نتيجتها تسرطن الخلية، وتجنباً لهذه الحصيلة الكارثية طورت الخلية، عبر ما يزيد عن 150 جيناً، خمس آليات متمايزة تخصصت كل منها في ترميم نوع محدد من أذيات الدنا (الجدول 2).
إن ارتباط جينات الرعاية بحرس البوابات ارتباط وثيق، إذ أن أذية الدنا تفعل التعبير عن هذه الأخيرة والتي، كما يتضح من اسمها، تعيق عبور الخلية من طور إلى آخر لاجمةً تقدم دورة الخلية، مما يتيح للأخيرة الوقت الكافي للتعبير عن جينات الرعاية وترميم أذية الدنا سواءاً أكانت بسيطة تنحصر في تحوّر كيميائي لأحد الأسس الأربع أم قطعاً وحيدة الطاق single strand break أو أذيات أشد وطأة على الخلية، كتوقف فقاعة تضاعف الدنا DNA duplication bubble خلال طور التصنيع أو ببساطة القطع ثنائي الطاق والذي قد يتصاحب ترميمه بفقد معتبر من مادة الدنا (5).
نعلم اليوم أن فعالية جينات الصنف الأول تتضح عند نقطتي عبور لدورة الخلية: من G1 إلى S ومن G2 إلى M، وخلال الطور S أيضاً وهي خاضعةٌ لإنزيمي كيناز هما ATM و ATR؛ فبينما يختص الأول بتفعيل منظومات الترميم نزلاً في حالة القطوع ثنائية الطاق وسواها من شذوذات الكروماتين، نجد الثاني فعالاً عند تعطل تقدم آلية تضاعف الدنا.
وبغض النظر عن التفاصيل والتعقيدات فإن المصب المشترك الأخير لكل شلالات الفسفرة التي يقدحها ATM وATR هو تفعيل الجين الكابح للورم p53، في عام 1991 كان أول مقال يوصف دوره في قدح الاستماتة (15) إذ أن إيتاء نسخة سوية منه في خلايا سرطانة الدم النقوية يحرض مظاهر الاستماتة من تشظٍ
نووي وتكدسٍ للكروماتين.
|
الجدول 2: أنظمة ترميم الدنا الخمس مع ذكر بعض الجينات التي تتواسطها والأمراض التي تنجم عن عطب هذه النظم.
المرض (عند عطب النظام) |
الجينات المتواسطة |
نظام ترميم الدنا |
أذية الدنا |
سرطان الرئة
Lung cancers |
DNA glycosylase gens, Polymerases (PARP1, 2) and Ligase |
استئصال أساس
Base excision repair (BER) |
التأكسد، الألكلة والحلمهة
Oxidation, Alkylation and Hydrolysis |
كارسينوما القولون الوراثية غير متعددة الموضع
Hereditary Non Polyposic Colon Carcinoma |
MSHs and hMLHs |
استئصال
اللا تراصف
Mis-match excision repair (MMR) |
مثنويات البيريميدين ونواتج التخرب الضوئية
Pyrimidine dimmers and 6, 4 Photoproduct |
تجفف الجلد الصباغي
Xeroderma pigmentosum
السرطانة حرشفية الخلايا للرأس والعنق HNSCC |
XPCs, RAD23B and Helicase gens |
استئصال نكليوتيد
Nucleotide excision repair (NER) |
لا تراصف نكليوتيدات صحيحة
Mispaired undamaged nucleotides |
متلازمتا وورنر وبلوم
Werner Syndrome
Bloom Syndrome |
XRCC2, Rad51, BRCA1, 2 and Helicase gens |
التأشيب التجانسي
Homologous recombination (HR) |
قطوعات الدنا ثنائية الطاق
DNA double-strand breaks |
ابيضاض الدم النقوي بالشذوذات الصبغية
Myeloid leukaemia by chromosomic aberration |
Ku70, Ku80 Nuclease and Ligase gens |
ربط النهايات
اللا تجانسي
Non-homologous end joining (NHEJ) |
|
|
| مقاومة الأورام للاستماتة Tumor resistance to apoptosis |
يتورط الموت الخلوي المبرمج programmed cell death أو الاستماتة الخلوية apoptosis في تنظيم العديد من الفعاليات الفيزيولوجية والإمراضية في الخلية وهو إحدى الآليات الأشد مصونية عبر سني التطور، إذ أن الاستتباب النسيجي tissue homeostasis ما هو إلا حصيلة تناغم تضاعف الخلايا من جهة وتماوتها من جهة أخرى فببساطة، غياب الاستماتة الفعالة كفيل بتحريض تشكل الأورام. وسمة هامة للسرطانات البشرية هي عدم قدرتها على المضي في برنامج الاستماتة استجابة لحاثات stimuli كان لها القدرة على قدحها في الخلايا السليمة المستجيبة (14).
إلى اليوم وصف سبيلان رئيسان للاستماتة، خارجي عبر تفعيل مستقبلات الموت death receptors كمستقبل عامل النخر الورمي tumor necrosis factor receptor وجزيئة السطح CD95 المعروفة باسم Fas، وسبيل داخلي تتوسطه المتقدرات mitochondriae، وكمحصلة، فإن تفعيل أحد هذين السبيلين ينشط إنزيمات الكاسباز caspases من بروتيازات السستئين cysteine proteases الكفيلة بتحطيم البنى النووية والسيتوبلازمية. تُنظم هذه الآليات برمتها بعوامل تنسيق إيجابية وسلبية تتحكم في بقيا الخلية cell survival.
لم تعرف إلى الآن الآليات الجزيئية المحرضة للاستماتة - أو أي سبيل موت آخر - والتي تقدحها معالجة الخلية بعوامل سامة cytotoxic agents، إلا أنه ومن المحتمل أن تكون بطبيعتها آليات تتعلق بماهية العامل السام نفسه تتوسطها سبل تأشير signaling pathways تُكبح، في الخلية السرطانية، عبر جزيئات مضادة للاستماتةantiapoptotic molecules، مما قد يفسر ولو جزئياً مقاومة بعض السرطانات لمعالجات شديدة الفعالية كالكيمائية والشعاعية وحتى المعالجات المناعية.
إلا أن الباب ما يزال مفتوحاً لتفسيرات أخرى تبرر مقاومة الخلية السرطانية للاستماتة، فقد وصفت تبدلات في مستقبلات الموت في عدة نماذج من السرطانات البشرية وعلى عدة صعد على مستوى الجزيئة نفسها؛ فقد ذكر التنظيم نُزلاً down regulation لـ CD95 على سطوح الخلايا الورمية في سرطانة الدم النقوية وأورام الأرومة العصبية neuroblastoma (8) في حين بينت دراسة أخرى أن خلايا سرطانة الرئة والقولون والورم الدبقي تعبر على سطوحها عن جزيئة المستقبل Decoy receptor 3 التي تنافس CD95 على ربائطها ligands المنشطة للاستماتة، مما يبطل مفعولها (13). إن تشوش هذه التفسيرات وتناولها تقريباً كل مستويات التأشير المصاحب للاستماتة قد تنعكس يوماً لمصلحة المريض؛ إذ قد تفيد لغايات التشخيص والإنذار ولربما العلاج أيضاً.
|
| مناعة الورم Tumor Immunity |
|
إن مبدأ المراقبة المناعية الذي اقترحه Macfarlane Burnet منذ نصف قرن يفترض أن الوظيفة الفيزيولوجية للجهاز المناعي هي أولاً التعرف والقضاء على النسائل الخلوية المستحالة قبل أن تنمو إلى أورام، وثانياً تصفية الأورام. وبالتالي فإن أحد العوامل السامحة بنمو الأورام الخبيثة هو قدرتها على التملص من آليات دفاع المضيف المناعية. فالأورام تعبر عن مستضدات antigens يتعرفها الجهاز المناعي، وقد أوضحت المشاهدات السريرية والتجارب على الحيوانات أنه على الرغم من كون الخلايا الورمية مشتقة من خلايا المضيف فإنها تثير استجابات مناعية، إذ تبين أن العديد من الأورام تحاط برشاحات خلايا وحيدة النواة mononuclear cell filtrats مؤلفة من اللمفاويات التائية والقاتلات الطبيعية Natural Keller cells والبلاعم الكبيرة Macrophages، وأن اللمفاويات والبلاعم الكبيرة المفعّلة تهاجر إلى العقد اللمفية المجاورة لمكان النمو الورمي. والجدير بالذكر أن وجود ارتشاحات خلايا لمفاوية في بعض أنواع الورم الميلانيني وسرطانة الثدي ينبئ بإنذار أفضل. ولعل المثال التجربي الذي يعزز هذا الطرح يكمن في إحداث غرن عند فئران سليمة بطلي جلدها بمادة الميثيل كولانتين methylcholanthene (MCA)، فإن جرت جباية الورم المحدث وازدراعه في فأر شقي النسل syngenic mouse (من الذرية نفسها) فإن الورم ينمو. وبشكل معاكس، إذا جرت إعادة ازدراع هذا الورم في المضيف الأصلي فإن الأخير سيرفضه مناعياً؛ فالفأر الذي أصبح منيعاً لورمه يبدو عاجزاً عن رفض أورام محدثة بالـ MCA مخلقة عند فئران أخرى، فهل كل ورم نوعي بمضيفه؟ إضافة لذلك، يمكن أن تنقل الخلايا التائية T cells من الحيوان الحامل للورم مناعةً منفعلةً passive immunity وقائية ضد الورم عند حيوان خالٍ من الورم (1). إن القدرة المستمنعة للأورام تتطلب أن تعبر الخلايا السرطانية عن مستضدات antigens تتعرفها الجملة المناعية كأجسام غريبة عن الذاتnon self .
|
| المستضدات الورمية Tumoral antigens |
وُصفت أنواع عدة من مستضدات الأورام التي يمكن أن يتم استعرافها من قبل اللمفاويات البائية والتائية، في السرطانات الحيوانية والبشرية، والتي نأمل أن تستخدم يوماً كلقاحات مضادة للسرطان، وقد اعتمد التصنيف القديم لهذه المستضدات الورمية على نموذج تعبيرها، فالمستضدات التي تعبر عنها الخلايا السرطانية وليس الخلايا السليمة دُعيت بالمستضدات النوعية للورم Tumor-Specific Antigens، وبعضها يكون محصوراً بأورام محددة، في حين يكون بعضها الآخر مشتركاً بين عدة أورام. بينما دعيت المستضدات الورمية المعبر عنها أيضاً على الخلايا الطبيعية بالمستضدات المرتبطة بالورم Tumor-Associated Antigens، وفي معظم الحالات تكون هذه المستضدات عبارة عن أجزاء خلوية طبيعية طرأ عليها خلل تنظيمي أو شذوذ، ومن هنا تأتي فكرة التصنيف الحديث للمستضدات الورمية والذي يعتمد كلياً على مصدرها (الجدول 3).
اعتمدت المحاولات الأولية لتنقية وتمييز المستضدات الورمية على إنتاج أضداد وحيدة النسيلة مختصة بالخلايا الورمية، ومن ثم تنقية وعزل المستضدات التي تتعرفها هذه الأضداد. لكن تبدو المستضدات الورمية التي تستهدفها الخلايا التائية T-cells وكأنها المحرضات الأساسية للمناعة المضادة للأورام والمكونات الواعدة في لقاحات الأورام المستقبلية، إذ تنحصر معرفتنا بمستضدات جرى تعرفها من قبل اللمفاويات السامة للخلايا Cytotoxic T Lymphocytes (CTLs)، وهذه المستضدات هي ببتيدات مشتقة من بروتينات عولجت في العصارة داخل الخلوية cytosol، وجرى تقديمها من قبل معقد التوافق النسجي الأكبر من النمط الأول MHC I على سطوح الخلايا الورمية ويجري العمل الآن على تحديد مستضدات تتعرفها الخلايا المساعدة CD4+ helper T-cells.
|
| الاستجابات المناعية المضادة للورم Anti tumor immune responses |
أظهرت آليات استجابة كل من المناعة الخلوية والمناعة الخلطية humoral and cellular immunity قدرتها على قتل خلايا السرطان في المختبر in vitro. ولكن يكمن التحدي لعلماء مناعة السرطان في تحديد أي من هذه الآليات تساهم في الاستجابات المناعية الوقائية ضد الأورام في الحي in vivo بهدف تعزيزها وتقوية هذه الآليات وزيادة فعاليتها في تصفية الخلايا الورمية. تتورط أربع آليات مناعية في الرد على السرطان وهي (1):
أولاً:اللمفاويات التائية T lymphocytes،
إن قابلية اللمفاويات السامة للخلايا لتوفير مناعة فاعلة ضد السرطان في الحي تشاهد بشكل واضح في التجارب على الحيوان عبر دراسة نماذج الأورام المحدثة بالمركبات الكيميائية
المسرطنة أو بالفيروسات الورمية. يمكن أن تؤدي CTLs وظيفة مراقب مناعي عبر التعرف على الخلايا وقتلها والتي من المحتمل أن تكون خبيثة، والتي تعبّر عن ببتيدات مشتقة من بروتينات خلوية طافرة أو بروتينات فيروسات ورمية ومقدمةً على جزيئات معقد التوافق النسجي الأكبر من النمط الأولI MHC.
من الجدير بالذكر أن الخلايا السرطانية لا تمتلك خاصية الخلايا المقدمة للمستضدات Antigen Presenting Cells فهي لا تعبر عن جزيئات المنبه المشارك co-stimulator molecules الضرورية لقدح الاستجابة الأولية للخلايا التائية، ولا عن جزيئات MHC II اللازمة لتفعيل الخلايا التائية المساعدة، التي تحرض تمايز اللمفاويات السامة الخلوية. في ظل هذه الحقائق لم يتبق لنا في محاولة تبرير رد الجملة المناعية على الورم إلا إمكان واحد هو أن بروتينات الخلايا الورمية الشاذة تُهضم من قبل APCs إلى ببتيدات تقدمها على MHC I لتتعرفها CTLs. فعلى خلاف الخلايا السرطانية تعبر الخلايا المقدمة للمستضدات APCs عن جزيئات المنبه المشارك التي تعطي الإشارات الضرورية لتمايز CD8+ إلى لمفاويات سامة خلوية مضادة للورم anti-tumor CTLs كما أنها تخلق MHC II التي تقدم مستضدات ورمية نوعية تفعل CD4+. وكتطبيق عملي لمبدأ التقديم المتصالب السابق ذكره سيمكننا قريباً اختزاع خلايا ورمية أو مستضدات ورمية وحضنها مع خلايا متغصنة Dendritic Cells من المريض نفسه ثم استعمالها كلقاحات مضادة للورم تحفز استجابة CTLs. ما يزال الدور الذي تلعبه الخلايا التائية المساعدة في المناعة السرطانية مبهماً جزئياً، ويمكن أن يتجلى في إفراز سيتوكينات تشارك في تطور فعالية CTLs كعامل النخر الورمي TNF وسيتوكينات أخرى كالانترفيرون غاما INF? التي يمكن أن تزيد التعبير عن MHC I على سطوح الخلايا الورمية، بالإضافة إلى زيادته حساسيتها للتحلل بفعل CTLs؛ كما أنه يفعل البلاعم الكفيلة بتصفية الخلايا الورمية إذ وُجد أن نسبة السرطانات ترتفع عند الفئران معوزة الانترفيرون غاما.
|
الجدول 3: واصمات الخلايا الجذعية السرطانية الشائع استخدامها والمرافقة لأنواع مختلفة من الأورام.
نموذج الورم Tumor type |
Marker |
Brain , colon , liver, lung, ovarian, pancreatic and prostate cancer |
CD133 |
Colorectal, HNSCC, liver, ovarian and prostate cancer |
CD44 |
lung, ovarian, prostate and thyroid carcinomas |
CD24 |
Breast, liver and lung cancers |
CD90 |
Acute myeloid leukaemia (AML) and lung cancers |
CD34 |
Lung and ovarian cancers |
CD117 |
Melanoma |
CD20 |
|
ثانياً: الخلايا القاتلة الطبيعية NK Cells
يمكن للـ NK أن تقتل العديد من أنماط الخلايا السرطانية، خاصةً الخلايا التي ينخفض فيها التعبير عن MHC I والتي يمكن أن تتجنب القتل المتواسط بالـ CTLs. وفي المختبر يمكن لخلايا NK أن تقتل الخلايا المعداة بالفيروسات وخطوط خلوية سرطانية معينة، خاصةً سرطانات الجملة المولدة للدم.
يمكن للقاتلات الطبيعية أن تستجيب لغياب جزيئة MHC I، حيث يتصاحب هذا الأمر بغياب إشارات تثبيطها التي تكون فاعلة طالما MHC I موجوداً. وإن بعض الأورام تفقد التعبير عن جزيئات MHC I كوسيلة للهروب من الاستجابة الخلوية القاتلة المتواسطة بالـ CTLs، لكن هذا يجعلها هدفاً لهجوم NK. كما أن بعض الأهداف الطبيعية للـ NK هي الخلايا الحاملة لصف التمايز CD16 (هو Fc?R III، أي المستقبل III للقسم المتبلور من الضد IgG) والذي يكون مغللاً بالأضداد IgG. إن زيادة مقدرة الخلايا NK القاتلة للورم تعزى جزئياً إلى تواسط بعض السيتوكينات بما فيها الإنترلوكينات IL2 , IL12 والإنترفيرونات. تدعى الخلايا NK المفعلة بالأنترلوكين الثاني IL2 بالخلايا القاتلة المفعلة باللمفوكينات LAK cells (Lymphokine-activated killer)، وهي تعزل من زروعات scultures لخلايا الدم المحيطي أو اللمفاويات المعزولة من رشاحات ورمية TIL حاوية على جرعات عالية من IL2. وعلى الرغم من وفرة المعلومات حول فاعليتها في المختبر إلا أن دور NK في الأحياء لا يزال قليل الوضوح، لكننا نعلم أن الفئران معوزة اللمفاويات التائية لا تبدي ميلاً لتكوين أورام عفوية لأنها تمتلك أصلاً قاتلات طبيعية تؤدي بالأساس وظيفة مراقب مناعي كفء.
ثالثاً: البلاعم Macrophages
إن دور البلاعم في المناعة الورمية يتوضح في المختبر، حيث يمكنها تصفية الخلايا الورمية بكفاءة أعلى من قدرتها على بلعمة الخلايا العادية. ولكن آلية تفعيل البلاعم في حالة الورم ما تزال غير معروفة بعد. تتبع البلاعم عدة آليات تمكنها من قتل الخلايا الورمية وقد تكون الآليات المتبعة نفسها لبلعمة العضيات الممرضة infectious micro-organisms وتتضمن هذه الآليات تحرير إنزيمات حالة lysosomal enzymes، ردود فعل تأكسدية متواسطة بالأكسجين وأكسيد الآزوت. كما تنتج عامل النخر الورمي TNF، وهو كما يتضح من اسمه عامل قادر على قتل الخلايا الورمية بإحداث خثار Thrombosis في الأوعية الدموية التي تغذيها.
رابعاً: الأضداد Antibodies،
يمكن لمريض السرطان أن يخلق أضداداً ضد المستضدات الورمية، ويمكن لهذه الأضداد أن تقتل الخلايا الورمية عبر تفعيل جملة المتممة Complement system أو عبر السمية الخلوية المتعلقة بالأضدادantibodies dependent cellular cytotoxicity (ADCC)، حيث تتواسط عملية القتل البلاعم أو الخلايا القاتلة الطبيعية الحاملة لمستقبل القسم المتبلور من الضد Fc. توضحت قدرة الأضداد على تصفية الخلايا الورمية بشكل كبير في المختبر in vitro، وفي السابق لم تقترح أدلة كبرى على أن المناعة الخلطية المضادة للورم تلعب دوراً كبيراً في الأحياء in vivo، إلا أن النظرة اليوم تبدلت فقد أثبت عقار Rituximab الضد الوحيد النسيلة anti CD20 فعاليته المضادة للورم في تدبير لمفومة الخلايا البائية اللا هودجكينية non Hodgkin B cell lymphoma، بينما رخص باستعمال Gemtuzumab (anti CD33 المقرون بالكاليكامايسين calicheamicin) لتدبير ابيضاض الدم النقوي الحاد (16). وبعيداً عن السرطانات الدموية فإن Herceptin (ضد المستقبل HER2/neu) شائع الاستخدام في تدبير سرطانة الثدي سواءاً لوحده أو في توليفة مع مضادات سرطان كيميائية أخرى. ولعل استخدام هذه الأضداد في المعالجة من شأنه أن يساعد في قدح استجابات مناعية تخصصية تتواسطها اللمفاويات (11). وأياً ما كانت آلية عمل الضد في حل الخلية الورمية فإن المحصلة واحدة، تَحَرُر عصارتها بما تحويه من بروتينات ورميـة تبتلعها الخلايـا المقدمـة للمستضدات وتهضمها إلى ببتيدات أصغر ثم تعرضها على اللمفاويات التائية المساعدة والقاتلة عبر حملها على جزيئات MHC II وMHCI، على الترتيب (الشكل 3). وفي المنظور نفسه يمكن أن تلعب هذه الأضداد دور الطاهية opsonin تساعد الخلايا المقدمة للمستضدات في قبط المستضدات الورمية وهضمها. عدا عن أن القسم المتبلور من الضد، عبر نوعين من المستقبلات متناقضين تماماً من حيث الفعالية الفيزيولوجية، يمكن أن يلعب دوراً غير مهمل في تحديد سيرورة الرد المناعي نحو التحمل tolerance أو الاستجابة، وذلك عبر محركات داخل خلوية عديدة التيروزين. ومن التوجهات
المستقبلية في هذا المضمار، تطوير أضداد نوعيـة تسـتهدف بقسمها Fc المستقبلات ذات المجالات داخل الخلوية الحاوية على محركات مناعية عديدة التيروزين مفعلة للاستجابة المناعية Immune Tyrosine Activating Motifs (ITAM)، من شأنها تعزيز الرد المناعي المتكيف المضاد للورم (16).
|
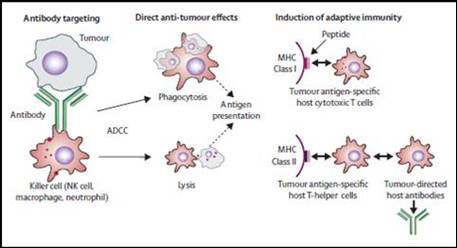
الشكل 3 : نموذج يقترح آلية قدح الأضداد وحيدة النسيلة المضادة للورم للاستجابة المناعية المتكيفية عبر السمية الخلوية وتهيئة البيئة الجزيئية الملائمة لتقديم المستضدات الورمية للخلايا الفاعلة.
|
| مقاومة الورم للاستجابة المناعية Tumor resistance to Immune response |
|
دون الخوض في التفاصيل والآليات الجزيئية المعقدة، يمكن القول بإيجاز أن فشل الاستجابات المناعية في إيقاف النمو الورمي أمر شبه حتمي، على الأقل في الحالات التي يصل فيها السرطان إلى طور التشخيص السريري المبكر. وهنالك العديد من الأسباب لعدم قدرة المناعة المضادة للورم على استئصال الخلايا المستحالة فهي في أصلها مشتقة من خلايا المضيف، ولذلك فهي تشبه الخلايا الطبيعية في العديد من النواحي. بمعنى آخر، تعبر معظم الأورام عن عدد قليل من المستضدات التي يتم تعرفها كغير ذاتية، وبالنتيجة تميل معظم الأورام لتكون ضعيفة الاستمناع. حيث تتضمن الأورام التي تثير استجابات مناعية عنيفة، المحرضة بالفيروسات الورمية التي يلعب فيها البروتين الفيروسي دور مستضد غريب، وكذلك الأورام المحرضة في الحيوان بوساطة مسرطنات فعالة potent carcinogens، والتي غالباً ما تتسبب بحدوث طفرات في الخلايا الطبيعية. كما أن نمو الورم السريع واتساعه يساهم في التغلب على قدرة الجهاز المناعي على تصفية الخلايا المستحالة، فالسيطرة على الورم تتطلب القضاء على كافة خلاياه الخبيثة.
|
| ما الجديد What is new ؟ |
تم التوافق على أن النمو الورمي المستدام تؤمنه جمهرة صغيرة فقط من الخلايا السرطانية تعرف بالخلايا الجذعية السرطانية Cancer Stem Cells، يعزى إليها على المدى الطويل تجدد كتلة الورم، وتبعاً لهذه الفرضية تمتلك الخلايا الجذعية السرطانية قابلية فريدة للتجدد الذاتي self-renewal، والقدرة على التمايز differentiation capability كما الأنسجة والخلايا الجذعية الطبيعية عن طريق الانقسام البطيء غير المتناظرslow asymmetric division كما يفترض أنها المسؤولة عن النقائل وكذلك عن مقاومة العلاج الكيميائي وتكرار ظهور الورم الخبيث بعد النجاح المبدئي للعلاج (2).
شهدت فرضية الخلايا الجذعية السرطانية نهضة ملحوظة في السنوات الخمس عشرة الماضية، من جراء الاعتراف بأن الخلايا السرطانية ليست على سوية واحدة في ما يتعلق بقدرتها على تكوين الأورام الأصيلة عندما تزدرع في الفئران الكفئة مناعياimmune compressed mice .
|
| عزل الخلايا الجذعية السرطانية
CSCs isolation |
لا نجد حتى اليوم خطةً عامةً تمكننا من عزل هذه الخلايا الجذعية السرطانية اعتماداً على بروتينات السطوح الخلوية بتوسط مقياس الجريان الخلوي flow cytometer، على الرغم من كم الأبحاث التي أشارت إلى أن جزءاً من جمهرات populations خلايا الورم دون سواها (2) تمتاز بالتعبير عن واصمات markers نوعية على سطوحها (الجدول 4). تتوفر تجارب أخرى تعتمد على الفحوص الوظيفيـة functional tests القائمـة على
مزايا الخلايا الجذعية السرطانية في قابليتها للتجدد الذاتي وإنشاء خطوط خلوية متغايرة heterogonous lineages، وقدرةٍ على تخليق الورم tumor forming potential. لكن فحوصاً كهذه تتطلب زراعة الخلايا الجذعية في المختبر ضمن مجموعة من الظروف التي قد تؤثر على سلوكها البيولوجي وصفاتها المورفولوجية morphological characters ولربما تغير من نموذج تعبيرها الجيني gene expression profil. بالإضافة إلى أن جمهرة الخلايا الأولية لا بد أن تكون عالية النقاوة، فإن شابتها خلايا أخرى لن يكون
للتنميط typing المعتمد على واصمات السطح أية قيمة، عدا عن كونها ستؤثر في نتائج ازدراع هذه الخلايا في أنواعٍ حيوانية أخرى بما يعرف بتجارب زرع الأجسام الغريبة xenotransplantation. إذ أوضحت الدراسات على النماذج الفأرية أن حقن مادة Matrigel (كمطرس matrix يشابه البيئة الجزيئية خارج خلوية) أو خلايا لا ورمية (كالسدوية stromal cells مثلاً) مع الخلايا الورمية يؤثر في قدرة هذه الأخيرة على إنشاء الورم، مما يفترض أن إشارات خارج خلوية ربما تكون مطلوبة لاتساع الكتلة الورمية.
إن الاستهداف الانتقائي للـ CSCs يبدو أنه استراتيجية فعالة للحد من مقاومة الورم للعلاج. لكن هذه الفرضية تواجه الكثير من التحديات، إذ تشير النتائج الأخيرة أن جمهرة الخلايا الجذعية السرطانية نفسها قد تكون غير متجانسة، من حيث خصائص مكوناتها وقدراتها على تشكيل الورم وإحداث النقائل، كما أنها قد لا تكون ثابتة على مر الزمن، فيمكن بالتالي أن تخضع لتطور نسيلي clonal evolution، عدا عن طبيعة البيئة المحيطة بهذه الخلايا والتي قد تلعب الدور الحاسم في سلوك السرطان في بعض الحالات.
|
الجدول 4 : التصنيف الحديث للمستضدات الورمية الذي يعتمد على مصدرها الجيني ومواضع التعبير عنها.
أمثلة Examples of human tumor antigens |
نمط المستضد Type of antigen |
البروتينات Ras و p53 الطافرة، على الترتيب |
منتجات الجينات الورمية أوالجينات الكابتة للورم |
عدة بروتينات في نماذج من الميلانوما تتعرفها اللمفاويات السامة للخلايا |
منتجات جينات لا ورمية طافرة |
البروتينات MAGE وMART في الميلانوما (تصنعها الخصية عادةً) |
منتجات جينات صامتة في النسج السوية |
إنزيم التيروزيناز في ورم الميلانوما |
منتجات جينات معبر عنها بشكل مفرط |
البروتينات E6 وE7 للفيروس الحليمي البشري HPV في سرطانة عنق الرحم |
البروتينات الفيروسية |
البروتين الجنيني ألفا Alpha Fetoprtein |
المستضدات الجنينية الورمية |
المستضدات GM2 وDM2 في ورم الميلانوما |
المستضدات الشحمية السكرية والبروتينية السكرية |
واصمات اللمفاويات البائية في لمفومة لاهودجكن، المستضد PSA |
مستضدات التمايز النوعية بالنسج |
|
| معالجات واعدة Promising treatments |
تبدو الجزيئات الصغيرة من مثبطات الكيناز small molecules Kinase inhibitors إحدى أكثر معالجات السرطان فعاليةً، ويقدر عددها بحوالي الثمانين. وتبين منذ سنين تورط شلال فعاليات الكيناز في سببيات العديد من الأدواء الاستقلابية metabolosis والمناعية بل حتى العدوائية infectious diseases. يرمّز المجين البشري حوالي 518 إنزيم كيناز تتوسط عمليات نقل الفسفات phosphate transfert متحكمةً بشلالات التأشير داخل الخلوي (6). ونظراً لارتباط هذه السبل ببعضها، عبر شبكات شديدة التعقيد، فإن الخلل في أحدها قد ينعكس سلباً على الخلية، بل لربما على مجاوراتها أيضاً، وبالتالي فإن انتخاب أحداها وتثبيطها انتقائياً يحتم استجابة فيزيولوجية معتبرة. إن فهم بنية الكينازات الفراغية يوضح أمراً لا غنىً عنه، إذ أنه يساعد على تصميم جزيئات تستهدف بصورة عالية الانتقائية كل فرد من عائلة الكينازات الكبيرة؛ ومعظم الجزيئات المستخدمة حالياً تستهدف موضع ارتباط الأدينوزين ثلاثي الفسفات ATP والمعروف بعروة التفعيل activation loop ومثالها الشهير الجزيئة STI571 (Gleevec; Imatinib) المستعملة لتدبير ابيضاض الدم النقوي المزمن الناجم عن صبغي فيلادلفيا (4) (الشكل 4).
من الأبحاث الواعدة في مجال معالجات السرطان تلك الهادفة إلى تثبيط التكون الوعائيangiogenesis في الورم، حيث تبين أن تشكل الأوعية الدموية ضمن الكتلة الورمية شرط أساسي لنموها، إلا أنه محصور في الأورام الصلبة، وذلك بإيتاء مستقبلات ذوابة لعوامل النمو أو ضواد antagonists لمستقبلاتها (7). وغني عن التذكير بأن الكثير من الدراسات تركز على البروتين p53 بغاية إيجاد عقاقير drugs يمكنها تفعيله سواءاً بزيادة التعبير عنه وانتساخه، أو بترميم الشكل الطافر منه في نماذج من سرطانات جسدية somatic cancer models، أو حتى زيادة فعاليته بشكل غير مباشر عبر كبح مثبطاته وأولها Mdm2، والذي غالباً ما يكون ناشطاً بإفراط في الأورام البشرية (3).
يتمثل التحدي الكبير في السنوات القادمة في كيفية استخدام جبل المعلومات المتراكمة في بيولوجيا ووراثيات السرطان والمناعيات الورمية لتصميم علاجات أكثر فعالية تحمل أمل الشفاء لكل مبتلٍ بداء العصر والذي لا تجدي معه وقاية، إن ارتبط بخلل جيني موروث.
|
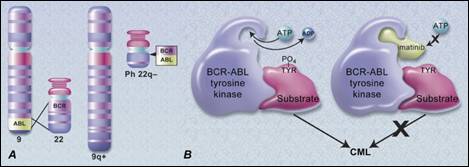
الشكل 4 : A - تمثيل تخطيطي للإزفاء الصبغي 22/9 الذي يشكل صبغي فيلادلفيا وانصهار الجينين Abl و Bcr .
B - آلية عمل Imatinib عبر حجب موقع ارتباط ATP بالبروتين الخيمري الوليد عن الانصهار.
|
| المراجع References |
1-Abbas A.K. and Litchman A.H.
Cellular and Molecular immunology.
Sauders Co Ltd, 5th edition 2003.
2-Akos Fabian et al.
Die Hard: Are Cancer Stem Cells the Bruce Willises of Tumor Biology?
Cytometry Part A: 67-74, 2009.
3-Alexei Vazquez, Elisabeth E. Bond, Arnold J. Levine and Gareth L. Bond.
The genetics of the p53 pathway, apoptosis and cancer therapy, Nature Reviews .
Drug discovery, 7: 979-987, 2008.
4-Brian J. Druker.
Translation of the Philadelphia chromosome into therapy for CML.
Blood, 112: 4808-4817 2008.
5-Chunying Li, Li-E. Wang and Qingyi Wei.
DNA repair phenotype and cancer susceptibility.
Int. J. Cancer: 124, 999-1007, 2009.
6-Jianming Zhang, Priscilla L. Yang and Nathanael S. Gray.
Targeting cancer with small molecule kinase inhibitors.
Nature Reviews, Cancer, 9: 28-39 2009.
7-Jie Ma and David J. Waxman.
Combination of antiangiogenesis with chemotherapy for more effective cancer treatment.
Mol Cancer Ther. 7(12): 3670-84 2008.
8-Jin Z, McDonald ER, Dicker DT. and El-Deiry WS.
Deficient tumor necrosis factor-related apoptosis-inducing ligand (TRAIL) death receptor transport to the cell surface in human colon cancer cells selected for resistance to TRAIL-induced apoptosis.
J Biol Chem. 279: 35829-39 2004.
9-Knudson A.G.
Cancer Genetics.
American Journal of Medical Genetics, 111: 96-102, 2002.
10-Knudson A. G.
A personal sixty-year tour of genetics And medicine.
Annu. Rev. Genomics Hum. Genet. 6: 1-14, 2005.
11-Louis M Weiner, Madhav V Dhodapkar. and Soldano Ferrone,
Monoclonal antibodies for cancer immunotherapy.
Lancet, 373: 1033-40, 2009.
12-Peter M. Howley and David M. Livingston.
Small DNA tumor viruses: Large contributors to biomedical sciences.
Virology, 384: 256-259, 2009.
13-Sheikh MS et al.
The antiapoptotic decoy receptor TRID/TRAIL-R3 is a p53-regulated DNA damage-inducible gene that is overexpressed in primary tumors of the gastrointestinal tract.
Oncogene, 18: 4153-9, 1999.
14-Simone Fulda
Tumor resistance to apoptosis.
Int. J. Cancer: 124, 511-515, 2009.
15-Yonish-Rouach E. et al.
Wild-type p53 induces apoptosis of myeloid leukaemic cells that is inhibited by interleukin-6.
Nature, 352: 345-347, 1991.
16-Yujian Zhang and Ira Pastan.
High Shed Antigen Levels within Tumors: An Additional Barrier to ImmunoconjugateTherapy.
Clin Cancer Res. 14(24): 7981-7986, 2008.
|
| |
