| المجلد 5 ,
العدد 5
, شوال 1430 - تشرين أول (أكتوبر) 2009 |
| |
| عزل الفيروسات العجلية وتنميطها بطريقة الـ PCR
عند الأطفال المصابين بإسهال في سورية
|
| The Isolation and Identification of Rota Virus by PCR
for Diarrhea Children in Syria
|
| رغد مسرابي، أ.د. ابتسام حمد و أ.د. محمد طاهر اسماعيل* |
| Misrabie R; Hamad E. and Ismail M.T.* |
كلية العلوم، جامعة دمشق
*كلية الصيدلة، الجامعة العربية الدولية الخاصة
Faculty of Science, Damascus University
*Faculty of pharmacy, Arab International Private University
|
| الملخص Abstract |
الخلفية: الفيروسات العجلية Rotaviruses من أهم الفيروسات المسببة للإسهال. وقد أطلق عليها هذا الاسم لأنها تبدو تحت المجهر الإلكتروني بشكل العجلة (وكلمة Rota باللاتينية تعني العجلة أو الدولاب).
لقد اكتشف هذه الفيروسة عند الإنسان عام 1973 Bishop ومساعدوه في استراليا وذلك عن طريق أخذ خزعة من المسلك المعدي المعوي من أطفال مصابين بالتهاب معدة أو أمعاء حاد. ولوحظ أن هذه الفيروسة تقاوم المطهرات والحرارة والخمائر الحالة. وتحافظ على تنسخها في درجة pH بين 3–10.
تصيب هذه الفيروسة المسلك المعدي المعوي وتتنسخ فيه بمستوى عال، وبهذا فهي تصيب آليات النقل مما يسبب خسارة المريض للملح والغلوكوز والماء ويؤدي بالتالي إلى الإسهال والإقياء..... الخ.
يتظاهر هذا الالتهاب عند الأطفال الصغار بمستو عال، مما يسبب التجفاف واضطراب توازن الأيونات المشكلة الرئيسية، أما الكهول فتكون أعراض الإصابة بمستوى أقل وضوحاً عادة.
تعد تقانة التفاعل السلسلي للبوليمراز PCR، أحد أهم التقانات التي تستطيع تعيين هوية الفيروسات العجلية لأنها تستخدم بشكل واسع في البيولوجيا الجزيئة.
الهدف: ركز هذا البحث على دراسة وتعيين هوية الفيروسات العجلية في مخبر وزارة الصحة في سورية نظراً لقلة الأبحاث التي تناولت الفيروسات العجلية ومقارنة النتائج مع نتائج الدول المتطورة.
الطرق: عينا هوية الفيروسات العجلية بوساطة تفاعل الـ PCR عند الأطفال المصابين بإسـهال
حاد والذين تراوحت أعمارهم بين الشهرين والسنتين (200 طفل)، واستخدمنا أيضاً طريقة المقايسة المناعية الإنزيمية EIA ثم توصلنا إلى العلاقة بين درجة الحرارة والإسهال والإقياء والتجفاف والمعالجة الفموية والوريدية والنسبة المئوية للعدوى.
النتائج والاستنتاج: أظهرت هذه الدراسة وجود 129 حالة عدوى كانت أعلاها 10.85% لدى الأطفال الذين بلغت أعمارهم السنتين عند الأطفال الذين يعانون من إسهالات حادة من أصل 200 حالة، وبلغت نسبة الإصابة 64.5%.
كما تبين أن نسبة الإصابة بالفيروسات الروتا قد بلغت ذروتها في شهر حزيران لعام 2008 بنسبة تساوي 74.07% لكنها وصلت إلى 60% في الشهر نفسه للعام السابق 2007، وهذا يدل على أن نسبة الإصابة بهذا الفيروس ترتفع عاماً بعد عام. وهذا يحتم علينا القيام بأبحاث واسعة حول طرق التحصين المستخدمة لحماية أطفالنا من هذه الفيروسات.
|
Background: Rotavirus is one of the most important viruses caused diarrhea. This name came from its shape under electronic microscope which looks like wheel. This virus was discovered in humans in 1973 from Bishop and his assistants in Australia by taking biopsy from gastro intestinal tract, from babies injured by stomach or intestine high inflammation. It was noticed that it resists heat, lyses yeasts, and disinfectants. It keeps on its replication on pH = 3-10. This virus infects the gastro intestinal tract and replicates in it at high level, so it injures transportation mechanisms which makes the patient lose salt ,glucose, and water causing diarrhea, vomiting, etc…. This inflammation presents in babies at a high level which cause dryness and a big problem in ions balance, otherwise this symptoms usually present at low level. PCR is one of the technology that diagnose and identify Rota virus because its used widely in molecular biology.Aim: This research focused on study and identified Rota virus in ministry of health in Syria because of the lack of researches there, and compare results with others in developing countries.
Methods: We identify Rota virus in Syria by PCR for diarrhea children from 2 months till 2 years old (200 babies). EIA was used also and we reached the relationship between heat, diarrhea, vomiting, dryness, oral fecal treatment and infection percentage.
Results and Conclusion: The study showed 129 infected states from 200, and infection percentage was 64.5%. The high one was 10.85% in 2 years old babies. In June 2008 reached 74.07% but it reached 60% in June 2007 and that means that this percentage rises year by year. So we have to make big researches about methods used to protect our children from this virus.
|
| المقدمة Introduction |
إن فضول الإنسان ومحاولاته العديدة لدراسة طبيعة الحياة والأحياء المحيطة به كانت العامل الأساسي لاكتشاف ورؤية الأحياء الدقيقة Microorganism، وذلك بفضل المجهر العادي والمجهر الالكتروني، كما استطاع بعدها أن يحدد مقدرتها على تبديل الوسط المحيط بها لمنفعة أو لضرر الإنسان.
وعند تقلب صفحات تاريخ علم الأحياء الدقيقة نجده حافلاً بالاكتشافات الهامة، ونستنتج منه أن البشرية استطاعت الانتصار في كثير من المعارك التي قامت بينها وبين هذه الأحياء، مما أسفر عن إمكان تسخير هذه الكائنات لصالح البشرية جمعاء.
تشكل الفيروسات مجموعة كبيرة من الأحياء الدقيقة وهي مجموعة غير متجانسة من العوامل الممرضة التي تعيش متطفلة على النسج الحية وتتميز جميعها بدقة حجمها لدرجة تسمح بمرورها عبر المرشحات الخزفية لأن أكبر فيروس لا يزيد حجمه على ربع حجم خلية جرثومة التيفوئيد Typhoid (حمد، 1995).
لا تمتلك الفيروسات القدرة على الحركة أو القيام بعمليات الاستقلاب الخلوية، وتتكاثر بالتنسخ Replication داخل خلية المضيف الحية فقط، إذ تستعمل ما يوجد في هذه الخلية من جسيمات ريبية وأحماض نووية لصناعة البروتين والحمض النووي الخاص بها (الشطي، 1998).
تتكاثر الفيروسات داخل خلايا جسم الإنسان والحيوان والنبات وخلايا الأحياء الدقيقة الأخرى، مسببة لها أمراضاً مختلفة، ومنها ما لا يسبب أي ضرر لخلايا المضيف كما هو الحال في عدوى نباتات التوليب بفيروس يكسبه خطوط جميلة متعددة الألوان بدلاً من اللون
الواحد (حمد، 1988).
وتضم الفيروسات بنية تحت خلوية تحتوي على ما يسمى بالجينوم genome وهو حمض نووي إما أن يكون DNA أو RNA، كما تحتوي على قفيصة بروتينية Capside وبعضها يحوي غلافاً أو أغلفة أخرى (Nestar, 1978).
وتعد الفيروسات وسيلة نقل للمادة الوراثية من خلية إلى أخرى.
إن الفيروسات عناصر تصيب معظم أنحاء جسم الكائن الحي، وهنالك فيروسات متعددة تصيب الأمعاء وتختلف في توزعها الجغرافي بين بلد وآخر، كما تختلف في نسبة إصابتها حسب الفصول، إذ تحدث الإصابة معظم الأحيان في فصل الشتاء وفي شهر حزيران من أشهر الصيف (حانوتي، 1994).
تنشأ الأمراض الفيروسية الغذائية نتيجة تناول أغذية أو شرب مياه تحوي أعداداً من كائنات حية دقيقة أو كميات من السموم الناتجة منها كافية لظهور أعراض المرض.
تعد الفيروسات العجلية Rotaviruses أو فيروسات الروتا (الشكل 1) من أهم الفيروسات الممرضة المسببة للإسهال. ولقد أطلق عليها هذا الاسم لأنها تبدو تحت المجهر الإلكتروني بشكل العجلة (وكلمة Rota باللاتينية تعني العجلة أو الدولاب) (Bass et al., 1995).
لقد اكتشف هذا الفيروس عند الإنسان عام 1973 من قبل بيشوب Bishop ومساعدوه في استراليا، وذلك عن طريق أخذ خزعات اثني عشرية من أطفال مصابين بالتهاب معدة أو أمعاء حاد (Anatol, 1985). ولوحظ أن هذه الفيروسات تقاوم المطهرات والحرارة والخمائر الحالة وتحافظ على وجودها في درجة pH بين 3–10، (Bern et al., 1992).
تصيب فيروسات الروتا مخاطية العفج والصائم، وأهم علاماتها المرضية التبدلات النسيجية كقصر الزغابات المعوية وانغلاف الأمعاء (Linhares et al., 1983).
ويتنسخ هذا الفيروس في مخاطية الأمعاء الدقيقة بشكل كبير فيؤذي آليات النقل، مما يسبب خسارة المريض للملح والغلوكوز والماء ويؤدي بالتالي إلى الإسهال.
وأهم أعراض الإصابة بهذا الفيروس الغثيان والإقياء والإسهال المائي غير المدمى.
يتميز التهاب المعدة أو الأمعاء بأنه يكون أشد
عند الأطفال الصغار، حيث يشكل التجفاف واضطراب توازن الأيونات المشكلة الرئيسية، أما عند الكهول فعادة ما تكون أعراض الإصابة غير واضحة (Miller, 2003).
تعد تقانة التفاعل السلسلي للبوليمراز PCR أحد أهم التقانات التي تستطيع تشخيص وتنميط الفيروسات العجلية (فيروسات الروتا) لأنها تعد من التقانات التي تستخدم بشكل واسع في البيولوجيا الجزيئية بشكل عام، لذلك كان لا بد من تنميط هذه الفيروسات لمعرفة نوعها والمجموعة الرئيسية التي تنتمي إليها.
ونظراً لقلة الدراسات التي تناولت فيروسات الروتا وعدم تنميطها حتى الآن في سورية فقد تركز هدف هذا البحث على عزل هذا الفيروس وتنميطه في مختبر البيولوجيا الجزيئية التابع لوزارة الصحة في سورية، ومقارنة النتائج مع نتائج الدول المتطورة.
|
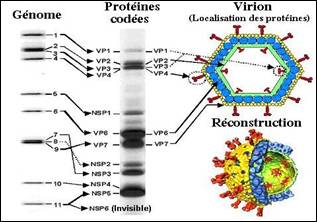
الشكل 1: بنية الفيروسة العجلية. |
| المواد والطرق Materials and Methods |
1- مكان جمع العينات: تمت عمليات جمع العينات من مستشفى الأطفال الجامعي ومستشفى المجتهد بدمشق، وذلك على عدة مراحل وعلى النحو التالي: تحديد المرضى وجمع وحفظ العينات في المستشفيات:
2- جمع المعلومات السريرية والديموغرافية:
- اختيار المرضى الموافقين لجميع معايير القبول بدون وجود أي معيار للرفض.
- تدوين المعلومات السريرية في القسم السريري من استمارة تحري الحالة.
- إتمام القسم السريري من المعلومات من سجل المريض.
3- جمع العينات البرازية:
- نقل حجم البراز بقدر حبة عنب صغيرة إلى عبوة بلاستيكية خاصة لجمع البراز ثم عنونتها وتغليفها بإحكام.
- حفظ البراز في البراد إلى حين إجراء اختبار المقايسة المناعية الإنزيمية (الإليزا) والتفاعل السلسلي للبوليمراز.
4- المواد والكواشف المستخدمة في تقانة (الإليزا) ELISA:
يحوي كاشف الفيروسة العجلية (الروتا) المستعمل في تحليل العينات البرازية المأخوذة ما يلي:
1- صفيحة معايرة ميكروية بلاستيكية Microtitration plate لوضع ما يعادل 96 بئر يحـوي كل منـها على المسـتضد
النوعي للفيروس.
2- محلول التخفيف Sample diluents: يحتوي هذا المحلول قرابة الـ 110 مل وهو محلول واقي ملحي يحوي عوامل ضد المكروبات وغالباً ما يكون لونه مائلاً إلى الأحمر الفاتح، كما ويمكن استخدامه كمحلول لعينة شاهدة سلبية Negative control.
3- محلول شاهد إيجابي Positive control، حيث يحوي فيروسات عجلية (روتا) نوعية غير فعالة ضمن محلول دارئة لونه مائل إلى الحمرة.
4- المحلول الرابط Conjugate: ويقوم بربط المستضدات الفيروسية العجلية بإنزيم البيروكسيداز ضمن المحلول الدارئي ولونه أزرق.
5- محلول دارئة الشطف Wash buffer: وهو محلول دارئة يحوي مواد منظفة وعوامل لا مكروبية.
6- الركيزة Substrate TMB: وتحوي مادة البيروكسيد المثبتة و (3,3-5,5) tetramethylbenzidine موجودة في محلول مولد اللون Chromogene الذي يظهر تبدلاً في اللون لدى وجود تفاعلات إيجابية.
7- محلول الإيقاف Stop solution: وهو عبارة عن محلول من حمض الكبريت ذو تركيز مناسب ويستخدم لإيقاف عملية التفاعل الإنزيمي اللوني.
5- تفسير الكشف عن الفيروس بوساطة تقانة المقايسة المناعية الإنزيمية (الإليزا) ELISA
الشاهد السلبي Negative control: يجب أن يكون عديم اللون وأن تكون قيمة قراءته أقل من 0.150 وحدة امتصاصية.
الشاهد الإيجابي Positive control: يكون لون العينة أزرق واضح مقارنة مع العينات السلبية، وتكون قيمة قراءته أكبر من 0.500 وحدة امتصاصية.
6- التفاعل السلسلي للبوليمراز وخطواته (Dubois et al., 1997)
تمسخ الدنا denaturation بالحرارة، ثم الالتحام annealing، ثم التطويل extension، وذلك حسب طريقة (Dubois et al., 1997).
تسمى مجموع هذه الخطوات دورة (الشكل 2)، وتتكرر هذه الدورات عدة مرات ليتم الحصول على عدد كاف من النسخ تسهل كشف وتنميط الفيروس، تجري هذه الدورات في جهاز خاص يسمى المدور الحراري Thermal Cycler.
الخطوة الأولى: التمسخ بالحرارة: تستخدم حرارة حوالي 94°م لزمن معين مما يؤدي إلى تباعد شريطي الـ DNA عن بعضهما.
الخطوة الثانية: الالتحام: أي ارتباط البادئة Primer مع السلسـلة الهدف. والبادئة:
تسلسل نوكليوتيدي قصير معلوم يقابل التسلسل الموافق المدروس وغالباً ما يكون موسوماً ولا يحدث التفاعل دونه، تستخدم حرارة 40–60 °م لزمن معين عادة من أجل حصول الالتحام.
الخطوة الثالثة: التطويل: حيث يبدأ إنزيم البوليمراز بوصل النكليوتيدات الموجودة في الوسط تباعاً وفق تسلسل متمم للسلسلة الهدف بدءاً من نقطة التحام البادئة، وذلك بحرارة حوالي 72?م لزمن معين.
في نهاية الدورة الأولى يتضاعف عدد النسخ الموجودة، ثم بتكرار الدورات يتضاعف العدد في كل مرة بشكل متوالية هندسية (2-4-8-16-32-64-128 ... الخ ...).
|
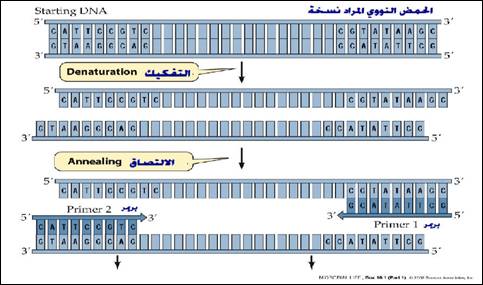
الشكل 2: خطوات التفاعل السلسلي للبوليمراز PCR .
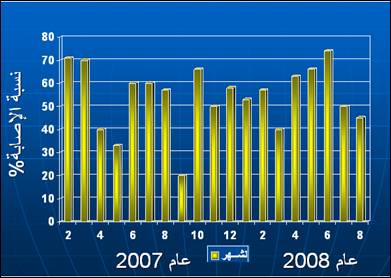
الشكل 3: نسب الإصابة بالفيروسة العجلية (الروتا) خلال عامي 2007–2008.
|
| النتائج Results |
أوضحت هذه الدراسة وجود 129 حالة إصابة بالفيروسات العجلية (الروتا) عند الأطفال الذين يعانون من إسهالات حادة من أصل 200 حالة تم إجراء الدراسة عليها إذ بلغت نسبة الإصابة 64.5%. بلغت أعلى نسبة إصابة لدى الأطفال في عمر السنتين إذ كانت 10.85%. وبلغت ذروة الإصابة لعام 2008 في شهر حزيران (74.07%)، أما في عام 2007 فكانت الذروة في شهر شباط إذ بلغت 71.42%، (الشكل 3).
وبدراسة تنميط الفيروسات المعزولة تبين أنها تنتمي للأنماط المصلية G1, G2, G9, G3 والأنماط P6, P4, P8.
وهذه الأنماط هي: G9، G1P[6]، G1P[4]، G2P[4]، G2P[6]، G1P[8]، G3P[6].
|
| المناقشة Discussion |
ُتعد هذه الدراسة هي الأولى من نوعها في تنميط الفيروسة العجلية (الروتا). لقد أجريت أبحاث في السنوات السابقة لمعرفة مدى انتشار هذه الفيروسة فقط وذلك بالكشف عنها بطريقة اللاتكس (حانوتي وإسماعيل، 1994) التي ُتعد أقل حساسية من التي استخدمناها في بحثنا الحالي.
تبين أن أعلى نسبة إصابة بالفيروسة بلغت لدى الأطفال المصابين بإسهال مائي حاد 61%.
وتبين أن حوالي ثلث حالات الإصابة قد ظهرت عند الإناث والثلثين عند الذكور، ولم يعرف بعد فيما إذا كان هنالك علاقة بين نوع الجنس البشري وقابلية الإصابة بالفيروسة العجلية.
أما بالنسبة لأثر البيئة على الإصابة بالفيروس فكانت أعلى نسبة إصابة قد ظهرت في محافظات ومدن المنطقة الشرقية، إذ بلغت 48.03%، تليها محافظة ريف دمشق 17.82%، وبلغت أقل نسبة إصابة لدى الأطفال القادمين من المنطقة الشمالية 3.09%، ولربما تدل هذه النتيجة على أن نسبة تلوث المياه والأطعمة التي يتناولها الأطفال في المنطقة الشرقية أكثر من غيرها من المناطق السورية. وقد يدل ذلك على نقص التوعية الصحية لدى الأهالي في تلك المنطقة وقلة النظافة الشخصية.
وبمقارنة نتائجنا مع الأعراض السريـرية التي
أخذناها من ملفات المرضى، لاحظنا أن أعلى نسبة إصابة بالفيروسة العجلية كانت لدى الأطفال الذين وصلت درجة حرارتهم بين 38-39.45%، مع إقياء شديد وتجفاف متوسط، ونبض مرتفع وضغط منخفض، ووجود ثنية جلدية ويافوخ طري وغائر. لوحظ انخفاض نسبة الإصابة بشكل ملحوظ بعد المعالجة سواءً أكان بالإماهة الوريدية أم الفموية، ولم نسجل هذا الانخفاض لدى الأطفال المعالجين بأدوية أخرى.
إن نتائج تنميط الفيروسات العجلية بطريقة التفاعل السلسلي البوليميرازي PCR، بينت أن كل حالات الإصابة المدروسة تحمل الفيروسة العجلية التي تنتمي إلى المجموعة A. ويظهر الشكل 4 نسبة توزع الأنماط المصلية في سورية.
يتبين من هذا المخطط أعلاه أن أعلى نسبة إصابة قد ظهرت لدى الأطفال الحاملين
للفيروس من نمط G2P4، بينما أظهرت النتائج في باقي دول العالم أن النمط المصلي الغالب هو G1P8، وهذا يدل على تميز النمط المصلي في سورية عن النمط الشائع في باقي البلدان. أما بالنسبة للدول المجاورة فلقد تبين أن الأنماط المصلية في جمهورية مصر العربية قريبة من الأنماط المصلية التي جرى عزلها في سورية.
ملاحظة: جرى أخذ النسب السابقة الذكر اعتماداً على معطيات مختبر البيولوجيا الجزيئية، مديرية مختبرات الصحة العامة، وزارة الصحة، دمشق والمكتب الإقليمي في القاهرة، منظمة الصحة العالمية.
لقد كان الهدف من دراستنا هذه هو تزويد الشركات المصنعة للقاح الفيروسة العجلية بالأنماط الموجودة في بلدنا.
إن التوصل إلى لقاح جديد يقضي على هذا الفيروس قريب جداً، ولكن مازالت هناك بعض العقبات لأن الدراسات حول هذا الفيروس في الدول النامية ما تزال ضحلة حتى الآن ولم يطلع على معرفة عواقبه الخطيرة على الأطفال. وقد أسفرت الجهود الاستطلاعية في أكثر من 40 دولة – قام بها Pressy و Parshar لعامي 2004–2005 [من مركز مكافحة الأمراض] مع منظمة الصحة العالمية، وبرنامج التقانة الملائمة في الصحة – عن أنهم مازالوا في بداية الطريق لتزويد صانعي القرار بما يحتاجون إليه من معلومات قبل أن يرحبوا باللقاح في دولهم. إضافة إلى أن المعلومات الأكيدة في تناول اللقاحات الحية عن طريق الفم في أفقر مناطق العالم مازالت متناقضة، مع العلم بأن هذه اللقاحات تكلف مئات الملايين من الدولارات لإنتاجها، ومن سيتحمل نفقات اللقاح لـ 135 مليون طفل يولدون في العالم كل عام (مجلة العلوم العددان 6/7 يونيو/ يوليو 2006).
ويتعلق أمل الكثير من الباحثين على أنه خلال عقد من الزمن، سيمكن القضاء على الفيروسة العجلية المسببة الأعظم للإسهال، والقاتل الرئيسي للأطفال في الدول النامية، وذلك بوساطة أقوى وأرخص الأسلحة، ألا وهي اللقاح (مجلة العلوم العددان 6/7 يونيو / يوليو 2006). وبمساعدة مجتمع دولي متعاون، وقادر على التنفيذ سوف تنضم الفيروسات العجلية إلى قائمة الفيروسات التي أمكن القضاء عليها بإعطاء اللقاح مثل شلل الأطفال والجدري والدفتيريا.
|
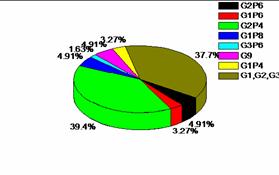
الشكل 4: نسب توزع كلا النمطين المصليين G–P للفيروسات المعزولة في سورية. |
| المراجع References |
|
1- د. حمد ابتسام
بيولوجيا الجراثيم والفيروسات، كلية العلوم – جامعة دمشق، المطبوعات الجامعية، الطبعة الثالثة، 1995.
2- د. الشطي محمد إياد، د. حشاش الكبب حسام الدين و د. زين الدين أمية
علم الأحيـاء الدقيقة الطبيـة وعلم المناعة،
مطبعة دار الشادي، 1988.
3- د. حمد ابتسام
الفيروسات والجراثيم، كلية العلوم، جامعة دمشق، مطبعة الاتحاد، 1988 .
4- د. حانوتي عامر
بحث علمي أعد لنيل درجة الماجستير بعنوان كشف الإسهالات عند الأطفال بين الصفر، السنتين الناجمة عن الحمة الدولابية Rotavirus بطريقة التراص باللاتكس. إشراف أ.د. محمد طاهر اسماعيل، 1994.
5- مجلة العلوم الأمريكية Scientific American. 22 (6/7)، 2006.
6-Anatol BC.
The pattern of gastrointestinal obstruction in children. 1985.
7-Bass DM. and Greenberg HB.
Infection of the gastrointestinal tract. Newyork: Raven press. 1995.
8-Bern C; Unicom BL; Gentsch JR; Banul N; Yunus M; Suck RB. and Glass RI.
Rotavirus diarrhea: correlation of disease severity with serotypes.
J. Clin. Mic. Biol, 1992.
9-Dubois E; Le Guyader F; Haugarreau L; Kopecka H; Cormier M. and Pommepuy M.
Molecular epidemiological survey of rotaviruses in sewage by reverse transcriptase seminested PCR and restriction fragment length polymorphism assay.
Appl Environ Microbiol. 63: 1794-1800, 1997.
10-Linhares AC; Gabbay YB; Mascarenhas JD; Freitas RB; Flewett TH. and Beards GM.
Epidemiology of rotavirus subgroups and serotypes in Belem, Brazil: a three-year study.
Ann. Inst. Pasteur Virol. 139 (1): 89-99, 1983.
11-Miller DS.
Applied microbiology.
N. Young . Manchester. 2003.
12-Nestar Roberts Pearsall and Mc Carthy.
Microbiology. 1978. Holth Saunders.
|
| |
| المجلد 5 ,
العدد 5
, شوال 1430 - تشرين أول (أكتوبر) 2009 |
|
|
|
