| الخلفية Background |
| يترافق كل من الالتهاب والإجهاد التأكسدي مع التصلب العصيدي atherosclerosis. إذ يتعلـق Myeloperoxidase (MPO) بكل من الالتهاب والإجهاد التأكسدي من خلال توضعه في الكريات البيضاء ودوره في تحفيز تشكيل عوامل مؤكسدة. توحي آخر الأدلة أن فعالية MPO تساهم في تطور التعصد atherogenesis. وبذلك فإن مقايسة MPO في البلازما يمكن أن تساهم في تصنيف اختطار الأمراض القلبية الوعائية risk stratification cardiovascular disease (CVD). |
| المحتوى Content |
| تم من خـلال عدة دراسات Cross-sectional studies, Case-control studies and prospective-cohort studies استقصاء العلاقة ما بين MPO وCVD. إن التباين في عدد أفراد الدراسة ومواد الاعتيان ومعاملة العينة وإجراء المقايسة تم التحقق منها بالتجربة. تشير أغلب الدراسات إلى أن مقايسة MPO في البلازما كانت مترافقة مع تصنيف اختطار CVD المتقدمة، ووراء تصنيف نتائج الاختطار كانت الواصمات المستخدمة بشكل روتيني في الممارسة السريرية. وعلى كل فقد كان هنالك عائق عند مقارنة هذه الدراسات الوبائية ذات العلاقة بـ MPO ونتائجها لأن تراكيز MPO تعتمد على طريقة المقايسة ومواد الاعتيان والإجراءات التحليلية، يمكن أن يفسر ولو بشكل جزئي الارتباط ما بين MPO وCVD من خلال أكسدة LDL وHDL المعتمدة على MPO ويؤدي ذلك إلى تراكم الكوليستيرول في جدران الشرايين. علاوة على ذلك فإن MPO قد ينقص من التوافر الحيوي لـ NO مما يؤدي إلى فشل وظيفة البطانة. وفي النهاية يحدث تزعزع للويحة العصيدية. |
| الخلاصة Summary |
| توحي الأدلة المتزايدة بأن MPO عامل مسبب للتصلب العصيدي ويمكن أن تحسن مقايسته من تقدير اختطار CVD. لكن قبل إمكان استعمال MPO في الممارسة السريرية المعتادة، لا بد من اتخاذ معايير لمعاملة العينة واختبارها. |
| الاختصارات |
CVD: Cardiovascular Disease
الأمراض القلبية الوعائية
MPO: Myeloperoxidase
CAD: Coronary artery disease
أمراض الشرايين التاجية
OR: Odds ratio
HR: hazard ratio
AMI: Acute myocardial infraction
احتشاء العضلة القلبية الحاد
ACS: Acute coronary syndrome
المتلازمة التاجية الحادة
NOS: nitric oxide synthase;
NO: nitric oxide;
ApoA-1: apolipoprotein A-1.
تعد CVD السبب الرئيسي المؤدي إلى الوفاة في المجتمعات الغربية. إذ تحرض عوامل اختطار CVD الرئيسية مثل فرط شحوم الدم وفرط ضغط الدم والتدخين زيادة معدل الاختطار والوفيات. هذا وإن تسلسل الحوادث المؤدية إلى CVD تتضمن ضعف وظيفة البطانة الوعائية وتشكل اللويحة العصيدية ومن ثم تمزقها (1). ويتدخل الالتهاب في كل مرحلة من مراحل تطور اللويحة العصيدية (1). علاوة على ذلك يعد الإجهاد التأكسدي عموما حدثا رئيسيا في تطور CVD (2).
Myeloperoxidase (MPO) هو إنزيم له علاقة بكل من الالتهاب والإجهاد التأكسدي، ويعبر عنه بغزارة في الحبيبات اللازوردية azurophilic granules لأغلب أنواع الكريات البيضاء المتضمنة العدلات neutophils والوحيدات monocytes (3).
يتحرر MPO من الكريات البيضاء في حالات الالتهاب ويحفز على تشكل العديد من المركبات المتفاعلة، المتضمنة تحت حمض الكلوريدريك، وبذلك فإن له دوراً دفاعياً في حماية المضيف من الكائنات الحية الدقيقة (3)، ومن جهة أخرى يتدخل MPO في تحريض وتطور التصلب العصيدي. بينت الأدلة المنبثقة عن الدراسات الوبائية خلال السنوات القليلة أن تراكيز MPO تكون أعلى عندما تترافق مع زيادة اختطار CVD وبشكل مستقل عن عوامل اختطار CVD التقليدية (4-15). وعلى كل فقد اصطدمت مقارنة هذه الدراسات الوبائية ذات الصلة بـ MPO ونتائجها حقيقة باختلاف معاملة العينة وطرق المقايسة المطبقة. والاختلافات المسندة إلى استعمال طرق مختلفة قد يكون لها تدخل هام في تفسير نتائج هذه الدراسات. تبين هذه المقالة الدليل الوبائي لـ MPO كواصم حيوي مناسب وعلاقته بـ CVD وتراجع آليات الوظيفة المرضية لـ MPO وعلاقتها بـ CVD وتوضح المواضيع التحليلية وما قبل التحليلية في قياس MPO.
|
| Myeloperoxidase والأمراض القلبية الوعائية Myeloperoxidase and Cardiovascular Diseases |
الدراسات الوبائية
Epidemiological studies
جاء في تقارير العديد من الدراسات الوبائية أن هنالك توجها لوجود ارتباط ما بين MPO و CVD وواصمات التصلب العصيدي على نطاق واسع من عدد أفراد الدراسة التي تتضمن مرضى التصلب العصيدي المتطور والمرضى الذين يبدون ألماً صدرياً حاداً كما في الجدول 1.
التصلب العصيدي المثبت
Established Atherosclerosis
إن أول تقرير وبائي للارتباط ما بين MPO وCVD كان في دراسة حالة مراقبة Case-control study التي نشرت من قبل Zhang وزملائه عام 2001 (15). درس فيها تراكيز MPO، والذي يعبر عنها إما على أساس كتلة في كل ملغرام من بروتين العدلات أو على أساس كتلة MPO في كل ميلتر من الدم لدى الذين لديهم اختطار لـ CAD. في Case-control designed أجريت على 158 مريضاً لديهم أمراض CAD مثبتة و 175 شاهداً؛ كانت تراكيز MPO لدى مرضى CAD أعلى بشكل واضح لدى مقارنتها بالمجموعة الشاهدة. تبين أن MPO كان مترافقا مع زيادة اختطار CAD بالنسبة لـ MPO الكريات البيضاء بمقدار 11.9 ضعفاً. وزيادة الاختطار لـ CAD بالنسبة لـ MPO الدم بمقدار 20.4 ضعفاً.
في Cross-sectional study قام بها Duzguncinar وزملاؤه كان MPO مرتفعاً لدى مرضى CAD وارتبط ذلك بمدى وشدة التصلب العصيدي للأوعية التاجية (16).
درس Meuwese وزملاؤه علاقة ارتباط MPO مع CAD على 1138 مريض CAD و 2237 شاهداً (11). وتبين أن MPO يرتبط مع CAD بعد التكيف مع عوامل الاختطار التقليدية odds ratio [OR, 1.36 (95% CI) 1.07-1.73].
في Case-control study أجريت على 680 مريضاً، 382 منهم مرضى بأمراض CAD مستقرة و 194 شاهداً جرى لهم تصوير الأوعية التاجية، كانت تراكيز MPO أعلى لدى مرضى CAD مقارنة مع المجموعة الشاهدة (14). بالإضافة إلى ذلك وجد أن تراكيز MPO ترتبط بوجـود CAD. [[OR, 2.08 (95% CI), 1.54-2.81.
درس Mocatta وزملاؤه كل أسباب الوفيات على مدار 5 سنوا ت على 512 مريض احتشاء عضلة قلبية مثبت (12). المرضى الذين كانت لديهم قيم MPO فوق المتوسط زاد
الاختطار لديهم ضعفين تقريبـاً [hazard ratio (HR) 1.81 (95% CI) 1.07-3.05] من كل أسباب الوفيات مقارنة مع المرضى اللذين كانت لديهم قيم MPO أقل من المتوسط. درست القيمة الإنذارية للـ MPO لمعدل الوفيات واحتشاء العضلة القلبية من قبل Baldus وزملائه على مجموعة ضمت 1090 مريضاً يعانون من ACS خلال فترة 6 أشهر من المتابعة (4). وعلى الرغم من أنه لم يكن هناك ارتباط مع الواصمات الأساسية لاختطار CVD والالتهاب والمتضمنة التروبونيـنT وربيطة CD40 الذوابة و CRP فالمرضى الذين كان MPO مرتفعاً لديهم زادت لديهم نسبة اختطار الحوادث الجانبية بمقدار2,25 ضعفاً [95% CI, 1.32-3.82] كعود الاحتشاء أو الوفاة.
عولج 38 مريضاً لديهم موجة الاحتشاء ST ويعانون من صدمة قلبية المنشأ بالتدخل التاجي، كان MPO أقوى مشعر مستقل لعواقب الأمراض القلبية الوعائية معبر عن معدل الوفيات في المستشفى [OR, 3.9 (95% CI:1.8-7.5)]، وذلك بعد ضبط المتغيرات السريرية والمخبرية والتصوير الوعائي (8).
درس Brevetti وزملاؤه القيمة الإنذارية للـ MPO مقابل CRP للحوادث القلبية الوعائية المميتة وغير المميتة على 156 مريضاً مصاباً بأمراض الشرايين المحيطية (6). رغم العدد القليل نسبياً من الحوادث n = 17)) خلال 6 أشهر من المتابعة بين الباحثون أن MPO مشعر قوي للحوادث الجانبيـة [[HR 6.80 (95% CI) 1.20-38.69 بينما لم يكن CRP كـذلك [[HR 0.88 (95% CI) 0.60-1.29.
درس Exner وزملاؤه تطور تضيق الشريان السباتي الداخلي على 1019 مريض CAD غير مصحوبين بأعراض مع متابعة 7.5 أشهر (9). فالمرضى الذين كان التضيق لديهم متطوراً كانت تراكيز MPO مرتفعة بشكل واضح مقارنة مع المرضى ذوي الوضع المستقر. والعلاقة ما بين MPO وتطور التضيق عدلت من خلال مستويات HDL. فتراكيز MPO فوق المتوسط ترافقت مع زيادة اختطار تطور المرض بمعدل 2.6 ضعف 95% CI, 1.4-4.8 ]] لكن فقط لدى المرضى اللذين كانت لديهم مستويات HDL أدنى من المتوسط.
تشير هذه الدراسات جميعها إلى أن MPO يمكن أن يكون واصماً جديداً هاماً للحوادث القلبية الوعائية. وينبغي الآخذ بعين الاعتبار أن هذا ليس تحيزا لـ MPO إذ أن هنالك موجودات سلبية؛ فلم يجد Stefanescu وزملاؤه ارتباطاً مستقلاً ما بين MPO وكل الأسباب المؤدية للوفاة لـ 382 مريضاً مصاباً بأمراض CAD مستقرة خلال 3.5 سنة من المتابعة (17). وخلافاً للدراسات المذكورة أعلاه والتي أشارت كل منها إلى وجود علاقة نوعية ما بين MPO وCVD، فإن هنالك Case-control study وحيدة لدى مرضى HIV لم تظهر وجود ارتباط مستقل نوعي للـ MPO مع حوادث CVD (18). وفي دراسة أخرى أجريت على مرضى متطوعين تم إخضاعهم لتصوير الأوعية التاجية لم تبد اختلافات نوعية في تراكيز MPO للمرضى الذين لديهم CAD مستقرة مقارنة مع أولئك اللذين لم يثبت أنهم مرضى CAD (19). إن التفسير الممكن لهذه الموجودات السلبية قد يكون الاختطار الأقل لدى مرضى CAD المستقرة مقابل مرضى CAD غير المستقرة. إن الحوادث القلبية الوعائية تكون أكثر احتمالاً لدى مرضى CAD غير المستقرة (20). قد تشير هذه المشاهدات إلى أن MPO واصم حيوي مفيد بشكل خاص لدى الأشخاص ذوي الاختطار العالي.
الإبداء الحاد للألم الصدري
Acute Presentation with Chest Pain
في دراسة مقطعية تصالبية Cross-sectional study قام بها Esporcatte وزملاؤه، كانت تراكيز MPO الأعلى مـن pmol/L 100 ذات حساسية تشخيصية 92% ونوعية 40% كواصم لمعرفة المرضى اللذين لديهم احتشاء قلبي AMI دون حدوث ارتفاع في موجة ST بتخطيط كهربية القلب. في هذه الدراسة جرت معرفة AMI من خلال التروبونين I الذي كان تركيزه أكثر من g/Lµ 1.0 (21).
وخلافا لذلك لم يجد Apple وزملاؤه قيمة تشخيصية إضافية للـ MPO مقارنة مع التروبونين I لدى المرضى المشخصين سريرياً بالمتلازمة التاجية الحادة ACS (22).
رغم أن MPO والتروبونين I أظهرا الحساسية التشخيصية نفسها فإن النوعية التشخيصية للـ MPO كانت أقل من التروبونين I بشكل واضح.
بلإضافة إلى ذلك فإن دراسة Apple وزملائه السابقـة (23). التي أظهرت أن المرضى الذين يبدون علامات ACS كانت التراكيز العالية من التروبونين I لديهم مترافقة مع كل أسباب معدل الوفيات بينما التراكيز العالية من MPO لم تترافق مع ذلك.
درس Morrow وزملاؤه القيمة الإنذارية للـ MPO وربيطة CD40 الذوابة والتروبونين I و CRP على 1524 مريضاً يعانون من ACS. فالمرضى ذوي التراكيز العالية من MPO كانوا على درجة عالية لاختطار AMI غير القاتل أو الدخول للمستشفى بسبب ACS. بالإضافة إلى ذلك كان MPO مترافقاً مع الحوادث الإقفارية المعاودة بعد تسوية ربيطة CD40 الذوابة والتروبونيـن I وCRP وعوامل اختطار الأمراض القلبية الوعائية الرئيسية الأخـرى (13) .
قام Brennanوزملاؤه بتقييم الأهمية السريرية للـ MPO للتنبؤ بـ AMI والآثار الجانبية بعد 30 يوماً و6 أشهر من المتابعة لدى المرضى الذين يعانون من ألم صدري حاد (5). كانت تراكيز MPO أعلى لدى المرضى الذين يعانون من AMI مثبت من أولئك اللذين لا يبدون AMI مثبت. كانت تراكيز MPO لدى المرضى سلبيي التروبونين T مبدئياً ثم أصبحوا إيجابيي التروبونين T فيما بعد من أولئك المرضى اللذين لا يبدون ارتفاعاً في التروبونين T. وإن المرضى الذين لديهم MPO عال كانوا أكثر ميلاً للإصابة بحوادث قلبية وعائية خلال 30 يوماً [OR 4.7 (95% CI) 2.8-7.7)] وخلال 6 أشهر [OR 4.7 ( 95% CI) 2.9-7.7] من المتابعة.
درس Khane وزملاؤه تواتر حدوث AMI غير القاتل والوفاة على 384 مريضاً لديهم موجة احتشاء العضلة القلبية ST ولاحظوا أ ن المرضى الذين لديهم قيم MPO فوق المتوسط يزداد لديهم اختطار الحوادث الجانبية 7 أضعاف [HR 6.9 ( 95% CI) 1.79-26.73] (10).
في دراسة Cavusoglu التي أجريت على 193 رجلاً يعانون من ACS خلال سنتين من المتابعة وجد أن MPO مستقل عن الاحتشاء [OR 1.60 (95% CI) 1.09-2.36] (7).
بينت دراسة مقطعية تصالبية Cross-sectional study أخرى أن MPO يملك حساسية ونوعية تشخيصية أعلى من التعداد الكلي لخلايا الدم البيضاء و -chlorotyrosine3 لمعرفة مرضى ) AMI 24).
يشير كل ما في جعبة هذه الدراسات إلى أن مقايسة MPO لدى مرضى الألم الصدري الحاد يقدم معلومات هامة سريرياً. وعلى كل، ما يجب ملاحظته أن التباين بين الدراسات في القيم الحدية لكل من التروبونين القلبي و MPO قد يؤثر على القيمة التشخيصية والإنذارية للـ MPO مقارنة مع التروبونين.
MPO كعامل مسبب في إمراضية التصلب العصيدي
MPO as a Causal Factor in the Pathogenesis of Atherocslerosis
يعد MPOمن العوامل الدفاعية الهامة لدى المضيف ضد العوامل الممرضة. ومن جهة أخرى أظهر عدد معتبر من الدراسات الوبائية والسريرية ارتباطاً ما بين التراكيز العالية من MPO و CVD بشكل مستقل عن عوامل الاختطار التقليدية الأخرى.
إن مصدر MPO في البلازما هو الكريات البيضاء المفعلة activated leukocytes، أما تحرر MPO والتشكل التالي للأنواع المتفاعلة المشتقة من MPO فيمكن أن يحرض بآليات متعددة (3):
أولا: من المعلوم أن الالتهاب يحرض على تجنيد وتفعيل خلايا الدم البيضاء.
ثانيا: قد يحرض تعديل جزيئات LDL بشكل طفيف في بطانة الشريان intima على تدفق influx الوحيدات monocytes التي تتطور إلى بالعات كبيرة مستوطنـة resident macrophages البعض منها يعبر عن MPO.
ثالثا: تنجذب وترتبط العدلات neutrophils في مجرى الدم إلى المواقع المتأذية من البطانة.
يرتبط MPO المتحرر من هذه الكريات البيضاء اللصوقة adherent leukocytes مع البطانة الوعائية في البداية ومن ثم يعبر إلى المطرس تحت البطانة subendothelial matrix (25). وبناء على ذلك فإن كل من التحرر الموضعي من قبل البالعات الكبيرة المستوطنة والعبور داخل اللمعة المنتجان للـ MPO يشكلان مصادر MPO في جدران الأوعية.
إن الحيز الضيق لتحت البطانة يكمن وراء فعالية MPO. هذا ويعد تنفس المتقدرات mitochondrial respiration و oxidase NAD(P)H وأكسيد النتريك سينتاز غير المقترن uncoupled NOS مصادر رئيسية لجذور السوبر أكسيد المتفاعلة reactive superoxide radical المتوفرة بشكل عال، والتي تتحول إلى بيروكسيد الهيدروجين hydrogene peroxide بوساطة سوبر أكسيد ديسموتاز superxide dismutase. وعلى الرغم من أن بيروكسيد الهيدروجين أقل فعالية من جذور السوبر أكسيد إلا أنه يعد ركيزة مساعدة لكل التفاعلات المحفـزة بـ MPO. ويزيد MPO القوة المؤكسدة لبيروكسيد الهيدروجين من خلال إنتاج مختلف المؤكسدات المتفاعلة المتضمنة الأنواع الكلورية والنترية. هناك الكثير من الجزيئات الخلوية الكبيرة والعمليات التي تتأثر بشكل معاكس بفعالية MPO الوعائية. ويوضح الشكل 1 الملامح الرئيسية للدور المعاكس لـ MPO في الجدار الوعائي.
أكسدة LDL بوساطة MPO
LDL Oxidation by MPO
يعد تعديل LDL بالأكسدة حدثاً مبكراً في التصلب العصيدي، ويساهم LDL المُؤكسـد oxidized LDL في التعصد atherogenesis من خلال ترسب الكوليستيرول وتحول البلاعم إلى خلايا رغوية foam cells (2).
إن احتجاز LDL تحت البطانة يجعل منه هدفا رئيسياً للأكسدة بوساطة طليعة المؤكسدات prooxidante المنتجة من قبل الخلايا الجدارية الشريانية. تتضمن مصادر المؤكسدات: mitochondrial respiration و oxidase NAD(P)H و NOS و lipoxygenases .
MPO هو بروتين هابطي cationic protein بشكل شديد ويمكنه الارتباط مع الخلايا البطانية والكريات البيضاء و LDL. إذ أن ارتباط MPO إلى LDL يمكن أن يعزز من أكسدة هذا الليبوبروتين (26). ويولد MPO العديد من الأنواع المتفاعلة المتضمنة:
تحت حمض كلوريدريك وجذور التيروزيل وثنائي أكسيد النتروجين التي تؤكسد البروتينات والشحوم والمكونات المضادة لأكسدة جزيئة LDL (27).
إن العديد من منتجات الأكسدة الأولية غير ثابتة لكن تقتصر مهمتها على أنها وسائط تفاعلية تحرض على تعديل جزيئة LDL بالأكسدة ويمكن أن تؤدي إلى ارتباطات متصالبة والتكدس. أما منتجات الأكسدة الثابتة فإن عدداً محدداً منها عرف بدوره كواصمات حيوية للأكسدة المحفزة بـ MPO. وتعد ثمالات التيروزين المعـدلة 3-chlorotyrosine و 3-nitrotyrosine من أكثر منتجات الأكسدة الثابتة تميزاً (28). على الرغم من أن الأنواع النتروجينة المتفاعلة التي يولدها MPO تتدخل في تحويل tyrosine إلـى 3-nitortyrosine فإن هنالك آليات أخرى يمكنها أن تساهم في تشكيل 3-nitortyrosine أيضاً. ومن الجدير ذكره أن البيروكسي نترات وناتج تفاعل NO والسوبر أكسيد تساهم أيضاً في توليد 3-nitortyrosine وذلك خلافا للـ 3-chlorotyrosine و3-nitrotyrosine المنتجة من قبل MPO بشكل مميز والتي يمكنها أن تقوم بدور جزيئة مميزة (بصمة الإصبع fingerprint) لتفاعلات الأكسدة المحفزة بـ MPO.
|
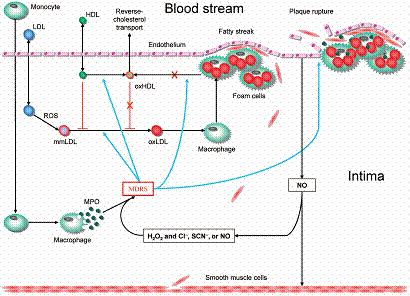
الشكل 1: الملامح الرئيسية للدور المعاكس لـ MPO في الجدار الوعائي. |
وحسـب ما ورد في تقـريـر Hazen and
Heinecke فـإن 3-chlorotyrosine كـان
أعلى بـ 6 مرات لدى المصابين بآفات تصلب عصيدي متقدمة مقارنة بأنسجة الشرايين الطبيعية. بالإضافة إلى ذلك فإن تركيـز 3-chlorotyrosine في LDL المعزولة من البطانة المصابة بالتصلب العصيدي كانت أعلى بـ 30 مرة من تراكيز LDL الجائل في الدوران (29).
قام Mocatta وزملاؤه بمقايسة chlorotyrosine في بروتين البلازما الكلي، ولم يجدوا فارقاً ما بين المجموعات التي تختلف بـ 5 مرات في متوسط تركيز MPO أو بـ 20 مرة في تركيز كربونيلات البروتين protein carbonyls. وبناء على هذه النتائج استنتجوا أن تحت حمض كلوريدريك الذي يولده MPO في البلازما غير كاف ليكون مصدراً لكربونيلات البروتين. ورغم تشكل 3-chlorotyrosine إلا أن جزءً صغيراً من منتجات أكسدة LDL تحمل بصمة MPO النوعية جداً. وتبين مؤخراً أن thiocyanate المتواجدة بوفرة لدى المدخنين تتأكسد بوساطة MPO إلى cyanate والتي يمكن، من خلال عملية carbamylation للبروتينات أن تبدل من بنيتها ووظيفتها (30).
أظهرت هذه الدراسة وبوضوح أن عملية الـ carbamylation المحفز بـ MPO قد تعزز من الخصائص المعصدة لـ LDL. وبناء على هذه المعطيات جرت الإشارة بقوة إلى تدخل MPO في تعديل LDL بالأكسدة في البطانة الوعائية وينتج عن ذلك تحول LDL إلى الشكل المعصد atherogenic form.
|
فشل وظيفة HDL بسبب MPO
Impairment of HDL Function by MPO
على الرغم أن HDL يلعب دوراً رئيسياً في جمع الكوليستيرول والنقل العكسي له، إلا أنه يمتلك أيضاً خصائص مضادة للالتهاب ومضادة للأكسدة (31). مع أن هذه الآليات لم تفهم تماماً، إلا أن هنالك بعض الآبوليبوبروتينات apolipoproteins والإنزيمات المترافقة مع جزيئات HDL والتي لها قدرة مضادة للأكسدة. من الأهمية بمكان دور الـ HDL المحصن من أكسدة LDL المتواسطـة بـ MPO MPO-mediate LDL oxidation. وتتضمن الآليات التي يمكن من خلالها للـ HDL أن يمنع أو يؤخر الأكسدة في جدر الأوعية ما يلي:
الارتباط إلى الأيونات المعدنية الانتقالية، تخلص الخلايا من الشحوم والشحوم الفسفورية المؤكسدة والألدهيدات قصيرة السلسلة والتخلص من LDL. وبعد أن يتم قبط منتجات الأكسدة من قبل HDL فإنها إما أن تتحلمه بوساطة الإنزيمات المترافقة مع HDL. مثل العامل المفعل للصفيحات platelet-activating factor و acetylhydrolase و paroxonase، أو تبقى مرافقة لـ HDL، وفي النهاية تطـرح من الدوران بعد أن يتـم
القبط الكبدي للـ HDL.
يمكن أن تعود الفعالية المضادة للالتهاب للـ HDL إلى فعاليته المضادة للأكسدة؛ حيث أن معظم الشحوم المؤكسدة تمتلك خصائص قوية مؤازرة للالتهاب ويمكن أن تحرض على التهاب الشرايين. تنقص جزيئات HDL التعبير عن جزيئات الالتصاق في الخلايا البطانية وتثبط التصاق الوحيدات إلى هذه الخلايا ودخول الخلايا الالتهابية إلى بطانة الشريان.
يمكن أن تكون جزيئات HDL معطلة وظيفياً في الأمراض الاستقلابية المترافقة مع تصلب عصيدي متسارع (31). إذ تفقد جزيئات HDL غير الوظيفية خصائصها المحصنة من التعصد وتعزز التأثيرات الالتهابية. وفي السنوات القليلة الماضية اتضح تورط MPO في جعل HDL غير وظيفـي (32-34).
يُعد صميم البروتين الشحمي (الآبوليبوبروتين) A-I apolipoprotein A-I (apo A-I) من الأهداف المفضلة لتفاعلات الأكسدة المحفزة بـ MPO، كما ثبت أنه أغنى بـ 100 ضعف تقريباً من كل من 3-nitrotyrosine و3-chlorotyrosine في apo A-I المسترد من HDL الجائل في الدوران مقارنة مع الجائلة البروتينات الأخرى في الدوران (35). علاوة على ذلك فإن غزارة هذه التعديلات المؤكسدة للـ apo A-I المعزولة من اللويحات العصيدية كانت عالية أيضاً. ترافق محتوى HDL العالي مـن 3-nitrotyrosine و 3-chlorotyrosine وبشكل نوعي مع انخفاض في قدرة تدفـق HDL (35، 36).
لوحظ أن هناك ترافقاً قوياً ما بين apo A-I المعدل وانتشار CVD. فالأشخاص الذين لديـهم الـ apo A-I الحاوي على 3-chlorotyrosine كان احتمال إصابتهم بـ CVD أعلى بـ 16 ضعف مقارنة مع أولئك الذين لديهم 3-chlorotyrosine (35).
كهدف يمكن أن تفسر انتقائية apo A-I للأكسدة انطلاقا من حقيقة أن apo A-I يحتوي على مواقع ارتباط نوعية لـ MPO (35، 36). إذ يحتفظ MPO المرتبط إلى HDL بفعاليته الإنزيمية بشكل هام والارتباط إلى HDL قد يحمي MPO من القبط الخلوي والتدرك. إن تعديل HDL المعتمد على MPO يزيد بشكل واضح من ألفة ارتباط HDL إلى MPO والذي يعتقد أنه يقود إلى دورة معيبة من التعديل المعتمد على MPO في مواقع الالتهاب المزمن (37). وما يجب ملاحظته أن النيتروتيروزين والكلوروتيروزين يقومان وبشكل خاص، بدور بصمة إصبع جزيئية بتورط MPO في التعديلات المؤكسدة للـ HDL، إلا أن التعديلات الأخرى المحفزة بـ MPO يحتمل أن تكون أهميتها أكثر من الناحية الكمية على تحريض فشل وظيفة HDL.
MPO يخفض التوافر الحيوي لأكسيد النتريك
MPO Reduces The Bioavailability of Nitric Oxide
يعد NO، الذي يقوم NOS البطاني بإنتاجه موسعاً وعائياً قوياً، كما أنه يلعب دوراً رئيسياً في الحفاظ على سلامة الأوعية، بالإضافة إلى ذلك فإنه يوقف ارتباط الخلايا الجائلة في الدوران إلى البطانة ويثبط تكاثر خلايا العضلات الملساء في الجدار الوعائي (الشكل 1).
تشير هذه الموجودات إلى أن NO عنصر هام في استتباب سلامة الأوعية، ونتيجة لذلك فإن الإنتاج غير الكافي و/أو زيادة كنس NO قد يضعف الوظيفة الوعائية ويسرع حدوث التصلب العصيدي. وهنالك مؤشرات قوية تشير إلى أن MPO يمكنه بآليات متعددة أن ينقص من التوافر الحيوي للـ NO.
أولا: يقوم NO بمهمة ركازة للبيروكسيدات وبذلك فإن MPO قد يقوم بدور مجرى تحفيزي للـ NO (38).
ثانيا: كنس NO بوساطة المواد المتفاعلة المشتقة من MPO قد يخفض إلى حد بعيد التوافر الحيوي للـ NO.
ثالثا: يمكن لتحت حمض كلوريدريك أن يتفاعل مع ذرات النتروجين لركازة الأرجنين لـ NOS لإنتاج أنواع الأرجنين المكلورة التي تعد مثبطة لكل أشكال NOS. والتي تبين أنها تنقص الارتخاء المعتمد على البطانة للحلقات الشريانية لدى الجرذان (39).
تبين أخيراً أن تحت حمض كلوريدريك
محرض قوي لفك اقتران NOS البطاني وبذلك يتحول NOS إلى إنزيم منتج للبيروكسيد (40). على الرغم من أن التأثير النسبي لهذه الآليات غير مفهوم تماما فإنه من الواضح أن MPO من خلال عملياته المحفزة وغير المحفزة يقوم باستنزاف NO في الجدار الوعائي، وتوافقاً مع هذه الفكرة كانت الملاحظة، أنه وجد لدى الأشخاص المشاركين في الدراسة وجود ارتباط عكسي قوي ما بين تراكيز MPO المصلية والجريان الدموي في الشريان العضدي المعتمد على توسع الشريان، الذي بقي معتداً به ضبط عوامل اختطار الأمراض القلبية الوعائيـة و CRP (41) .
في الدراسة التي قام بها Baldus وزملاؤه وجد أن تحرر MPO الوعائي من الحيز تحت البطانة من خلال الحقن الوريدي للهيبارين يؤدي إلى تحسن الوظيفة الوعائية المعتمدة على البطانة، والذي ينعكس بزيادة الجريان الدموي في الشريان العضدي المعتمد على التوسع الشرياني والجريان الدموي في الساعد المحرض بالأستيل كولين (42) .
MPO وقابلية التعرض للويحة
MPO and Plaque Vulnerability
يعتـقد أن عدم ثبات اللويحـة وتمزقـها من العمليات الأساسية المسببة للحوادث القلبية الوعائية الحادة. فعلى سبيل المثال وجد Rossi وزملاؤه تواتراً عالياً للويحات غير المستقرة لدى مرضى AMI (20). وقد يلعب MPO دوره في عدم ثبات اللويحات من خلال تفعيل metalloproteinases وبذلك تضعف القلنسوة الليفية. دعمت هذه الفكرة دراسات عديدة بينت وجود علاقة إيجابية ما بين MPO ومعدل وفيات CVD لدى مرضى الحوادث القلبية الوعائية الحادة، ولم تفلح دراستان تضمنتا مرضى مصابين بأمراض CAD مستقرة في إظهار قيمة تنبؤية للـ MPO لـ CVD (17، 19). هنالك دليل إضافي لدور MPO في عدم ثبات اللويحة قدمته دراسات الفيزيولوجياً المرضية. إذ إن أذية اللويحة يفعل العدلات التي قد تؤدي إلى تحرر MPO (43).
لاحظ Malle وزملاؤه التوضع المشارك للـ MPO والبروتينات المعدلة بالكلورة في الآفات المصابة بالتصلب العصيدي (44).
وجاء في تقرير Sugiyama وزملائه أنه خلافاً للبلاعم في الأثلام الشحمية fatty straeks التي قد تحوي على كميات قليلة من MPO أو لا تحوي، تكون البلاعم في اللويحات المتآكلة أو الممزقة غنية بـ MPO (45).
وبناء على ما ورد تبين وجود تراكيز عالية من البروتينات المعدلة بتحت حمض كلوريدريك في اللويحات المتآكلة والممزقة مقارنة مع اللويحات الثابتة، وهذا يقدم دليلاً قوياً على أن MPO قد يتدخل في تحويل مراحل التصلب العصيدي المتأخرة إلى حوادث قلبية وعائية حادة.
التحليل المخبري لـ MPO: المنهجية والعوائق
Laboratory Analyses of MPO: Methodology and Pitfalls
إن التباين في أفراد الدراسة أو الطرق التحليلية قد يؤثر في تقدير القيمة التنبؤية للـ MPO في تصنيف عوامل اختطار CVD. وأغلب نتائج الدراسات أعلاه مبنية على قياس كتلة MPO.
وعلى الرغم من وجود علاقة قوية ما بين كتلة ونشاط MPO (r = 0.95) (15)، فإنه لا يمكن الجزم تماماً أن قياس نشاط MPO بدلاً من التركيز سيؤثر على النتائج. وفي الحقيقة الطريقة المفضلة لإجراء المقايسة ( الكتلة أو النشاط) غير معروفة تماماً. وعلى كل حال فإن ما يجب ملاحظته أن قياس نشاط MPO خارج العضوية ليس من الضروري أن يعكس نشاط الإنزيم ضمن العضوية. يعتمد النشاط الإنزيمي لـ MPO وبشكل كبير على التركيز الموضعي لركازة بيروكسيد الهيدروجين المساعدة، التي تكون عالية نسبياً في الحيز الضيق لتحت البطانة، خاصة لدى الأشخاص الذين لديهم عوامل اختطار مترافقة مع شدة تأكسدية زائدة كالتدخين وفرط ضغط الدم والداء السكري من النمط الثاني. يقاس نشاط MPO مخبرياً عادة بوجود كميات زائدة من الركازة وبيروكسيد الهيدروجين وبذلك فإنها تمثل الفعالية العظمى للإنزيم والتي على الأغلب تعد بمثابة كتلة الإنزيم.
يختلف نمـط العينة المحللة من دراسـة إلـى
أخرى فقد استعمل الدم الكامل والكريات البيضاء والبلازما. بالإضافة إلى ذلك فقد تمت مقايسة MPO في البلازما بعد الحقن الوريدي للهيبارين الذي يحرك MPO من الأحياز الوعائية، وبذلك تنتج كميات أكبر بالمقارنة مع التراكيز الأساسية للبلازما خاصة لدى مرضى CAD (42). قد يحرض الهيبارين على تحرر MPO من الكريات البيضاء (46)، وتتفعل العدلات أثناء تخثر الدم (47).
لقد درس مؤخراً تأثير أنابيب الدم جميعهاعلى تراكيز MPO لدى المرضى الذين يعانون من أعراض ACS (48). كانت تراكيز MPO في عينات المصل والعينات التي جرى جمعها على الهيبارين أعلى من تراكيز MPO المأخوذة على EDTA أو سيترات. علاوة على ذلك، فإن العينات المأخوذة على EDTA والمحفوظة في الجليد أو بدرجة حرارة الغرفة كانت الأكثر ثباتاً. بينما بقيت تراكيز MPO البلازمية ثابتة نسبياً في عينات الهيبارين المحفوظة في الجليد، لكن العينات المحفوظة بدرجة حرارة الغرفة لمدة ساعتين أدت إلى زيادة في تراكيز MPO بمقدار أربع مرات. وبناء على هذه النتائج، استنتج Shih وزملاؤه أن الـ EDTA هو مضاد التخثـر المفضـل
لتحديد كميات MPO.
هناك نقطة إضافية تعيق مقارنة تراكيز MPO وهي حقيقة أن بعض المؤلفين عبروا عن تراكيز
MPO على أسس مولية أو وزنية بينما عبر البعض الآخر عن ذلك على أساس البروتين الكلي بناء على النسبة MPO /protein.
من الواضح أن مقايسة MPO غير قابلة للمقارنة بشكل مباشر وتعتمد على نمط العينة المستخدمة. وفي الحقيقة هناك تقارير قليلة لا تتضمن معلومات عن مضاد التخثر المستعمل للحصول على البلازما. وهكذا فإنه من الضروري جداً وضع معايير لنمط خطط (بروتوكولات) طرق المقايسة وأنابيب جمع الدم.
ملاحظات استنتاجية
Concluding Remarks
تشير الدراسات الوبائية المجراة على نطاق واسع من الأفراد وبوضوح إلى أن MPO بالإضافة إلى أنه واصم تقليدي فهو واصم اختطار هام لـ CVD خصوصاً ممن لديهم CAD غير مستقرة. لقد جرى تدعيم الدور المسبب لـ MPO في تحريض CVD والحوادث القلبية الوعائية الحادة بتجارب في الزجاج وأشارت الملاحظات الفيزيولوجية المرضية إلى تورط MPO في كل مراحل التعصد بدءً من فشل وظيفة البطانة وحتى تمزق اللويحة. على الرغم من ذلك وقبل إمكان استعمال MPO في الممارسة السريرية كعامل اختطار لـ CVD فإن التوصيات والفهم الأفضل للتطبيقات التحليلية وما قبل التحليلية على قدر كبير من الأهمية.
|
| |
