| المجلد 5 ,
العدد 6
, محرم 1431 - كانون الثاني (يناير) 2010 |
| |
| دراسة مستويات الببتيد المماثل للغلوكاغون-1 (GLP-1)
عند مرضى السكري النمط الثاني
|
| Study of Glucagon Like Peptide-1 (GLP-1)
in Type II Diabetes Patients
|
| د. عيسى سعيد، أ.د ميشيل عبيد و أ.د فايزة القبيلي |
| Issa Saied, Mechail Obeid and Faizeh Al Quobaili |
كلية الصيدلة، جامعة دمشق
Faculty of Pharmacy, Damascus University |
| الملخص Abstract |
هدف الدراسة: إن الببتيد المماثل للغلوكاغون -1 GLP-1)) هو الهرمون المعوي الرئيسي الذي يعزز وبشكل هام من إفراز الأنسولين بعد الطعام، ويمتلك دوراً هاماً في استتباب الغلوكوز وغيره من الآثار الفيزيولوجية الكثيرة في الجسم. لذلك فقد كان هدفنا تقييم مستويات GLP-1 البلازمية لدى مرضى السكري النمط الثاني بغية تقييم وظيفة الهرمونات المعوية لديهم.
الطرق: قمنا في هذه الدراسة بتعيين مستويات GLP-1 الفعال البلازمية بعد وجبة إفطار مختلطة (270 kcal) عند مجموعتين من الأفراد: مجموعة مرضى السكري النمط الثاني (22 فرداً)، ومجموعة الأصحاء من فئة عمرية مماثلة لمجموعة المرضى (13 فرداً)، وذلك باستخدام طريقة الإمتزاز المناعي المرتبط بالإنزيم ELISA. تم استقصاء العلاقة بين المستويات البلازمية للـ GLP-1 الفعال والمستويات البلازمية لكل من الغلوكوز والأنسولين عند مجموعتي الدراسة.
النتائج: كانت المستويات الصيامية لسكر الدم عند المرضى 171±40 mg/dl وقد ارتفعت إلى 260±52 mg/dl في الدقيقة 60 بعد تناول الوجبة. أما المستويات الصيامية للأنسولين فقد كانت مشابهة لمجموعة الأصحاء، ولكن الاستجابة لتناول الطعام كانت منخفضة ومتأخرة. وقد تميزت استجابة GLP-1 الفعال عند المرضى بارتفاع صغير ومبكر (الدقيقة 30) 9.82±0.82 pmol/l، وانخفاض واضح في الطور المتأخر (الدقيقة 60-120) لدى مقارنتها بمجموعة الأصحاء، حيث كانت استجابة الطور المتأخر أعلى 14±0.64 pmol/l (الدقيقة 90) (P<0.05).
الاستنتاج: يعاني المرضى السكريين النمط الثاني من انخفاض واضح في استجابة GLP-1 الفعال بعض الطعام، وهذا ما يدعم نظرية أن الوظيفة المتأذية للـ GLP-1 كناقل في المحور الجزيري – المعوي، تساهم في الإفراز غير الملائم للأنسولين عند مرضى السكري النمط الثاني.
|
Objective: Glucagon like peptide-1 (GLP-1) is the main incretin hormone which importantly enhances postprandial insulin secretion, and it has an important role in glucose homeostasis and a lot of physiological effects in the body. Our objective was to evaluate plasma GLP-1 levels in type II diabetes patients in order to evaluate the incretin hormones function.
Methods: In this study we determined plasma active GLP-1 levels after a mixed breakfast meal (270 kcal) of two groups of subjects: type II diabetes patients (n=22), and age matched healthy subjects (n=13), using Enzyme Linked Immunosorbant assay (ELISA). Then we investigated the relationship between plasma active GLP-1 levels and plasma glucose, insulin levels in the two study groups.
Results: The patients had fasting hyperglycemia (171±40 mg/dl) increasing to 260±52 mg/dl at 60 min after meal ingestion. Fasting levels of insulin were similar to those of the healthy subjects, but the postprandial responses were reduced and delayed.
The profile of the active GLP-1 response in the patients was characterized by a small early rise (30 min) 9.82±0.82 pmol/l, and a significantly reduced late phase (60-120 min) when compared with the healthy group, whereas the late phase of the active GLP-1 response was higher 14±0.64 pmol/l (90 min) (P<0.05).
Conclusion: type II diabetic patients had a significantly reduced postprandial active GLP-1 response, supporting the hypothesis that an impaired function of GLP-1 as a transmitter in the enteroinsular axis contributes to the inappropriate insulin secretion in type 2 diabetes.
الكلمات المفتاح Key words: الببتيد المماثل للغلوكاغون-1 Glucagon like peptide-1، بعد الطعام postprandial.
|
| المقدمة Introduction |
يشير تأثير الهرمونات المعوية incretins إلى أن تناول السكريات (الغلوكوز) يتسبب في تحرر مواد من مخاطية المعي، تزيد هذه المواد من تحرر الأنسولين علاوةً على التحرر المحدث بالغلوكوز نفسه. يمكن قياس هذا التأثير بمقارنة استجابات كل من الأنسولين والببتيد -C لحمل غلوكوز فموي وغلوكوز معطى وريدياً؛ بحيث يؤدي ذلك إلى زيادة متماثلة في تراكيز الغلوكوز البلازمية، وتكون الاستجابات الأعلى لكل من الأنسولين والببتيد-C الملاحظة بعد حمل الغلوكوز الفموي ناجمة عن أثر الهرمونات المعوية Incretin effect. قياساً على هذه الطريقة، تبيّن أن الهرمونات المعوية incretins مسؤولة بشكل طبيعي عن 50 -70% تقريباً من استجابة الأنسولين للغلوكوز الفموي. على الرغم من إمكانية وجود عدة هرمونات تتحرر بعد الطعام وتؤثر على إفراز الأنسولين، فإن الدليل التجريبي المتوفر يقترح أن الهرمونين الأكثر أهمية هما:عديد الببتيد الموجه للأنسولين المعتمد على الغلوكوز Glucose- dependent insulinotropic polypeptide (GIP) والببتيد المماثل للغلوكاغون-1(GLP-1) (Glucagone like peptide -1) (1)، كما ينتمي إلى عائلة الهرمونات المعوية incretin أيضاً الأوكسينتوموديولين Oxyntomodulin المشتق أيضاً من قبل طليعة الغلوكاغون، إلا أنه ليس بأهمية GIP و GLP-1.
إن GLP-1 هو أحـد منتجـات جيـن طليـعة
الغلوكاغون البشرية human proglucagon المتوضعة على الذراع الطويل للصبغي 2 ، وهي تتألّف من 6 إكسونات و 5 أنترونات. في الثدييات، تعطي جين طليعة الغلوكاغون proglucagon نسخة رنا مرسال m RNA وحيدة، والتي تترجم وتعامل بطرق مختلفة في جزيرات البنكرياس والمعي والدماغ (الشكل 1).
|
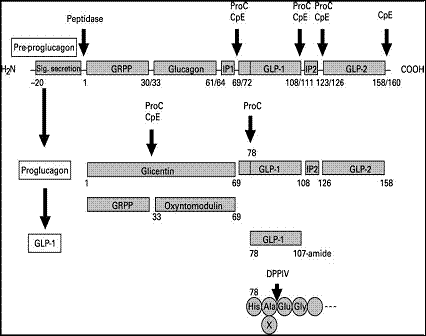
الشكل 1: الببتيدات المشتقة من طليعة الغلوكاغون( 2 ).
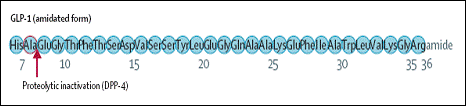
الشكل 2: بنية الببتيد المماثل للغلوكاغون -1 /GLP-1 / |
لا يتم التعبير عن جين طليعة الغلوكاغون في الخلايا α البنكرياسية فحسب، وإنما في الخلايا L لمخاطية المعي، والتي تعد من أكثر خلايا الغدد الصم وفرةً وغزارةً في المعي، وهي مصدر إفراز GLP-1، يجري في هذه الخلايا شطر ناتج الترجمة البدئي (طليعة الغلوكاغون)، ليس لإعطاء الغلوكاغون في الجزر البنكرياسية، بل ليتحرر من نهايته الكربوكسيلية C-terminal الببتيدان المماثلان للغلوكاغون GLP-1 وGLP-2 واللذان يملكان حوالي 50% من التتالي المماثل للغلوكاغون.
نظراً لتعرّض الخلايا L داخلية الإفراز المعوي لكلٍ من محتويات لمعة الأمعاء والعوامل الهرمونيّة الجائلة في الدوران، فإنّ اصطناع طليعة الغلوكاغون المعوي intestinal proglucagon وإفرازه يخضع للتعديل من قبل كلٍ من الأغذية والعوامل الهرمونية (3).
إن تحرر GLP-1 في المعي هو نتيجة لتعبير نوعي نسيجي لمحولات طليعة الهرمون PCs)) prohormone convertases: PC1/3 التي يعبر عنها في الخلايا داخلية الإفراز المعوي وهي الإنزيم المسؤول عن تحرر GLP-1 (4).
تقود عدة عمليات على طليعة الغلوكاغون من قبل طليعة المحولة 1/3 proconvertase 1/3 إلى إنتاج GLP-1 في الخلايا L. في حين تقود معالجة منتج جين طليعة الغلوكاغون من قبل proconvertase 2 في الخلايا α البنكرياسية إلى إنتاج الغلوكاغون. ينتج GLP-1 كببتيد غير فعال مؤلف من 37 حمضاً أمينياً والذي تحتوي نهايته الكربوكسيلية على الغليسين (الشكل 2). يتم الوصول إلى الشكل الفعال للـ GLP-1 من خلال الشطر بعد الترجمة لـ 6 أحماض أمينية من النهاية الطرفية الأمينية N-terminal للـ GLP-1(1 -37).
هذا الشكل المبتور truncated (37 -7) للـ GLP-1 يمكن أن تتم أميدته amidated عند النهاية الكربوكسيلية للغليسين ويعد GLP-1(7-36 amide) الشكل الرئيسي الجائل في الدوران.
إن كلاً من GLP-1(7-37) وGLP-1(7-36 amide) ببتيدان متساويان في الفعالية الموجهة للأنسولين، على الرغم من كون الأخير هو الأكثر انتشاراً (5)، ويتحرض إفراز GLP-1 بوجود الغذيّات في لمعة المعي ولكن يمكن أن تتدخل أيضاً آليات عصبية أو صماوية في ذلك (6).
يتحرر GLP-1 بسرعة إلى الدوران بعد تناول وجبة مختلطة لدى كل من القوارض والبشر. وإنّ الإعطاء الفموي للغذيّات يؤدي إلى ازدياد ثنائي الطور في GLP-1 البلازمي (الشكل3)، مع ذروة مبكرة خلال 15-30 دقيقة بعد تناول الغذّيات، تتبع بذروة ثانية في إفراز GLP-1، تقريباً خلال 1-2 ساعة
تالية(7) . يخضع كل من GLP-1 وGIP لشطُّر سريع حال للبروتين من قبل بروتياز السيرين serineprotease الواسعة الانتشار، دي ببتيديل ببتيداز -4 (dipeptidyl peptidase –IV) DPP-IV عند ثمالة الألانين ما قبل الأخيرة، ناتجاً عن ذلك ببتيدات مبتورة النهاية الأمينية N-terminal عاجزة عن تنبيه إفراز الأنسولين. يعد GLP-1 موجهاً قوياً للأنسولين Insulinotropic لدى البشر ويبدو أنه يمتلك دوراً هاماً في إفراز الأنسولين الصيامي وبعد الطعام.
كما يثبط GLP-1 إفراز الغلوكاغون وينبه إفراز السوماتوستاتين .somatostatin وإن الزيادة في إفراز السوماتوستاتين، متواسطة بشكل مباشر عبر مستقبلات GLP-1 المعبّر عنها على الخلايا α المنتجة للسوماتوستاتين. في حين أن التأثير المثبط لإفراز الغلوكاغون قد يكون مباشراً من خلال تفاعل GLP-1 مع مستقبلاته على الخلايا α، أو غير مباشر عبر تنبيه إفراز الأنسولين والسوماتوستاتين، حيث أنّ كل منهما مثبط لإفراز الغلوكاغون.
بالإضافة إلى التأثير على إفراز الأنسولين، فإنّ GLP-1 (و GIP أيضاً) يزيد من تعبير الخلية α للأنسولين، وذلك بزيادة انتساخ جين الأنسولين، وثبات واصطناع mRNA ((8.
|
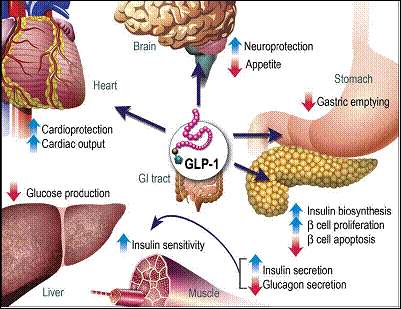
الشكل 3: آثار GLP-1 لدى البشر، ودور المفرزات الصماوية الداخلية المنظم للغلوكوز. |
| المواد والطرق Materials and Methods |
شملت دراستنا 35 فرداً قسموا إلى مجموعتين:
- المجموعة الشاهدة: وشملت13 فرداً سوياً ظاهرياً (10 ذكور + 3 إناث) غير مصابين بالسكري وليس لديهم قصة عائلية للإصابة به، ولا يتناولون أية أدوية، متوسط أعمارهم 41.6 ± 12 عاماً.
- مجموعة مرضى السكري النمط الثاني:
شملت 22 مريضاً مصاباً بالسكري النمط الثاني (16 ذكور + 6 إناث) متوسط أعمارهم 54.8±9.9 عاماً، ويخضعون للعلاج إما بالحمية لوحدها أو بالحمية وخافضات السكر الفموية (السلفونيل يوريا و/أو البيغوانيد). ولقد جرى انتقاء المرضى بعد أن تمَّ التأكد من عدم وجود اختلاطات سكرية لديهم، أي نفي وجود اعتلال شبكية retinopathy بالإضافة إلى نفي وجود اعتلال كلوي nephropathy وذلك بمقايسة كلٍّ من الكرياتينين والبيلة الألبومينية الزهيدة.
- الاعتيانSampling
بالنسبة للمرضى المعالجين بخافضات السكر الفموية، جرى إيقاف المعالجة بهذه الأدوية قبل 48 ساعة من بدء تطبيق الدراسة. وبعد صيام ليلة كاملة (منذ 10 pM)، وفي صباح اليوم التالي (8-9 صباحاً) جرى غرز scalp أو cannula في الوريد الذراعي لكل فرد من مجموعات الدراسة من أجل جمع عينات الدم. في البداية بزلت عينات الدم الصيامية من أفراد الدراسة (4 مل في أنبوب يحتوي على EDTA و 4 مل في أنبوب جاف). ثم قام أفراد مجموعات الدراسة بتناول وجبة طعام محددة الكالوري ( 270كيلو كالوري) مؤلفة من قطعة من الخبز الكندي + مثلثين من الجبنة المطبوخة.
بحيث جرى استهلاك الوجبة خلال 15 دقيقة، ومن ثمَّ جرى جمع عينات الدم في أنابيب مبرّدة حاوية على الـ EDTA خلال الفواصل الزمنية التالية 30، 60، 90، 120 دقيقة على الترتيب. وينبغي أن تكون أنابيب الـ EDTA جميعها مبردة في الثلج قبل استعمالها (أي تسحب من الثلج مباشرةً لحظة جمع العينة) عندها وخلال أقل من 30 ثانية من جمع الدم يضاف المثبط الإنزيمي إلى الأنبوب وذلك بمقدار 10 lµ من المثبط لكل 1 مل دم، ويرج الأنبوب بلطف من أجل المزج، ومن ثم تنبّذ الأنابيب مباشرةً بواسطة منبذة مبردة (+4°م) أو توضع في حمام ثلجي ليتم تنبيذها خلال ساعة باستخدام المنبذة المبردة بسرعة 1000 دورة /دقيقة ولمدة 10 دقائق. بعد ذلك يوزع المصل الناتج على 5 أنابيب إيبندورف لتحفظ في درجة حرارة - 70°م.
- تم في هذه الدراسة مقايسة GLP-1 الفعال، ولهذا السبب أضيف المثبط الإنزيمي DPP-IV inhibitor – وهو مادة aprotinin – الذي يقوم بتثبيط الإنزيم DPP-IV وبالتالي يسمح بمقايسة الشكل الفعال للـ GLP-1 قبل أن يتـم تعطيله وتحويله إلى مسـتقلبات غير
فعالة من قبل DPP-IV.
جرت المقايسة باستخدام عتيدة Human GLP-1 ELISA لشركةDRG – Germany . تسمح هذه العتيدة Kit بالمقايسة الكمية للـ GLP-1 الفعال البشري في البلازما والأوساط الحيوية الأخرى.
|
| لنتائج Results |
| بلغ متوسط تركيز GLP-1 الصيامي لدى المجموعة الشاهدة 0.54±8.87 بيكومول/ل. ولقد ارتفعت هذه التراكيز -بشكلٍ بطيء- بعد تناول الوجبـة لتبـلغ ذروتها في الدقيقة 90 تقريباً، حيث كان متوسط تركيز GLP-1 في تلك اللحظة 14.5±0.64 بيكومول/ل. وبالنسبة لمرضى السكري النمط الثاني فلقد كان متوسط تركيز GLP-1 الصيامي 7.02±0.79 بيكومول/ل. وبعد تناول الوجبة ارتفعت مستويات GLP-1 المصلية لتبلغ ذروتها في الـ 30 دقيقة الأولى، حيث كان متوسط تركيز GLP-1 في تلك اللحظة 9.82±0.82 بيكومول/ ل، ثم بدأت مستوياته بالانخفاض تدريجياً (الشكل 4).
بتطبيق اختبار T-Student لوحظ وجود انخفاض واضح يعتد به إحصائياً في استجابة الطور المتأخر لإفراز GLP-1 عند مجموعة المرضى مقارنةً بالمجموعة الشاهدة (P<0.05) (الشكل 5).
|
| المناقشة Discussion |
وجدنا من خلال الدراسة التي أجريناها ما يلي:
- انخفاض واضح في مستويات GLP-1 الصيامية لدى مرضى السكري النمط الثاني
مقارنةً مع المجموعة الشاهدة. ويمكن أن يساهم ذلك في ارتفاع مستويات الغلوكوز الصيامية لدى مرضى السكري النمط الثاني.
- انخفاض هام في استجابة GLP-1 بعد تناول الطعام postprandial لدى مرضى السكري النمط الثاني مقارنة مع المجموعة الشاهدة، وذلك في ما يخص الطور المتأخر late phase من إفراز GLP-1. وهذا ما يدعم الفرضية التي تقول أن انخفاض إفراز GLP-1 يساهم في الإفراز غير الملائم للأنسولين لدى مرضى السكري النمط الثاني.
توافقت نتائج دراستنا هذه مع نتائج عدد من الدراسات العالمية كدراسة Knop F.K. وزملائه عام 2007، حيث وجدوا أيضاً انخفاضاً واضحاً في وظيفة الهرمونات المعوية لدى مرضى السكري النمط الثاني، وذلك من خلال انخفاض إفراز GLP-1 وارتفاع مستويات كل من الغلوكوز والغلوكاغون وانخفاض مستويات الأنسولين لديهم(9). وكذلك دراسة Vilsboll T. وزملائه عام 2003، حيث وجدوا أن الانخفاض في إفراز GLP-1 قد يساهم في الإفراز غير الكافي للأنسولين لدى مرضى السكري النمط الثاني، في حين كان إفراز GLP-1 طبيعياً لدى مرضى السكري من النمط الأول(10). وتوافقت النتائج أيضاً مع دراسة Toft- Neilsen M.B. وزملائه عام 2001 حيث وجدوا انخفاضاً في استجابة GLP-1 المتعلقة بالوجبة مما يؤدي إلى انخفاض في وظيفة المفرزات الداخلية incretin لدى مرضى السكري النمط الثاني(11).
- تبيّن لنا من خلال هذه الدراسة ترافق المستويات الصيامية المنخفضة من GLP-1 مع ارتفاع مستويات الغلوكوز الصيامية لدى المرضى. كما وجدنا علاقة ارتباط إيجابية يعتد بها إحصائياً R=0.709)، P<0.05) بين GLP-1 والأنسولين لدى المجموعة الشاهدة وذلك بعد ساعةٍ واحدة من تناول الوجبة، وهو ما يدعى بالطور المتأخر من إفراز GLP-1، حيث تكون الغذيات في هذه الأثناء قد وصلت إلى أماكن توضع الخلايا L في المعي القاصي لتنبّه بشكل مباشر تحرر GLP-1 الذي ينبه بدوره تحرر الأنسولين من أجل إعادة الغلوكوز إلى مستوياته الطبيعية وبالتالي ضمان استتباب homeostasis غلوكوز الدم. في حين لوحظ انخفاض واضح في إفراز الطور المتأخر من GLP-1 لدى مرضى السكري النمط الثاني، مما يترتب عليه ارتفاع كبير في غلوكوز الدم بعد الطعام postprandial.
يمكن أن يعزى هذا الانخفاض في مستويات GLP-1 (وبالتالي الانخفاض في incretins effect) إلى أنّ حالة السكري قد تؤدي إمّا إلى نقص في إفراز GLP-1 من الخلايا L المعوية، و/أو زيادة تدرّك GLP-1، والتي تعود إلى ارتفاع في فاعلية الإنزيم المسؤول عن ذلك وهو DPP-IV (9). يؤدي ذلك - في كلتا الحالتين- إلى عدم وصول GLP-1 إلى مستويات كافية لإعطاء التأثيرات الفيزيولوجية الطبيعية على مستوى الأعضاء والنسج الهدف (البنكرياس والكبد والعضلات وغيرها). وبالتالي يؤدي هذا النقص في مستويات GLP-1 إلى ارتفاع غلوكوز الدم، وبشكل خاص بعد الطعام postprandial. ويمكن أن تساهم زيادة إفراز الغلوكاغون (والتي تعود إلى انخفاض مستويات GLP-1 المثبط لإفرازه عادةً) في زيادة سيوح excursion أو ارتفاع غلوكوز الدم (12). والذي لم تتمكن كميات الأنسولين المفرزة لدى المرضى من ضبطه وإعادته إلى مستوياته الطبيعية، مما يعكس عدم كفاية وكفاءة هذا الأنسولين لديهم، ويُظهر ذلك أيضاً العوز في القدرة الإفرازية للخلايا Β (10).
نظراً للمستويات المنخفضة من GLP-1 لدى المرضى وما يترتب على ذلك من مستويات مرتفعة من الغلوكوز وعدم كفاية الأنسولين، فإنه يمكن تحقيق ضبط أفضل للمرض من خلال رفع أو تعويض مستويات GLP-1 لدى مرضى السكري النمط الثاني. ويكون ذلك إما بإطالة عمر GLP-1 داخلي المنشأ عبر استخدام أدوية تثبّط عمل الـ DPP-IV (الإنزيم المدرّكة للـ GLP-1) مثل Vildagliptin و Sitagliptin أو باستخدام محاكيات GLP-1 مثل Exendin-4 الذي يعد شاداً لمستقبلGLP-1 .
وإنّ إدخال هذه الأدوية ضمن الخطط العلاجية للسكري يمكن أن يفيد في السيطرة على المرض من خلال ضبط أفضل للغلوكوز والأنسولين والغلوكاغون، والحد من الارتفاع الكبير لغلوكوز الدم بعد الطعام postprandial، بالإضافة إلى تحسين الوظيفة البنكرياسية.
|
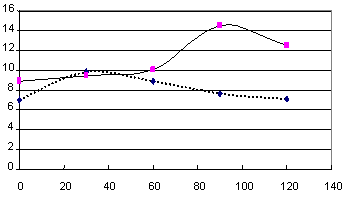
الشكل 4: مقارنة متوسطات تراكيز GLP-1 بين المرضى والمجموعة الشاهدة بدءاً من إعطاء الوجبة (اللحظة 0) حتى الدقيقة 120.
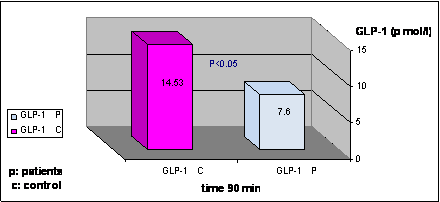
الشكل 5: مقارنة متوسط تركيز GLP-1 بين المجموعة الشاهدة والمرضى في الدقيقة 90. |
| المراجع References |
1-Fehmann H.C, Goke R, Goke B.
Cell and molecular biology of the incretin hormones glucagon-like peptide-I and glucose-dependent insulin releasing polypeptide.
Endocr Rev 16:390-410, 1995.
2-Burcelin R.
The incretins: a link between nutrients and well-being.
British Journal of Nutrition, 93، Suppl. 1, S147–S156, 2005.
3-Drucker DJ.
Glucagon-like peptides.
Diabetes;47:159– 169, 1998.
4-Dhanvantari S, Seidah NG, Brubaker PL.
Role of prohormone convertases in the tissue-specific processing of proglucagon.
Mol Endocrinol;10:342– 355, 1996.
5-Ranganath L R.
Incretins: pathophysiological and therapeutic implications of glucose-dependent insulinotropic polypeptide and glucagon- like peptide -1.
J. Clin. Pathol.;61;401-409, 2008.
6-Holst JJ.
Glucagon-like Peptide 1(GLP-1): an intestinal hormone signaling nutritional abundance, with an unusual therapeutic potential.
Trends Endocrinol Metab10:229–234, 1999.
7-Herrmann C, Goke R, Richter G, Fehmann HC, Arnold R, Goke B.
Glucagon-like peptide-1 and glucose-dependent insulin-releasing polypeptide plasma levels in response to nutrients.
Digestion; 56:117-126, 1995.
8-Fehmann H.C and Habener J.F.
Insulinotropic hormone glucagon-like peptide-1 (7–37) stimulation of proinsulin gene expression and proinsulin biosynthesis in insulinoma beta TC-1 cells,
Endocrinology 130, 159-166, 1992.
9-Knop F.K, H?jberg P.V, Larsen S, Madsbad S, V?lund A, Holst J.J, and Krarup T.
Reduced Incretin Effect in Type 2 Diabetes.
Diabetes 56:1951-1959, 2007.
10-Vilsb?ll T, Krarup T, Sonne J, Madsbad S, V?lund A, Juul AG, Holst JJ. Incretin secretion in relation to meal size and body weight in healthy subjects and people with type 1 and type 2 diabetes mellitus.
J Clin Endocrinol Metab; 88(6): 2706-2713, 2003.
11-Toft-Nielsen MB, Damholt MB, Madsbad S, Hilsted LM, Hughes TE, Michelsen BK, Holst JJ.
Determinants of the impaired secretion of glucagon-like peptide-1 in type 2 diabetic patients.
J Clin Endocrinol Metab; 86(8):3717-3723, 2001.
12-Vilsboll T, Krarup T, Deacon C.F, Madsbad S, and Holst J.J.
Reduced postprandial concentrations of intact biologically active glucagonlike peptide 1 in type 2 diabetic patients.
Diabetes. 50:609–613, 2001.
|
| |
| المجلد 5 ,
العدد 6
, محرم 1431 - كانون الثاني (يناير) 2010 |
|
|
|
