| الملخص Abstract |
ازدادت المعرفة حول الهبسيدين ودوره في امتصاص وحركة الحديد في الجسم في السنوات الحديثة مزوداً بذلك رؤية وظيفية أكثر عن استقلاب الحديد. يعد الهبسيدين المنظم المحوري لاستقلاب الحديد لكونه يتحكم بتدفق الحديد من الخلايا المعوية والخلايا الكبدية والبلاعم عن طريق تذويب وتدرك مصّدر الحديد (البروتين الحديدي) وأيضاً عن طريق تنظيم مستوى حديد البلازما. يرتفع تنظيم الهبسيدين استجابة للزيادة في مخازن الحديد أو بداية العدوى وينخفض تنظيمه بتأثير فقر الدم ونقص الأكسجة. بينما يعد الهبسيدين أيضاً من متفاعلات الطور الحاد والذي يحرض من قبل الالتهاب والذي يبدي نشاطاً مضاداً للجراثيم. إن اكتشاف الهبسيدين وفهم كيفية تثبيطه لحركة الحديد سوف يساعد الأطباء على تقييم أفضل لحالة الحديد عند المريض وربما يساعد في معالجة أكثر فعالية لمعالجة فقر دم الأمراض المزمنة. |
in recent years, Knowledge has increased about hepcidin and its role in the absorption and movement of iron in the body which has started to provide a more functional view of iron metabolism. Hepcidin is a pivotal regulator of iron metabolism because it controls the efflux of iron from enterocytes, hepatocytes, and macrophages by internalization and degradation of the iron exporter (ferroportin), and also regulates the plasma iron level. Hepcidin is upregulated in response to an increase of body iron stores or the onset of infection and is downregulated by anemia or hypoxia, while it is also an acute phase reactant induced by inflammation that shows antimicrobial activity. The discovery of hepcidin and further understanding of how it inhibits the movement of iron and is itself regulated may eventually help clinicians better evaluate a patient’s iron status and may assist in more effective, efficient treatment for anemia of chronic diseases. |
| المقدمة Introduction |
تعد اضطرابات استتباب الحديد Iron homeostasis والتي تؤدي إلى عوز الحديد Iron deficiency أو فرط حمل الحديد Iron overload شائعة جداً عبر العالم (1). يعتمد استتباب الحديد الطبيعي على العلاقة الوثيقة بين امتصاص الحديد الغذائي وحاجة الجسم من الحديد (2). وهناك احتمال قوي لوجود عامل محوري يلعب دوراً في التواصل بين مخازن الحديد Iron stores في الجسم وبين الخلايا الامتصاصية المعوية Intestinal absorptive cells. عرف العامل السابق كبروتين كبدي يدعى الهبسيدين Hepcidin، والذي تم كشفه في الأصل كببتيد له خواص مضادة للجراثيم يوجد في الدوران.
الهبسيدين هرمون ببتيدي Peptide hormone يصطنع في الكبد تم اكتشافه عام 2000 ويبدو أنه هو المنظم الرئيسي لاستتباب الحديد Iron homeostasis عند الإنسان وعند بقية الثدييات Mammals (3). وعند الإنسان يكون HAMP هو الجين المرمز للهبسيدين.
إن الافتراض بكون هرمون الهبسيدين هو المنظم لاستتباب الحديد في الجسم جعله مسؤولاً بشكل رئيس عن التآثرات الملاحظة بين المواقع المميزة تشريحياً لامتصاص الحديد إعادة استخدام الحديد والانتفاع به.
أدى اكتشاف ببتيد الهبسيدين وتوصيف الجيـن
HAMP المسؤول عن اصطناعه إلى تعديل الطرازات السابقة لتنظيم استتباب الحديد وإدراك أن الكبد يلعب دوراً محورياً في تحديد امتصاص الحديد من المعي Gut وتحرره من أماكن إعادة الاستخدام وأماكن التخزين (4).
وهو يعد المثال الأهم الذي بدل من الطراز الممرض pathogenic model لداء ترسب الأصبغة الدموية الوراثي Hereditary haemochromatosis المرتبط ببروتين HFE من طراز برمجة Programming model يركز على الخلية المعوية الامتصاصية العفجية Doudenal absorptive enterocyte إلى طراز الهبسيدين Hepcidin model الذي يركز على الخلية الكبدية Hepatocyte (5، 6). يفترض طراز الهبسيدين على أن سرعة تدفق الحديد Iron efflux في البلازما تعتمد بشكل رئيسي على مستوى الهبسيدين في البلازما. فعندما يكون مستوى الحديد عالياً يزداد اصطناع الهبسيدين ويتناقص تحرر الحديد من الخلايا المعوية والبلاعم. بشكل معاكس عندما تتناقص مخازن الحديد فإن اصطناع الهبسيدين ينخفض بحيث يتحرر الحديد من الخلايا المعوية ومن البلاعم بشكل أكبر.
عرف ببتيد الهبسيدين للمرة الأولى بالبروتين المضاد للمكروبات المعبر عنه في الكبد Liver-Expressed Antimicrobial Protein (LEAP-1) (7). تم اكتشاف الهبسيدين كببتيد مترافق مع الالتهاب أثناء التحري عن ببتيدات ذات تأثير مضاد للمكروبات. تشير Hep- في تسمية الهبسيدين إلى إنتاج هذا الببتيد في الكبد والذي يملك خواصاً مبيدة للمكروبات يشير إليها الجزء -cidin من التسمية هذه (8). بعد هذا الاكتشاف تم التعرف على أن إنتاج الهبسيدين في الفئران يزداد في حالات الحمل المفرط للحديد Iron overload كما في الالتهاب. ولقد واجهت الفئران المعدلة جينياً Genetically modified mice والمهندسة للتعبير المفرط عن الهبسيدين الموت بعد وقت قصير من الولادة مع وجود حالة من عوز حديد وخيم Severe iron deficiency مقترحة ذلك دوراً مركزياً للهبسيدين في تنظيم الحديد. ارتبط الهبسيدين بحالة سريرية عرفت بفقر دم الالتهاب Anemia of inflammation من خلال حالات مرضية لأورام كبدية Liver tumors مع فقر دم صغير الكريات Microcytic anemia لم تستجب للإمداد بالحديد. ووجد أن الأورام الكبدية كانت مفرطة الإنتاج للهبسيدين وتحوي على كميات كبيرة من الرنا المرسال للهبسيدين Hepcidin mRNA. وأدت إزالة الأورام الكبدية جراحياً إلى شفاء حالة فقر الدم (9).
|
| استقلاب الحديد Iron metabolism |
يجري إرجاع الحديد الغذائي الحر من الشكل الثلاثي Ferric (Fe3+) إلى الشكل ثنائي Ferrous (Fe2+) وذلك على السطح اللمعي Luminal surface للأمعاء الدقيقة الدانية Proximal small intestine (10). ينقل الشكل المرجع من الحديد إلى الخلايا المعوية بتواسط ناقل قمي Apical transporter هو DMT1 الذي يعرف أيضاً بـ DCT1 أو Nramp (10).
يجري قبط الحديد الغذائي الهيمي من قبل ناقل غير معروف ليتحرر من جزيئة الهيم ضمن الخلايا المعوية. يمكن للحديد أن يخزن ضمن الخلايا المعوية كفريتين Ferritin ليجري طرحه مع الخلايا المعوية الشيوخة Senescent enterocyte أو نقله عبر الغشاء إلى البلازما من قبل بروتين ناقل هو Ireg1 (11) والذي يعرف بأسماء أخرى مثل Ferroportin1 (12) و MTP1 (13). تتطلب العملية الأخيرة أكسدة Fe2+ إلى Fe3+ بتأثير Hephaestin (14). حالما يدخل الحديد إلى الدوران فإنه لا توجد آليات فيزيولوجية هامة لفقدان الحديد غير الحيض Menstruation.
يرتبـط الحديـد الممتص بالترانسـفيرين Transferrin الموجود في الدوران ليمر بشكل أولي عبر الجملة البابية Portal system للكبد الذي يعد الموضع الرئيسي لتخزين الحديد. تأخذ الخلايا الكبدية الحديد المرتبط بالترانسفرين عبر مستقبل الترانسفرين المدرسي TfR1 ولكن يتم ذلك بشكل أكبر عبر البروتين المماثل Homologus protein الذي جرى تعيين هويته حديثاً TfR2 (15، 16). يعد نقي العظام المكان الرئيسي لاستخدام الحديد حيث يجري أخذ الحديد من قبل طلائع الكريات الحمر Erythrocytes precursors ليستخدم في اصطناع الهيم Heme synthesis. وتجري إعادة استخدام الحديد الهيمي عن طريق إلتقام الكريات الحمر الشائخة Senescent erythrocytes من قبل البلاعم الشبكية البطانية Reticuloendothelial (RE) macrophages. حيث تعبر البلاعم عن TfRs وهي تأخذ الحديد من الدوران مباشرة.
يمكن لحديد البلاعم أن يحتجز ويخزن كفريتين Ferritin أو يتحرر إلى البلازما حيث تجري أكسدته من قبل السيرولوبلازمين Ceruloplasmin ويتم نقله عبر الترانسفيرين من أجل إعادة الاستخدام (الشكل 1).
يحدث الارتباط الوثيق بين امتصاص الحديد وبين مخازن الحديد في الجسم في الأمعاء الدقيقة الدانية Proximal small intestine. تتحسس الخلايا الخبيئة العفجية Duodenal crypt cells والتي تمثل طليعة Precursor للخلايا المعوية الامتصاصية Absortive enterocytes لمتطلبات الجسم من الحديد ويتم
برمجتها لتنضج متحولة إلى الخلايا المعوية الامتصاصية (17) التي تعبر عن مستويات ملائمة من البروتينات الناقلة للحديد (18).
تحصل الخلايا الخبئية Crypt cells على معلومات احتياجات الجسم من الحديد عن طريق منظمين مفترضين (2). يتمثل المنظم الأول بمنظم المخازن Stores regulator الذي يستجيب إلى مخازن حديد الجسم والمنظم الثاني هو منظم تكوين الكريات الحمر Erythropoietic regulator الذي يستجيب إلى متطلبات الجسم من اجل تكون الكريات الحمر Erythropoiesis. إن سعة Capacity منظم المخازن إلى تغيرات امتصاص الحديد منخفضة نسبياً بالمقارنة مع منظم تكوين الكريات الحمر وعلى الرغم من ذلك فهو يلعب دوراً أساسياً في مواجهة زيادة متطلبات الجسم من الحديد وفي منع زيادة الحديد (19).
تظهر أهمية منظم المخازن من خلال ملاحظة أن مرضى ترسب الأصبغة الدموية الوراثي Hereditary hemochromatosis (HH) تحدث لديهم عملية امتصاص زائد للحديد الغذائي بالنسبة لمخازن الحديد مقترحاً بذلك حدوث تبدل في منظم المخازن. ويؤدي تراكم الحديد الزائد مع مرور الوقت إلى الضرر النسيجي Tissue damage وفشل العضو Organ failure (20). يُرَمِّز الجين HFE الذي يصبح جيناً معيباً في مرض ترسب الأصبغة الدموية الوراثي البروتين التكاملي الغشائي Integral membrane التابع لمعقد التوافق النسيجي من الصنف الأول Major histocompatibility class I والذي يوجد بشكل معقد فيزيائي مع الغُلوبُلين المكروي بيتا 2 β2-microglobulin (21).
يعد الترافق السابق مع β2M ضرورياً من أجل نقل HFE إلى سطح الخلية (22). يقتصر وجود المعقد β2M HFE/ في العفج في الخلايا الخبيئة حيث يترافق مع TfR1 (23).
تقترح الملاحظات السابقة بقوة أن البروتين HFE يعدل من قبط أو تحرر الحديد المشتق من البلازما في الخلايا الخبيئة. تبدي المخاطية العفجية في HH ملامح أكثر وصفية لحدوث حالة من استنزاف للحديد أكثر من حدوث حالة من فرط حمل الحديد (11، 18، 24) مقترحاً ذلك بأن الفقدان الوظيفي للـ HFE في الخلايا الخبيئة يؤدي إلى تناقص قبط أو احتجاز الحديد البلازمي والذي يبرمج الخلايا المعوية البنت لزيادة امتصاص الحديد الغذائي.
يكون الوضع متبادلاً في العديد من النواحي لما يحدث في HH في اضطراب شائع لتوازن الحديد يتمثل بفقر دم الخمج Anemia of infection أو المرض المزمن Chronic disease. تكون مستويات الحديد في الدوران في HH مرتفعة ومخازن الجملة الشبكية البطانية من الحديد منخفضة والامتصاص المعوي للحديد زائداً. بشكل معاكس: تكون في فقر دم المرض المزمن مستويات الحديد في الدوران منخفضة مخازن الجملة الشبكية البطانية من الحديد مرتفعة والامتصاص المعوي للحديد متناقصاً (25، 26).
يؤثر كل من الإضطرابين السابقين في التواصل بين مواقع خزن الحديد في الكبد والجملة الشبكية البطانية ومواقع قبط الحديد في العفج. إن الطرق التي يجري من خلالها تواصل المواقع السابقة كانت لغزاً تم حله باكتشاف الهبسيدين Hepcidin.
|
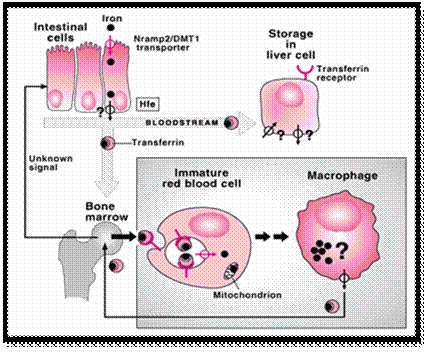
الشكل 1 : الإستقلاب الطبيعي للحديد.
|
| بنية الهبسيدين Hepcidin structure |
| تتألف قبل طليعة هرمون Preprohormone الهبسيدين طليعة هرمون Prohormone الهبسيدين وهرمون الهبسيدين Hepcidin hormone من 84,60 , 25 حمضاً أمينياً على الترتيب. تم عزل الهبسيدين من البول البشري حيث يعد الشكل المؤلف من 25 حمضاً أمينياً هو الشكل السائد على الرغم من أن ببتيدات أقصر مؤلفة من 22 و20 حمضاً أمينياً تشاهد أيضاً. تعد منطقة المطراف الآزوتي N-Terminal region من الهبسيدين ضرورية لوظيفة الهرمون وخبن (حذف) Deletion ببتيدات المطراف الآزوتي يؤدي إلى فقدان وظيفة الهرمون. يملك الهبسيدين بنية غنية بالصفيحة بيتا Beta-sheet كما يحتوي على ثمان ثمالات من السيستئين Cysteine residues ترتبط مع بعضها البعض بأربعة جسور ثنائية السلفيد disulfide bridges معطياً ذلك جزيئة ذات بنية ملقط شعر Hairpin structure بسيطة وجسور ذات هيئة تشبه السلم Ladder-like configuration (27) (الشكل 2). تتصف البنية السابقة بكونها مميزة للببتيدات القادرة على تمزيق الأغشية المكروبية وهي مشابهة لبقية الببتيدات ذات التأثير المضاد للمكروبات. |
| وظيفة الهبسيدين Hepcidin function |
أظهر الهبسيدين فاعلية مضادة للفطريات Antifungal activity ثابتة بشكل واضح إلا أن الفاعلية المضادة للجراثيم Antibacterial activity يبدو أنها غير ثابتة. تقترح الدلائل العلمية الحديثة بأن الهبسيدين هو هرمون منظم مركزي يتمثل دوره الرئيسي في تنظيم استتباب الحديد Iron homeostasis. يثبط الهبسيدين بشكل مباشر البروتين الحديدي (Ferroportin) البروتين الذي يقوم بنقل الحديد خارج الخلايا التي يختزن فيها. يوجد البروتين الحديدي الفروبورتين في الخلايا المعوية Enterocytes والبلاعم Macrophages (الشكل 3).
يمنع الهبسيدين، عن طريق تثبيط البروتين الحديدي (الفروبورتين) الخلايا المعوية من إفراز الحديد في الجملة البابية الكبدية Hepatic portal system منقصاً بذلك بشكل فعال من امتصـاص الحديـد. يمنـع البروتيـن الحديدي
(الفروبورتين) كذلك تحرر الحديد من البلاعم عن طريق تثبيط البروتين الحديدي لذلك فان الهبسيدين يحافظ على استتباب الحديد Iron homeostasis (الشكل 4). |

الشكل 2 : بنية الهبسيدين.
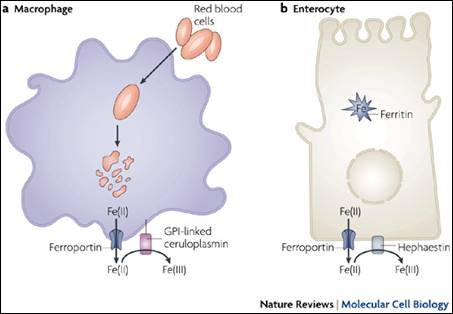
الشكل 3 : أماكن توافر البروتين الحديدي في البلاعم والخلايا المعوية.
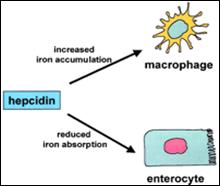
الشكل 4 : تأثير الهبسيدين على امتصاص الحديد من الخلايا المعوية وعلى تحرر الحديد من البلاعم.
|
| البروتين الحديدي (الفروبورتين)
Ferroportin
|
| الفروبورتين عبارة عن بروتين جرى توصيفه للمرة الأولى عام 2000. وهو يعد البروتين الرئيسي المصدر للحديد، ويتوضع على سطح الخلايا المعوية والبلاعم والخلايا الكبدية التي تعد الخلايا الرئيسية القادرة على تحرير الحديد في البلازما لينقل من قبل الترانسفيرين Transferrin (28). يتركز مسلك إعادة استخدام الحديد على تدرك الكريات الحمر الشائخة Senescent red cells من قبل بلاعم الشبكية البطانية Reticuloendothelial macrophages المتوضعة في نقي العظام وخلايا كوبفر الكبدية Hepatic kupffer cells والطحال. يجري التحكم بخروج الحديد من البلاعم من قبل البروتين الحديدي (الفروبورتين). يعد دور الخلايا الكبدية مركزياً بالنسبة لتأثير البروتين الحديدي (الفروبورتين) حيث تتحسس الخلايا الكبدية إلى حالة حديد الجسم وتقوم بتحرير أو تحدث تنظيماً منخفضاً للهبسيدين الذي يتآثر مع البروتين الحديدي (الفروبورتين) من أجل تعديل تحرر الحديد الخلوي. يرتبط الهبسيدين بشكل مباشر إلى البروتين الحديدي لينقص من نشاطه الوظيفي Functional activity عن طريق بلعمته من السطح الخلوي وتدركه (29). |
| آلية تنظيم استتباب الحديد من قبل الهبسيدين |
| يؤدي العوز في نواتج أربع جينات مختلفة إلى حدوث الأنماط الظاهرية HFE (30) 2M (31) TfR2 (32) والهبسيدين (33) الشبيهة بترسب الأصبغة الدموية الوراثي HH. يمكن لكل ناتج من النواتج الأربعة السابقة أن يساهم كمنظم لمخازن الحديد. يمكن للـ TfR1 المرتبط بـ HFE في الخلايا الخبيئة أن يلعب أيضاً الدور السابق (34). ولقد افترض أن TfR2 يتواسط قبط الحديد من قبل الخلايا الكبدية والذي يعدل من التعبير عن الهبسيدين الذي يتفاعل بدوره مع HFE 2M و TfR في الخلايا الخبيئة لتنظيم امتصاص الحديد الغذائي (33) (الشكل 5). |
| العوامل المنظمة لمستويات الهبسيدين |
تتمثل العوامل الرئيسية التي تنظم مستويات الهبسيدين بتحميل الحديد Iron loading والالتهاب Inflammation وفاعلية تكون الكريات الحمر Erythropoiesis.
1- تحميل الحديد: تؤثر مستويات الحديد المصلية على كمية الهبسيدين المنتجة في الكبد. تنقص مستويات الحديد المنخفضة من إنتاج الهبسيدين بينما تزيد المستويات المرتفعة من الحديد من إنتاج الهبسيدين (35).
2- الالتهاب: تزيد السيتوكينات الجوالة، مثل IL-6، من مستويات الهبسيدين ومن المحتمل أنها تسبب إحصاراً شبكياً بطانياً Reticuloendothelial blockade يكون فيه الإمداد بالحديد غير فعال ويمكن أن يؤدي إلى حالة من فرط حمل الحديد. يعمل IL-6 على تحريض إنتاج الهبسيدين بربط منشط الانتساخ Transcription activator إلى محرض الهبسيدين Hepcidin promoter (36، 37).
3- فاعلية تكون الكريات الحمر: من المتوقع أن زيادة إنتاج الكريات الدموية الحمر تنقص من إنتاج الهبسيدين وتسبب زيادة في امتصاص وحركة الحديد في الجسم.
|
| زيادة اصطناع الهبسيدين
Increased hepcidin synthesis
|
| يعتقد أن زيادة اصطناع الهبسيدين تتواسط استقلاب الحديد في حالتين سريريتين هامتين: عند الأشخاص الذين ليس لديهم طفرات مسببة لترسب الأصبغة الدموية يعتقد ان الخلايا الكبدية تتفاعل لزيادة إشباع الترانسفيرين بالحديد Iron saturation of transferrin أو لزيادة مخازن الحديد في الخلايا الكبدية نفسها عن طريق تحريض اصطناع الهبسيدين بآلية غير معروفة حتى الآن. إن الاستجابة الفيزيولوجية للحمل المفرط للحديد في الظروف الطبيعية يجري تواسطها من قبل الهبسيدين عن طريق منع امتصاص الحديد من قبل الخلايا المعوية ومنع إعادة استخدامه من قبل البلاعم ومنع خزنه في الخلايا الكبدية. ينقص تحريض اصطناع الهبسيدين تصدير الحديد من الخلايا الامتصاصية (الخلايا المعوية) وخلايا إعادة الاستخدام (البلاعم) وخلايا الاختزان (الخلايا الكبدية) (الشكل 6). يجري تواسط اصطناع وتحرر الهبسيدين كذلك من قبل عديد السكاريد الشحمي الجرثومي Bacterial lipopolysaccaride ومن قبـل السيتوكين Cytokine وخصوصاً الأنترلوكين-6 "Interleukine-6". لذلك فإن جين الهبسيدين تعد جين استجابة للطور الحاد Acute-phase responsive gene والتـي يحدث فرط التعبير عنها استجابة للالتهاب. |
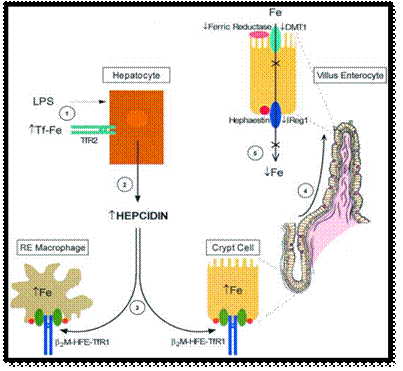
الشكل 5 : مراحل تنظيم استتباب الحديد من قبل الهبسيدين.
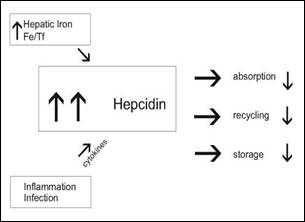
الشكل 6 : تأثير تحريض اصطناع الهبسيدين الكبدي على تصدير الحديد من الخلايا المعوية والبلاعم والخلايا الكبدية.

الشكل 7 : تأثير تحريض تناقص اصطناع الهبسيدين الكبدي على تصدير الحديد من الخلايا المعوية البلاعم والخلايا الكبدية.
|
إن التحريض المحدث من قبل السيتوكين للهبسيدين والمسبب من الالتهاب أو العدوى قد يكون مسؤولاً عن فقر الدم في المرض المزمن حيث يتم إحتجاز الحديد من قبل الخلايا الرئيسية التي تزود بالحديد وهي الخلايا المعوية والبلاعم والخلايا الكبدية. يسبب احتجاز الحديد إلى ظهور الملامح الرئيسة لفقر الدم في الأمراض المزمنة إشباع ترانسفيرين منخفض تكون كريات حمر معوز للحديد وفقر دم خفيف إلى متوسط الشدة (38).
لم تعرف إلى الآن طبيعة مستقبل الهبسيدين ويعد تطوير عوامل حاصرة لمستقبل الهبسيدين في المستقبل هدفاً لمعالجة فقر دم الأمراض المزمنة والذي يعد مشـكلة سـريرية شـائعة صعبة المعالجة.
|
| نقصان اصطناع الهبسيدين
Decreased hepcidin synthesis
|
يؤدي التنظيم المنخفض لاصطناع الهبسيدين إلى زيادة تحرر الحديد الذي يرتفع في حالتين: تشكل الطفرات في جينات البروتين الحديدي (الفروبورتين)، أو مستقبل الترانسفيرين أو الهبسيدين من الأسباب الرئيسية لترسب الأصبغة الدموية غير المرتبط بالجين HFE.
تتصـف حـالات ترسـب الأصبـغة الدموية
المرتبطة بالجين HFE التقليدية Classial HFE haemochromatosis وكل أنماط ترسب الأصبغة الدموية غير المرتبطة بالجين HFE Non-HFE haemochromatosis باستثناء ترسب الأصبغة الدموية المرتبطة مع البروتين الحديدي (الفروبروتين) كلها متعلقة بعوز هبسيدين غير ملائم. تصبح الخلايا الكبدية في جميع الحالات السابقة ذات حمل بالحديد بسبب أن قبط الحديد المرتبط بالترانسفيرين من الدوران يتجاوز تصدير الحديد المتواسط من قبل البروتين الحديدي (الفروبروتين).
يجري تثبط الهبسيدين في متلازمات الثلاسيمية Thalassaemic syndroms حيث يتنشط امتصاص الحديد بشكل غير ملائم، على الرغم من وجود فرط حمل جسيم للحديد (39).
في الدراسات التي أجريت على الحيوانات حرض كل من فقر الدم ونقص التأكسج Hypoxia على تناقص مستويات الهبسيدين (40) (الشكل 7). جرى إحداث حالة من فقر الدم بوساطة النزف الزائد أو الانحلال الدموي سامحاً بذلك تحريك الحديد من البلاعم والخلايا المعوية والذي يعد ضرورياً من أجل النشاط المكون للكريات الحمر Erythropoietic activity المحفز من قبل الاريثروبويتين Erythropoietin.
|
| قياس الهبسيدين
Measuring of hepcidin
|
| ترافق التعرف على المزيد عن دور الهبسيدين
في استقلاب الحديد مع تطوير طرق مختلفة للقياس الدقيق لمستويات الهبسيدين. يمكن لقياسات الهبسيدين غير المكلفة أن تكون ذات فائدة كبيرة في التشخيص السريـري ومعالجة الأفراد الذين
يشكون من أمراض ذات علاقة بالحديد.
تُمكن مقايسة مستويات الهبسيدين من معرفة مستويات الحديد عند الشخص وإمكان استخدامه وفيما إذا كان قادراً على الانجبال في كريات الدم الحمراء.
يعد قياس الهبسيدين في البول باستخدام أضداد مضادة للهبسيدين Antihepcidin antibody باللمعان الكيميائي Chemiluminescence من الطرق القديمة لمقايسة الهبسيدين (41). يعد مقياس الطيف الكتلوي Mass spectrometry من الطرق الأكثر حداثة للمعايرة الكمية للهبسيدين في المصل وفي البول. على الرغم من أن هذه الطريقة تمكن من قياس كافة أشكال الهبسيدين المؤلفة من 20 حمضاً أمينياً 22 حمضاً أمينياً و25 حمضاً أمينياً إلا أن ما يحد من استخدام هذه الطريقة هو محدودية توافر هذا الجهاز (42). جرى حديثاً تطوير مقايسة مناعية تنافسية مرتبطة بالإنزيم Competitive enzyme-linked immunoassay لمعايرة الهبسيدين المصلي. تملك الطريقة السابقة للمعايرة حداً أدنى للكشف يقدر بـ 5 نغ/ مل، كما تتمتع بحساسية كافية لكشف تموجات الهبسيدين Hepcidin fluctuations المسببة بالاختلاف النهاري Diurnal variation والاستجابة للحديد الفموي (43). يمكن لهذه المقايسة أن تكون غير مكلفة فيما لو طورت لتصبح بشكل عتيدة جاهزة Kit (44).
بما أن الهبسيدين يملك دوراً وظيفياً في توازن
الحديد لذلك فان معرفة مستوى الهبسيدين عند الفرد يمكن أن يزود بمعلومات مفيدة عن حالة حديد Iron status الفرد وتوافره. بالإضافة إلى ذلك فان تطوير طريقة غير مكلفة لمعايرة الهبسيدين يعد ذا أهمية باعتبار أن واصمات حالة الحديد الحالية مثل الفريتين Ferritin وإشباع الترانسفيرين Transferrin saturation (TSAT) ذات محدودية.
|
| التطبيقات السريرية للهبسيدين
Clinical applications of hepcidin
|
| يمكن لقياس مستويات الهبسيدين أن يُستخدم في التطبيقات السريرية التالية:
1- الكشف المبكر عن عوز الحديد Iron deficiency عند الرضع Infants.
2- تعيين هوية مرضى فقر دم المزمن غير المستجيبين للعوامل المنبهة لتكون الحمر Erythropoiesis-stimulating agents (ESAs).
3- كشف المرضى الذين سيحتاجون للحقن الوريدي للحديد قبل كشف عدم فاعلية المعالجة الفموية بالحديد.
|
| الاستنتاج Conclusion |
| إن اكتشاف الهبسيدين وفهم طريقة منعه لحركة الحديد والتنظيم الذاتي للهبسيدين يمكن أن يساعد في تقييم حالة الحديد عند الفرد، وربما يساعد ذلك في معالجة فعالة لفقر دم الأمراض المزمنة ومرض ترسب الأصبغة الدموية، حيث يزود الهبسيدين بفرضية لتوضيح تصرف الحديد في هاتين الحالتين. تعد الفيزيولوجية المرضية للهبسيدين كافية لإيجاد عوامل علاجية لكلا الحالتين. عندما يجري توصيف مستقبل الهبسيدين فان ذلك سيمكن من تطوير عوامل قادرة على احصار مستقبل الهبسيدين بهدف معالجة فقر الدم المترافق مع الأمراض المزمنة. كذلك يمكن للمعالجة بالهبسيدين أو الشادة Agonist أن تستخدم لمعالجة ترسب الأصبغة الدموية وهو الحالة التي يكون فيها إفراز الهبسيدين منخفضاً بشكل شاذ. |
| المراجع References |
| 1-Andrews NC.
Disorders of iron metabolism.
N Engl J Med. 341: 1986-1995, 1999.
2-Finch C.
Regulators of iron balance in humans.
Blood. 84: 1697-1702, 1994.
3-Ganz T.
Hepcidin, a key regulator of iron metabolism and mediator of anemia of inflammation.
Blood. 102 (3): 783-788, 2003.
4-Roetto A; Papanikolaou G; Politou M. et al.
Mutant antimicrobial peptide hepcidin is associated with severe juvenile hemochromatosis.
Nat Genet. 33: 21-22, 2003.
5-Fleming RE.
Advances in understanding the
molecular basis for the regulation of dietary iron absorption.
Curr Opin Gastroenterol. 21: 201-206, 2005.
6-Pietrangelo A.
Hereditary hemochromatosis-a new look at an old disease.
N Engl J Med. 350: 2383-2397, 2004.
7-Krause A; Neitz S; M gert HJ; Schulz A; Forssmann WG; Schulz-Knappe P. and Adermann K.
LEAP-1, a novel highly disulfide-bonded human peptide, exhibits antimicrobial activity.
FEBS Lett. 480 (2-3): 147-150, 2000.
8-Park CH; Valore EV; Waring AJ. and Ganz T.
Hepcidin, a urinary antimicrobial peptide synthesized in the liver.
J. Biol. Chem. 276 (11): 7806-7810, 2001.
9-McKie AT; Barrow D; Latunde-Dada GO; Rolfs A; Sager G; Mudaly E; Mudaly M; Richardson C; Barlow D; Bomford A. et al.
An iron-regulated ferric reductase associated with the absorption of dietary iron.
Science. 291: 1755-1759, 2001.
10-Gunshin H; Mackenzie B; Berger UV; Gunshin Y; Romero M F; Boron W F; Nussberger S; Gollan J L. and Hediger M A.
Cloning and characterization of a mammalian proton-coupled metal-ion transporter.
Nature (London). 388: 482-488, 1997.
11-McKie AT; Marciani P; Rolfs A;
Brennan K; Wehr K; Barrow D; Miret S; Bomford A; Peters T J; Farzaneh F. and et al.
A novel duodenal iron-regulated transporter, IREG1, implicated in the basolateral transfer of iron to the
circulation.
Mol Cell. 5: 299-309, 2000.
12-Donovan A; Brownlie A; Zhou Y; Shepard J; Pratt S J; Moynihan J; Paw BH; Drejer A; Barut B; Zapata A. et al.
Positional cloning of zebrafish ferroportin1 identifies a conserved vertebrate iron exporter.
Nature (London). 403: 776-781, 2000.
13-Abboud S. and Haile DJ.
A novel mammalian iron-regulated protein involved in intracellular iron metabolism.
J Biol Chem. 275: 19906-19912, 2000.
14-Vulpe CD; Kuo YM; Murphy TL; Cowley L; Askwith C; Libina N; Gitschier J. and Anderson GJ.
Molecular cloning of transferrin receptor 2. A new member of the transferrin receptor-like family.
Nat Genet. 21: 195-199, 1999.
15-Kawabata H; Yang R; Hirama T; Vuong PT; Kawano S; Gombart AF. and Koeffler HP.
Molecular cloning of transferrin receptor 2. A new member of the transferrin receptor-like family.
J Biol Chem. 274: 20826-20832, 1999.
16-Fleming RE; Migas MC; Holden CC; Waheed A; Britton RS; Tomatsu S; Bacon BR. and Sly WS.
Transferrin receptor 2: continued expression in mouse liver in the face of iron overload and in hereditary hemochromatosis.
Proc Natl Acad Sci USA. 97: 2214-2219, 2000.
17-Roy CN. and Enns CA.
Iron homeostasis: new tales from the crypt.
Blood. 4020-4027, 2000.
18-Zoller H; Koch R O; Theurl I; Obrist P; Pietrangelo A; Montosi G; Haile D J; Vogel W. and Weiss G.
Expression of the duodenal iron transporters divalent-metal transporter 1 and ferroportin 1 in iron deficiency and iron overload.
Gastroenterology. 120: 1412-1419, 2001.
19-Sayers MH; English G. and Finch C.
Capacity of the store-regulator in maintaining iron balance.
Am J Hematol. 47: 194-197, 1994.
20-Bacon BR.
Hemochromatosis: diagnosis and management.
Gastroenterology. 2001; 120:718-725, 2001.
21-Feder J N; Gnirke A; Thomas W; Tsuchihashi Z; Ruddy D A; Basava A; Dormishian F; Domingo R; Jr, Ellis M C; Fullan A. and et al.
A novel MHC class I-like gene is mutated in patients with hereditary haemochromatosis.
Nat Genet. 13: 399-408, 1996.
22-Feder J N; Tsuchihashi Z; Irrinki A; Lee V K; Mapa F A; Morikang E; Prass C E; Starnes S M; Wolff R K; Parkkila S. et al.
The hemochromatosis founder mutation in HLA-H disrupts beta2-microglobulin interaction and cell surface expression.
J Biol Chem. 272: 14025-14028, 1997.
23-Waheed A; Parkkila S; Saarnio J; Fleming RE; Zhou XY; Tomatsu S; Britton RS; Bacon BR. and Sly WS.
Association of HFE protein with transferrin receptor in crypt enterocytes of human duodenum.
Proc Natl Acad Sci USA. 96: 1579-1584, 1999.
24-Cox TM. and Peters TJ.
Uptake of iron by duodenal biopsy specimens from patients with iron-deficiency anaemia and primary
haemochromatosis.
Lancet. 1: 123-124, 1978.
25-Lee G R.
The anemia of chronic disease.
Semin Hematol. 20: 61-80, 1983.
26-Cortell S. and Conrad ME.
Effect of endotoxin on iron absorption.
Am J Physiol. 213: 43-47, 1967.
27-Atanasiu V; Manolescu B. and Stoian I.
Hepcidin-central regulator of iron metabolism.
Eur. J. Haematol. 78 (1): 1-10, 2007.
28-Pigeon C; Ilyin G; Courselaud B; et al.
A new mouse liver-specific gene, encoding a protein homologous to human antimicrobial peptide hepcidin, is over expressed during iron overload.
J Biol Chem.; 276: 7811-7819, 2001.
29-Nemeth E; Tuttle MS; Powelson J. et al.
Hepcidin regulates cellular iron efflux by binding to ferroportin and inducing its internalization.
Science. 306: 2090-2093, 2004.
30-Zhou X Y; Tomatsu S; Fleming R E; Parkkila S; Waheed A; Jiang J; Fei Y; Brunt E M; Ruddy D A; Prass C E. et al.
HFE gene knockout produces mouse model of hereditary hemochromatosis.
Proc Natl Acad Sci USA. 95: 2492-2497, 1998.
31-Rothenberg B E. and Voland J R.
Knockout mice develop parenchymal iron overload: A putative role for class I genes of the major histocompatibility
complex in iron metabolism.
Proc Natl Acad Sci USA. 93: 1529-1534, 1996.
32-Roetto A; Totaro A; Piperno A; Piga A; Longo F; Garozzo G; Cali A; De Gobbi M; Gasparini P. and Camaschella C.
New mutations inactivating transferrin receptor 2 in hemochromatosis type 3.
Blood. 97: 2555-2560, 2001.
33-Nicolas G; Bennoun M; Devaux I; Beaumont C; Grandchamp B; Kahn A. and Vaulont S.
Lack of hepcidin gene expression and severe tissue iron overload in upstream stimulatory factor 2 (USF2) knockout mice.
Proc Natl Acad Sci USA. 98: 8780-8785, 2001.
34-Waheed A; Parkkila S; Saarnio J; Fleming R E; Zhou X Y; Tomatsu S; Britton R S; Bacon B R. and Sly W S.
Association of HFE protein with transferrin receptor in crypt enterocytes of human duodenum.
Proc Natl Acad Sci USA. 96: 1579-1584, 1999.
35-Nemeth E; Rivera S; Gabayan V; Keller C; Taudorf S; Pedersen BK. and Ganz T.
IL-6 mediates hypoferremia of inflammation by inducing the synthesis of the iron regulatory hormone hepcidin.
J Clin Invest. 113(9): 1271-1276, 2004.
36-Schmidt PJ; Toran PT; Giannetti AM; Bjorkman PJ. and Andrews NC.
The transferrin receptor modulates Hfe-dependent regulation of hepcidin
expression.
Cell Metab. 7(3): 205-214, 2008.
37-Goswami T. and Andrews NC.
Hereditary hemochromatosis protein, HFE, interaction with transferrin receptor 2 suggests a molecular mechanism for mammalian iron sensing.
J Biol Chem. 281(39): 28494-28498, 2006.
38-Weiss G. and Goodnough LT.
Anemia of chronic disease.
N Engl J Med. 352:1011-1023, 2005.
39-Papanikolaou G; Tzilianos M; Christakis JI. et al.
Hepcidin in iron overload disorders.
Blood. 105: 4103-4105, 2005.
40-Nicolas G; Chauvet C; Viatte L. et al.
The gene encoding the iron regulatory peptide hepcidin is regulated by anemia, hypoxia, and inflammation.
J Clin Invest. 110: 1037-1044, 2002.
41-Ganz T; Olbina G; Girelli D; Nemeth E. and Westerman M.
Immunoassay for human serum hepcidin.
Blood. 15; 112(10): 4292-4297, 2008.
42-Kemna E; Tjalsma H; Laarakkers C; Nemeth E; Willems H. and Swinkels D.
Novel urine hepcidin assay by mass spectrometry.
Blood. 106(9): 3268-3270, 2005.
43-Brugnara C.
Blood. An immunoassay for human serum hepcidin at last.
Blood. 112(10): 3922-23, 2008.
44-Young B. and Zaritsky J.
Hepcidin for Clinicians.
Clin J Am Soc Nephrol. 2009.
|
| |
| |
