| الملخص Abstract |
تقدم الطب الحديث بقفزات واسعة في السنوات الأخيرة، حتى أصبح الخيال العلمي جزءاً من الحقائق التي نعيشها يوماً بعد يوم، ولا شك أن التقدم الأكبر كان اكتشاف الخلايا الجِذْعِيّة وما حملته الدراسات المتتالية عليها من بشائر.
الخلايا الجِذْعِيّة هي خلايا غير متخصصة توجد عند الجنين والبالغ، يمكنها أن تعطي نسائل تتمايز إلى خلايا متخصصة، وتتجدد بعملية الانقسام الخلوي والتضاعف، لكن ما إن تتعرض لتأثيرات معينة حتى تتمايز إلى خلايا نسيجية محددة يتجاوز عددها 220 نوعاً من الخلايا حسب طبيعة العامل المؤثر، كأن تتمايز إلى خلايا قلبية أو كبدية أو بنكرياسية. تتميز الخلايا الجِذْعِيّة بإمكان تكثيرها وإجراء الدراسات عليها في المختبر in vitro، كدراسة التأثير العلاجي أو الضار للعقاقير الجديدة على خلايا الأنسجة المختلفة.
ومن تطبيقات استخدام الخلايا الجِذْعِيّة استخدامها في عمليات زرع نقي العظم لدى المرضى المصابين بأمراض الدم، حيث تنقسم هذه الخلايا وتتمايز إلى خلايا الدم المختلفة، كما يمكن استخلاص الخلايا الجِذْعِيّة من الأجنة وتكثيرها إلى أنسجة محددة تزرع مكان الأنسجة المعطوبة.
|
| لمحة تاريخية |
حسب ما ورد عن Leslie Arey "أبو علم الأجنة الحديث"(1)، فإن أول محاولة مسجلة لفهم أصل الحياة والتطور الباكر للكائن البشري قام بها أرسطو (384-322 ق.م) حيث تعرف على المراحل الأولى من التطور في الرحم، وكان أول من تأمل في الجدل حول ما إذا كان الفرد الجديد يتشكل مسبقاً في الأم، ويكبر فقط خلال تطوره أم لا، استنتج أرسطو أن الجنين مشتق من الدم الحيضي للأم، وهذا الاستنتاج مبني على النظرية القائلة إن الحيوانات الحية تنشأ من الطين أو المادة المتحللة (نظرية عرفت في القرون الوسطى باسم النشوء التلقائي spontaneous generation) ظلت هذه النظرية سائدة حتى القرن التاسع عشر عندما وضع Leydig عام 1855م نظرية تقول: إن الحياة تنشأ من حياة موجودة مسبقاً (1)، ثم وسّع Virchow عام 1855م المفهوم وافترض أن كل الخلايا في متعضية ما مشتقة من خلايا موجودة مسبقاً“All cells come from cells" .
دُحضت نظرية التوالد التلقائي رسمياً عام 1864م عندما قام العالم Louis Pasteur (1) بتجارب دقيقة وموثوقة بينت فشل الكائنات الحية الدقيقة في النمو في مرق عقيم في أوعية ذات أعناق طويلة تحول دون دخول الكائنات المحيطة. وتبين في بدايات القرن العشرين أن الجنين يتشكل من تلقيح بويضة تتطور في مبيض الأنثى بالاندماج مع نطفة من الذكر، ومنتج هذا الاندماج هو الخلية الجِذْعِيّة الكاملة القدرة (2).
بدأ الاهتمام بالخلايا الجِذْعِيّة في ستينيات القرن الماضي على يد العالم الكندي James Thomson حيث حقن فئران التجربة بخلايا مأخوذة من نقي العظم، وهذا ما أدى إلى تشكل عقد صغيرة في طحال تلك الفئران (الطحال هو العضو الذي يتم فيه تخزين كريات الدم)، وقد افترض أن كل عقدة نتجت من خلية نقوية واحدة، وتبين لاحقاً أن كل خلية في هذه العقد لها القدرة على الانقسام وإعطاء خلايا جديدة، كما نجح أيضاً في استخلاص خلايا من أجنة فائضة من تجارب الإخصاب، ثم قام بتنميتها في المختبر وحصل على أول خط من الخلايا
الجِذْعِيّة الجنينية البشرية (3).
وفي العام نفسه عزل العالم Gearhart خلايا من أجنة بعمر 2-4 أشهر (حصل عليها من إجهاضات طوعية بعد موافقة خطية من المتبرعات اللاتي قررن إنهاء الحمل)، وحصل على خط مختلف من المزارع الخلوية بجمع الخلايا من أجنة بعمر 9 أسابيع.
يمكن أن تعد هذه الاكتشافات نقطة البداية لما أصبح أخيراً حقيقة لا جدال فيها وهي أن الخلايا الجنينية يمكنها أن تتحول تقريباً إلى أي من الخلايا المتخصصة في الجسم، ولذلك يمكنها أن تعطي خلايا بديلة لعدد كبير من الأنسجة والأعضاء، كالقلب والكبد والبنكرياس والجملة العصبية، حيث يمكن إنتاج خلايا مختلفة بدءاً من خلايا جِذْعِيّة متماثلة بتبديل الشروط المختبرية (من عوامل نمو ومواد كيميائية وغيرها). ويبين الجدول 1 تعريفاً مختصراً للمصطلحات المستخدمة في هذا المقال.
|
| الخلايا الجِذْعِيّة |
تعد الخلية الجِذْعِيّة أصل الحياة. فهي خلية وحيدة يمكنها أن تعطي نسائل تتمايز إلى أي من الخلايا المتخصصة الجنينية أو الكهلة وهذا يعني أنها كاملة القدرة totipotency . الخلية الجِذْعِيّة الأساسية هي البيضة المخصبة fertilized egg التي تنقسم 5 أو 6 مرات لتعطي خطوطاً خلوية تشكل أعضاء متمايزة مختلفة. (الشكل 2)، وخلال هذه الانقسامات
المبكرة تبقى كل خلية بنت كاملة القدرة totipotent. ثم من خلال سلسلة من الانقسامات والتمايز تقفد الخلايا الجِذْعِيّة المضغية embryonic stem cells (ESCs) كمونها وتصبح ذات وظيفة متخصصة (بعملية تسمى التعيين)(4). إن الخلايا الجِذْعِيّة الأقل قدرة من الخلايا الكاملة القدرة تدعى خلايا سلفية cells progenitor.
باستثناء الخلايا المنتشة (الجنينية) germinal cells التي تبقى كاملة القدرة فإن أغلب الخلايا الجِذْعِيّة في الأنسجة البالغة تصبح أقل قدرة على إنتاج أنماط خلوية مختلفة، وعلى كل فإن هنالك أدلة كثيرة تشير إلى بقاء خلايا كاملة أو متعددة القدرة toti/multi-potent cells في أنسجة البالغين وخاصة في نقي العظم.
تتوضع الخلايا الجِذْعِيّة لدى البشر في الطبقة الخلوية الداخلية للجنين في مرحلته المبكرة كما في الشكل1. وفي بعض الأعضاء البالغة يمكن أن تعطي الخلايا الجِذْعِيّة أكثر من نمط خلوي متخصص ضمن ذلك العضو، فمثلاً الخلايا الجِذْعِيّة العصبية يمكنها أن تعطي ثلاثة أنماط خلوية توجد في عصبونات الدماغ neurons brain والخلايا الدبقية glial cells والخلايا النجمية astrocytes (5). |
الجدول1: تعاريف مختصرة بأهم التعابير المستخدمة في المقال.
الخلايا الجِذْعِيّة
Stem cells |
خلايا لها القدرة على الانقسام لفترات غير محددة في الوسط الزرعي وتنشأ عنها خلايا متخصصة |
الكيسة الأريمية
Blastocyst (الشكل1) |
تمثل الجنين في مرحلة ما قبل الانغراس وتتألف من 30-150 خلية وعمرها 7 أيام. وتتكون من كرة تكوّن الطبقة الخارجية من الخلايا |
خلايا نقي العظم الجِذْعِيّة
Bone marrow stem cell |
تشير إلى نمط واحد على الأقل من الخلايا الجِذْعِيّة المتعددة الكمون multipotent stem cells كالخلايا الجِذْعِيّة المكونة للدم hematopoietic stem cell |
المضغة
Embryo |
تمثل لدى البشر تطور الكائن الحي من وقت الإخصاب حتى نهاية الأسبوع الثامن من الحمل، عندها يصبح ما يعرف بالجنين fetus |
الخلايا الجِذْعِيّة المضغية Embryonic stem cell (ESC) |
خلايا بدئية غير متمايزة من المضغة، لها القدرة على التحول إلى أنماط خلوية متخصصة مختلفة. |
الطبقات المنتشة
layers Germ |
ثلاث طبقات نسيجية أولية تنشأ من المضغة – الأديم الباطن endoderm والأديم المتوسط mesoderm والأديم الظاهر ectoderm ، تتطور من خلالها أنماط الأنسجة الجسمية somatic tissue جميعها |
الخلايا الجِذْعِيّة المكونة للدم Hematopoietic stem cell (HSC) |
خلايا جِذْعِيّة تتطور منها كل خلايا الدم الحمراء والبيضاء |
الكتلة الخلوية الداخلية
Inner cell mass |
تَجمّع (عنقود) من الخلايا داخل الكيسة الأريمية، وتشكل مصدر الخلايا الجِذْعِيّة المضغية (الشكل1) |
اللحمة المتوسطة
Mesenchyme |
نسيج ضام ينشأ عن عدة طبقات خلوية منتشة تتألف من خلايا غير متخصصة. وتنشأ عن اللحمة المتوسطة العديد من الأنماط الخلوية كالخلايا التي تعطي الكولاجين والعضلات والغضاريف والعظام |
المشيمة
Placenta |
بنية وعائية بيضوية أو قرصية ذات قوام إسفنجي في الرحم، يحصل الجنين من خلالها على الغذاء والأكسجين |
الخلايا الجِذْعِيّة البالغة
Adult stem cell |
خلايا غير متمايزة توجد في أنسجة متمايزة بالغة، يمكنها أن تتجدد ذاتياً، ويمكنها( ضمن حدود معينة) التمايز لإعطاء كل أنماط الخلايا المتخصصة للأنسجة التي نشأت منها |
|
| 1- تصنيف الخلايا الجِذْعِيّة |
يمكن أن تصنف الخلايا الجِذْعِيّة كما يلي:
1-1- تصنيف الخلايا الجِذْعِيّة حسب مرونتها (6):
البيضة الملقحة لها أعلى درجة مرونة وقادرة على إعطاء كل خلايا الجسم، لذا تسمى كاملة القدرة totipotent. والقسيمة الأرومية blastomere تكون في البداية كاملة القدرة لكن سريعاً ما تتراجع مرونتها. وفي الحقيقة فإن القسيمة الأرومية من جنين عمره خمسة أيام (200 خلية) تسمى متعددة القدرات pluripotent، لأنها تعطي مجالاًً محدوداً من أنماط الخلايا. وباستمرار تطور الجنين تصبح الخلايا أقل قدرة من السابقة وتسمى multipotent، وهي تعطي عدداً قليلاً من أنماط الخلايا، لذا أصبح معروفاً الآن أن الخلايا الجِذْعِيّة في اللحمة المتوسطة mesenchymal stem cells التي كانت السلائف progenitors غير الدموية الأولى التي عزلت من نقي العظم يمكنها أن تتمايز إلى خلايا عظمية أو شحمية أو عضلية بالإضافة إلى قدرتها على التمايز إلى خلايا دموية (7).
وأخيراً تصبح الخلايا متخصصة متمايزة وهذا يعني أنها ستعطي خلايا من النوع نفسه أو ستفقد القدرة على التكاثر كالخلايا العصبية، ويبيـن الجـدول 2 تصنيف الخلايـا حسـب مرونتـها (درجة قدرتها) مع الأمثلة.
تشير الأدلة الحديثة إلى أن بعض الخلايا في الأنسجة المستخدمة كأمثلة عن درجة المرونة، يمكن أن تكون لها مرونة أكثر مما تم تقديره، فمثلاً الخلايا الجِذْعِيّة الجلدية التي كان يعتقد أنها أحادية أو ثنائية القدرة قد تحوي خلايا سلفية متعددة القدرة.
|
 |
1-2 تصنيف الخلايا الجِذْعِيّة حسب مصدرها
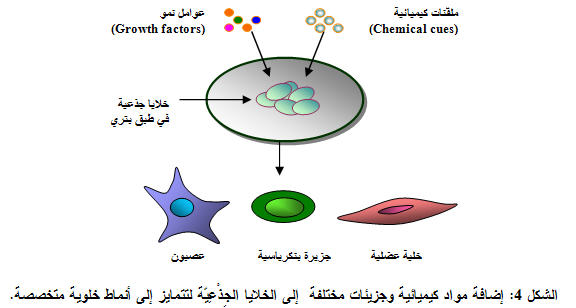
تصنف الخلايا الجِذْعِيّة حسب مصدرها إلى ثلاثة أنماط رئيسة: مضغية embryonic وسُرّية umbilical وبالغة adult وكل منها تختلف عن الأخرى من حيث المرونة plasticity، وهكذا يمكن استخدامها لغايات طبية مختلفة، وليغدو هذا ممكناً لابد من دراسة وتحديد التقنيات المختبرية لجمع وتنمية وتمييز الخلايا الجِذْعِيّة المختلفة، ودور عوامل النمو
في عملية التنمية بحيث تصبح إمكان تنمية الخلايا متوفرة تجارياً.
|
الجدول 2: تصنيف الخلايا الجِذْعِيّة حسب مرونتها (6).
نمط الخلية |
درجة القدرة (المرونة) |
المثال |
Totipotent |
All |
الخلايا المضغية |
Multipotent |
Many/much |
الخلايا المكونة للدم |
Pluripotent |
Several/many |
الخلايا المكونة للدم |
Oligopotent |
Few/little |
الخلايا الجِذْعِيّة في القناة الهضمية |
Quadripotent |
Four |
الخلايا الجِذْعِيّة في القناة الهضمية |
Tripotent |
Three |
البطانة القصبية |
Bipotent |
Two |
القناة الصفراوية |
Unipotent |
One |
البروستات |
|
| 2- مصادر الخلايا الجِذْعِيّة |
2-1- الخلايا الجِذْعِيّة المضغية
Embryonic stem cells (ESCs)
تشتق من الجنين بمرحلته المبكرة، حيث ينتج عن تلقيح البويضة بالنطفة بيضة ملقحة، وهي أبكر مرحلة جنينية.
تبدأ البيضة الملقحة بالانقسام بعد 30 ساعة من التلقيح (الإخصاب)، وفي اليوم الثالث إلى الرابع يكون الجنين على شكل كرة مكتنزة compact ball مؤلفة من 12 خلية أو أكثر تسمى التويتة morula، وبعد خمسة إلى ستة أيام من التلقيح، وبعد عدة دورات من الانقسامات الخلوية، تبدأ خلايا التويتة بالتخصص مشكلة كرة خلوية مجوفة تدعى الكيسة الأريمية blastocyst التي يبلغ قطرها حوالي 150 مكروناً (8) (الشكل3).
تدعى الطبقة الخارجية من الكيسة الأريمية الأرومة المغذية trophoblast، وفيها تجمع خلوي يدعى الكتلة الخلوية الداخلية inner cell mass. وهي خلايا جِذْعِيّة متعددة الكمون multipotent stem cells تعطي كل الأنماط الخلوية لطبقات الأنسجة الرئيسية (الأديم الظاهر ectoderm والأديم المتوسط mesoderm والأديم الباطن endoderm) للجنين (9,10).
أصبح من الممكن إزالة الخلايا الجِذْعِيّة من الكيسة الأريمية وإبقائها بحالة غير متمايزة في خطوط زرع خلوية في المختبر. (كما في الشكل 2)، وحتى تصبح ذات فائدة في المعالجات الطبية لا بد من أن تتمايز الخلايا الجِذْعِيّة المضغية المزروعة إلى أنسجة مناسبة لنقلها إلى المرضى. ولا يزال الباحثون يعملون جاهدين لتحقيق هذا الغرض.
تمتلك الخلايا الجِذْعِيّة المضغية ثلاث مزايا تجعلها تنفرد عن بقية الأنماط الخلوية الأخرى وهي: قدرتها على التجدد بشكل مستمر، وقدرتها على توليد أنماط خلوية متنوعة، والذخيرة الوراثية فيها فطرية وتامة (11).
نظرياً؛ يقدم إمكان التطور والتكاثر غير المحدود للخلايا الجِذْعِيّة الجنينية فرصة عظيمة لتطبيقها في مجال الطب وهندسة النسج. وعلى كل توجد عدة عوائق تعترض استخدام الخلايا الجِذْعِيّة الجنينية المشتقة من الأنسجة في معالجة الأمراض البشرية. أحد أهم هذه العوائق عدم القدرة على ضبط تمايز الخلايا الجِذْعِيّة إلى سلائف ذات ذرارٍ نوعية. والعائق الثاني رفض الخلايا الجِذْعِيّة الجنينية المشتقة من الأنسجة (12).
|
 |
| * خصائص الخلايا الجِذْعِيّة المضغية الهامة في الطب |
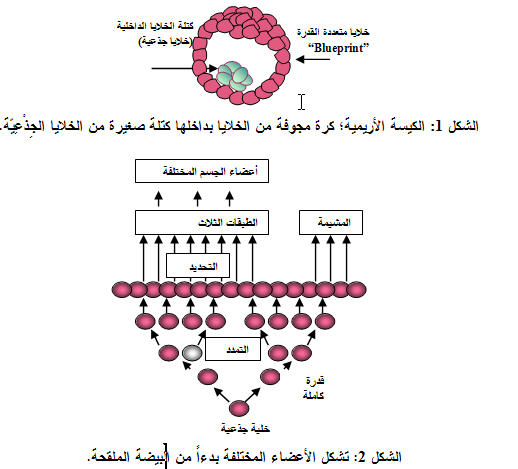
هنالك اهتمام واضح في تطوير منتجات المعالجة الخلوية المشتقة من الخلايا الجِذْعِيّة المضغية البشرية والتي تعزى بشكل رئيسي إلى قدرتها على التجدد الذاتي والتكاثر ومحافظتها على قدرتها على التمايز في الوسط الزرعي. تسمح هذه الخصائص بإنتاج أعداد كبيرة من الخلايا الجِذْعِيّة المضغية البشرية التي يمكن أن ينشأ عنها ذرارٍ خلوية نوعية. ونظراً لقدرة الخلايا الجِذْعِيّة المضغية البشرية على إصلاح الخلايا والأنسجة المتضررة فمن المتوقع أن تكون الخلايا المتمايزة المشتقة منها ذات مستقبل واعد في المعالجة الخلوية (13).
لقد تمت تنمية الخلايا الجِذْعِيّة المضغية البشرية في المختبر بنجاح لأول مرة عام 1998، وتحت ظروف زرع مناسبة أظهرت الخلايا قدرة واضحة على التجدد الذاتي باستمرار وإنتاج المزيد من الخلايا المتشابهة المتعددة الكمون multipotent (الشكل 4).
أبدت الخلايا الجِذْعِيّة المضغية البشرية التي جرى تكثيرها لأكثر من عامين حفظها للكروموزومات بشكل طبيعي وثابت خلافاً لخطوط الخلايا المضغية السرطانية التي استخدمت في الماضي لدراسة المراحل المبكرة لتطور الجنين.
تتكاثر الخلايا الجِذْعِيّة لدى الفئران بالحالة غير المتمايزة بوجود العامل المثبط لابيضاض الدم leukemia inhibitory factor (LIF)، لكن ظروف الزرع تتطلب الحفاظ على الخلايا الجِذْعِيّة المضغية البشرية من التمايز وذلك بتنميتها في أطباق بتري على طبقة من الخلايا المغذية في وسط يحوي مصلاً بقرياً. عند إزالة الخلايا المغذية وإتمام الزرع في معلق (في وسط سائل) تتجمع كريات من الخلايا الجِذْعِيّة المضغية البشرية تدعى الأجسام المُضغية embryonic bodies والتي اتضح أنه ينشأ عنها الكثير من الأنماط الخلوية التي تمثل الطبقات الثلاث جميعها لتطور أنسجة الجنين.
والدليل على تمايز الخلايا في الوسط الزرعي كان من خلال كشف جينات تعود إلى أنماط خلوية متعددة، وفي بعض الحالات من خلال وجود أشكال مميزة تميز أنماطاً خلوية مختلفة (14).
عند إعطاء الخلايا الجِذْعِيّة المضغية البشرية بأعداد كافية فإنها تحـث على تشـكل الأورام
خية المكونة من كل من الخلايا المتمايزة والخلايا غير المتمايزة. من الممكن أن تكون منتجات المعالجة الخلوية المشتقة من الخلايا الجِذْعِيّة المضغية البشرية متغايرة المنشأ في تكوينها وتتألف من خلايا لها القدرة على التمايز بدرجات مختلفة، والخلايا الجِذْعِيّة المضغية البشرية المتبقية غير المتمايزة جزئيا تحتفظ بقدرتها على التكاثر والتمايز. أما فيما يخص أمان الخلايا الجِذْعِيّة المضغية البشرية فإنه يتعلق بقدرة الخلايا على الهجرة من مكان إعطائها وتمايز هذه الخلايا غير المناسب في الموضع غير المرغوب به (15).
|
 |
2-2- الخلايا الجِذْعِيّة البالغة Adult stem cells
|
خلايا غير متمايزة توجد في أنسـجة متمايزة، كما في نقي العظام أو الدماغ في جسم البالغ. يمكنها أن تجدد نفسها ذاتياً في الجسم معطية نسخاً مماثلة لها مدى حياة الكائن الحي، أو أن تصبح متخصصة لتعطي أنماطاً خلوية لأنسجة الأعضاء.
تتضمن مصادر الخلايا الجِذْعِيّة البالغة نقي العظم والدم والعين والدماغ والعضلات الهيكلية ولب الأسنان والكبد والجلد وبطانة السبيل المعدي المعوي والبنكرياس. وتقترح الدراسات أن بعض الخلايا الجِذْعِيّة البالغة على الأقل متعددة الكمون multipotent. فمثلا جرى الإعلان عن أن خلايا نقي العظم الجِذْعِيّة وأنسجة الأديم المتوسط يمكن أن ينتج عنها الأنماط الرئيسية الثلاثة لخلايا الدماغ، التي تشتق من الأديم الظاهر ectodermal وأن الخلايا الجِذْعِيّة في الدماغ يمكن أن تتمايز إلى خلايا الدم والأنسجة العضلية إلا أن هذه الموجودات تحتاج لدراسات أعمق (16).
من محاسن استخدام الخلايا الجِذْعِيّة البالغة هي أن خلايا المريض نفسه تجري تنميتها في الوسط الزرعي ثم تعاد إلى المريض وهذا يعني أنها لا تواجه الرفض المناعي.
ومن الأمثلة على الخلايا الجِذْعِيّة البالغة الخلايا الجِذْعِيّة المولدة للدم وهي أول الخلايا التي استخدمت بنجاح في المعالجة واستخدمت لعقود في معالجة ابيضاض الدم وأمراض دموية أخرى (17) كما استخدمت لمعالجة سرطان الثدي (18).
|
الفرق بين الخلايا الجِذْعِيّة المضغية والبالغة
تمتلك كل من الخلايا الجِذْعِيّة المضغية والخلايا الجِذْعِيّة البالغة القدرة على التطور إلى عدة أنماط خلوية مختلفة في الجسم. إلا أنهما تختلفان بعدد ونمط الخلايا التي ستؤول إليه كل منهما.
فالخلايا الجِذْعِيّة المضغية يمكنها أن تتطور إلى كل الأنماط الخلوية، بينما الخلايا الجِذْعِيّة البالغة يكون عدد ونمط الخلايا التي ستتطور إليها في الأنسجة والأعضاء محدوداً.
تأتي الخلايا الجِذْعِيّة المضغية من المضغة. إذ تتطور هذه الخلايا عن البيضة المخصبة، ويتم تطويرها في المختبر من خلال التخصيب ومن ثم تعطى للبـحث. ولا تتطور عن البـويضات المخصبة في جسم الأنثى مسبقاً.
إن الخلايا الجِذْعِيّة البالغة لا تبدل من نمطها الخلوي الأصلي. ويمكن أن توجد بين الخلايا الأخرى التي تحولت إلى أنماط خلوية أخرى ضمن النسيج أو العضو مسبقاً. ويمكنها أن تتحول إلى أنماط خلوية متخصصة أخرى في النسيج أو العضو. والدور الرئيسي للخلايا الجِذْعِيّة البالغة استخدامها كأداة تصليح للنسج أو العضو الذي توجد فيه.
|
2-3- الخلايا الجِذْعِيّة الجنينية
Fetal stem cells
هي أنماط خلوية أولية لدى الجنين تتطور في النهاية إلى أعضاء الجسم المختلفة. لكن إلى الآن ما زال البحث مقتصراً على عدة أنماط خلوية فقط وهي: الخلايا الجِذْعِيّة العصبية neural stem cells والخلايا الجِذْعِيّة المكونة للدم hematopoietic stem cells وأسلاف الجزر البنكرياسيةpancreatic islet progenitors . فالخلايا الجِذْعِيّة العصبية التي توجد بأعداد كبيرة في دماغ الجنين يمكن أن يجري عزلها وتنمو بشكل غير متمايز في المزارع الخلوية، وتبين أنها تتمايز إلى ثلاثة أنماط من خلايا الدماغ. استخدمت هذه الخلايا لدى القوارض المصابة بداء باركنسون. الخلايا العرفية (تأخذ شكل عرف الديك) العصبية Neural crest cells تنشأ من الأنبوب العصبي وتهاجر منه طيلة فترة تطور الجنين. ويمكنها أن تتطور إلى عدة أنماط خلوية بما فيها الأعصاب التي تعصب القلب والأمعاء وأعضاء أخرى (19).
يعد الكبد والدم الجنيني من المصادر الغنية بالخلايا الجِذْعِيّة المكونة للدم المسؤولة عن توليد أنماط خلوية متعددة في الدم إلا أنه لم يجرِ الاستقصاء عن خصائصها بشكل كبير.
تبين أن الأنسجة المستخلصة من بنكرياس الجنين تحث على إنتاج الأنسولين عند نقلها إلى الفئران المصابة بالداء السكري، لكن لم يكن واضحاً فيما إذا كان ذلك يعزى إلى الخلايا الجِذْعِيّة الحقيقية أو إلى أسلاف الخلايا الأكثر نضجاً، أو إلى وجود خلايا الجزر البنكرياسية المنتجة للأنسولين الناضجة بشكل كامل (20).
2-4- خلايا الحبل السري الجِذْعِيّة
يجري جمع الخلايا الجِذْعِيّة من الحبل السري بإدخال إبرة إليه وسحب الدم إلى وعاء خاص، وتعالج العينة لتركيز الخلايا الجِذْعِيّة ويمكن أن تحفظ الخلايا مجمدة في الآزوت السائل عدة سنوات، وتستخدم عند الحاجة، ولهذه الخلايا مرونة تطورية ممتازة مساوية تقريباً لتلك المأخوذة من الجنيـن (21)، ومعدل قبول أعلى لدى الأخوة من حيث تطابق معقد التوافق النسيجي HLA وكذلك عند اختلاف معقد التوافق النسيجي عند المتلقين (22)، ومن محاسنها أنها جاهزة للزرع عند الحاجة فوراً. أنجزت أول زراعة لدم الحبل السري عام 1970 في فتى عمره 16 عاماً يعاني من ابيضاض دم لمفاوي حاد (23)، كما يمكن لدم الحبل السري أن يكون مصدراً لمعالجات خلوية متعددة مثل سرطان الثدي (21).
لقد استخدمت الخلايا الجِذْعِيّة للحبل السري لمعالجة أكثر من 70 مرضاً كالخباثات وفقر الدم والأمراض الاستقلابية الوراثية والعوز المناعي وغالبية عمليات زرع دم الحبل السري إلى الآن أجريت في مرضى تقل أعمارهم عن 18 عاماً. ومن هذه الأمراض (23، 26):
- ابيضاض الدم الحاد والمزمن
- متلازمات خلل تنسج النقي
- أمراض الخلايا المكونة للدم
- أمراض البلاعم
- الأمراض الاستقلابية الوراثية
- الأمراض النسيجية الخلوية
- شذوذ الكريات الحمر والصفيحات الوراثي
- أمراض جهاز المناعة الوراثية
- أمراض الخلية البلازمية
- خباثات أخرى (سرطان الثدي وسرطانة الكلية).
2-5- مصادر أخرى للخلايا الجِذْعِيّة
أشارت أبحاث أجريت مؤخراً إلى وجود خلايا في حليب الأم لها صفات الخلايا الجِذْعِيّة ويمكن أن تحل محل الخلايا الجِذْعِيّة الجنينية التي تلاقي جدلاً مستمراً.
كما تم تحديد الخلايا الجِذْعِيّة السَّدَوِيَّة في نسيج
بطانة الرحم (27، 28)، ومع ذلك فإن الحصول على الخلايا مباشرة يتطلب إجراءً باضعاً. إن بطانة الرحم لها قدرة مميزة على التجدد ، فخلال كل دورة حيضية menstrual cycle يحصل نمو كبير للأنسجة والأوعية الدموية يطرح في نهاية الدورة. إن الدم والأنسجة المطروحة يحتويان على جمهرة population من خلايا مختلفة، للبعض منها قدرة على التجدد (29)، والخلايا السَّدَوِيَّة الرحمية، مثلها مثل الخلايا الجِذْعِيّة في اللحمة المتوسطة لنقي العظم (30) من أهم واصمات تحديد تعدد القدرة ,Oct-4, SSEA-4c-kit والتي يجري التعبير عنها في الكثير من الخلايا الجِذْعِيّة بما فيها الخلايا الجِذْعِيّة الجنينية (28).
|
| 3- حصاد الخلايا الجِذْعِيّة |
| أستحصل على الخلايا الجِذْعِيّة من نقي العظم منذ أكثر من 30 عاماً، وهي عملية سهلة نسبياً يمكن إجراؤها في غرفة الجراحة، حيث يتلقى المريض مخدراً عاماً ويدخل الطبيب إبرة طويلة إلى نقي العظم ويسحب عدة عينات منه حتى الحصول على لتر واحد وتستغرق العملية ساعتين، هذه العملية تسبب ألماً شديداً في مكان جمع النقي وأحياناً تسبب مضاعفات مثل النزف والعدوى وتأذي العصب. |
3-1- حصاد الخلايا الجِذْعِيّة من الدم المحيطي
وهي عملية أكثر تعقيداً من الجمع من نقي العظم، وأُجريت منذ أكثر من 10 سنوات، ولها عدة محاسن مقارنة مع سابقتها، إذ تجول الخلايا الجِذْعِيّة في الدم المحيطي عادة بكميات قليلة ويتم جمعها بإدخال قثطرة في أحد أوردة الذراع، إن حقن السيتوكينات وعوامل نمو الخلايا الدموية يحفز زيادة إنتاج خلايا نقي العظم الناضجة وغير الناضجة وتسمى هذه العملية تحريك أو استنفار الخلايا الجِذْعِيّة (32) "stem cell mobilization" وقد وافقت الـ FDA على اثنين من هذه السيتوكينات هما NeupogenA® and Leukine⢠لاستخدامهما عند المرضى لزيادة عدد الخلايا الجِذْعِيّة الجائلة في الدوران. وخلال عملية تحريك الخلايا الجِذْعِيّة يتلقى المرضى جرعات من السيتوكين يتم تقييمها يومياً. وتسمى عملية جمع الخلايا الجِذْعِيّة من نقي العظم الفصادة apheresis (تقنية تزال بها مادة أو مركب ما من الدم) والتي تبدأ عندما يكون هنالك عدد كاف من الخلايا الجِذْعِيّة في الدوران، حيث تدخل قثطرة في وريد الذراع ليتدفق الدم من الوريد إلى آلة الفصادة التي تفصل الخلايا الجِذْعِيّة وتعيد الدم ثانية إلى المريض. تُجرى الفصادة لعدة أيام (عادة 2- 5 أيام) حتى الحصول على عدد كاف من الخلايا الجِذْعِيّة وهو حوالي 5 مليون خلية إيجابية المستضد CD34 لكل كغ من وزن المريض.
يجري تحديد الخلايا الجِذْعِيّة بدقة عالية، حيث إنها تحتوي على واصم نوعي هو المستضد CD34، فبقياس عدد الخلايا الحاوية على هذا المستضد يمكن تحديد عدد أيام الفصادة، وفي عملية زرع الخلايا الجِذْعِيّة من الدم المحيطي Peripheral Blood Stem Cell Transplant (PBSCT)، يتلقى المعطي علاجاً بـ Neupogen (colony-stimulating factor (G-CSF) قبل عدة أيام من جمع الخلايا الجِذْعِيّة وهذا ما يحث الخلايا الجِذْعِيّة على الخروج من نقي العظم إلى الدوران العام.
واستخدام المركب AMD3100، وهو مثبط لـ CXCR4، في استنفار الخلايا المولدة للدم عند المرضى المصابين بالنقيوم المتعدد الخاضعين لزرع خلايا جِذْعِيّة ذاتية. إن CXCR4 وربيطته العامل السدوي 1، stromal derived factor-1 (SDF1)، ينظمان تحرك الخلايا المولدة للدم، وإن AMD3100، ربيطة تنافسية لـ CXCR4، تمنع ارتباط SDF1 مما يؤدي إلى تسريع استنفار الخلايا CD34+ ويسهل استنفار (خروج) الخلايا الجِذْعِيّة في المتطوعين الأصحاء دون تأثيرات سمية هامة (33، 34).
|
| 4- الاستخدام العلاجي للخلايا الجِذْعِيّة |
تعد عملية زرع نقي العظم transplantation Bone marrow معالجة معترف بها في العديد من الأمراض الدموية التي تتضمن نقل الخلايا الجِذْعِيّة الدموية، وما تزال التطبيقات التي تستخدم المصادر الأخرى من الخلايا الجِذْعِيّة البالغة لمعالجة أمراض مختلفة لا تزال قيد الدراسات قبل السريرية أو خاضعة لمحاولات سريرية مبكرة فعلى سبيل المثال تجرى محاولات سريرية لنقل الخلايا الجِذْعِيّة لمعالجة الحالات الشديدة من الأمراض القلبية.
وعلى الرغم من اعتقاد العلماء أن هنالك عدة أشكال من الخلايا الجِذْعِيّة الواعدة ذات التطبيقات العلاجية، إلا أنها لا تزال حديثة نسبياً وتتطلب سنوات من البحث لإثبات أمانها وفعاليتها.
|
4-1- الاستنساخ العلاجي Therapeutic Cloning
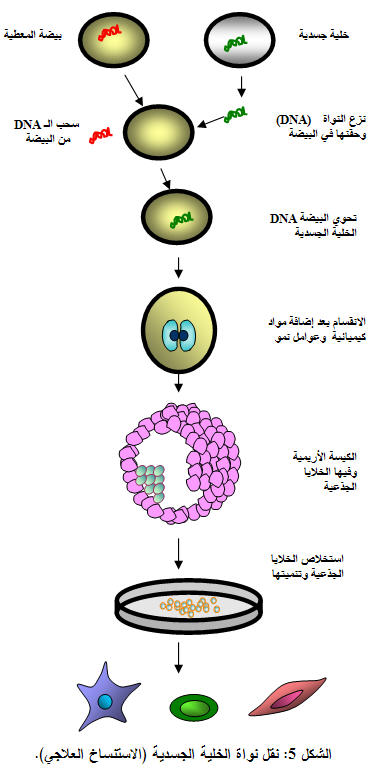
يتم في هذه العملية تشكيل أجنة بإدخال المادة الوراثية للمريض إلى داخل البويضة، وعندما تصل هذه الأجنة إلى عمر خمسة أيام تستخلص الخلايا الجِذْعِيّة منها، حيث يكون التركيب الوراثي للخلايا الجِذْعِيّة الجنينية مطابقاً للتركيب الوراثي للمريض، وتمتاز هذه العملية بتجنب رفض الجسم للأنسجة الغريبة الناتجة من خلايا جِذْعِيّة من جنين ما، لكنها تواجه اعتراضات تتعلق بالقيم والأخلاق.
يسمى الاستنساخ العلاجي أيضاً الاستنساخ غير الإنجابي non-reproductive cloning، أو نقل نواة الخلية الجسدية Somatic Cell Nuclear Transfer (SCNT) (الشكل5)، فبعد نقل نواة الخلية الجسدية إلى بويضة غير ملقحة تتطور المضغة إلى كتلة متعددة الخلايا تحتوي على طبقة تسمى الكتلة الخلوية الداخلية inner cell mass (ICM) وهي مصدر غني بالخلايا الجنينية المتعددة القدرات (35). هنالك نمط آخر من الخلايا الجِذْعِيّة يوجد في الأنسجة الكهلة الناضجة تسمى الخلايا الجِذْعِيّة الكهلة، ففي حين أنه يمكن أن تتطور الخلايا الجِذْعِيّة الجنينية إلى أي من الخلايا العائدة للطبقات المنتشة الثلاث: الأديم الظاهر والأديم الباطن والأديم المتوسط فإن الخلايا الجِذْعِيّة البالغة تعطي خلايا العضو الذي أخذت منه فقط، وخلايا نقي العظم الجِذْعِيّة تعطي خلايا دموية وخلايا مناعية وهي تستخدم لإصلاح الأعضاء والمحافظة عليها.
وبما أن المادة النووية مأخوذة من المريض فإن الخلايا المتمايزة عند زرعها في المريض تعد خلايا ذاتية بالنسبة للجهاز المناعي. والاستنساخ بهذه الطريقة يختلف جذرياً عن استنساخ البشر ففي هذه الطريقة يجري استنساخ الخلايا فقط بينما في استنساخ البشر يجري تشكيل كائن بشري كامل.
وأكثر من ذلك فإن الخلايا الجِذْعِيّة الجنينية المتعددة القدرات يمكن استخدامها في المعالجة الجينية، حيث يجري استبدال الجين المعطوبة بنسخة سليمة من الجين باستخدام ناقل معين للجين.
يمكن استخلاص الخلايا الجِذْعِيّة من أنسجة مختلفة كالجلد والكبد والبنكرياس، لكنها ذات مرونة أقل من الخلايا الجِذْعِيّة الجنينية، إذ إنها تتمايز إلى النسيج الذي أخذت منه فقط كأن تتمايز الخلايا المأخوذة من الكبد إلى خلايا كبدية فقط.
|
| 5- مصرف الخلايا الجِذْعِيّة |
يفترض الاحتفاظ بدم الحبل السري بدلاً من التخلص منه. وبينما يقدم مصرف حفظ الدم السري العام خدمة مهمة فلا بد من إخبار الوالدين بعدة اعتبارات قبل أن يقررا التبرع بالدم السري للوليد للمصرف العام أو حفظه في مصرف خاص للاستخدام العائلي المستقبلي المحتمل.
إن دم الحبل السري غني بالخلايا الجِذْعِيّة التي توجد أيضاً بشكل طبيعي في نقي العظم، ويمكن لدم الحبل السري المجموع من ملايين الأجنة أن يكون مصرفاً بالغ الأهمية للأنسجة ويستخدم لمعالجة الكثير من الأمراض دون رد فعل مناعي، وهو في الوقت نفسه لا يثير مشاكل أخلاقية كتلك التي تسببها الخلايا الجِذْعِيّة المضغية (36).
يتميز دم الحبل السري بأنه أكثر قابلية للاستخدام من نقي العظم لسهولة استخلاص الخلايا الجِذْعِيّة منه وبالتالي تجنيب الأم والطفل الخطر والألم، وعلى العكس من ذلك فإن جمع نقي العظم هو إجراء باضع invasive procedure ويحتاج إلى تخدير عـام وما ينطوي عليه من مخاطر، كـما أن
خلايا الحبل السري الجِذْعِيّة ذات معدل زرع عال وأكثر تحملاً لاختلافات معقد التوافق النسيجي HLA وبالتالي يتناقص معدل رفض الطعم للمضيف Graft Versus Host Disease، ونادراً ما تكون ملوثة بالفيروسات الكامنة latent viruses وهذا يعني أن الجسم غالباً ما يقبل الخلايا الجِذْعِيّة للحبل السري أفضل من تلك الآتية من نقي العظم، بالإضافة إلى ذلك فإن خلايا الحبل السري الجِذْعِيّة المحفوظة في المصرف تكون سهلة المنال مما يسمح ببدء المعالجة باكراً، عند الحاجة، دون هدر الوقت في عمليات البحث والمطابقة التي تتطلبها الخلايا الجِذْعِيّة في المصارف العامة (37).
فالخلايا الجِذْعِيّة المطابقة الضرورية لعملية الزرع يصعب الحصول عليها نتيجة المتطلبات الدقيقة للمطابقة، لكن الخلايا المأخوذة من الوليد تكون مطابقة بشكل تام له، فمثلاً في حال مواجهة الطفل لمرض ما يتطلب معالجة كيميائية أو بالإشعاع فإن هنالك إمكانية لحصول تأثير سلبي على جهاز المناعة. رغم أن الزرع الذاتي المنشأ لا يكون ملائماً لكل الأمراض فإن هنالك فائدة لاستخدام خلايا الحبل السري المحفوظة لدعم وإعادة بناء جهاز المناعة.
بالإضافة إلى ذلك فإن الخلايا الجِذْعِيّة للحبل السري تكون فيها فرصة المطابقة للأخوة 1: 4، كما تمتاز الخلايا الجِذْعِيّة للحبل السري بأنها غير معرضة للكثير من الأمراض. وقد تستخدم التقانة الطبية الحديثة الخلايا الجِذْعِيّة المحفوظة لإعادة بناء الأنسجة القلبية أو إصلاح الأضرار الناتجة عن السكتة أو أذيات الحبل الشوكي ومعاكسة تأثيرات مثل هذه الأمراض كالتصلب المتعدد وداء باركنسون.
|
 |
5-1- دم الحبل السري يحمل المفتاح إلى الخلايا الجِذْعِيّة للوليد
دم الحبل السري هو الدم الذي يبقى في الحبل السري والمشيمة عند الولادة، يطرح هذا الدم بعد الولادة، لكن عندما اكتشف العلماء أنه مصدر غني بالخلايا الجِذْعِيّة، أصبح بديلاً حيوياً لنقي العظم في الآلاف من عمليات الزرع الناجحة (38).
إن الخلايا الجِذْعِيّة هي الخلايا الرئيسية المسؤولة عن إنتاج كل الخلايا الناضجة في الدم وفي الجهاز المناعي، فهي تشكل الخلايا البيضاء التي تواجه العدوى والخلايا الحمراء التي تحمل الأكسجين والصفيحات التي تحفز التخثر وخلايا الجهاز المناعي.
لقد استخدمت الخلايا الجِذْعِيّة لمعالجة طيف واسع من الأمراض مثل لمفومة لاهودجكن non-Hodgkin lymphoma ابيضاض الدم، مرض الخلايا المنجلية sicle cell disease، فقر الدم الوخيم severe anemia ويحمل توسيع تجارب استخدام الخلايا الجِذْعِيّة الكثير من البشائر.
|
| 6- دور الخلايا الجِذْعِيّة في تشكل السرطان |
قاد توسع مفهوم الخلايا الجِذْعِيّة النسيجية البالغة، كسلائف متعددة القدرة pluripotent progenitors لأنسجة متعددة إلى الاهتمام بقوة الخلايا الجِذْعِيّة. إن قدرة الخلايا الجِذْعِيّة النسيجية الكهلة والجنينية على إعطاء خلايا سلفية لتجديد الأنسجة وفرت إمكانات واسعة لمعالجة أمراض العوز الولادية وتجديد الأنسجة المتضررة، ولقد استبدلت بالمفاهيم القديمة التي تقول إن الأنسجة الكهلة تفقد قدرتها أثناء التمايز أفكار أحدث تقول إن الخلايا المتعددة القدرات موجودة في أعضاء كهلة مختلفة، وأن الخلايا التي كان يعتقد أنها تتمايز إلى نمط خلوي واحد قد تكون قادرة على التمايز إلى أنماط خلوية لنسيج آخر transdifferentiate. وهكذا فإن مفهوم التوضعات الجنينية “embryonic rests” في النسج الكهلة اعتقده Durante and Conheim في نهايات القرن التاسع عشر أنه المنشأ الخلوي للسرطان، يمكن توسيعه الآن ليشمل بقاء الخلايا المتعددة القدرات التي تشبه الخلايا الجِذْعِيّة الجنينية في الأنسجة الكهلة.
افترض اختصاصيو الباثولوجيا في القرن التاسع عشر أن الخلايا الجِذْعِيّة موجودة في الكهل على شكل توضعات جنينية لشرح الأصل الخلوي للسرطان، وتشير معظم الدراسات اللاحقة أن معظم السرطانات تنشأ من خلايا جِذْعِيّة أو نسائلها المباشرة، حيث ينشأ السرطان من حالة عدم توازن بين سرعة إنتاج الخلايا وسرعة تمايزها أو موتها، إن فهم كيفية التحكم بتكاثر وتمايز الخلايا الجِذْعِيّة ونسائلها ليس فقط المفتاح للتحكم بمعالجة السرطان لكنه أيضاً للتحكم باستبدال الخلايا والمعالجة الجينية للعديد من الأمراض الاستقلابية والتنكسية والمناعية.
|
| بين العلم والأخلاق |
تتميز الخلايا الجِذْعِيّة عند الأجنة مقارنة مع البالغين بأنها أكثر مرونة وأسهل تعاملاً معها أسهل، ففي بداية الأبحاث استحصل على هذه الخلايا من الأجنة الفائضة خلال عمليات التلقيح الاصطناعي (حيث يتم تخصيب أكثر من بويضة في هذه العمليات) أو من الأجنة الطبيعية المجهضة، إلا أن هاتين الطريقتين واجهتا اعتراضاً من المهتمين بأخلاقيات العلم، فقد وصف البابا بينديكت السادس عشر عملية استخلاص الخلايا الجِذْعِيّة من الأجنة بأنه "عمل شرير وغير قانوني يقتل الأطفال" وهو في الوقت نفسه "يقدر ويشجع تطور العلوم الحيوية التي تفتح آفاقاً جديدة في المعالجة" (39).
وقد تعرض الرئيس الأميركي جورج بوش، الذي سمحت حكومته بتمويل أبحاث الخلايا الجِذْعِيّة، إلى الجانب الأخلاقي لتلك الأبحاث: "ما هي البداية الحقيقية التي تبدأ عندها الحياة البشرية ويمكن وصف إعدامها بالقتل؟ وما هي حدود العلم وسلطان الأخلاق؟ ومهما يكن الجواب فلا بد من احترام الإنسان في كل أطواره".
وكان مجمع الفقه الإسلامي قد أصدر مجموعة من القرارات حول أبحاث الخلايا الجِذْعِيّة في دورته السادسة المنعقدة في جدة 1990 تتلخص بما يلي:
- لا يجوز إجهاض الجنين الآدمي لاستخدام خلاياه في زرع الأعضاء أو استخراج العقاقير.
- يجوز نقل الخلايا الجنينية في حالة الجنين الميت واستخدامها لعلاج الأمراض المستعصية وفق شروط محددة.
- يجوز أخذ الخلايا الجِذْعِيّة من الإنسان البالغ عندما لا يشكل ذلك ضرراً له وتكون هذه الخلايا ذات فائدة لشخص مريض.
- لا يسمح بالتبرع بالنطاف أو البويضات لإنتاج بويضة ملقحة تتحول إلى جنين تستخلص منه الخلايا الجِذْعِيّة.
- منع طريقة الاستنساخ للحصول على الخلايا الجِذْعِيّة الجنينية.
- إباحة الحصول على الخلايا الجِذْعِيّة من الحبل السري أو من المشيمة.
هنالك قلق متزايد لما تنطوي عليه هذه العملية من استغلال لأعداد كبيرة من النساء بهدف توفير البويضات وما يرافق ذلك من مخاطر على صحتهن، إذ أجازت بريطانيا أبحاث الخلايا الجِذْعِيّة باستخدام الأجنة في مراحل مبكرة، وتدرس اليابان وضع قوانين تجيز الأبحاث المتعلق بالخلايا الجِذْعِيّة. وقد دفعت الحاجة الكبيرة للخلايا الجِذْعِيّة إلى ابتكار وسائل للحصول على خلايا جنينية بدءاً من أجنة تتم تنميتها خارج الأحياء بعملية الاستنساخ العلاجي Therapeutic Cloning.
|
| خاتمة |
| إن البشائر التي تحملها الخلايا الجِذْعِيّة تكمن في أنها لا تشبه الأعضاء التي فقدت القدرة على التكاثر كالجلد والعظم والكبد، لذا يستخدم العلماء الخلايا الجِذْعِيّة على أمل معالجة أمراض لا يمكن الشفاء منها مثل داء الزهايمر، داء باركنسون، التصلب المتعدد، الذأب الحمامي والأمراض القلبية الوعائية. وهكذا يظل موضوع الخلايا الجِذْعِيّة مرهوناً بعوامل قانونية واجتماعية وأخلاقية شتى، وحتى بعوامل اقتصادية للوصول إلى الشكل التطبيقي الأمثل له. |
| المراجع References |
1-Arey L.B.
Developmental Anatomy: A Textbook and LaboratoryManual of Embryology, 7th ed. W.B. Saunders, Philadelphia, PA. 1974.
2-Needham A.
History of Embryology, Cambridge University Press, New York, NY, 1959.
3-Thomson J.A; Itskovitz-Eldor J; Shapiro S.S; Waknitz M.A; Swiergiel
J.J; Marshall V.S. and Jones J.M.
Embryonic stem cell lines derived from human blastocysts.
Science, 282: 1145-1147, 1998.
4-Stewart Sell.
Stem Cells. What Are They? Stem Cells Handbook. Edited by: S. Sell, Humana Press Inc, p1; 2005.
5-Odorico J.S; Kaufman D.S. and Thomson J.A.
Multilineage differentiation from human embryonic stem cell lines.
Stem Cells, 19: 193-204, 2001.
6-Liang L. and Bickenbach J.R.
Somatic epidermal stem cells can produce multiple cell lineages during development.
Stem Cells, 20: 21-31, 2002.
7-koc O.N. and lazarus H.M.
Mesenchymal stem cells : heading into the clinic.
Bone marrow transplant, 27: 235-239, 2001.
8-Evans M.J. and Kaufman M.H.
Establishment in culture of pluripotential cells from mouse embryos.
Nature, 292: 154-156, 1981.
9-Reubinoff B.E; Per M.F; Fong C.Y; Trounson A. and Bongso A.
Embryonic stem cell lines from human blastocysts: somatic differentiation in vitro.
Nat Biotechno; 18: 299-404, 2000.
10-Blum B. and Benvenisty N.
Clonal analysis of human embryonic stem cell differentiation into teratomas.
Stem Cells, 25: 1924-1930, 2007.
11-Przyborski SA.
Differentiation of human embryonic stem cells after transplantation in immune-deficient mice.
Stem Cells, 23:1242-1250, 2005.
12-Wagner J.L; Burnett R.C; DeRose S.A. et al.
Histocompatibility testing of dog families with highly polymorphic microsatellite markers.
Transplantation, 62: 876-877, 1996.
13-Blum B. and Benvenisty N.
Clonal analysis of human embryonic stem cell differentiation into teratomas.
Stem Cells, 25: 1924-1930, 2007.
14-Itskovitz-Eldor J; Schulding M; Karesenti D; Eden A; Yanuka O; Amit M; Soreq H. and Benvenisty N.
Differentiation of human embryonic stem cells into embryoid bodies comprising the three embryonic germ layers.
Mole Med; 5: 88-95, 2000.
15-Oottamasathien S; Wang Y; Williams K; Franco OE; Wills ML; Thomas JC; Saba K; Sharif-Afshar AR; Makari JH; Bhowmick NA; DeMarco RT; Hipkens S; Magnuson M; Brock JW; Hayward SW; Pope JCt. and Matusik RJ.
Directed differentiation of embryonic stem cells into bladder tissue.
Dev Biol; 304: 556-566; 2007.
16-Mezey E; Chandross K.J; Harta G; Maki R.A. and McKercher S.R.
Turning blood Science, 290:v1779-1782, 2000.
17-Bush et al.
Conditional and unconditional estimation of multidmensioal quality of life after hematopoietic stem cell translation: Alongitudinal follow up of 415 patients.
Biol Blood Marrow Transplant, 6: 576-591, 2000.
18-Damon et al.
High dose chemotherapy and hematopoietic stem cell rescue for
breast cancer.Eperience in California.
Biol. Blood Marrow. Transplant, 6: 496-505. 2000
19-Villa A; Snyder E.Y; Vescovi A. and Martinez-Serrano A.
Establishment and properties of a growth factor-dependent perpetual neural stem cell line from the human CNS.
Exp Neurol, 161(1): 67-84, 2000.
20-Brazelton T.R; Rossi F.M; Keshet G.I. and Blau H.M.
From marrow to brain: expression of neuronal phenotypes in adult mice.
Science, 290: 1775-1779, 2000.
21-Laughlin M.J; Barker J; Bamblach B. et al.
Hematopoietic engraftment and survival in adult recipients of umbilical cord blood from unrelated donors.
N. Eng. J. Med, 14: 1815-1822. 2001.
22-Long et al.
unrelated umbilical cord blood in adult patients.
Biol. Blood Marrow Transplant, 9: 772-780, 2003.
23-Ende M. and Ende N.
Hematopoietic transplantationby means of fetal cord blood.
Virginia Med. Monthly, 99: 276-680.
24-Paquette et al.
Ex vivo expanded unselected peripheral blood: progenitor cell reduce post transplantation neutropenia, thrombocytopenia and anemia in patients with breast cancer.
Blood, 1: 2385-2390, 2000.
25-Rocha V; Cornish J; Sievers EL, et al.
Comparison of outcomes of unrelated bone marrow and umbilical cord blood transplants in children with acute leukemia.
Blood, 97: 2962-2971, 2001.
26-Rocha V; Wagner JE Jr; Sobocinski KA. et al.
Graft-versus-host disease in children who have received a cord-blood or bone marrow transplant from an HLA-identical sibling. Eurocord and International Bone Marrow
Transplant Registry Working Committee on Alternative Donor and Stem Cell Sources.
N Engl J Med; 342: 1846-1854, 2000.
27-Cho N.H; Park Y.K; Kim Y.T; Yang H. and Kim S.K.
Lifetime expression of stem cell markers in the uter ine endometrium.
Fertil. Steril. 81: 403-407; 2004.
28-Schwab K.E; Chan R.W. and Gargett C.E.
Putative stem cell activity of human endometrial epithelial and stromal cells during the menstrual cycle.
Fertil. Steril. 84: 1124-1130, 2005.
29-Cui C.H; Uyama T; Miyado K; Terai M; Kyo S; Kiyono T. and Umezawa A.
Menstrual blood-derived cells confer human dystrophin expression in the murine model of Duchenne muscular dystrophy via cell fusion and myogenic transdifferentiation.
Mol. Biol. Cell, 18: 1586-1594, 2007.
30-Kearns M. and Lala P.K.
Bone marrow origin of decidual cell precursors in the pseudopregnant mouse uterus.
J. Exp. Med; 155: 1537-1554, 1982.
31-Yao S; Chen S; Clark J; Hao E; Beattie G.M; Hayek A. and Ding S.
Long-term self-renewal and directed differentiation of human embryonic stem cells in chemi cally defined conditions.
Proc. Natl. Acad. Sci. USA, 103: 6907-6912, 2006.
32-Mickie Bhatia
Chasing Stem Cells Out of Their Home.
Ann NY Acad Sci;1106: 219-222, 2007.
33-Civin C.I; Trischmann T; Kadan N.S. et al.
Highly purified CD34-positive cells reconstitute hematopoiesis.
J Clin Oncol; 14(8): 2224-2233, 1996.
34-Gallacher L; Murdoch B; Wu DM; Karanu FN; Keeney M. and Bhatia M.
Isolation and characterization of human CD34(-)Lin(-) and CD34(-) Lin(-) hematopoietic stem cells using cell surface markers AC133 and CD7.
Blood, 95(9): 2813-2820, 2000.
35-Lanza R.P; Cibelli J.B. and West M.D.
Human therapeutic cloning.
Nature Medicine, 5, 975-977, 1999.
36-O’Brien TA; Teidemann K. and Vowels MR.
No longer a biological waste product: umbilical cord blood.
Med J Aust; 184: 407-410, 2006.
37-Sugarman J; Reisner EG. and Kurtzberg J.
Ethical aspects of banking placental blood for transplantation.
JAMA, 274: 1783-1785, 1995.
38-Gabrielle N. Samuel, Ian H. Kerridge and Tracey A.O.
Brien Umbilical cord blood banking: public good or private benefit?
MJA, 188 (9): 5, 2008.
39-Pope Benedict X.V.I.
Address to the Participants in the Plenary Session of the Congregation for the Doctrine of the Faith, 2008.
|
| |
