| المجلد 5 ,
العدد 7
, ربيع الثاني 1431 - نيسان (أبريل) 2010 |
| |
| استخدام اختبارات الرقاقات الحيوية النانوية المعتمدة على اللعاب في تشخيص احتشاء عضل القلب الحاد في وحدة العناية: دراسة الجدوى |
| Use of Salvia-Based Nano-Biochip Tests for Acute Myocardial Infarction at the Point of Care: A Feasibility Study |
| عن مجلة Clinical Chemistry, 55(8): 1530-1538, 2009 |
| ترجمة د. إسماعيل الساري |
| الخلفية Background |
يستخدم مخطط كهربية القلب ECG ومقايسة الواصمات الحيوية في المصل لتحري وتشخيص نخر العضلة القلبية عند البالغين الذين يعانون من ألم صدري، إذ تحتاج المقايسات إلى وقت قد يؤخر المعالجة ويؤثر على الإنذار.
كان هدف الدراسة استقصاء وجدوى استخدام اللعاب كسائل تشخيصي بديل لتحديد الواصمات الحيوية لاحتشاء عضل القلب الحادAMI .
|
| الطرق Methods |
| جرى استخدام طريقتي Luminex و Lab-on-a-chip لاختبار 21 بروتيناً في المصل واللعاب الكلي غير المحرض من 41 مريض احتشاء عضل قلب حاد خلال 48 ساعة من بدء الألم الصدري ومن 43 شاهداً سليماً ظاهرياً، وجرى تحليل البيانات باستخدام الانحدار اللوجيستي logistic regression والمساحة تحت المنحنى AUC لتحليل الـROC لتقييم الاستخدام التشخيصي لكل واصم حيوي أو مشاركات الواصمات الحيوية في تحري الـ AMI. |
| النتائج Results |
أظهرت الواصمات القلبية الجديدة والقديمة اختلافات جوهرية في التراكيز بين مرضى الـ AMI والمجموعة الشاهدة ( دون AMI).
أظهرت مجموعة الواصمات الحيوية اللعابية المكونة من الميوغلوبين والـ CRP والبيروكسيداز النقوية قدرة ذات أهمية تشخيصية (AUC=0.85, p<0.0001)، وبضمها إلى الـ ECGأعطت قدرة تشخيصية قوية لـ (AUC=0.96) AMI مقارنة مع المجموعة المكونة من الببتيد الدماغي المدر للصوديوم BNP والتربونينI و CK-MB والميوغلوبين (AUC=0.98) وتجاوزت القدرة التشخيصية للـ ECG منفرداً (AUC=0. 6).
وفي سـبيل ترجمة هذه المعطيات إلى تطبيق سريري تم إجراء هذه الاختبارات على اللعاب الكامل غير المحرض بطريقة Lab-on-a-chip لتأكيد مبدأ التحريات عن AMI.
|
| الاستنتاج Conclusion |
بالتكامل مع ECG فإن الاختبارات المعتمدة على اللعاب في نظام Lab-on-a-chip قد تعطي طريقة تحر سريعة ومقنعة للأحداث القلبية في مراحل ما قبل دخول المستشفى لمرضى AMI.
وجد أنه لدى 13.2 مليون أمريكي مصابين بمرض قلبي شرياني، كان 7.8 مليوناً منهم يعانون من AMI و 6.8 مليوناً منهم لديهم أعراض ذبحة قلبية angina pectoris(1). لذلك يشكل مرض الألم الصدري تحديات تشخيصية واقتصادية وجراحية هامة. ويعد ECG اختبار التحري المبدئي الذي يحدد ارتفاع القطعة ST المتعلقة بالألم الصدري الذي ينشأ نتيجة انسداد الشرايين، لهذا السبب فإن الـ ECG يجرى عادة من قبل شخص مدرب قبل وصول المريض إلى المستشفى(2)، على كل فإن أقل من ثلث المرضى المقبولين في الإسعاف يظهرون ECG محدداً للأذية القلبية والبقية يجب مراقبتهم لاستبعاد إمكانية احتشاء عضل القلب الذي لا ترتفع فيه القطعة ST.
لتحديد أو استبعاد نخر العضل القلبي في هؤلاء المرضى تطلب سلسلة من مقايسات الواصمات الحيوية في المصل والتي تشمل الميوغلوبين (MYO) و CK-MB و الـCK الكلي والتربونينين T و I القلبيين cTnT, cTnI(3).
إن سرعات تحرر الواصمات الحيوية تختلف اعتماداً على خصائص التموضع في الخلية وحجم البروتين والدم الموضعي والتدفق اللمفي(4).
يجري حالياً تحديد الـ AMIبتحديد زيادة أو نقص الواصمات الحيوية القلبية وخاصة التربونين، بالإضافة إلى وجود دليل على نقص التروية القلبية استناداً إلى الـ ECG أو التصوير(5، 6). وعلى الرغم من التقدم الهائل في تطوير طرق التشخيص والتحري فإن عدداً لا يستهان به من حالات الـ AMI تكون خاطئة أو تشخص بشكل متأخر جداً لتقديم المعالجات الفعالة. واستناداً إلى تقرير صدر مؤخراً فإن فحص 25% من مرضى AMI يستغرق 60 دقيقة في غرف العناية المشددة (7).
هناك اهتمام متزايد في استخدام عينات السائل الفموي لتشخيص أنواع من الأمراض الفموية والجهازية (8-12)، وفي الحقيقة فإن اللعاب كوسط تشخيصي لا يحتاج إلى إجراءات باضعة وله مميزات عديدة مثل سهولة جمعه وحفظه وتدبيره مما يجعله يدرس جيداً في نقطة العناية المركزة.
اسـتخدم اللعاب لمقايسـة الأيـونات والأدوية والسيتوكينات والهرمونات والإنزيمات والأضداد والميكروبات و RNAs(13-15). ومع ذلك فإنه حتى تاريخه لم يسجل استخدامه لتشخيص AMI، وعلاوة على ذلك فإنه لا يعرف إلا القليل عن مستويات التعبير عن الواصمات الحيوية اللعابية للمؤشرات القلبية المختلفة. أحد التحديات المترافقة مع السوائل الفموية هو أن تراكيز الواصمات الحيوية غالباً ما يكون أخفض مما هو عليه في المصل مما يجعل مقايستها أكثر صعوبة بالوسائل التشخيصية التقليدية.
خلال العقد الماضي جرى القيام بجهود مطولة لإشراك وتكييف أنظمة مختلفة مثل (LOC) Lab-on-a-chip وأدوات الرقاقات الحيوية النانوية للحصول على مُشعرات فائقة الحساسية ملائمة لتطبيقات هامة كالتحليل المتعدد لكميات دقيقة من المواد الحيوية المراد تحليلها في المصل واللعاب، وأمكن لهذه الأنظمة أن تنجز كل جوانب معالجة العينة وفصلها وتحري المادة المراد تحليلها (16-26).
استخدمت خرزات محسسة كيميائياً ضمن نظام الـ LOCلمقايسة الـ CRP وأظهرت واصمات الالتهاب الأخرى في اللعاب مستوى أقل بشكل جوهري لكشف CRP منه في طريقة hs-CRP ELISA (21).
تسجل الدراسة الحالية مقايسة الواصمات الحيوية اللعابية المترافقة مع AMI وتكشف إمكان استخدام هذه الواصمات في مجموعة رقاقات حيوية نانوية جديدة لتحري AMI عند مرضى الألم الصدري.
الهدف الأولي للدراسـة هو تحـديـد ما إذا كانت الواصمات الحيوية في المصل المترافقة حالياً مع تشخيص AMI يمكن أن تحدد بشكل موثوق باستخدام اللعاب الكلي غير المحرض. والأشخاص الذين ليس لديهم مرض صدري جرى جمعهم كشواهد للجزء الأول من الدراسة لتأكيد إمكان مقايسة تراكيز البروتين لكل من المعياري والواصمات الحيوية الجديدة في المصل واللعاب.
|
| المواد والطرق Materials and Methods |
اعتمدت دراسة سريرية مقطعية متصالبة وجرى أخذ 56 مريضاً خلال الـ 48 ساعة من بدء أعراض AMI و59 حالة شاهدة. جرى الانتقاء بالتنسيق مع فريق العناية القلبية وكان كل المشاركين في الدراسة بأعمار لا تقل عن 18 عاماً.
معايير الاستبعاد: الحمى، السكتة، الأمراض المناعية، استخدام الأدوية الستيرويدية، المضاعفات العضوية، عدم القدرة على إعطاء اللعاب.
جرى أخذ المعلومات السكانية ومراجعة السجلات الطبية والتقييم الفموي وأخذ السوائل الحيوية (دم ولعاب) من كل المشاركين في الدراسة ونقلت العينات في الثلج إلى مخابر محلية ونبذت وقسمت إلى قسيمات وحفظت في الدرجة -80م حتى إجراء التحليل. جرى تحليل العينات بشكل مزدوج للإنزيمات القلبية ولمجموعة مكونة من 21 واصماً حيوياً. أجري التحليل باستخدام Luminex ELISA أو Beckman Access خلال ثلاثة أشهر من الحفظ. جرى تقييم صحة الفم عيانياً قرب سرير المريض أو في العيادة السنية بالنسبة للشواهد وجرى تقييمها على أساس سيئة - وسط – جيدة اعتماداً على وجود أو غياب المضاعفات السنية ودرجة التهاب المخاطية.
|
مقايسة الواصمات الحيوية باستخدام Luminex ELISA و Beckman Access تمت مقايسة الواصمات القلبية المعيارية والببتيد الدماغي المدر للصوديوم MYO, cTnI,CK-MB, BNP باستخدام Beckman Access. جرى استخدام جهاز Luminex IS-100 للتحديد المتعدد التابع للمرض القلبي الوعائي واستخدمت مع عتائد متوفرة من Beadlyte Technology (Millipore) للاختبارات التالية:
CRP, IL-6, MCP-1, IL-1β, MPO, Scd40L, TNF-α, sVCAM -1, ENA-78, IL-18, E-selectin, Gro-α, sICAM -1, MMP-9..
|
| تحليل البيانات |
| جرى استخدام اختبار ويلكوكسون- مان- وينتي لتقييم الاختلافات بين متوسط تراكيز الواصمات الحيوية المحددة في اللعاب لمجموعتي الدراسة. واستخدمت برمجية Medcalc V.9.5.2.0 من أجل الانحدار اللوجيستي وتحليل الـ ROC، جرى رسم منحنيات الـ ROC وحساب المساحة تحت المنحنى إما من تراكيز واصم واحد أو من أجل مجموعات واصمات متعددة. وجرى تحديد p value, 2-tailes عند حدي ثقة 95%. |
| النتائج Results |
دُرس 21 واصماً حيوياً بروتينياً لها علاقة بالمرض القلبي من عينات أخذت بين الساعة 12 والساعة 48 من بداية الألم الصدري المتعلق بـ AMI، كانت النسبة الأعظم في التعبير عن بروتين المصل لـ cTnI ثم باقي البروتينات (الشكل 1 الخطوط الحمراء) والبروتين الأقل تعبيراً Gro-α.
أظهر تحليل الواصمات الحيوية التقليدية في المصل قدرات تشخيصية كما هو موضح بقيم AUC (الجدول1).
وهذه القيم على توافق مع قيم مسجلة سابقاً لهذه الواصمات الحيوية في دراسة شملت أكثر من 2000 مريض ومشاركة هذه الواصمات أعطت AUCs بين 0.99 و 1 (الجدول 1).
إن تراكيز الواصمات الجديدة في اللعاب كانت مرتفعة من أجل قدرتها التمهيدية لتخدم كواصمات حيوية للتحري الدقيق عن AMI.
أما في ما يخص اللعاب الكلي غير المحرض (الشكل 1 الخطوط الزرقاء) أظهر CRP النسبة الأعلى في متوسط التراكيز للمرضى/ الشاهدة وأقلها كان IL-6.
|
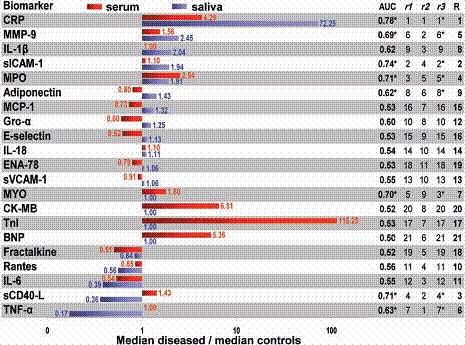
الشكل 1: التعبير عن الواصم الحيوي وقيم المضبوطية التشخيصية.
الجدول 1: AUC ، SE ، P ، AUC 95% CI ، والنوعية والحساسية الأفضل لواصمات حيوية لعابية مختلفة ولتشاركات الواصمات الحيوية معاً.
Strategy |
Biomarker (BM) panela |
AUC |
SE |
95% CI |
P |
Sensitivity |
Specificity |
Aggregate based on R |
BM 1 |
0.78 |
0.051 |
0.679–0.865 |
0.0001 |
68.3 |
73.7 |
Aggregate based on R |
BMs1–2 |
0.77 |
0.052 |
0.668–0.856 |
0.0001 |
68.3 |
76.7 |
Aggregate based on R |
BMs 1–3 |
0.78 |
0.051 |
0.681–0.866 |
0.0001 |
65.1 |
79.1 |
Aggregate based on R |
BMs 1–4 |
0.81 |
0.048 |
0.709–0.887 |
0.0001 |
73.2 |
79.1 |
Aggregate based on R |
BMs 1–5 |
0.81 |
0.048 |
0.705–0.884 |
0.0001 |
73.2 |
79.1 |
Aggregate based on R |
BMs 1–6 |
0.82 |
0.047 |
0.718–0.893 |
0.0001 |
85.4 |
65.1 |
Aggregate based on R |
R BMs 1–7 |
0.85 |
0.045 |
0.752–0.920 |
0.0001 |
89.5 |
68.3 |
Aggregate based on R |
BMs 1–8 |
0.85 |
0.044 |
0.752–0.921 |
0.0001 |
89.5 |
70.7 |
Aggregate based on R |
BMs 1–9 |
0.85 |
0.044 |
0.752–0.921 |
0.0001 |
89.5 |
70.7 |
Aggregate based on R |
BMs 1–10 |
0.87 |
0.042 |
0.775–0.935 |
0.0001 |
89.5 |
70.7 |
All biomarkers |
All 21biomarkers |
0.97 |
0.025 |
0.889–0.996 |
0.0001 |
96.2 |
97.1 |
BPSFAb |
CRP MPO |
0.82 |
0.047 |
0.720–0.895 |
0.0001 |
90.2 |
62.8 |
BPSFA |
CRP MYO |
0.85 |
0.044 |
0.756–0.923 |
0.0001 |
92.1 |
73.2 |
BPSFA |
CRP MPO MYO |
0.85 |
0.045 |
0.746–0.916 |
0.0001 |
92.1 |
68.3 |
All biomarkers + ECG |
All 21 biomarkers _ ECG |
1.00 |
0.000 |
0.941–1.000 |
0.0001 |
100.0 |
100.0 |
BPSFA + ECG |
CRP MPO & ECG |
0.95 |
0.026 |
0.872–0.983 |
0.0001 |
90.2 |
90.7 |
BPSFA + ECG |
CRP MYO & ECG |
0.94 |
0.028 |
0.866–0.982 |
0.0001 |
100.0 |
73.2 |
BPSFA + ECG |
CRP MPO MYO & ECG |
0.94 |
0.028 |
0.866–0.982 |
0.0001 |
81.6 |
92.7 |
Reduced training set |
CRP MYO |
0.88 |
0.048 |
0.766–0.953 |
0.0001 |
96.3 |
71.4 |
Reduced training set |
CRP MYO & ECG |
0.96 |
0.028 |
0.869–0.993 |
0.0001 |
92.6 |
85.7 |
Testing set |
CRP MYO |
0.85 |
0.084 |
0.641–0.958 |
0.0001 |
90.2 |
69.2 |
Testing set |
CRP MYO & ECG |
0.89 |
0.073 |
0.693–0.977 |
0.0001 |
81.8 |
92.3 |
a BMs are ranked and combinations assembled according to aggregate score (R) listed in Figure 1: CRP (1), sICAM-1 (2), sCD40L (3), MPO (4), MMP-9 (5), TNF- α(6), MYO (7), IL-1β(8), adiponectin (9), and RANTES (10).
b BPSFA, Biomarkers with precedent in serum that are FDA approved.
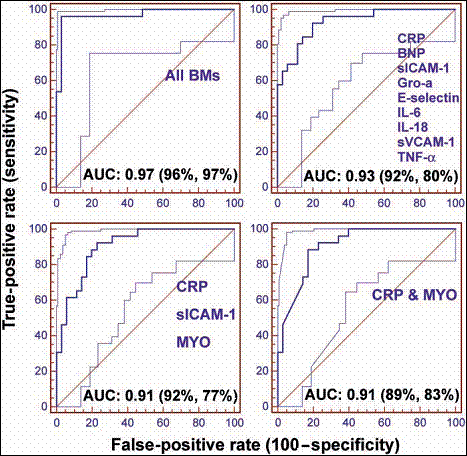
الشكل 2: سلسلة 4 منحنيات ROC لتصنيف الـ AMI باستخدام لوغاريتمات انحدار لوجيستية مختلفة.

الشكل 3: طريقة Multiplex lab-on-a-chip (LOC) من أجل تحري AMI .
|
إن تحديد سلسلة من الواصمات الحيوية التي يمكن أن تقاس بشكل موثوق في اللعاب مكنت من استخدام الانحدار اللوجيستي كأداة للتحري لهذا التحديد الأولي لمجموعة الواصمات الحيوية الأكثر فائدة في تقييم الـ AMI.
يوضح الشكل 2 سلسلة من 4 منحنيات ROC لتصنيف الـ AMI باستخدام لوغاريتمات انحدار لوجيستية مختلفة (الشكل 2).
تضمن أول نموذج مدروس مدخلات كل الواصمات الحيوية اللعابية بصرف النظر عن الأهمية الإحصائية أو البيولوجية، ويبدو أن نموذج الـ ""enter هذا يعطي القدرات التشخيصية الأكثر دقة للحالات المدروسة، لكنه يعاني من عدم ملائمة ويتضمن عدداً من الواصمات الحيوية غير المقبولة. تضمن النموذج التالي فقط المتحولات التي أدخلت بالتتابع إلى نموذج يعتمد على الأهمية الإحصائية كواصمات مفردة وأعطت الواصمات التالية:CRP, IL-6, BNP TNF-α, sVCAM-1 IL-18, E-selectin, Gro-α, sICAM-1, هذا النموذج المسمى الانتقاء للأمام forward selection أعطى AUC; 0.91, 95%CI: 0.80-0.97; p=0.0001
أدخلت لاحـقاً كل المتحولات المسـتقلة إلـى نموذج ثم أزيلت بالتتابع إذا وجد أنها ليست ذات أهمية، وأعطى هذا النموذج المسمى الانتقاء للخلف الواصمات اللعابية التالية CRP, sICAM-1, MYO وأعطى AUC; 0.93, 95%CI: 0.84-0.98; p=0.0001، أخيراً فإن كل الواصمات الحيوية ذات الأهمية أدخلت بالتتابع أُعيد حساب النموذج بعد استبعاد أي متحول وجد أنه غير ذي أهمية عند إدخال متحول مستقل آخر. أشارت هذه الطريقة التدريجية إلى أن CRP, MYO لهما تأثيرات كبيرة وأعطت AUC; 0.91, 95%CI: 0.80-0.97; p=0.0001، حتى مع الحصول على مقايسة بروتين شاقة لـ 84 مريضاً في هذه الدراسة فإن عوامل أخرى، مثل العينات الشاذة وعدم ثبات العينات وعدم دقة المقايسات، يمكن أن تؤثر في النتائج الرئيسية المتعلقة باستخدام واصمات كيميائية حيوية لعابية مختلفة. وللحصول على فهم أفضل للقدرات التشخيصية الكامنة لهذه الواصمات اللعابية جرى تحليل بيانات مركبة من عدد من المشاهدات، وهكذا جرى إنشاء سلسلة إجمالية لكل الواصمات اللعابية (الشكل 1 المجموعة اليمنى) باستخدام العوامل الثلاثة التالية:
1- AUC لواصمات مفردة (الشكل 1) يقود إلى السلسلة r1.
2- قيمة النسبة لمتوسط المرضى على متوسط الشاهدة (الشكل 1، r2).
3- قيمة p التي تحدد الأهمية الإحصائية للاختلاف بين المتوسطات للمرضى والشاهـــدة ( الشكل 1، (r3.
وأخيراً السلسلة الإجمالية لمعدل العوامل الثلاثة السابقة (الشكل 1، R).
يعطي مجموع النقاط الإجمالي القائمة التالية لأعلى 10 واصمات، التي يمكن أن تعد الأكثر فائدة في تشخيص الـ AMIمن واصم لعابي واحد وهي على الترتيب:
CRP, sICAM -1, Scd40L, MPO, MMP-9, TNF-α, MYO, IL-1β, adiponectin, RANTES.
إن نتائج تحليل الـ ROC بإدخال المجموعات التي تتضمن مشاركات هذه الواصمات العشرة مدرجة في الجدول 1.
في هذه الدراسة جرى استخدام تقييم اللعاب كاختبار مرافق للـ ECG لتحديد المرضى الذين لم يحددوا بالمسح الأولي باستخدام الـECG ، ورُسمت مجموعة من منحنيات الـROC اعتماداً على استخدام المجموعات نفسها باستثناء أن بيانات الكيمياء الحيوية للعاب مقرونة مع معلومات التحري بـ ECG، إن تضمين معلومات الـ ECG في مجموعات الاختبار زادت قيم AUC في معظم مشاركات الواصمات الكيميائية الحيوية.
إن التركيز على مجموعتين من الواصمات بأرقام أدنى اختيرت لتأكيد استخدام المشاركة بين الـ ECG والاختبارات اللعابية.
أعطى الانحدار اللوجيستي وتحليل منحنى الـ
ROC للواصمات التالية MPO, CRP, MYO بالمشاركة مع ECG قيمة لـ AUC 0.94 (الجدول1)، هذه المجموعة نفسها أظهرت حساسية 82% ونوعية 90% في تمييز مرضى القلب عن الشواهد. MPO-CRP, أعطيا AUC مشابهة بحساسية 100% ونوعية 73% (الجدول1)، تتجاوز هذه النتائج تلك التي لـ ECG نفسه والتي أعطت حساسية 61% في هذه الدراسة.
في خطوة نهائية تمت ترجمة اختبارات اللعاب المتعددة المتعلق بتحري AMI إلى نظام LOC الذي يمكن استخدامه في وحدة العناية المركزة (الشكل3) ومكنت من تحديد IL-1β, MPO, CRP, MYO في مقايسات الفلورة المتعددة التي تمت على مجموعتي المرضى والشواهد.
|
| المناقشة Discussion |
هذه هي الدراسة الأولى لاستقصاء استخدام السائل الفموي لمرضى AMI لتقييم واصمات حيوية تساهم في شلال المرض القلبي، حيث تمت مشاركة الواصمات الحيوية اللعابية مع مجموعات جرى فحصها من أجل قدرتها على تمييـز مـرضى AMI عن الأصـحاء فـي المجموعة الشاهدة.
إن تقييم مستويات التعبير عن الواصمات المصلية cTnI, CK-MB, BNP, MYO في اللعاب أعطى نسباً متدنية وقدرة تمييزية قليلة بين المرضى والشواهد (الجدول1). أظهر تحليل عينات اللعاب أن هذه الواصمات رغم أنها يعبر عنها بمستويات قابلة للقياس ظاهرياً في العينات المثالية للمرضى فإنها تكون متدنية دون حد الكشف بجهاز Beckman عندما تقاس في الوقت الأولي المتاح للدراسة (48 ساعة).
من الـ21 واصماً تبين أن CRP- MYO هي المجموعة الأقل موثوقية وقد حذفتهما الـ FDA من الاستخدام السريري في المصل.
إن المجموعات التي تتضمن CRP, MYO, MPO عندما تستخدم بالمشاركة مع الـ ECG تعطي دقة تشخيصية، حيث أنها عندما قيست بتحليل الـ ROC أعطت AUC 0.96 وهي مطابقة للمجموعات المصلية المتعددة الواصمات الأفضل المسجلة سابقاً (0.98 لــBNP, MYO و cTnI و CK-MB (27).
مع قيم حساسية في المجال 90-100% للمجموعات MYO-CRPو MYO-CRP-MPO فإن هذه الاختبارات يبدو أنها تعزيزات ممتازة لـECG .
هنالك تقارير تشير إلى أن تقييم الألم الصدري قد يتضمن طريقة متعددة الواصمات تشمل بعض المشاركات للـMYO, CK-MB, cTnI والواصمات الالتهابية في الاستراتيجيات التشخيصية (27-29).
في هذه الدراسة جُمعت العينات بعد 12–48 ساعة من بداية الألم الصدري المتعلق بـ AMI. يحد من هذه الدراسة التأخر في سحب العينة كما هو الحال في استخدام مرضى لا يعانون من ألم صدري في المجموعة الشاهدة.
كان الهدف في هذه الدراسة رسم مخطط حركي لهذه الواصمات في اللعاب المأخوذ من مرضى ألم الصدر في وقت مبكر.
إن تطوير مقايسات LOC اللعابية الفائقة الحساسية للتربونين هي المعيار الذهبي لتقييم تشخيص AMI وسوف تسمح بإعادة تقييم المساهمات والمشاركات بين الواصمات بطريقة مماثلة للمستخدمة في هذه الدراسة، وتماماً مثلما هو الحال في أطوار تحديد صلاحية الواصم فإن دراسة LOC هنا توثق اختلافات الإشارة القابلة للقياس في تحديد بصمة البروتين الوراثية (20، 21، 25).
مع استخدام نظام LOC فإن معاملة العينة وفصل المادة المراد تحليلها وتحديدها وتحليلها يمكن أن تتم على رقاقات حيوية نانوية تستخدم لمرة واحدة معدة للاستخدام بالمشاركة مع محلل محمول مما يقلل من زمن التشخيص والمعالجة (23، 30). |
| المراجع References |
1. Rosamond W, Flegal K, Friday G, Furie K, Go A, Greenlund K, et al.
Heart disease and stroke statistics, 2007 update: a report from the American Heart Association Statistics Committee and Stroke Statistics Subcommittee.
Circulation 2007; 115:E69 –E171.
2. Ting HH, Krumholz HM, Bradley EH, Cone DC, Curtis JP, Drew BJ, et al.
Implementation and integration of prehospital ECGs into systems of care for acute coronary syndrome: a scientific statement from the American Heart Association Interdisciplinary Council on Quality of Care and Outcomes Research, Emergency Cardiovascular Care Committee, Council on Cardiovascular Nursing, and Council on Clinical Cardiology.
Circulation, 2008;118:1066 –79.
3. Christenson RH.
ed. The National Academy of Clinical Biochemistry presents laboratory medicine practice guidelines: biomarkers of acute coronary syndromes and heart failure.
The American Association for Clinical Chemistry; 2007. http://
www.aacc.org/SiteCollectionDocuments/NACB LMPG/ACS_PDF_online.pdf (Accessed July 2009).
4. NACB Writing Group M, Morrow DA, Cannon CP, Jesse RL, Newby LK, Ravkilde J, et al.
National Academy of Clinical Biochemistry laboratory medicine
practice guidelines: clinical characteristics and utilization of biochemical markers in acute coronary syndromes.
Clin Chem 2007;53:552–74.
5. Thygesen K, Alpert JS, White HD; Joint ESC/ACCF/AHA/WHF Task Force for the Redefinition of Myocardial
Infarction, Jaffe AS, Apple FS, et al. Universal definition of myocardial infarction.
Circulation 2007;116:2634 –53.
6. Apple FS, Ler R, Chung AY, Berger MJ, Murakami MM.
Point-of-care i-STAT cardiac troponin I for assessment of patients with symptoms suggestive of acute coronary syndrome.
Clin Chem 2006;52: 322–5.
7. Wilper AP, Woolhandler S, Lasser KE, McCormick D, Cutrona SL, Bor DH, Himmelstein DU.
Waits to see an emergency department physician: U.S. trends and predictors, 1997–2004.
Health Aff (Millwood) 2008;27(2):w84 –95. Acad Emerg Med 2005;12(5 Suppl 1):33a.
8. Denny P, Hagen FK, Hardt M, Liao LJ, Yan WH, Arellanno M, et al.
The proteomes of human parotid and submandibular/sublingual gland salivas
collected as the ductal secretions.
J Proteome Res 2008;7:1994 –2006.
9. Siqueira WL, Salih E, Wan DL, Helmerhorst EJ, Oppenheim FG.
Proteome of human minor salivary
gland secretion.
J Dent Res 2008;87:445–50.
10. Streckfus CF, Bigler L, Dellinger T, Kuhn M, Chouinard N, Dai XL.
The expression of the c-erbB-2 receptor protein in glandular salivary secretions.
J Oral Pathol Med 2004;33:595– 600.
11. Li Y, St John MA, Zhou X, Kim Y, Sinha U, Jordan RC, et al.
Salivary transcriptome diagnostics for
oral cancer detection.
Clin Cancer Res 2004;10: 8442–50.
12. Herr AE, Hatch AV, Throckmorton DJ, Tran HM, Brennan JS, Giannobile WV, Singh AK.
Microfluidic immunoassays as rapid saliva-based clinical diagnostics.
Proc Nat Acad Sci 2007;104:5268–73.
13. Kaufman E, Lamster IB.
The diagnostic application of saliva: a review.
Crit Rev Oral Biol Med 2002;13:197–212.
14. Mandel ID.
Salivary diagnosis: more than a lick and a promise.
J Am Dent Assoc 1993;124:85–7.
15. Malamud D.
Saliva as a diagnostic fluid.
Br Med J, 1992;305:207– 8.
16. Lavigne JJ, Savoy S, Clevenger MB, Ritchie JE, McDoniel B, Yoo SJ, et al.
Solution-based analysis of multiple analytes by a sensor array: toward the
development of an “electronic tongue.”
J Am Chem Soc 1998;120:6429 –30.
17. Goodey A, Lavigne JJ, Savoy SM, Rodriguez MD, Curey T, Tsao A, et al.
Development of multianalyte sensor arrays composed of chemically derivatized polymeric microspheres localized in micromachined cavities.
J Am Chem Soc 2001;123: 2559 –70.
18. Christodoulides N, Tran M, Floriano PN, Rodriguez M, Goodey A, Ali M, et al.
A microchip-based multianalyte assay system for the assessment of cardiac risk.
Anal Chem 2002;74:3030–6.
19. Ali MF, Kirby R, Goodey AP, Rodriguez MD, Ellington AD, Neikirk DP, McDevitt JT.
DNA hybridization and discrimination of single-nucleotide mismatches using chip-based microbead arrays.
Anal Chem 2003;75:4732–9.
20. Christodoulides N, Floriano PN, Acosta SA, Michael-Ballard K, Weigum SE, Dharshan P, et al.
Towards the development of a lab-on-a-chip dual function white blood cell and C-reactive protein analysis method for the assessment of inflammation and cardiac risk.
Clin Chem 2005;51:2391–5.
21. Christodoulides N, Mohanty S, Miller CS, Langub MC, Floriano PN, Dharshan P, et al.
Application of microchip assay system for the measurement of C-reactive protein in human saliva.
Lab Chip2005;5:261–9.
22. Floriano PN, Christodoulides N, Romanovicz DK, Bernard B, Simmons GW, Cavell M, McDevitt JT.
Membrane-based on-line optical analysis system for rapid detection of bacteria and spores.
Biosens Bioelectron 2005;20:2079–88.
23. Rodriguez WR, Christodoulides N, Floriano PN, Graham S, Mohanty S, Dixon M, et al.
A microchip CD4 counting method for HIV monitoring in resource-poor settings.
Plos Medicine 2005;2: 663–72.
24. Christodoulides N, Dharshan P, Wong J, Floriano PN, Neikirk DP, McDevitt JT.
A microchip-based assay for interleukin-6. In: Floriano PN, ed. Microchip-based assay systems, methods and applications. Vol. 385. Totowa (NJ): Humana Press; 2007. p 131–44.
25. Christodoulides N, Floriano PN, Miller CS, Ebersole JL, Mohanty S, Dharshan P, et al.
Lab-on-achip methods for point-of-care measurements of salivary biomarkers of periodontitis.
Oral-Based Diagn 2007;1098:411–28.
26. Weigum SE, Floriano PN, Christodoulides N, Mc- Devitt JT.
Cell-based sensor for analysis of EGFR
biomarker expression in oral cancer.
Lab Chip 2007;7:995.
27. Hollander JE, Peacock WF, Shofer FS, Green GB, Lowenstein CJ, Blankenberg S, et al.
A cardiac multimarker index performs better than standard markers to diagnose acute myocardial infarction.
28. Apple FS, Murakami MM, Pearce LA, Herzog CA.
Multi-biomarker risk stratification of N-terminal pro-B-type natriuretic peptide, high-sensitivity C-reactive protein, and cardiac troponin T and I in end-stage renal disease for all-cause death.
Clin Chem 2004;50:2279–85.
29. Baldus S, Heeschen C, Meinertz T, Zeiher AM, Eiserich JP, Munzel T, et al.
Myeloperoxidase serum levels predict risk in patients with acute coronary syndromes.
Circulation 2003;108: 1440 –5.
30. Cohen J.
Monitoring treatment: at what cost?
Science (Wash DC) 2004;304:1936.
|
| |
| المجلد 5 ,
العدد 7
, ربيع الثاني 1431 - نيسان (أبريل) 2010 |
|
|
|
