| المجلد 5 ,
العدد 8
, رجب 1431 - تموز (يوليو) 2010 |
| |
| دراسة المستويات المصلية للريزستين لدى مرضى فشل القلب |
| Studying Serum Resistin levels in heart failure patients |
| د. مهند الشبلاق*، أ.د. مروان شامية** و أ.د. فايزة القبيلي* |
| Alchiblak M;* Shamia M.** and Al-Quobaili F* |
*كلية الصيدلة. **كلية الطب، جامعة دمشق.
*Faculty of Pharmacy, **Faculty of Medicine, Damascus University |
| الملخص Abstract |
الريزستين هرمون حديث الاكتشاف، فلقد أُكتشف من قبل مجموعة الدكتور Mitchell A. Lazar عام 2001. وهو يفرز بشكل رئيسي من النسيج الشحمي لدى الفئران، بينما لا يكون النسيج الشحمي النسيج الرئيس لإفرازه لدى البشر، فهو يفرز من الخلايا وحيدة النواة في الدم المحيطي والقلب والأنسجة الأخرى.
ربطت الدراسات المبكرة للريزستين بينه وبين السكري النمط الثاني والسمنة، وأظهرت الدراسات الحديثة أن له دوراً حيوياً في الالتهاب والأمراض القلبية الوعائية.
شملت دراستنا 155 شخصاً، 110 مرضى فشل قلب و 19 مرضى يعانون من زلة تنفسية غير قلبية المنشأ و 26 شخصاً من الشواهد. أظهرت نتائجنا ارتفاعاً واضحاً في مستويات الريزستين المصلية لدى مرضى فشل القلب مقارنة مع مجموعة مرضى ضيق النفس (الزلة) والمجموعة الشاهدة، كما ترافقت مستويات الريزستين المصلية مع وخامة فشل القلب تبعاً لتصنيف NYHA السريري.
|
Resistin is a newly discovered hormone, it was discovered in 2001 by the group of Dr Mitchell A. Lazar. In mice, adipose tissue is the major organ that secrets resistin, while in human, adipose tissue is not the major tissue, it is secreted from peripheral blood mononuclear cells, heart and other tissues.
Earlier studies showed that resistin is a link between type 2 diabetes and obesity, recent studies showed that resistin play a biological role in inflammation and cardiovascular diseases.
Our study contains 155 subjects, 110 heart failure patients, 19 non-cardiac dyspnea patients, and 26 control subjects. Our results show increasing serum resistin levels in patients with heart failure compared with non-cardiac dyspnea subjects and control subjects, and serum resistin levels was correlated to severity of heart failure according to New York Heart Association (NYHA) classification.
|
| المقدمة Introduction |
أكتشف الريزسـتين عام 2001 من قبل مجموعـة الدكتور Mitchell A. Lazar من كلية الطب في جامعة Pennsylvania، وسمي ريزستين resistin بسبب المقاومة للأنسولين الملاحظة لدى الفئران المحقونة بالريزستين.(1) وبالتزامن مع هذا الاكتشاف عرفت مجموعات بحثية أخرى الريزستين وهي:
1- Kim وزملاؤه عرفوا الريزستين كـعامل نوعي يفرز من النسيج الشحمي adipose tissue-specific secreted factor ويعرف اختصاراً ADSF وذلك بتقنية المصفوفة الصغرية microarray(2).
2- Holcomb وزملاؤه عرفوا الريزستين كعامل متواجد في المنطقة الالتهابية found in inflammatory zone 3 أو اختصاراً (FIZZ3)(3).
3- Steppan وزملاؤه حددوا الريزستين من خلال مسح المورثات التي يتحرض التعبير عنها خلال تمايز الخلية الشحمية، وبالمقابل يكبح التعبير الجيني لها في الخلايا الشحمية الناضجة لدى تعريضها للتيازوليدينات TZDs (مجموعة من الأدوية المضادة السكري والشائعة الاستعمال)(1).
يتوضع جين الريزستين لدى البشر على الصبغي 19 ولدى الجرذان على الصبغي 8، وعلى مسـتوى البروتيـن هنالك تشابه بيـن البروتين البشري والفأري بنسبة 55% فقط.(4)
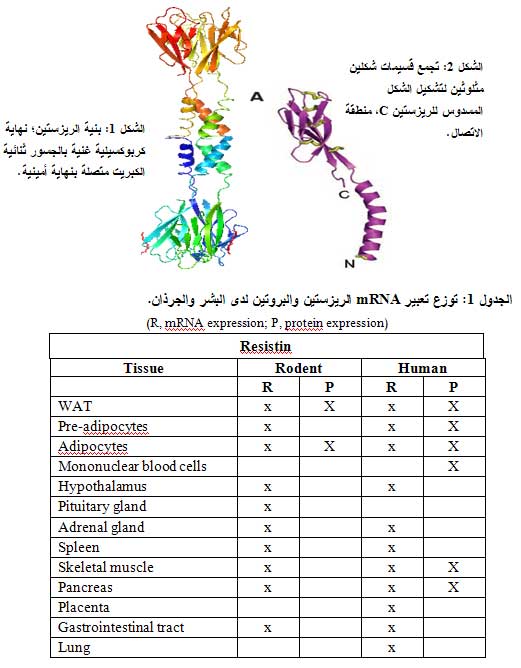
يبلغ طول طليعة ببتيد الريزستين عند البشر 108 حمضاً أمينياً، وعند الفئران 114 حمضاً أمينياً. للريزستين بنية متعددة القسيمات multimeric structure غير عادية، ويتكون كل قسيم من نهاية كربوكسليلية (β-sandwich) غنية بالجسور ثنائية الكبريت، ونهاية أمينية α-helical تمثل الذيـل. ويرتبـط الجزء الكروي إلى الذيل الحلزوني عبر منطقة اتصال مرنة (الشكل 1). تتجمع القطع α-helical لتشكل حلزونات ملتفة ثلاثية الطاق three-strand coiled coils، تتشكل الأشكال المسدوسة بارتباط الأشكال المثلوثة ذيلاً لذيل عبر جسور ثنائية الكبريت. أظهرت تحاليل عينات المصل أن الريزستين يجول بحالتين متجمعتين متميزتين تمثلان الشكل المثلوث والشكل المسدوس(5) (الشكل 2).
يعبر عن الريزستين لدى الفئران ويفرز من الخلايا الشحمية 3T3-L1، أما بالنسبة للبشر فلقد وجد أن الريزستين يعبر عنه ويفرز من خلايا النسيج الشحمي تحت الجلد البطني abdominal subcutaneous adipose tissue وفي الثرب omentum، وبشكل أكبر من خلايا مأخوذة من النسيج الشحمي المتواجد في الفخذ أو الصدر، الأمر الذي يجعل من السمنة المركزية عامل اختطار.(6)
إلا أن الكميات المفرزة من النسيج الشحمي لدى البشر ما زالت ضئيلة، فهو يعبر عنه بمستويات أعلى في الوحيدات monocytes، وكذلك في البلاعم macrophages. وهذا التعبير الجيني الغزير على مستوى الوحيدات والبلاعم يقترح أدوراً إضافية للريزستين، بالإضافة إلى دوره على مستوى البطانة الوعائية وتكاثر خلايا العضلات الملساء الوعائية (الجدول1).(7،8)
توصلت الدراسة الوظيفية الأولى للريزستين إلى أنه عامل مهم جداً يربط ما بين السمنة والسكري من النمط الثاني. وبعد ذلك أجريت العديد من الدراسـات اللاحقة لتحديد دور الريزسـتين في
السمنة والسكري من النمط الثاني، ومؤخراً فقد أظهرت العديد من الدراسات أنه من المحتمل أن يلعب الريزستين دوراً محورياً في الالتهاب والأمراض المتعلقة بالعملية الالتهابية (9).
أظهرت الدراسات المجراة في المختبر على مزارع خلايا عضلة قلبية أن هذه الخلايا تعبر عن الريزستين، كما لوحظ في المختبر أن الشد الميكانيكي Mechanical stretch لخلايا العضلة القلبية يحرض التعبير الجيني عن الريزستين، وذلك بتواسط عامل النخر الورمي(10).
كما يلعب الريزستين البشري دوراً مباشراً على خلية العضلة القلبية سواءٌ لدى البشر أو لدى الجرذان، من خلال إحداث نقص واضح في قبط الغلوكوز المتواسط بالأنسولين على مستوى العضلة القلبية (11).
في حالة فرط تحميل ديناميكية الدم hemodynamic overload، وخصوصاً في حالة فرط التحميل الحجمي، فإن الخلايا القلبية المتمددة سوف تبدي خللاً في قبط الغلوكوز والوظيفة الإنقباضية، وهذا يقترح أن الريزستين يشكل رابطاً بين الإجهاد الميكانيكي mechanical stress وضخامة القلب (10).
نظراً لأن العديد من الدراسات قد أثبتت أن المستويات المرتفعة من السيتوكينات الالتهابية تلعب دوراً في إمراضية فشل القلب، فإنه من المحتمل أن المستويات المرتفعة من الريزستين قد تسبب ارتفاعاً في مستويات عامل النخر الورمي، والتي قد تتعلق بحصيلة التظاهرات السريرية المؤذية (12). كما أظهرت التجربة السريرية أن الريزستين يحدث خللاً في الشفاء القلبي cardiac recovery التالي للإقفار من خلال تحريض الـ TNF-α في القلب. (13,12)
كما وجد أن المستويات المرتفعة من الريزسـتين
تترافق مع تطور فشل القلب، حتى بعد استثناء المرضى البدينين وأولئك الذين يعانون مقاومة الأنسولين، والحالات الالتهابية، والحالات التي يعاني فيها المرضى من أمراض قلبية إكليلية CHD. وإن الآلية التي يحرض بها الريزستين فشل القلب مازالت غير مفسرة ولكن هذه المعطيات تقترح أن هنالك آلية فريدة تحرض فشل القلب لكنها مازالت مجهولة. كما لوحظ أن المستويات المرتفعة من الريزستين لدى الأشخاص الذين لا يعانون من فشل القلب يشكل عامل اختطار مستقل للإصابة بفشل قلب.(14)
كما أُثبت دور الريزستين في تحريض ضخامة العضلة القلبية من خلال ملاحظة الزيادة في السطح الخلوي والنسبة المئوية من القسيمات العضلية المتمايزة وكذلك في اصطناع البروتين والتعبير الجيني . إن التضخم يتضمن العديد من سبل الإشارة داخل الخلوية، ولقد سجلت زيادة في تفعيل كل من سبل الإشارة ERK و p38 وذلك بعد زيادة التعبير الجيني للريزستين في خلايا العضلة القلبية. وهذه الاستجابة للريزستين كانت معتمدة بشكل كامل على ERK- و p38-.(15) |
 |
| تصنيف NYHA الوظيفي New York Heart Association Functional Classification |
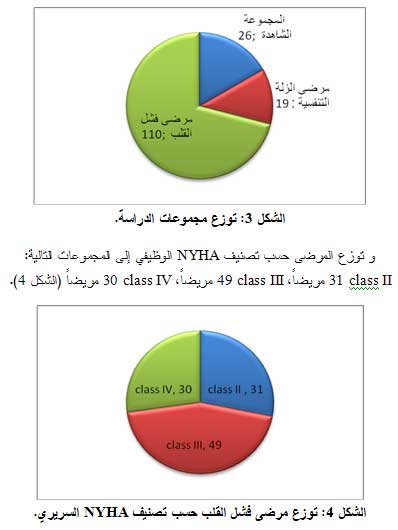
صُنف مرضى فشل القلب سريرياً اعتماداً على العلاقة بين الأعراض والجهد اللازم لإثارتها إلى:
Class I: مرضى فشل القلب اللاعرضي، لا تظهر لديهم الأعراض عند الفعالية الفيزيائية، ولا يسبب الجهد الفيزيائي العادي تعباً، أو ضيق النفس (زلة)، أو ألم خُناقي anginal pain.
Class II: مرضى فشل القلب العرضي عند الجهد الشديد، يبقى المريض مرتاحاً أثناء الراحة وتظهر أعراض خفيفة عند الجهد الفيزيائي الشديد كالتعب، والزلة، والخُناق الصدري.
Class III: مرضى فشل القلب العرضي عند الجهد الخفيف، يبقى المريض مرتاحاً أثناء الراحة وتظهر أعراض واضحة عند القيام بأي نشاط خفيف أقل من العادي كالتعب، والزلة، والألم الذبحي.
Class IV: مرضى فشل القلب العرضي عند الراحة، يعجز المريض عن القيام بأي مجهود أو نشاط وتظهر أعراض فشل القلب والألم الصدري
حتى أثناء الراحة وتزداد عند القيام بأي نشاط.(16)
|
| المواد والطرق Materials and Methods |
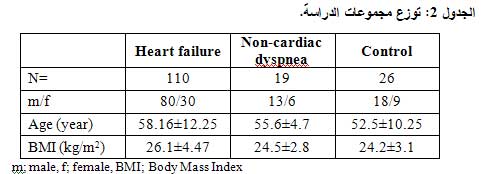
شملت الدراسة 155 شخصاً من الذكور والإناث تراوحت أعمارهم ما بين (85-35 سنة) (الشكل 2)، جرى جمعهم في الفترة مابين أيلول 2008 ونيسان 2009 من المراكز التالية:
مستشفى الأسد الجامعي.
- مستشفى المواساة.
- مركز جراحة القلب والأوعية الدموية.
- مركز الباسل لجراحة القلب.
ووُزع هؤلاء الأفراد إلى 110 مرضى فشل قلب، 19 مريض زلة تنفسية غير قلبية المنشأ، 26 شخصاً من الأسوياء يشكلون المجموعة الشاهدة (الجدول 2).
جرى جمع 6-8 مل دم في أنابيب جافة (أنبوبين لكل مريض)، ثم نُبذت العينات خلال 45 دقيقة كحد أقصى بسرعة 3500 دورة/ دقيقة وبدرجة حرارة 18°م، وحفظت المصول في أنابيب ابندروف في درجة حرارة -80°م إلى حين المعايرة.
كما استبعد المرضى السكريين (سواء كانوا من النمط الأول أو الثاني)، وكذلك المرضى الذين يعانون من قصور كلوي المشخصين بمستويات مصلية من الكرياتينين أكبر أو تساوي 1.5 ملغ/ دل، وكذلك المرضى الذين يعانون من حالات التهابية مثل التهاب المفاصل الروماتويدي أو الربو أو الذأب الحمامي الجهازي.
جرت مقايسة الريزستين باستخدام عتيدة human resistin ELISA المصنعة من قبل شركة Bio Vendor التشيكية، وتسمح هذه العتيدة بمقايسة مستويات الريزستين البشري كمياً في المصل
والبلازما والأوساط الزرعية النسيجية بطريقة المقايسة المناعية الإنزيمية.
منسب كتلة الجسم لأفراد المشمولين في الدراسة حدد بتقسيم وزن الجسم مقدراً بالكيلوغرام على مربع الطول مقدراً بالمتر.
تم التعبير عن القيم بالمتوسط الحسابي والانحراف المعياري ومجال القيم لكل مجموعة. كما اعتمد اختبار T-Student لتحديد ما إذا كان الفارق بين المتوسطات ناجماً عن المصادفة أم حقيقياً.
اعتمد معامل Person للارتباط لدراسة علاقة الارتباط بين متثابتات المجموعة الواحدة.
اعتمدت P<0.05 كقيمة يعتد بها إحصائياً. كما استخدم برنامج Microsoft excel 2007 و SPSS الإصدار 18 لتحليل البيانات إحصائياً.
|
 |
| النتائج Results |
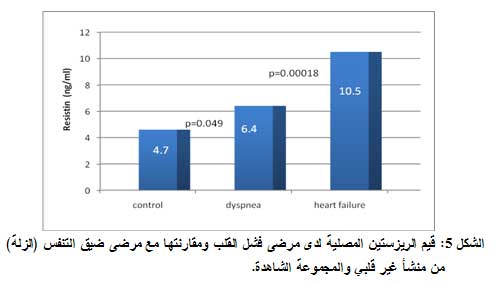
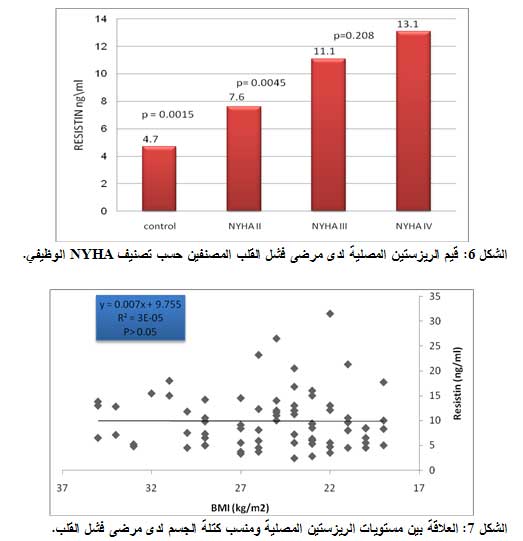
أظهرت نتائجنا ارتفاعاً واضحاً في مستويات الريزستين المصلية لدى مرضى فشل القلب (X±SD: 10±5.68 ng/ml) مقارنة مع المجموعة الشاهدة 4.7±1.5 ng/ml) (X±SD: وبفارق إحصائي هام جداً P< 0.0001))، كما كانت مستويات الريزستين المصلية لدى مرضى فشل القلب أعلى منها لدى مرضى الزلة من منشأ غير قلبي (X±SD 6.5±3.1 ng/ml) وأيضاً كان الفارق الإحصائي هاماً جداً (P=0.00018).
كما بينت نتائجنا ارتفاع مستويات الريزستين المصلية لدى مرضى فشل القلب تبعاً لدرجة وخامة المرض لدى هؤلاء المرضى، وذلك اعتماداً على تصنيف NYHA السريري وبالتالي مع سوء إنذار المريض
NYHA II: 3.7±4.7 ng/ml
NYHA III: 6±11.1 ng/ml
NYHA IV: 5.5±13.1 ng/ml
بتطبيق اختبار T -Student وجد فارق يعتد به إحصائياً (P<0.01) بين المجموعة الشاهدة ومجموعة مرضى فشل القلب NYHA II. كما وجد فارق يعتد به إحصائياً (P<0.001) بين المجموعة الشاهدة ومجموعة فشل القلب NYHA III، وأيضاً لاحظنا فارق يعتد به احصائياً (P<0.001) بين المجموعة الشاهدة ومجموعة مرضى فشل القلب NYHA IV.
بالمقابـل وجدنـا فارقاً يعتـد به إحصائيـاً (P<0.05) بين مجموعة مرضى فشل القلب NYHA II ومجموعة مرضى فشل القلب NYHA III، بالمقابل لم يكن هنالك فارق يعتد به إحصائياً (P>0.05) بين مجموعتي مرضى فشل القلب III ، IV (الشكل 6).
بدراسة العلاقة بين الريزستين ومنسب كتلة الجسم لدى المرضى لم يُلاحظ وجود علاقة ارتباط يعتد بها إحصائياً و R≈0، P>0.05 (الشكل 7).
|
|
| المناقشة Discussion |
إن الريزستين هو هرمون حديث الاكتشاف، وهو يُنتج بالإضافة إلى النسيج الشحمي الأبيض في عدد من الأعضاء المختلفة في الجسم كخلايا الدم البيضاء والبنكرياس والقلب، وهذا ما يؤكد أنه يلعب أدواراً حيويـة مختلفة بالإضافة إلى دوره كرابط ما بين السمنة والداء السـكري من النمط الثاني.(17)
أظهرت نتائجنا ارتفاعاً واضحاً في مستويات الريزستين المصلية لدى مرضى فشل القلب (X±SD: 10±5.68 ng/ml) مقارنة مع المجموعة الشاهدة 4.7±1.5 ng/ml) (X±SD: وبفارق إحصائي يُعتد به (P< 0.0001)، كما كانت مستويات الريزستين المصلية لدى مرضى فشل القلب أعلى منها لدى مرضى الزلة من منشأ غير قلبي (6.5±3.1 ng/ml) وأيضاً كان الفارق مُعتداً به إحصائياً (P=0.00018).
كما بينت نتائجنا ارتفاع مستويات الريزستين المصلية لدى مرضى فشل القلب بترقي درجة المرض لدى هؤلاء المرضى، وذلك اعتماداً على تصنيف NYHA السريري وبالتالي مع
سوء إنذار المريض.
وهذا يتوافق مع دراسة Yasuchika Takeishi وزملاؤه عام 2007 (12)، إذ أكدوا أن مستويات الريزستين المرتفعة لدى مرضى فشل القلب يترافق مع تدهور حالة المرضى وإنذار سيء للوفاة لدى هؤلاء المرضى.
أكد Bao-Wei Wang وزملاؤه عام 2007 (10) أن الشد الميكانيكي mechanical stretch لخلايا عضلة قلبية معزولة يزيد من التعبير الجيني للريزستين، وإن فرط الحمل الدموي الملاحظ لدى مرضى فشل القلب يسبب ضغطاً ميكانيكياً على جدران البطين الأيسر، الأمر الذي يزيد من التعبير الجيني عن الريزستين، وبالتالي الإسهام في رفع مستوياته الدموية لدى مرضى فشل القلب.
وبالمقابـل فـإن المسـتويات المرتفعـة من الريزستين تمارس تأثيراً مؤذياً على عضلة القلب وذلك من خلال:
- تراجع في قبط الغلوكوز عبر خلايا العضلة القلبية وبالتالي إحداث خلل في الوظيفة القلوصية للقلب (Bao-Wei Wang, 2007) (10).
- إضعاف قلوصية العضلة القلبية، فقد لاحظ عام Maengjo Kim, 2008 وزملاؤه (15) تراجعاً في نقل أيونات الكالسيوم عبر خلايا البطين التي تعبر عن الريزستين مقابل الشواهد.
- تحريض ضخامة العضلة القلبية من خلال تفعيل MAP Kinases (Maengjo Kim, 2008) (15).
وبالنتيجة تدهور حالة المريض، وهذا أشبه بسوء التكيف الوظيفي maladaptation الملاحظ لدى مرضى فشل القلب بالنسبة للعديد من الهرمونات، كالهرمونات العصبية وجملة رينين- انجيوتنسين- الدوستيرون والسيتوكينات الالتهابية.
لقد حاولنا في دراستنا استثناء جميع الحالات المرضية التي أكدت الدراسات العالمية أن مستويات الريزستين ترتفع فيها. فلقد استثنينا مرضى فشل القلب الذين يعانون من السكري (سواءٌ كانوا من النمط 1 أو من النمط 2)، ومرضى الفشل الكلوي والمرضى الذين يعانون من الربو أو التهاب المفاصل الروماتويدي أو الذأب الحمامي SLE، وهذا يؤكد أن ارتفاع مستويات الريزستين المصلية لدى مرضى فشل القلب هو مستقل ومتعلق بحالة فشل القلب فقط.
وجد أن التعبير الجيني عن الريزستين يتزايد بتأثير هذه السيتوكينات(18). كما أن الريزستين يزيد من التعبير الجيني لكلٍ من IL-6 و TNF-α NF-B(19). وقد بينت الدراسات أن الريزستين يحرض تعبير القلب عن عامل النخر الورمي(20). كما تبين أن الريزستين يزيد من التعبير الجيني للبروتين المتفاعل C (CRP) (22,21).
لقد أظهرت العديد من الدراسـات العالمية ارتفاع مستويات هذه المتثابتات لدى مرضى فشل القلب وبالتالي يمكننا القول أن المستويات المرتفعة من هذه السيتوكينات سوف تزيد من التعبير الجيني للريزستين الأمر الذي سوف يؤدي بالنتيجة إلى الإسهام في رفع المستويات الدموية للريزستين لدى مرضى فشل القلب.
وبالمقابل فالمستويات المرتفعة للريزستين تزيد أيضاً من التعبير الجيني لكلٍ من IL-6 وTNF-α و CRP. ونتيجة لكل ذلك تزداد التأثيرات المؤذية على عضلة القلب الأمر الذي يؤدي إلى تدهور وضع المريض وسوء الإنذار.
كما بينت نتائجنا عدم وجود علاقة بين مستويات الريزستين المصلية ومنسب كتلة الجسم لدى مرضى فشل القلب بخلاف الأسوياء، الأمر الذي يشير إلى أن منسب كتلة الجسم ليس هو المؤثر الرئيسي في مستويات الريزستين المصلية لدى هؤلاء المرضى، وإنما هي متعلقة بشكل أساسي بحالة فشل القلب.
|
| الاستنتاج Conclusion |
- ارتفاع مستويات الريزستين لدى مرضى فشل القلب بسبب زيادة الضغط الميكانيكي الذي يمارسه الحمل الدموي على جدران البطين الأيسر وزيادة مستويات المتثابتات الالتهابية.
- يمارس الريزستين دوراً مؤذياً لعضلة القلب وبالتالي تترافق المستويات المصلية للريزستين مع تدهور حالة المريض وسوء الإنذار.
|
| المراجع References |
1-Steppan CM, Bailey ST, Bhat S, et al.
The hormone resistin links obesity to diabetes.
Nature, 409: 307-312, 2001.
2-Christine M. Kusminski, Philip G. et al.
Role of resistin in obesity, insulin resistance and Type II diabetes.
Clinical Science. 109: 243-256, 2005.
3-Kim KH; et al.
A Cysteine-rich Adipose Tissue-specific Secretory Factor Inhibits Adipocyte Differentiation.
The Journal of Biological Chemistry, 276, 11252-11256, 2001.
4-Holcomb IN, Kabakoff RC, han b. et al.
FIZZ1, a novel cysteine-rich secreted protein associated with Pulmonary inflammation, defines a new gene family
EMBOJ. 19; 4046-4055, 2000.
5-Saurabh D. Patel, Michael W. Rajala, Luciano Rossetti, Philipp E. Scherer, Lawrence Shapiro.
Disulfide-Dependent Multimeric Assembly of Resistin Family Hormones.
Science, 304: 1154-1158, 2004.
6-McTernan P.G; Mc Ternan.C.L, et al.
Increased resistin gene protein expression in human abdominal adipose tissue.
The Journal of Clinical Endocrinology & Metabolism, 87(5): 2407-2410, 2002.
7-Yang Yun-mei, XU Zhe-rong, WU Ling-jiao, et al.
Study of Resistin gene expression in peripheral blood mononuclear cell and its gene polymorphism in a small range population.
J Zhejiang Univ Sci B; 8(2): 132-135, 2007.
8-Hye Seung Jung, Ki-Ho Park, Young Min Cho, et al.
Resistin is secreted from macrophages in atheromas and promotes atherosclerosis.
Cardiovascular Research, 69: 76-85, 2006.
9-Shanshan Pang and Yingying Le.
Role of Resistin in Inflammation and Inflammation-Related Diseases.
Cellular & MolecularImmunology, 3(1): 29-34, 2006.
10-Bao-Wei Wang, Huei-Fong Hung, Hang Chang, et al.
Mechanical stretch enhances the expression of resistin gene in cultured cardiomyocytes via tumor necrosis factor-?.
Am J Physiol Heart Circ Physiol; 293: 2305-2312, 2007.
11-Christophe Graveleau, Vlad G. Zaha, Arash Mohaje, et al.
Mouse and Human Resistins Impair Glucose Transport in Primary Mouse Cardiomyocytes, and Oligomerization Is Required for This Biological Action.
J. Biol. Chem; 280(36): 31679-31685, 2005.
12-Yasuchika Takeishi, Takeshi Niizeki, Takanori Arimoto, et al.
Serum Resistin is Associated With High Risk in Patients With Congestive Heart Failure-A Novel Link Between Metabolic Signals and Heart Failure.
Circ J; 71: 460-464, 2007.
13-Rothwell SE; Richards AM. and Pemberton CJ.
Resistin worsens cardiac ischemia-reperfusion injury.
Biochem Biophys Res Commun; 349: 4000-4007, 2006.
14-David S. Frankel, Ramachandran S. Vasan, Ralph B. D'Agostino, et al.
Resistin, Adiponectin, and Risk of Heart Failure: The Framingham Offspring.
JACC; 53(9): 1-8, 2009.
15-Maengjo Kim, Jae kyun Oh, Susumu Sakata, et al.
Role of resistin in cardiac contractility and hypertrophy.
Journal of Molecular and Cellular Cardiology; 45 :270-280, 2008.
16-Eugene Braunwald, Wilson Colucci and William Grossman.
Clinical Aspects of Heart Failure in “Heart Disease“ Eugene Braunwald.
5th ed. W.B. Saundrers company, 445-470, 1997.
17-Adeghate E.
An update on the biology and physiology of resistin.
Cell. Mol. Life Sci. 61, 2485-2496, 2004.
18-Kaser S, Kaser A, Sandhofer A, Ebenbichler C.F, Tilg H. and Patsch J.R.
Resistin messenger-RNA expression is increased by proinflammatory cytokines in vitro. Biochem Biophys Res Commun; 309, 286-290, 2003.
19-Bokarewa M; Nagaev I; Dahlberg L; Smith U. and Tarkowski A.
Resistin, an adipokine with potent proinflammatory properties.
J Immunol; 174, 5789-95, 2005.
20-Rothwell SE; Richards AM. and Pemberton CJ.
Resistin worsens cardiac ischaemia-reperfusion injury.
Biochem Biophys Res Commun; 349: 400-407, 2006.
21-Al-Daghri N; Chetty R. and McTernan PG.
Serum resistin is associated with C-reactive protein and LDLcholesterol in type 2 diabetes and coronary artery disease in a Saudi population.
Cardiovascular Diabetology, 4: 10, 2005.
22-Anne Kunnari, Olavi Ukkola, Markku Pa¨iva¨nsal, et al.
High Plasma Resistin Level Is Associated with Enhanced Highly Sensitive C-Reactive Protein and Leukocytes.
Clin Endocrinol Metab, 91(7): 2755-2760, 2006.
|
| |
| |
| المجلد 5 ,
العدد 8
, رجب 1431 - تموز (يوليو) 2010 |
|
|
|
