| المجلد 5 ,
العدد 9
, شوال 1431 - تشرين أول (أكتوبر) 2010 |
| |
| مقايسة الأضداد الذاتية للبروتين الكابت للورم p53
لدى مرضى سرطان القولون والمستقيم
|
| Tumor Suppressor Protein p53 Autoantibodies Assay
in Colorectal Cancer Patients
|
| د. أنس ملص، أ.د. عبدو عطايا و د. جمانة الصالح |
| Mallas A; Ataya A. and Salh J. |
كلية الصيدلة، جامعة دمشق
Faculty of Pharmacy, Damascus University |
| الملخص Abstract |
الخلفية: تعد الطفرات في الجين الكابت للورم p53 التبدل الجيني الأكثر شيوعاً في سرطان القولون والمستقيم، وإن كشف أضداد p53 في المصل يمكن أن يكون من الإجراءات الفعالة غير المباشرة لكشف التبدلات في جين .p53
الهدف: هدفت هذه الدراسة إلى الكشف عن وجود أضداد p53 لدى مرضى سرطان القولون والمستقيم، ودراسة علاقة وجود هذه الأضداد مع كل مرحلة من مراحل الورم وتوضعه وعمر وجنس المريض والتدخين.
الطريقة: حللنا المصل للتحري عن أضداد p53 عند 57 مريض سرطان قولون ومستقيم و 33 مريضاً بأمراض معدية معوية حميدة (داء كرون أو التهاب القولون التقرحي) و 35 شخصاً سليماً باستخدام طريقة المقايسة بالامتزاز المناعي المرتبط بالإنزيم ELISA.
النتائج: كشفت أضداد p53 المصلية عند 8 مرضى من أصل 57 مريض سرطان قولون ومستقيم %14، بينما لم تكشف هذه الأضداد لدى المصابين بأمراض معدية معوية حميدة أو الأشخاص السليمين (مجموعة الشاهد). وكان الفارق معتد به احصائياً (P 0.05). ووجدنا أنه ليس هنالك ترابط يعتد به احصائياً بين تواتر أضداد p53 وحجم الورم، وتوضع الورم، والجنس، والتدخين. إلا أن المرضى الذين كانت مصولهم إيجابية كانوا أكبر من المرضى الذين كانت مصولهم سلبية الأضداد.
الاستنتاج: إن أضداد p53 هي واصم نوعي لسرطان القولون والمستقيم، كما أنه لا يوجد ارتباط بين تواتر أضداد p53 وحجم الورم، وتوضع الورم والجنس، والتدخين.
|
Background: Mutation of the p53 tumer suppressor gene is the most common genetic alteration in colorectal cancer, and detection of p53 antibodies in serum might be an effective indirect procedure to detect alterations of the p53 gene.
Aim: This study aimed to detect the presence of p53 antibodies in patient with colorectal cancer, and to study the association between this antibodies and tumor stage, tumor location, gender, age and smoking.
Method: we analyzed serum for p53 antibody using Enzyme linked Immune-adsorbent assay in 57 patients of colorectal cancer and 33 patients of benign
disease in gastrointestinal (Crohn's Disease,Ulcerative Colitis) and 35 healthy individuals.
Results: Eight of seventy five colorectal cancer patients were positive for p53 antibodies (14%), and p53 antibodies weren’t detected in patients with benign gastrointestinal diseases, neither in healthy subjects (control group). The difference was statistically significant (p<0.05). We found no significant association between the frequency of anti-p53 antibodies and tumor size, tumor location, gender and smoking. However sero-positive patients were older than sero-negative patients.
Conclusion: p53 antibodies are a specific tumer marker of colorectal cancer, and there is no association between the frequency of anti-p53 antibodies and tumor size, tumer location, gender and smoking.
|
| مقدمة Introduction |
تزداد نسبة انتشار الأورام يوماً بعد يوم في بلدان العالم نتيجة ازدياد التعرض للمسرطنات، ويعد سرطان القولون والمستقيم واحداً من أكثر الخباثات شيوعاً في العالم، وهو مسؤول عن حوالي 11% من وفيات السرطان (1). وفي سورية، نلاحظ ازدياد أعداد مرضى الأورام الخبيثة خلال السنوات الأخيرة، حيث بلغ عدد مرضى الأورام الخبيثة الجدد الذين راجعوا مستشفى البيروني بدمشق عام 2000 حوالي 7155 مريضاً بينما وصل عدد مرضى الأورام الخبيثة الجدد في مستشفى البيروني عام 2009 إلى 10059 مريضاً، وبلغ عدد مرضى الأورام الخبيثة الذين راجعوا الشعبة الهضمية في مستشفى البيروني في عام 2009 حوالي 1551 مريضاً، وذلك وفقاً لبيانات مكتب الإحصاء في مستشفى البيروني.
يبدأ السرطان عادة في الطبقة الأعمق من البطانة ويتقدم ببطء عبر الطبقات الأخرى، وعندما تتراكم التبدلات الجينية تصبح الخلايا أكثر شذوذاً ويتقدم السرطان. ومن أهم الجينات التي ثبتت أهميتها في تطور سرطان القولون والمستقيم جين APC وجين K-Ras وجين DCC-DCC وجين p53 (2). تلعب جين p53 دور حارسٍ جزيئيٍ للحفاظ على ثباتية الجينوم وضمان سلامته، وذلك عبر المراقبة الدائمة لأية أذية أو عطب يصيب المادة الوراثية (3)، وعندها تسارع لاتخاذ إجراءات وتدابير وقائية تتضمن إيقاف الدورة الخلوية مباشرة. يجري التعبير عن p53 في الخلايا المنقسمة بمستويات ضئيلة جداً، لكن يحصل تنظيم إيجابي up-regulate كاستجابة لأذية الدنا DNA ويؤدي هذا إلى إيقاف دورة الخلية في الطور G1 وإصلاح الدنا قبل الدخول إلى الطور S(4)، أو تحريض الموت الخلوي المبرمج، فيما لو كانت هذه الأذية شديدة وغير قابلة للعكس (5). ومن هنا فإن الضياع الوظيفي لهذه الجين يتيح تكاثر الخلايا المعطوبة وراثياً، والذي يشكل الخطوة الأولى على طريق تطور الخباثة (6). يرتبط فقدان وظيفة p53 الطبيعية مع استحالة الخلية Cell transformation في المختبر وتطور الأورام في العضوية. ويمكن أن يفقد p53 وظيفته الطبيعية بعدة آليات كحدوث تبدلات جينية في مورثة p53 (7)، أو من خلال تشكيل معقدات بروتينية مع البروتينات الفيروسية الورمية (8)، أو الارتباط مع بروتينات خلوية مثل بروتين mdm2 (9)، أو من خلال خلل توضع بروتين p53 بين أقسام الخلية (10).
تُعد الطفرات التي تصيب جين p53 من أكثر التبدلات الجينية الشائعة في السرطانات البشرية، إذ أن هذه التبدلات في الجين والبروتين اللا وظيفي الناتج عنها يمكن استعمالها في علم الأورام السريري لمسح المرضى، أو للتقييم الإنذاري، أو لتقييم مدى الاستجابة على العلاج 12,11)). لم يكتشف بروتين p53 في مصول مرضى السرطان، لكن تتشكل أضداد له عند نسبة من هؤلاء المرضى تختلف من ورم لآخر، ولا تزال الآلية التي تقود إلى تشكيل أضداد p53 غير واضحة ،فلقد اقترح et al. Montenarh أن تشكل هذه الأضداد يعتمد على نمط الطفرة في جين p53 (13). كما اقترح Davidoff et al. بأن تشكيل معقد مع بروتين الصدمة الحرارية 70 هو المسؤول عن جعل p53 الطافر يبدو كمستضد للجملة المناعية (14). أما مجموعة Hainaut فلقد اقترحت بأنّ تراكم p53 في الورم هو محرض رئيسي لتشكيل الاستجابة المناعية لدى مرضى السرطان (15). وعلى الرغم من غياب بروتينp53 من مصول مرضى السرطان إلا أن أضداده الجوالة موجودة في مصول العديد من هؤلاء المرضى، فحوالي 40-20% من المرضى الذين لديهم طفرات p53 ستتولد في مصولهم أضداد p53 (16). ويمكن الاعتماد على هذه الأضداد في عمليات التحري والاستقصاء الروتيني، كما أصبح بالإمكان استخدام هذه الأضداد في مناطرة المرضى ومراقبتهم أثناء تلقي العلاج (17).
|
| المواد والطرق Materials and Methods |
مجموعة الدراسات Study groups
شملت الدراسة 125 شخصاً وزعوا على النحو التالي:
1- مجموعة الأسوياء: ضمت 35 شخصاً سوياً ظاهرياً (18 ذكراً، 17 أنثى)، متوسط أعمارهم 45.1±14.4 عاماً.
2- مجموعة الأمراض المعدية المعوية الحميدة: ضمت 33 مريضاً (16 ذكراً، 17 أنثى) متوسط أعمارهم 39.7±14.7 عاماً، لديهم أمراض حميدة في القولون والمستقيم وهي التهاب القولون القرحي وداء كرون وسلائل.
3- مجموعة مرضى سرطان القولون والمستقيم: ضمت 57 مريضاً مصاباً بسرطان القولون والمستقيم (36 ذكراً،21 أنثى) متوسط أعمارهم 57.3±15.0 عاماً. (الشكل 1).
|
|
الشكل 1: النسبة المئوية لتوزع عينة البحث وفقاً للمجموعة المدروسة.
|
الاعتيان Sampling
جمعت العينات من شعب مستشفى الأسد الجامعي ومستشفى المجتهد ومستشفى البيروني، في الفترة الممتدة من 15/6/2008 إلى 15/1/2009 م. بزلت عينات الدم من المرضى على أنابيب جافة للحصول على المصل، نبذت العينات بسرعة 3000 g لمدة 10 دقائق عند الدرجة +°4م، وزع المصل في أنابيب صغيرة حفظت في الدرجة -°80م إلى حين إجراء المقايسات.
الطرق المستخدمة Methods used
جرى كشف أضداد p53 باستخدام عتائد لشركة Biodiagnostic الألمانية بطريقة المقايسة بالامتزاز المناعي المرتبط بالإنزيم نمط الساندويتش Sandwich-ELISA، باستخدام خلاصات من خلايا ورمية بشرية تحوي بروتين p53. يثبت p53 على الآبار بوساطة أضداد وحيدة النسيلة ضد p53. ولكشف الارتباط غير النوعي بين المصل ومعقد المستضد ـ ضد، جرى إدخال طبق معايرة آخر مغلف بمستضد شاهد، عبارة عن خلاصات خلوية ورمية خالية من p53. اعتبرت أضداد p53 إيجابية عندما يكون تركيزها أكبر من 0.4 مكغ/ مل وذلك وفق ما ذكر في نشرة العتيدة.
أجريت الدراسة الإحصائية باستخدام اختبار T Student لتحديد كون الفارق بين المتوسطات ناجماً عن المصادفة أم أنه فارق جوهري ومعتد به إحصائية، كما أُعتمد اختبار كاي مربع لدراسة كون الفارق في تواتر أضداد p53 ناجماً عن المصادفة أم أنه فارق جوهري ومعتد به إحصائياً، أُعتمدت قيمة p<0.05 للدلالة الإحصائية.
|
| النتائج Results |
كشفت أضداد p53 المصلية عند 8 مرضى من أصل 57 مريض سرطان قولون ومستقيم (%14)، ولكن لم تكشف هذه الأضداد عند أي مريض من بين المصابين بأمراض معدية معوية حميدة ولا الأشخاص السليمين، وبتطبيق اختبار كاي مربع لوحظ وجود فارق معتد به إحصائياً في تواتر أضداد p53 بين المجموعات الثلاث المدروسة، حيث كانت قيمة مستوى الدلالة p=0.006 (أصغر من القيمة 0.05p<). (الشكل 2).
كما قمنا بدراسة علاقة وجود هذه الأضداد مع كل مرحلة من مراحل الورم وتوضعه وعمر وجنس المريض وعلاقتها مع التدخين. يبين الجدول 1 بيانات مرضى سرطان القولون والمستقيم وفقاً لبعض الواصمات السريرية، والعلاقة مابين أضداد p53 وهذه الواصمات السريرية.
وبتطبيق اختبار Student T لدراسة العلاقة مابين أضداد p53 وعمر المريض في مجموعة المصابين بسرطان القولون، أو المستقيم، لوحظ وجود فارق معتد به إحصائياً في متوسط عمر المرضى (بالسنوات) بين مجموعة المرضى الذين كانت لديهم أضداد p53 سلبية ومجموعة المرضى الذين كانت لديهم أضداد p53 إيجابية. حيث كان المرضى إيجابيو أضداد p53 أكبر عمراً من المرضى سلبيي أضداد p53 ، وبلغت قيمة مستوى الدلالة p=0.044 (أصغر من القيمة 0.05p<). أما عند دراسة العلاقة مابين أضداد p53 وجنس المريض فقد بلغت قيمة مستوى الدلالة p=0.105، أي لا يوجد فارق معتد به إحصائياً في تواتر أضداد p53 بين مجموعة المرضى الذكور ومجموعة المريضات الإناث. كما لم يوجد فارق معتد به إحصائياً في تواتر أضداد p53 بين مجموعة المرضى غير المدخنين ومجموعة المرضى المدخنين (p=0.776). كما لم يوجد فارق معتد به إحصائياً في تواتر أضداد p53 بالاعتماد على توضع الورم (p=0.619) أو مرحلة الورم (p=0.831) حيث كانت قيمة p>0.05.
|
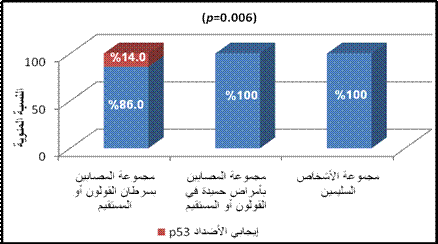
الشكل 2: النسبة المئوية لنتائج مقايسة أضداد p53 في عينة البحث وفقاً للمجموعة المدروسة.
الجدول 1 : بيانات مرضى سرطان القولون والمستقيم وفقاً لبعض الواصمات السريرية، والعلاقة مابين أضداد p53 وهذه الواصمات.
p-value |
سلبي أضداد p53 (%) |
إيجابي أضداد p53 (%) |
العدد |
الواصم |
0.105 |
91.7% |
8.3% |
36 |
ذكور |
الجنس |
76.2% |
23.8% |
21 |
إناث |
0.776 |
87.5% |
12.5% |
24 |
مدخن |
التدخين |
84.8% |
15.2% |
33 |
غير مدخن |
0.044 |
55.7 years |
67.1 years |
57 |
بالسنوات |
وسطي الأعمار |
0.619 |
88.5% |
11.5% |
26 |
قولون |
توضع الورم |
83.9% |
16.1% |
31 |
مستقيم |
0.831 |
90% |
10.0% |
10 |
Stage I |
مرحلة الورم حسب تصنيف TNM |
81% |
19.0% |
21 |
Stage II |
90% |
10.0% |
20 |
Stage III |
83.3% |
16.7% |
6 |
Stage IV |
|
| المناقشة Discussion |
إن أول من وثق وجود أضداد للبروتين p53 البشري هو Crawford et al. عام 1982 في مصول 9% من مريضات سرطان الثدي (18). ثم تتابعت الدراسات عن أضداد p53 في الأورام المختلفة ومن بينها سرطان القولون والمستقيم. ففي عام 1997 وجد et al. Hammel أضدادp53 بنسبة %26 (14 مريضاً من أصل 54 مريض سرطان قولون ومستقيم CRC)، بينما كان المرضى المصابين بأمراض هضمية غير خبيثة سلبيي أضداد p53 (19). وفي عام 2001 وجد Tang R et al.هذه الأضداد بنسبة %13 (130 مريضاً من بين 998 مريضاً CRC)، وعند أقل من 1% من مرضى السلائل (20). وفي عام 2004 وجد Lechpammer et al. أضداد p53 بنسبة 18% (37 مريضاً من أصل 220 مريضاً CRC)، بينما كان 42 شخصاً سليماً سلبيي أضداد p53 (21). وفي دراستنا جرى كشف أضداد p53 في مصول 14% من مرضى سرطان القولون والمستقيم (8 مرضى من أصل 57 مريضاً CRC)، ولكن لم تكشف هذه الأضداد عند أي مريض من مرضى الأمراض الحميدة للقولون والمستقيم أو المجموعة الشاهدة، وذلك بفارق ذي أهمية إحصائية p<0.05. وتوافقت دراستنا مع الدراسات السابقة بأن أضداد p53 هي واصم نوعي لمرضى سرطان القولون والمستقيم باختلاف نسب تواتر أضداد p53. يعزى ذلك إلى عدم وجود بروتين p53 لا وظيفي لدى مرضى الأمراض الحميدة للقولون والمستقيم أو المجموعة الشاهدة، بينما يؤدي تراكم بروتين p53 اللا وظيفي لدى مرضى سرطان القولون والمستقيم إلى تحريض الجملة المناعية على تشكيل أضداد ضد هذا البروتين ويجري كشفها في مصول هؤلاء المرضى. إن تنوع طرق المعايرة المستخدمة لمقايسة أضدادp53 يمكن أن يفسر الاختلاف في تواتر أضداد p53. حيث إن أحد أكثر المعايير أهمية هو المستضد المستخدم في هذه المقايسات. ويستخدم في طريقة ELISA مستضد p53، الذي إما أن يُصّنع جرثومياً أو أن يكون ببتيدات صنعية تتكون من 15 حمضاً أمينياً أو أن يكون p53 مستخلصاً من خلايا ورمية بشرية ويعد مستضد p53 الذي يعبر عنه في الخلايا الورمية البشرية أفضل من مستضد p53 الذي يعبر عنه في الجراثيم (16). وهذا الأخير هو الذي جرى استخدامه في مقايسة أضداد p53 في دراستنا من أجل الحصول على نتائج دقيقة.
بينت دراستنا أن المرضى إيجابيي أضداد p53 كانوا أكبر عمراً من المرضى سلبيي أضداد p53 بفارق يعتد به احصائياًً (p<0.05) وتوافقت دراستنا مع دراسة Tang R. وزملائه عام 2009 (22).
بينت دراستنا أن توزع أضداد p53 مستقل عن جنس المريض والتدخين، حيث كانت قيمة p>0.05، وتوافقت مع دراسة Tang R. وزملائه عام 2001 وعام 2009 (22,20).
بينت دراستنا أن توزع أضداد p53 مستقل عن مرحلة الورم (حسب تصنيف TNM) حيث كانت قيمة .p>0.05 وتوافقت مع دراسة Tang R. وزملائه عام 2001 وعام 2009 (24,22).
بينت دراستنا أن توزع أضداد p53 مستقل عن توضع الورم (قولون، مستقيم)، حيث كانت قيمة .p>0.05 ولم تتوافق مع دراسة Tang R. وزملائه عام 2009، التي وجدت أن المصل الإيجابي أكثر ارتباطاً مع سرطان المستقيم. يمكن أن يعزى ذلك إلى الاختلاف في المنشأ المضغي لأجزاء متعددة من القولون والمستقيم، واختلاف جريان الدم ما بين سرطان القولون وسرطان المستقيم والذي يؤثر على الاستجابة الخلطية وتشكيل أضداد p53.
|
| المراجع References |
1-Michael M. and Henry MB.
Large bowel including appendex.
Clinical surgery. W.B. Sanders, 343-361, 2001.
2-Wilding J; Straub J; Bee J; Churchman M; Bodmer W; Dickson C; Tomlinson I. and Ilyas M.
Genetic pathways in colorectal and other cancers.
Eur J Cancer, 35: 1986-2002, 1999.
3-Pietenpol JA. and Vogelstein B.
Tumor suppressor gene. No room at the p53 inn.
Nature, 365: 176-180, 1993.
4-Waga S; Hannon GJ. and Beach D.
The p21 inhibitor cyclin-dependent kinases controls DNA replication by intraction with PCNA.
Nature, 369: 574-578, 1994.
5-Yonish M. and Rouach E.
The Tumor suppressor gene. A mediator of a G1 growth arrest and of apoptosis.
Experientia, 52: 1001, 1996.
6-Lane DP.
p53 guardian of the genome.
Nature, 358: 15-16, 1992.
7-Soussi T; Legros Y. and Lubin R.
Multifactorial analysis of p53 alteration in human cancer.
Int J Cancer, 57: 1-9, 1994.
8-Levine AJ.
The p53 protein and its interactions with the oncogene products of the small DNA tumor viruses. Virology, 177: 419-426, 1990.
9-Cordon-Cardo C; Latres E. and Drobnjak M.
Moleculare abnormalities of mdm2 and p53 genes in adult soft tissue sarcomas.
Cancer Res; 54: 794-799, 1994.
10-Moll UM; Riou G. and Levine AJ.
Tow distinct mechanisms alter p53 in breast cancer. Mutation and nuclear exclusion.
Proc Nalt Acad Sci USA, 89: 7262-7266, 1992.
11-Fuju C; Stina S. and Kari S.
Implications of the p53 tumor-suppressor gene in clinical oncology.
Journal of Clinical Oncology, 13(4): 1009, 1995.
12-Angelopoulou K; Yu H; Bharaj B; Giai M. and Diamandis PE.
P53 gene mutation tumor P53 Protein Overexpression, and serum P53 autoantibody generation in patients with breast cancer.
Clinical Biochemistry, 33(1): 53-62, 2000.
13-Montenarh M. and Gotz C.
P53 autoantibodies and human malignancies.
4: 991-1010, 1997.
14-Davidoff AM; Iglehart JD. and Marks JR.
Immune response to P53 is dependent upon p53 HSP 70
complexes in breast cancer.
Proc Natl Acad Sci; 89: 3439-3442, 1992.
15-Hainaut P; Soussi T; Shomer B; Hollstein M; Greenblant M; Hoving E; Harris CC. and Montesano R.
Database of p53 gene somatic mutations in human tumors and cell lines; Updated complication and future prospect.
Nucleic acids Res; 25: 151, 1997.
16-Soussi T.
p53 Antibodies in the Sera of Patients with Various Types of Cancer.
Cancer research, 60: 1777-1788, 2000.
17-Hassapoglidou S; Diamandis EP. and Sutherland DJA.
Quantification of p53 protein in tumor cell lines, breast tissue extracts and serum with time. Resolved immunofluorometry Oncogene, 8: 1501, 1993.
18-Crawford L.V; Pim D.C. and Bulbrook R.D.
Detection of antibodies against the cellular protein p53 in sera from patients with breast cancer.
Int. J. Cancer, 30: 403-408, 1982.
19-Hammel P; Boissier B; Chauumette M; Piedbois P. and Soussi T.
Detection and monitoring of serum p53 antibodies in patients with colorectal cancer.
GUT; 40(3): 356-361, 1997.
20-Tang R; Ko MC; Wang JY; Changchien CR; Chen HH; Chen JS. and Hsu KC.
Humoral response to p53 in human colorectal tumers.
Int. J. Cancer, 94: 859-863, 2001.
21-Lechpammer M; Lukac J; Lechpammer S; Kovacevi? D; Loda M. and Kusi? Z.
Humoral immune response to p53 correlates with clinical course in colorectal cancer patients during adjuvant chemotherapy.
Int J Colorectal Dis; 19(2): 114-120, 2004.
22-Tang R; Yeh CY; Wang JY; Changchien CR; Chen JS; and Hsieh LL.
Serum p53 as tumer marker for follow-up of colorectal cancer after curative resection.
Ann Surg Oncol; 16(9): 2516-23, 2009.
|
| |
| |
| |
| المجلد 5 ,
العدد 9
, شوال 1431 - تشرين أول (أكتوبر) 2010 |
|
|
|
