| الملخص Abstract |
| إن تعدد أشكال النوكليوتيد المفرد Single nucleotide polymorphism (SNP) عبارة عن اختلاف أو تبدل جيني صغير، يمكن أن يحدث ضمن متوالية الـ DNA. يحدث اختلاف تعدد أشكال النوكليوتيد المفرد عندما يتم استبدال نوويد مفرد بآخر كاستبدال النوكليوتيد A بالنوكليوتيد C أو G أو T. وبتعيين هوية معظم الـ SNPs البالغ عددها عشرة ملايين والمتوقع حدوثها في المجين البشري، فإن مشروع الخريطة الفردانية الدولية International HapMap هو استعراض الأساس لجزء كبير من التنوع الجيني بين الأنواع البشرية. يمكن للـ SNPs أن تؤثرعلى اختطار الفرد للإصابة بالمرض أو تؤثر على استجابته للأدوية. بالإضافة إلى التبدلات في الجينات المفردة والتي تؤثر على اختطار الإصابة بالمرض، فإنه يعتقد بوجود توليفات خاصة للـ SNPs متوضعة عبر جينات متعددة تساهم في إحداث حالة من التأهب للإصابة بحالات مرضية. يعتقد كذلك بأن الـ SNPs تشكل الأساس للاختلاف الفردي في ما يتعلق بالاستجابة للمعالجة الطبية. تعد دراسة التبدلات الجينية المتمثلة بالـ SNPs ذات قيمة كبيرة في مجال الأبحاث الطبية الحيوية، وتطوير منتجات صيدلانية، وفي مجال التشخيص الطبي. |
| A single nucleotide polymorphism (SNP) is a small genetic change, or variation, that can occur within a DNA sequence. SNP variation occurs when a single nucleotide, such as an A, replaces one of the other three nucleotide letters-C, G, or T. By identifying most of the approximately 10 million SNPs estimated to occur in the human genome, the international HapMap project is identifying the basis for a large fraction of the genetic diversity in the human species. SNPs can affect an individual's risk of disease or response to drugs. In addition to changes in single genes that affect disease risk, it is thought that particular combinations of SNPs located across multiple genes contribute to a predisposition to developing medical conditions. SNPs are also believed to underlie individual variation in response to medical treatment. The study of SNPs is a great value for biomedical researches, development of pharmaceutical products and medical diagnostics |
| المقدمة Introduction |
بعد الانتـهاء من مشـروع المجيـن البشـري Human genome project، الحدث الهام الذي تم انجازه في مجال علم الحياة، فإن الموضوع الهام الذي يركز عليه في الوقت الحاضر يتمثل بالفهم التام لبنية Structure، تعضي Organization، تنظيم regulation، ووظيفة Function المجين البشري.
تظهر مقارنة المتواليات المجينية Genomic sequences لشخصين من الجنس نفسه ولا يمتان بأية صلة لبعضهما البعض وجود تطابق بحدود %99.9 (1). تنشأ الاختلافات الجينية Genetic variations والتي تتمثل بنسبة %0.1 بشكل رئيسي من وجود أحد أشكال الاختلافات الجينية التي تدعى تعدد أشكال النوكليوتيد المفرد Single nucleotide poly-morphisms (SNPs) والتي تشكل حوالي %90 من الاختلافات الجينية البشرية. تعتبر الـ SNPs شكلاً شائعاً جداً من الطفرات التي تحدث في المجين، وهي الآن من أكثر مواضيع الأبحاث المتعلقة بالمجين البشري شيوعاً (1).
إن تعدد أشكال النوكليوتيد المفرد عبارة عن اختلافات أو تبدلات جينية صغيرة تحدث ضمن تسلسل الحمض الريبي النووي منقوص الأكسجين Deoxy ribonucleic acid
(DNA) (2).
تتمثل نوعية الراموز الجيني Geneti code بوجود أربعة من النيكليوتيدات والتي ترمز بالأحرف A، T، C، G تبعاً للأساس الآزوتي الذي يدخل في تركيبها (Guanine, Cytosine, Thymine, Adenine) (الشكل 1).
يحدث تعدد أشكال النوكليوتيد المفرد عندما يستبدل نوكليوتيد مفرد بأخر كاستبدال النوكليوتيد A بالنوكليوتيد C أو G أو T (3) (الشكل 2).
يبدل الـ SNP على سبيل المثال متوالية الـ
DNA من AAGGCTAA إلى ATGGCTAA.
يعد التبدل الجيني عبارة عن SNP عندما يحدث بنسبة %1 على الأقل من تعداد السكان. تعد الـ SNP ثابتة بشكل كبير ولا تتبدل كثيراً من جيل لآخر مما يمكن من تتبعها في الدراسات السكانية.
يقدر عدد الـ SNP بحوالي 10 ملايين توجد ضمن 3 بليون من النوكليوتيدات التي تشكل الجينوم البشري (4، 5).
يحدث اثنان من كل ثلاثة SNPs نتيجة استبدال الأساس السيتوزين Cytosine (C) بالأساس التيمين Thymine (T). يرمز حوالي %5-3 فقط من متوالية الـ DNA اصطناع البروتينات، وعليه فإن معظم الـ SNPs توجد خارج المتواليات المرمزة (6، 7، 8). تحظى الـ SNPs التي توجد ضمن المتوالية المرمزة باهتمام الباحثين لكونها على الغالب تبدل من الوظيفة الحيوية للبروتين.
|
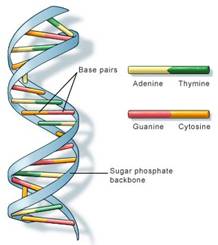
الشكل 1 : بنية الحمض الريبي النوووي منقوص الأكسجين.
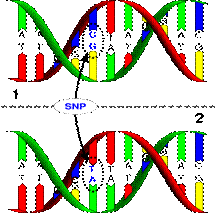
الشكل 2 : طريقة تشكل تعدد أشكال النوويد المفرد.
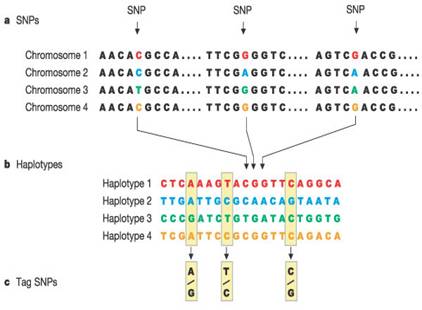
الشكل 3 : انشاء خريطة الانماط الفردانية يتم بخطوات ثلاثة: -aيجري تعيين هوية الـ SNPs في عينات الـ DNA للعديد من الأشخاص. -b يجري تجميع الـ SNPs التي يتم توريثها معاً في ما يعرف بالأنماط الفردانية. -cيجري بعدها تعيين هوية الـ SNPs البطاقة ضمن خريطة الأنماط الفردانية، والتي تعين هوية الأنماط الفردانية. عن طريق التنميط الجيني للـ SNPs البطاقة الموضحة في هذا الشكل يمكن تعريف أي من الأنماط الفردانية الأربعة الموضحة في الشكل توجد عند كل شخص.
|
| تعدد أشكال النوكليوتيد المفرد والأنماط الفردانية SNPs and Haplotypes |
| يجري توريث مجموعات من الـ SNP الموجودة على الصبغيات ضمن تجمعات من النوكليوتيدات يتراوح عددها بين 20.000-10.000 نوكليوتيد تعرف باسم الأنماط الفردانية Haplotypes (9). إن تقصي وجود عدد قليل من الـ SNP يمكن أن يفيد في تحليل تتالي العديد من النوكليوتيدات التي تحيط بها. تفيد المقارنة بين الأنماط الفردانية للأشخاص الأصحاء والأشخاص المرضى في تحديد أي من الجينات يكون وجودها مترافقاً مع حدوث الأمراض (10) (الشكل 3). |
بدأت قبل سنوات قليلة العديد من مجموعات عمل من العلماء حول العالم بوضع خريطة لتحديد مواقع مليون من الـ SNPs الموجودة ضمن المجين البشري ولتحديد هوية الأنماط الفردانية المرافقة.
قدمت خريطة الأنماط الفردانية HapMap فهرساً أو قائمة بالتبدلات الجينية الشائعة التي تحدث في الكائنات البشرية. تصف الخريطة السابقة طبيعة التبدلات الجينية، المكان من الـ DNA الذي تحدث فيه هذه التبدلات، وكيفية انتشارها بين أفراد المجموعة السكانية الواحدة وبين المجموعات السكانية في أجزاء مختلفة من العالم.
لا يستخدم مشروع خريطة الأنماط الفردانية الدولي المعلومات الموجودة في هذه الخريطة لإيجاد العلاقة بين تبدلات جينية خاصة والأمراض وإنما لتزويد الباحثين بمعلومات يمكن استخدامها لإيجاد علاقة بين التبدلات الجينية ومخاطر الإصابة بأمراض نوعية مما يمكن من إيجاد طرق جديدة لمنع، تشخيص ومعالجة المرض.
للبدء بالمشروع السابق، والذي عرف بمشروع HapMap الدولي International HapMap project فإن العلماء قاموا باستخلاص الـ DNA من دماء 296 من الأشخاص المتطوعين من نيجيريا، الصين، اليابان، والولايات المتحدة الأمريكية، والتي أظهرت الدراسات بأن سكان تلك الدول يملكون النسبة العظمى من تبدلات الأنماط الفردانية المختلفة والموجودة عند البشر. عن طريق تحديد وجود الـ SNPs في كل 5000 نوكليوتيد من الأفراد المتطوعين، تمكن الباحثون من وضع خريطة مفصلة للأماكن التي تحدث فيها التبدلات الجينية في كل صبغي من الـ 46 صبغي عند الإنسان (11). تتوالى في الوقت الحاضر الجهود لتقصي DNA المتطوعين من التجمعات البشرية الأخرى حول العالم لتحديد مواقع SNP إضافية. يعتقد العلماء بأن خارطة الـ SNPs سوف تساعد في تحديد هوية العديد من الجينات التي تتشارك مع حدوث الأمراض المعقدة مثل السرطان، السكري، الأمراض الوعائية وبعض أشكال الأمراض العقلية.
عن طريق تعيين هوية معظم الـ SNPs البالغ عددها عشرة ملايين والمتوقع حدوثها في المجين البشري فإن مشروع الخريطة الفردانية الدولية سوف يوضح الأساس لجزء كبير من التنوع الجيني بين الأنواع البشرية.
إن اختبار جميع الـ SNPs البالغ عددها عشرة ملايين والموجودة في الصبغيات يعد مكلفاً جداً. وسيساعد تطوير الخارطة الفردانية HapMap في فهم طريقة توضع الـ SNPs وبقية الاختلافات الجينية في الصبغيات. تميل الاختلافات الجينية والتي تتوضع بالقرب من بعضها البعض لأن تورث معاً. على سبيل المثال فإن جميع الأشخاص الذي يملكون الأساس A أكثر من G في موقع معين من الصبغي يملكون تبدلات جينية متطابقة بالنسبة لبقية منطقة الصبغي التي تحيط بالأساس A. إن هذه المناطق من التبدلات الجينية المرتبطة تعرف بالنمط الفرداني Haplotype (11).
في أجزاء عديدة من الصبغيات فإن عدداً قليلاً من الأنماط الفردانية يوجد في الإنسان. في تجمع من السكان فإن %55 من الأشخاص يملكون نسخة واحدة من النمط الفرداني، %30 يملكون نسخة ثانية من النمط الفراداني، %8 يملكون نسخة ثالثة، والبقية من الأفراد تملك أنماطاً فردانية أقل شيوعاً.
إن مشروع الخارطة الفردانية الدولي يعرف هذه الأنماط الفردانية الشائعة في التجمعات الأربعة من الأفراد من أجزاء مختلفة من العالم. يعرف هذا المشروع أيضاً الـ SNPs البطاقة tag SNPS، الذي يميز هذه الأنماط الفردانية. عن طريق تحري وجود الـ tag SNPS الشخصي، العملية التي تعرف بالتنميط الجيني Genotyping فإن الباحثين سوف يكونون قادرين على تعريف مجموعه من الأنماط الفردانية في DNA الشخص (الشكل 3). إن عدد الـ tag SNPS، والذي يحوي معظم المعلومات حول أنماط التبدلات الجينية يبلغ حوالي 600000-300000 وهو عدد أقل بكثير من العشرة ملايين من SNPs الشائعة (9).
حالما تصبح المعلومات حول الـ tag SNPS، والتي يمكن الحصول عليها من الخارطة الفردانية، متوافرة فإن الباحثين سوف يكونون قادرين على تحديد مواقع الجينات المسؤولة عن الصفات الهامة طبياً.
تعمل العديد من المجموعات لإيجاد الـ SNPs ورسم خريطة للمجين البشري. من تلك المجموعات مجموعة مشروع المجين البشري الامريكية U.S. Human Genome Project (HGP) ومجموعة كبيرة أخرى مؤلفة من العديد من الشركات الدوائية تدعى SNP consortium أو مشروع TSCTSC project(11).
بالإضافة إلى أبحاث علم تأثير الأدوية الجيني، الأبحاث التشخيصية، الأبحاث الطبية الحيوية فإن خريطة الـ HapMap سوف تساعد في تحديد هوية العديد من الواصمات الإضافية على طول المجين البشري (9).
يتمثل التحدي التالي للعلماء باستخدام المعلومات البدئية المتعلقة بخريطة HapMap وترجمتها إلى طرق تعتمد على المجين بهدف مقاومة الأمراض.
|
| - الـ SNPs وتشخيص المرض SNPs and Disease Diagnosis |
تعزى العديد من الأمراض كالسرطان والأمراض القلبية إلى منشأ جيني يؤثر بشكل كبير على نشوء المرض، وتطوره، وعلى الاستجابة للمعالجة.
لا تحدث العديد من الأمراض الشائعة عند الإنسان بسبب تبدلات جينية في جين مفرد وإنما تتأثر بالعديد من التاثرات بين العديد من الجينات وبالعديد من العوامل البيئية والعوامل المتعلقة بنمط الحياة. بسبب الصعوبة في تقييم دور العوامل البيئية والعوامل المتعلقة بنمط الحياة على عملية نشوء المرض فإن الجهود تتوجه نحو التركيز على التأهب الجيني Genetic predisposition، أو على إمكان الفرد لتطوير حدوث مرض يعتمد على الجينات وعلى العوامل الوراثية Hereditary factors. تؤثر العوامل الجينية على الاستعداد للإصابة أو مقاومة الأمراض وعلى درجة اختطار أو تطور المرض. إن عدم معرفة العوامل جميعها التي تتعلق بالمسالك الجينية المعقدة فإن الباحثين يجدون صعوبة في تطوير اختبارات تقصي لمعظم الأمراض والاضطرابات.
عن طريق دراسة أجزاء الـ DNA التي تحوي الـ SNP المترافقة مع خلة Trait المرض فإن الباحثين بدأوا باكتشاف الجينات المترافقة مع حدوث المرض (الشكل 4).
إن تحديد وفهم دور العوامل الوراثية في حدوث المرض سوف يسمح للباحثين بتقييم أفضل لدور العوامل غير الجينية Non-genetic factors كالسلوك، الغذاء، نمط الحياة والفعالية الفيزيائية في حدوث المرض.
تحوي المادة الوراثية للشخص على طراز متميز من الـ SNPs والذي يتشكل اعتباراً من العديد من التبدلات الجينية. وجد الباحثون بأن معظم الـ SNPs ليست مسؤولة عن إحداث المرض. بدلاً من ذلك فإن الـ SNPs تخدم كواصمات حيوية Biological markers لتحديد المرض على خارطة المجين البشري بسبب كون الـ SNPs تتوضع بالقرب من الجين الذي يترافق مع حدوث مرض معين (9). تساعد الـ SNPs في تحديد احتمال كون الشخص سيصاب بمرض معين. يعد apolipoprotein E أو ApoE أحد الجينات التي تترافق مع مرض ألزهايمر Alzheimer disease مثالاً جيداً عن كيفية تأثير الـ SNPs على تطور المرض. يحتوي هذا الجين على اثنين من الـ SNPs مما يؤدي إلى وجود ثلاثة من الآلائل Alleles المحتملة لهذا الجين تتمثل بـ E2، E3، وE4. يختلف كل أليل عن الآخر بأساس واحد وبالتالي فإن البروتين الناتج عن كل جين سوف يختلف بحمض أميني واحد. يرث كل شخص نسخة واحدة من ApoE من الأم ونسخة واحدة من ApoE من الأب. أظهرت الأبحاث بأن الشخص الذي يرث على الأقل أليلاً واحد E4 سوف يملك الفرصة للإصابة بمرض الزهايمر. بشكل واضح فإن الاختلاف في حمض أميني واحد في البروتين سوف يبدل من بنيته ووظيفته بشكل كاف لإحداث المرض. عندما يرث الفرد الأليل E2 فإن الاحتمال يكون أقل لإصابته بالمرض. إن الـ SNPs لا تعد مشعرات مطلقة للإصابة بالمرض، فقد يملك الشخص اثنان من الالليلات E4 ولا يصاب أبدا بالمرض بينما يصاب بالمرض شخص آخر يملك الألليلين .E2 إن الجين ApoE هو واحد من الجينات ذات العلاقة بمرض ألزهايمر (12). بشكل مشابه للاضطرابات المزمنة الشائعة مثل الأمراض القلبية، السكري، أو السرطان، فإن مرض ألزهايمر مرض يمكن أن يحدث بتأثير التبدلات في العديد من الجينات. إن الطبيعة متعددة الجين لهذه الاضطرابات تجعل من الاختبار الجيني لمثل هذه الأمراض أمراً معقداً. عندما تكون الـ SNPs أحياناً مسؤولة فعلياً عن حدوث المرض فإنه يمكن استخدامها للبحث عن الجين المسبب للمرض وعزله.
لإيجاد اختبار جيني يخدم لتحري المرض الذي يكون فيه الجين المسبب قد جرى تعيين هويته، فإن العلماء يجمعون عينات الدم من مجموعة من الأشخاص المصابين بالمرض ويجري تحليل الـ DNA لتحديد طراز الـ SNP. يقارن العلماء بعدها الطراز المحدد مع الطراز المحدد لأشخاص غبر مصابين بالمرض والناتج عن تحليل الـ DNA التابع لهم. يسمى هذا النمط من المقارنة دراسة الترابط أو المشاركة Association study والذي يستطيع تحديد الاختلافات بين طرازات الـ DNA لمجموعتين وبالتالي يحدد أي طراز يتشارك مع الجين المسبب للمرض. إن أنماط الـ SNPs والتي تكون مميزة للعديد من الأمراض سوف يجري إنشاؤها بحيث تمكن الأطباء من تحري قابلية الأشخاص للإصابة بالمرض عن طريق تحليل عينات الـ DNA للكشف عن العديد من نماذج الـ SNP النوعية (10).
|
| - الـ SNPs وتطوير الدواء SNPs and Drug Development |
على الرغم من أن نسبة كبيرة من الأشخاص تستجيب بشكل جيد للأدوية التي توصف لها، إلا أن نسبة أقل لا تستجيب لها وعليه فإن العديد من الأدوية التي تفيد في معالجة مثل هؤلاء المرضى لا تجد طريقاً للإنتاج والتسويق. لا يوجد حالياً طريقة بسيطة لتحديد طريقة استجابة المريض للمعالجة بأدوية خاصة? فقد تكون المعالجة الدوائية فعالة في مريض معين ولكنها غير فعالة في آخر، وقد يبدي بعض المرضى تفاعلات مناعية ضائرة Adverse immunologic reactions لأدوية خاصة أو أنهم يعانون من استجابة مهددة للحياة أو حتى الموت بسبب تفاعلات الدواء الضائرة Adverse drug reactions (ADRs) والتي تعد بأنها السبب في وفاة الآلاف من الأشخاص سنوياً (13).
في المستقبل فإن معظم الأدوية الملائمة للفرد والضرورية للمعالجة سوف يتم تحديدها اعتماداً على تحليل طراز الـ SNP الخاص بكل مريض (الشكل 5). إن استهداف الدواء لجعله ملائماً لأشخاص معينين سيكون مفيداً وهو ما يشار إليه بجعل الدواء فردياً (زبونية الدواء) Personalized medicine والذي سيمكن الشركات الدوائية من إنتاج العديد من الأدوية التي تسمح للأطباء بوصف معالجات خاصة بكل مريض، تكون نوعية تبعاً لحاجة المريض (14).
تؤثر العوامل الجينية على استجابة الشخص للمعالجة الدوائية، لذلك فإن تعدد أشكال الـ DNA DNA polymorphism مثل الـ SNPs سوف يكون مفيداً في تحديد وفهم الاختلاف في قابلية الأشخاص لامتصاص وطرح الدواء وفي تحديد السبب الذي يمكن بسببه أن يعاني الشخص من تفاعلات جانبية ضائرة لدواء معين.
يعد الاكتشاف الحديث للـ SNPs بإحداث ثورة ليس فقط على مستوى تحديد طريقة حدوث المرض، ولكن أيضاً على مستوى ممارسة الطب الوقائي والعلاجي Preventative and curative medicine.
إن الجهود التي تبذل في مجال الـ SNPs سوف تستخدم كأساس لعلم تأثير الأدوية الجيني Pharmacogenomics، المجال الجديد من العلوم الذي يسعى إلى جعل الدواء شخصياً، عن طريق إعطاء الدواء الصحيح، الجرعة الصحيحة إلى الشخص المحدد وفي الوقت الصحيح (15).
تتسابق الشركات الدوائية في الوقت الحاضر لتطبيق نظم جديدة فيما يتعلق بالمجين البشري من أجل تعريف أهداف جديدة وجعلها ذات دور فعال. إن مشروع الـ SNPs سيزود بفهم أساسي للعديد من الأمراض متعددة المنشأ الجيني Polygenic diseases وبالتالي التعريف بأهداف علاجية جديدة. الهدف الهام الآخر يتمثل بتعيين هوية مثل هذه الـ SNPs والتي تترافق مع تأثيرات حيوية هامة في ما يتعلق بالاستجابة للأدوية.
|
| الاستنتاج Conclusion |
|
مما سبق يمكن القول بأن الاختلافات الجينية المتمثلة بالـ SNPs تعد احد العوامل الرئيسية لوجود اختلاف بين الأفراد. بالإضافة إلى ذلك فإن مثل هذه الاختلافات تملك تأثيراً كبيراً على كيفية الاستجابة للأمراض والأضرار البيئية المتمثلة بالجراثيم، الفيروسات، المواد الكيميائية، الأدوية والعلاجات الأخرى جاعلاً من الـ SNPs قيمة كبيرة في مجال الأبحاث الطبية الحيوية، تطوير منتجات صيدلانية، وفي مجال التشخيص الطبي.
|
| المراجع References |
1-Goldstien D.B. et al.
Genomics: understanding human diversity.
Nature; 437: 1241-1242, 2005.
2-SNP and genotyping overview.
www.perkinelmer.com.
3-Barnes M.R.
Human genetic variation: databases and concepts.
Bioinformatics for geneticists. Chapter; 3, 2003.
4-Sherry S.T. et al.
dbSNP: the NCBI database of genetic variation.
Nucleic Acids Research; 29: 308-311, 2001.
5-The human project and genomic research.
www.ghr.nlm.nih.gov.
6-Wolfgang S.
The human genome project, pharmacogenomics.
BMJ; 319: 1286, 1999.
7-Berger J. et al.
Genetic mapping with SNP markers in Drosophila.
Nat Genet; 29: 475-481, 2001.
8-Hoskins R.A. et al.
Single nucleotide polymorphism markers for genetic. mapping in Drosophila melanogaster.
Genome Res; 11: 1100-1113, 2001.
9-Developing a haplotype map of a human genome for finding genes related to health and disease, 2001.
www.genome.gov.
10-Sellick G.S. et al.
Genome-wild linkage searches for Mendelian disease loci can be efficiently conducted using high-density SNP genotyping arrays.
Nucleic Acids Res; 32(20): 164, 2004.
11-The international HapMap consortium. A haplotype gene expression by regional and genome-wide association.
Nature; 437: 1356-1369, 2005.
12-John S. et al.
Whole-Genome scan, in a complex disease, using 11.
Am. J. Hum. Genet; 75:54-64, 2004.
13-Lazarou J.B.H. et al.
Incidence of adverse drug reactions in hospitalized patients: a meta-analysis of prospective studies.
JAMA; 279: 1200-1205, 1998.
14-Pharmacogenetics; Personalized medicines.
www.carthage.edu.
15-IT-enabled prototype psychiatric pharmacogenomics tool.
www.medgadget.com.
|
| |
