| الملخص Abstract |
| الخلفية: إن البروتين كيناز CK2 الذي عُرف سابقاً باسم كازئين كيناز Casein Kinaseهو بروتين كيناز مُعبّر عنه بشكل شائع. وإن فاعليته والتعبير عنه كبروتين كيناز تتعلق بشكل وثيق بالتكاثر، أي أن الخلايا المتكاثرة بشكل سريع لديها مقادير عالية من الإنزيم وتكون فاعليته فيها بشكل عام أعلى من فاعليته في الخلايا السوية.
يتألف البروتين كيناز CK2 من وُحيدتين منظمتين β Regulatory β subunits)) و وحيدتين تحفيزيتين α، ά (Catalytic ά, α subunits)، إلا أن هذه الوُحيدات توجد أيضاً بشكلها الحر. على الرغم من أن التعبير عن CK2 يجري في كل نسيج، لكن توجد بعض الاختلافات في مستوى التعبير عنه في النسج المختلفة. يُعَبّر بشدة عن الوُحيدة CK2ά في الدماغ والخصى، بينما وجدت مقادير قليلة فقط في بقية الأنسجة. إن الوُحيدة المنظمة β والوُحيدة المحفزة α كلاهما ضروريان بشكل مطلق لبُقيا الخلايا، لأن الاقتطاعات Knockouts تكون مميتة خلال تخلق المضغة Embryogenesis. تكون الفئران مقتطعة الوُحيدة CK2ά عيوشةً Viable بينما تكون الفئران الذكر عقيمة.
المواد والطرق: شملت هذه الدراسة 83 رجلاً، منهم 17 رجلاً منجباً و 66 رجلاً يعانون مشاكل عقم مجهول السبب. جرى الحصول على عينات المني المطلوبة من وحدة الإخْصَابٌ في المُخْتَبَر (طفل الأنبوب). استخلِصت النطاف وعُين محتواها البروتيني. حُمِلّت مقادير متساوية من البروتين على هلامة بولي أكريلاميد بوجود سلفات دودوسيل الصوديومSDS- polyacrylamide . بعد تلطيخ ويسترن Western blotting، كُشفت الوُحيدات CK2α، CK2ά،CK2β ، بوساطة أضداد نوعية.
النتائج: كانت النسبة المئوية لوجود الوُحيدة الدوينية ά للبروتين كيناز CK2 %12.1 لدى مجموعة الرجال العقيمين، وهي أقل لدرجة يُعتد بها مقارنةً مع مجموعة الشاهد، والتي كانت النسبة فيها %100.
الاستنتاج: إن غياب الوُحيدة CK2ά من النطاف، يمكن استخدامه كواصم لاستعراف العقم الذكري مجهول السبب.
|
Background: Protein kinase CK2 which was formerly known as casein kinase is a ubiquitously expressed protein kinase. Its expression and its activity as a protein kinase is closely connected with proliferation i.e. rapidly proliferating cells have high amounts of the enzyme and its activity in general higher than in normal cells.
Protein kinase CK2 is composed of two regulatory β subunits and two Catalytic α, ά subunits, but these subunits are also found in its free form. Although CK2 is expressed in every tissue, there are some differences in the expression level in various tissues. CK2ά is most highly expressed in brain and testes whereas only low amounts of CK2ά are found in other tissues. The regulatory β subunit and the catalytic α subunit are both absolutely necessary for the survival of cells, because the Knockouts are lethal during embryogenesis. Mice with a CK2ά Knockout are viable however the male mice are infertile.
Materials and Methods: 83 men were involved in this study, they were 17 normal men and 66 men with idiopathic infertility problems. Required sperm samples were obtained from an in vitro fertilization unit. The sperms were extracted and their protein content is determined. Equal amounts of protein will be loaded on SDS-polyacrylamide gel. After a Western Blotting, the CK2ά, CK2α and CK2β subunits were detected by specific antibodies.
Results: the presence percentage of CK2ά was 12.1% in infertile men group, and it was significantly lower compared to control group, which was 100 %.
Conclusion: the absence of CK2ά from the sperm would be used as a marker for the identification of idiopathic men infertility.
|
| مقدمةIntroduction |
يعد البروتين كيناز CK2 (المعروف سابقاً بالكازئين كيناز Casein Kinase) إنزيماً واسع الانتشار (1)، مؤلفاً من سيرين/ تريونين، وهو يفسفر مئات الركائز المختلفة (2). ونظراً للتزايد المستمر في عدد الركائز الفيزيولوجية للبروتين كيناز CK2، أصبح من الواضح أنه إنزيم أساسي لعيوشة الخلية cell Viability (3)، وهو يلعب دوراً في تنظيم العمليات الخلوية الأساسية مثل اصطناع tRNA، وrRNA، وتضاعف الدناDNA Replication ، والانتساخ Transcription، والاستماتة Apoptosis، وبُقيا الخلية (4).
يتألف البروتين كيناز CK2 من وحيدتين منظمتين β Regulatory β subunits)) ووحيدتين تحفيزيتين α، ά (Catalytic α, ά subunits). وتتواجد هذه الوُحيدات الفردية في الخلية مرتبطة إلى البروتينات الخلوية الأخرى، أو بشكل غير مرتبط. توضحت الملامح البنيوية للوُحيدات الفردية وبنيتها ثلاثية الأبعاد لدى توفر مبحث البلورات بالأشعة السينية x-ray Crystallographic (5)، ويبين الشكل 1 هذه البنية.
إن وظيفة الوُحيدات المنظمة هي التنظيم بنوعيه الإيجابي والسلبي، والتعرف على نوعية الركازة، والثباتية. أما وظيفة الوُحيدات التحفيزية فهي الفعالية، وتمييز الموقع، والتثبيط بواسطة عديدات الشوارد (6) ويبين الشكل 2 هذه الوظائف.
إن العيب الأولي لاصطناع النطاف في الخصى Csnk2a2-/- هو شذوذ نوعي في الشكل الأمامي لرأس أرومة النطاف، وهي أول مورثة معروفة تنظم شكل رأس النطفة. وتكون الخلايا المنتشة مختلفة، فهي قادرة على الخضوع لتكثف الكروماتين Chromatin Condensation، كما أن العديد من الخلايا الشاذة تُحذف خلال الاستماتة أو بلعمة خلايا سيرتولي. قد يعبر القليل من الخلايا الشاذة إلى البربخ، مما يعزز الشذوذ في رأس النطاف بشكل مشابه لما هو ملاحظ لدى البشر. ولهذا تكون Csnk2a2 الجين المسؤولة عن هذه المتلازمات الموروثة. يجري التعبير عن الجين Csnk2a2، التي ترمز الوُحيدة CK2ά، بشكل مفضل في المراحل الأخيرة لاصطناع النطاف لدى الرجل والفأر، وتكون الذكور التي ليس لديها هذه الجين عقيمة، ويترافق ذلك بقلة في عدد النطاف Oligozoospermia، وبوجود نطاف ذات رأس مدور Globozoospermia (7).
نلاحظ الوحيدتين التحفيزيتين باللون الغامق والوحيدتين المنظمتين باللون الفاتح كما يظهر المطراف الأميني والمطراف الكربوكسيلي ومنطقة ربط ATP على الوُحيدة β، في حين يظهر في منطقة ربط ATP على الوُحيدة α المركب AMPPNP، وهو مُضاهِئ ATP غير مهدرج.
|
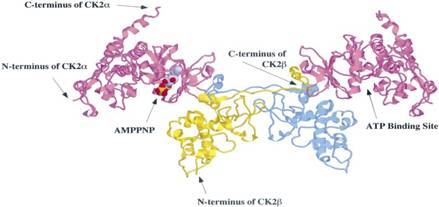
الشكل 1: الملامح البنيوية للوُحيدات الفردية وبنيتها ثلاثية الأبعاد
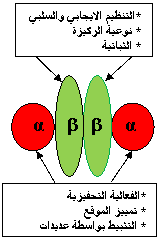
الشكل 2: بنية البروتين كيناز CK2 ووظائف وُحيداته. |
| هدف البحث |
| تنبع أهمية هذه الدراسة في تحري التعبير عن الوُحيدات الفردية الدوينية α، ά، β للبروتين كيناز CK2 في النطاف لدى الإنسان بطريقة مناعية. إذ يجري تحديد الرجال العقيمين تبعاً لوجود الوُحيدة CK2ά في نطافهم، وذلك باستخدام تقانة الرَحَلاَنٌ المَناعِيّImmuno-electrophoresis ، وهذا يعد هدفاً بحثياً للوصول إلى بروتوكولات علاجية للرجال المصابين بالعقم بأنماطه المختلفة. |
| المواد والطرق Methods Materials and |
جُمعت عينات السائل المنوي (المني) من رجال يعانون مشاكل عقم مجهولة السبب، يراجعون المستشفيات التخصصية أملاً بالإنجاب. طُبقت على العينات الطرق اللازمة لدراسة متثابتات السائل المنوي، وذلك خلال ساعة من الجمع. جرى استخلاص النطاف تحت شروط غير تمسخية من السائل المنوي، باستخدام دارئة Laemmli، تحوي سلفات دودوسيل الصوديوم SDS بتركيز %4. وضعت عينات السائل المنوي في أنابيب ايبندورف خاصة وجُمدت بالدرجة -80°م.
جرى في الخطوة الثانية فك التجميد، وحُدد تركيز البروتين في خلاصة الخلايا المنوية بتطبيق طريقة Bradford. تعد هذه الطريقة أساسية لمقارنة مقادير متساوية من البروتينات العائدة لمعطين مختلفين، لأجل التعبير عن الوُحيدات الدوينية للبروتين كيناز CK2، وخاصة الوُحيدة CK2ά. رُحّلت مقادير متساوية من البروتينات المستخلصة على هلامة البولي أكريلاميد بوجود سلفات دودوسيل الصوديومSDS- polyacrylamide. وطُبق تلطيخ ويسترن Western blot باستخدام غشاء PVDF. حُضن الغشاء بعد ذلك مع أضداد نوعية ضد الوُحيدات الفردية CK2ά، CK2β، CK2α للبروتين CK2. وقد يكون من الضروري إزالة الشوائب والبلازما الزائدة بتنبيذ السائل المنوي قبل استخلاص الخلايا المنوية. ويجب في كل حالة يجرى فيها تحليل للنطاف المأخوذة من المعطين الأصحاء، إجراء ذلك على التوازي مع الشاهد.
|
| مجموعات الدراسة |
شملت العينة المدروسة 83 رجلاً تتراوح أعمارهم بين 24 و 66 عاماً. جرى توزيع العينة المدروسة إلى عدة مجموعات تبعاً لما يلي:
1- مجموعة الأسوياء: شملت 17 رجلاً منجباً.
2- مجموعة المرضى الذين لديهم فقد نطاف تام Azoospermia وعددهم 4.
3- مجموعة المرضى الذين لديهم قلة في عدد النطاف Oligozoospermia وعددهم 11.
4- مجموعة المرضى الذين لديهم شذوذ في شكل النطاف Teratozoospermia وعددهم 5.
5- مجموعة المرضى الذين لديهم شذوذ في حركة النطاف Asthenozoospermia وعددهم 8.
6- مجموعة المرضى الذين لديهم قلة عدد وشذوذ في الشكل وعددهم 2.
7- مجموعة المرضى الذين لديهم قلة عدد وشذوذ في الحركة وعددهم 15.
8- مجموعة المرضى الذين لديهم شذوذ في الشكل والحركة وعددهم 5.
|9- مجموعة المرضى الذين لديهم قلة عدد وشذوذ في الشكل والحركة أي متلازمة (OAT) وعددهم 16.
|
| النتائج Results |
أولاً- مجموعة الأسوياء Normozoospermia
حيث جرى ترحيل للبروتينات المستخلصة من عينات السائل المنوي للشواهد الـ 17 عينة، فكانت النتيجة ظهور إشارات واضحة تمثل كلاً من الوُحيدات الثلاث للبروتين كيناز CK2 (كما في الشكلين 3 و 4).
ثانياً- مجموعة المرضى الذين لديهم فقد نطاف تام Azoospermia
عددهم 4، لم تظهر لديهم أي عصابات تدل على وجود أي من الوُحيدات الثلاث للبروتين كيناز CK2.
ثالثاً- مجموعة المرضى الذين لديهم قلة في عدد النطاف Oligozoospermia
عددهم 11، ظهرت لديهم الوُحيدة α للبروتين كيناز CK2 بشكل واضح، ظهرت أيضاً الوُحيدة β، لكن ليس لدى الجميع، حيث لم تظهر لدى المرضى في الأرقام 8، 9، 10، 11. أما بالنسبة للوُحيدة ά فعلى الرغم من أنه جرى توزيع تراكيز متساوية من البروتين في كل مسارات الترحيل، إلا أن العصابات الناتجة لم تكن بالشدة نفسها، كما لم تظهر الوُحيدة ά لدى المرضى في الأرقام 9 و 10 و 11 (يوضح ذلك الشكل 5).
رابعاً- مجموعة المرضى الذين لديهم شذوذ في
شكل النطاف Teratozoospermia
عددهم 5، ظهرت لديهم عصابات تدل على وجود الوحيدتين β و α بشكل واضح، أما الوُحيدة ά فلم تظهر لدى الجميع (الشكل 6).
خامساً- مجموعة المرضى الذين لديهم قلة في حركة النطاف Asthenozoospermia
عددهم 8، ظهرت عصابات تدل على وجود الوحيدتين β و ά للبروتين كيناز CK2 لكن الوُحيدة ά لم تظهر (الشكل 7).
سادساً- مجموعة المرضى الذين لديهم قلة عدد وشذوذ في الشكل Oligo teratozoospermia
عددهم 2، ظهرت عصابات تدل على وجود الوحيدتين β و α للبروتين كيناز CK2 لكن الوُحيدة ά لم تظهر (الشكل 8).
سابعاً- مجموعة المرضى الذين لديهم قلة عدد وشذوذ في الحركة Oligoasthinazoo-spermia
عددهم 15 مريضاً، ظهرت عصابات تدل على وجود الوحيدتين β و α للبروتين كيناز CK2 لكن الوُحيدة ά لم تظهر (الشكل 9).
ثامناً- مجموعة المرضى الذين لديهم شذوذ في الشكل والحركة Asthinoteratozoospermia
عددهم 5، حيث ظهرت الوحيدتان α و β فقط لدى المريضين رقم 4 و 5، أما الوُحيدة ά فلم تظهر لدى الجميع (الشكل 10).
تاسعاً- مجموعة المرضى الذين لديهم قلة عدد
وشذوذ في الشكل والحركة، أي متلازمة Oligo-asthinoteratozoospermia (OAT)
عددهم 16 مريضاً، حيث ظهرت الوُحيدة β لدى الجميع أما الوحيدتان α و ά فلم تظهرا أبداً (الشكل 11).
|
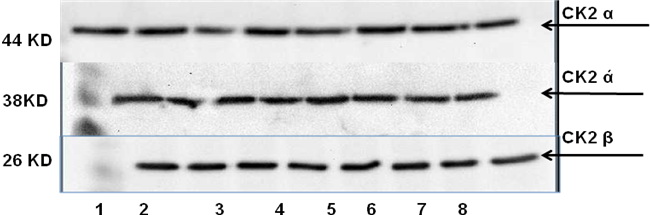
الشكل 3: نتائج رحلان البروتينات المستخلصة من عينات السائل المنوي لثمانية شواهد.
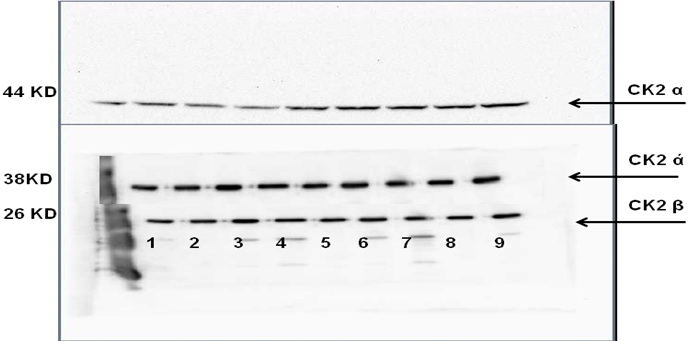
الشكل 4: نتائج رحلان البروتينات المستخلصة من عينات السائل المنوي لتسعة شواهد.
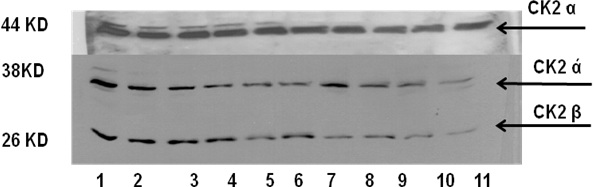
الشكل 5: نتائج رحلان البروتينات المستخلصة من عينات السائل المنوي للمرضى الذين لديهم قلة في عدد النطاف Oligozoospermia .
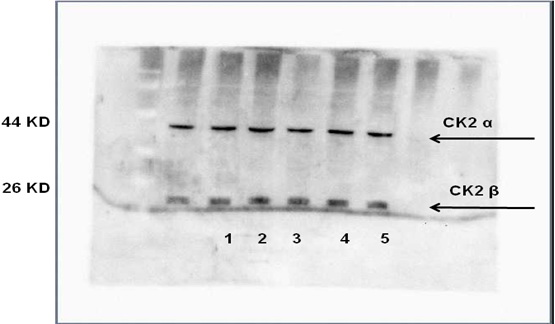
الشكل 6: نتائج رحلان البروتينات المستخلصة من عينات السائل المنوي للمرضى الذين لديهم شذوذ في شكل النطاف Teratozoospermia .
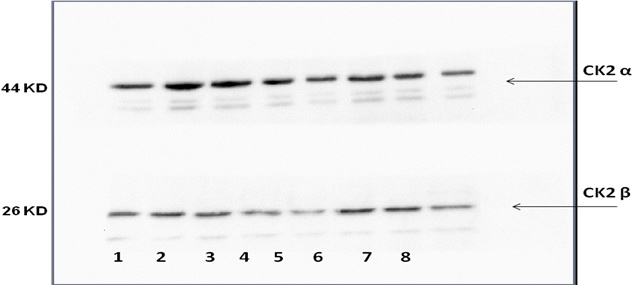
الشكل 7: نتائج رحلان البروتينات المستخلصة من عينات السائل المنوي للمرضى الذين لديهم قلة في حركة النطاف Asthenozoospermia .
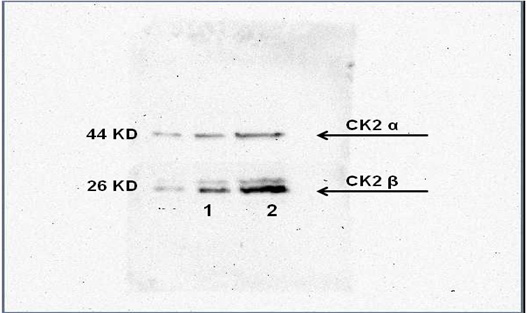
الشكل 8: نتائج رحلان البروتينات المستخلصة من عينات السائل المنوي للمرضى الذين لديهم قلة عدد وشذوذ في الشكل Oligo teratozoospermia .
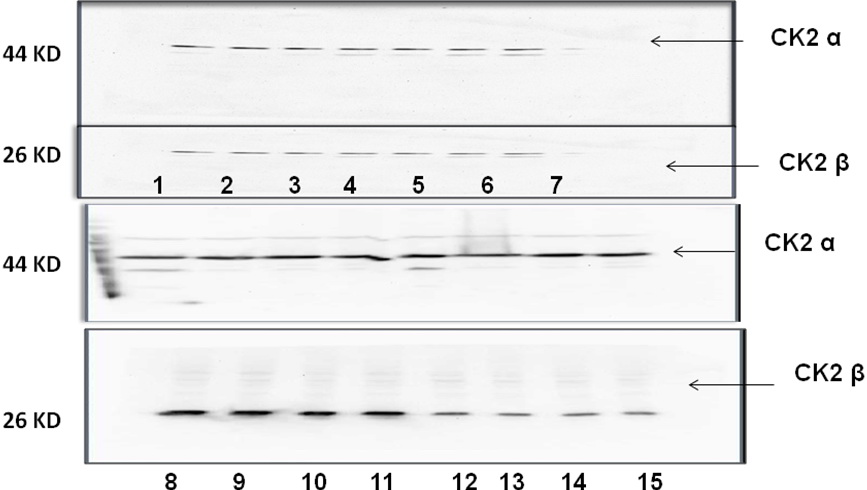
الشكل 9: نتائج رحلان البروتينات المستخلصة من عينات السائل المنوي للمرضى الذين لديهم قلة عدد وشذوذ في الحركة Oligoasthinazoospermia .
الشكل 10: نتائج رحلان البروتينات المستخلصة من عينات السائل المنوي للمرضى الذين لديهم شذوذ في الشكل والحركة Asthinoteratozoospermia .
الشكل 11: نتائج رحلان البروتينات المستخلصة من عينات السائل المنوي للمرضى الذين لديهم قلة عدد وشذوذ في الشكل والحركة (OAT) .
|
| المناقشة Discussion |
الوُحيدة الدوينية α للبروتين كيناز CK2:
أظهرت نتائجنا وجود الوُحيدة الدوينية α للبروتين كيناز CK2 بنسبة %65.2 لدى الرجال العقيمين وهي نسبة عالية، إلا أنها أصغر من نسبتها لدى الأسوياء والتي بلغت %100.
بالإضافة إلى ذلك، لاحظنا وجود فوارق ثنائية هامة في تواتر وجود الوُحيدات CK2α بين مجموعة الأسوياء من جهة ومجموعة المرضى العقيمين من جهة أخرى. حيث بلغت النسبة المئوية لوجود الوُحيدة الدوينية α للبروتين كيناز CK2 %100 لدى المجموعات التالية: الأسوياء، والمرضى الذين لديهم قلة في عدد النطاف، والمرضى الذين لديهم قلة في حركة النطاف، والمرضى الذين لديهم شذوذ في شكل النطاف، والمرضى الذين لديهم قلة عدد وشذوذ في الشكل، والمرضى الذين لديهم قلة عدد وشذوذ في الحركة. كما بلغت هذه النسبة %40 لدى مجموعة المرضى الذين لديهم شذوذ في الشكل والحركة، في حين كانت %0 لدى مجموعة المرضى الذين لديهم قلة عدد وشذوذ في الشكل والحركة ومجموعة المرضى الذين لديهم فقد نطاف تام.
إذا أخذنا بعين الاعتبار تواجد الوُحيدات CK2α لدى الأسوياء والمرضى جميعهم وغيابها فقط لدى مجموعة المرضى الذين لديهم فقد نطاف تام، والذين لديهم متلازمة OAT، نستنتج أن هذه الوُحيدة الدوينية α للبروتين كيناز CK2 ضرورية من أجل عيوشية الخلية. يعبر عن الوُحيدة CK2α في النسج المتنوعة للثدييات بشكل واسع وغزير. إن نفاد أو تثبيط الوُحيدة المحفزة α بوجود مثبطات القنيات الدقيقة يسبب إلغاء توقف G2 في دورة الخلية واستماتتها (8).
لاحظنا أيضاً لدى مجموعة المرضى الذين لم تظهر لديهم الوُحيدات CK2α (مجموعة المرضى الذين لديهم متلازمة OAT) أن قيم نسبة عيوب الجسيم الطرفي كانت أكبر منها في مجموعة المرضى الذين ظهرت لديهم الوُحيدات CK2α في عينة البحث.
الوُحيدة الدوينية ά للبروتين كيناز CK2:
من خلال النتائج، لاحظنا وجود الوُحيدة الدوينية ά للبروتين كيناز CK2 بنسبة %12.1 لدى الرجال العقيمين، وهي نسبة ضئيلة جداً، بالإضافة لكونها أصغر بكثير من نسبة تواجدها لدى الأسوياء والبالغة %100 في عينة البحث المدروسة، كما بلغت النسبة المئوية لوجود الوُحيدات الدوينية للبروتين كيناز CK2ά قيمة 0 لدى المجموعات التالية: المرضى الذين لديهم فقد نطاف تام، والمرضى الذين لديهم شذوذ في شكل النطاف، والمرضى الذين لديهم قلة في حركة النطاف، والمرضى الذين لديهم قلة عدد وشذوذ في الشكل، والمرضى الذين لديهم قلة عدد وشذوذ في الحركة، والمرضى الذين لديهم شذوذ في الشكل والحركة، والمرضى الذين لديهم قلة عدد وشذوذ في الشكل والحركة. وبلغت أيضاً قيمة %72.7 لدى مجموعة المرضى الذين لديهم قلة في عدد النطاف، في حين كانت %100 لدى مجموعة الأسوياء. مما يدل على دور هذه الوُحيدة الهام في تقييم حالة العقم مجهول السبب لدى الرجال.
أما بالنسبة لجميع المقارنات الثنائية المدروسة، فتوجد فروق ثنائية يعتد بها إحصائياً في تكرارات وجود الوُحيدات CK2α، CK2ά بين مجموعة الأسوياء وكل من المجموعات المدروسة الباقية في عينة البحث، حيث يُلاحظ أن نسبة وجود الوُحيدات CK2α، CK2ά في مجموعة الأسوياء كانت أكبر منها في كل من المجموعات المدروسة الباقية (المرضى الذين لديهم قلة في عدد النطاف، والمرضى الذين لديهم شذوذ في شكل النطاف، والمرضى الذين لديهم قلة في حركة النطاف، والمرضى الذين لديهم قلة عدد وشذوذ في الشكل، والمرضى الذين لديهم قلة عدد وشذوذ في الحركة، والمرضى الذين لديهم شذوذ في الشكل والحركة، والمرضى الذين لديهم قلة عدد وشذوذ في الشكل والحركة، والمرضى الذين لديهم فقد نطاف تام) في عينة البحث.
بالإضافة إلى ذلك، وجدت لدى دراسة قيم كل من متثابتات السائل المنوي مثل الحركة، وقيمة باهاء pH السائل المنوي، والتركيز، ونسبة الأشكال الطبيعية، ونسبة عيوب الجسيم الطرفي acrosome، فروق يعتد بها إحصائياً في متوسط قيم كل من المتغيرات المذكورة، بين مجموعة المرضى الذين لم تظهر لديهم الوُحيدات CK2ά، CK2α ومجموعة المرضى الذين ظهرت لديهم هذه الوُحيدات، وإن قيم كل من هذه المتثابتات في مجموعة المرضى، الذين لم تظهر لديهم الوُحيدات، كانت أصغر منها بالمقارنة مع مجموعة المرضى الذين ظهرت لديهم الوُحيدات في عينة البحث.
إن حذف جين CK2ά في KO mouse يؤدي إلى تطور فئران عيوشة، لكنها عقيمة في مرحلة البلوغ لأنها تنتج نطافاً شاذة شكليا ً ينقصها الجسيم الطرفي acrosome، أو يحدث لديها سوء تشكل الجسيم الطرفي. كذلك تكون الذكور التي لديها طفرة في CK2ά عقيمة بينما تبدي الإناث الطافرة خصوبة طبيعية (9). كما يؤدي حذف جين CK2ά إلى تشكل خلايا تعاني الاستماتة، بينما الخلايا القليلة الباقية على قيد الحياة تكون قادرة على تشكيل البربخ وتبدي شذوذات في رأس النطفة كما في متلازمة Globozoospermia لدى البشر (10)، مما يؤكد على الدور الوثيق للوُحيدة CK2ά في تنظيم التشكل الحيوي للجسيم الطرفي في مرحلة تكون النطاف لدى الثدييات.
تتدخل CK2ά في سبل تنبيغ الإشارة المرتبطة بالاستجابة السريعة لحويصلة الجسيم الطرفي، بعد التماس بين النطفة والبيضة (11). إن الفسفرة المعتمدة على CK2ά و/ أو التآثر مع البروتينات الهيكلية قد تؤدي لإعادة تعضي هيولي سريع وإلى تفاعل الجسيم الطرفي (12). |
الوُحيدة الدوينية β للبروتين كيناز CK2: |
| بلغت نسبة وجود الوُحيدة الدوينية ά للبروتين كيناز CK2 %83.3، وهي أعلى نسبة تواجد مقارنة مع الوحيدتين CK2α، CK2ά، لدى الرجال العقيمين، بينما كانت %100 لدى الأسوياء في عينة البحث المدروسة.
لم تظهر فروق يعتد بها إحصائياً في تكرارات وجود الوُحيدات CK2β بين مجموعة المرضى المصابين بالعقم ومجموعة الأسوياء في عينة البحث.
أما بالنسبة لحجم السائل المنوي، فلقد وجدت فروق يعتد بها إحصائياً في متوسط قيم حجم السائل المنوي بين مجموعة المرضى الذين لم تظهر لديهم الوُحيدات CK2β، ومجموعة المرضى الذين ظهرت لديهم الوُحيدات CK2β. ونستنتج أن قيم حجم السائل المنوي في مجموعة المرضى الذين لم تظهر لديهم الوُحيدات CK2β كانت أصغر منها في مجموعة المرضى الذين ظهرت لديهم الوُحيدات CK2β في عينة البحث.
يؤدي غياب CK2β إلى عيب استقلال الخلية Cell autonomous defect من جهة، ومن جهة أخرى، يعبر عن الوُحيدة CK2β بشكل كبير في بذرة النطاف للفئران البالغة، وهذا قد يعود إلى الوظيفة النوعية، ولكن غير المعروفة، في العلم الحيوي للخلية الجذعية الانباتية (13).
تنظم الوُحيدة CK2β التعضي لمغزل الانقسام الفتيلي وتقترح نماذج KO mouse أنها غير ضرورية لإنتاج النطاف وخصوبة الذكر، وهذا يفسر نسبة وجودها الأعلى من كل الوُحيدات الأخرى لدى مجموعات الرجال العقيمين والذين لديهم مشاكل في الخصوبة (14).
|
| الاستنتاج Conclusion |
| يمكننا أن نستنتج من خلال هذه المعطيات كلها أهمية دور الوُحيدة CK2α في بُقيا الخلية وأهمية الوُحيدة CK2ά في الإخصاب موضوع دراستنا والدور المنظم الذي تلعبه الوُحيدة CK2β في مجمل العملية. |
| المراجع References |
1
-Burnett C. and Kennedy E.P.
The enzymatic phosphorylation of proteins.
Biol. Chem. 211, 969-980, 1954.
2-Stigare'J; Buddelmeijer N; Pigon A. and Egyhazi E.
A majority of CK2 alpha subunit is tightly bound to intra¬nuclear compounds but not to the beta subunit.
Mol. Cell. Biol; 129, 77-85,1993.
3-Buchou T; Vemet M; Blond O; Jensen H.H; Pointu H. and Olsen B.B.
Disruption of the regulatory beta subunit of protein kinase CK2 in mice leads to a cell-autonomous defect and early embryonic lethality.
Mol Cell Biol; 23: 908-915, 2003.
4-Ahmed K; Gerber D.A. and Cochet C.
Joining the cell survival squad: an emerging role for protein kinase CK2.
Trends Cell Biol; 12, 226-230, 2002.
5-Pinna L.A.
Proteinkinase CK2.
Int. J. Biochem. Cell. Biol. 29, 551-554, 1997.
6-Faust M; Jung M; Gunther J; Zimmermann R. and Montenarh M.
Localization of individual subunits of pro¬tein kinase CK2 to the endoplasmic reticulum and to the Golgi apparatus.
Mol. Cell Biochem. 227, 73-80, 2001.
7-Litchfield DW.
Protein kinase CK2: structure, regulation and role in cellular decisions of life and death.
Biochem J. 369: 1-15, 2003.
8-Meraldi P. and Nigg E.A.
The Centrosome cycle.
FEES Lett. 521: 9-13, 2002.
9-Escalier D, Silvius D, Xu X
Spermatogenesis of mice lacking CK2alpha: failure of germ cell survival and characteristic modifications of the spermatid nucleus.
Mol Reprod Dev; 66: 190-201, 2003.
10-Xu X; Toselli PA; Russell LD. and Seldin DC.
Globozoospermia in mice lacking the casein kinase II alpha catalytic subunit.
Nat Genet; 23: 118-121, 1999.
11-Marin O; Meggio F. and Pinna LA.
Structural features underlying the unusual mode of calmodulin phosphorylation by protein kinase CK2: a study with synthetic calmodulin fragments.
Biochem Biophys Res Cotmnun; 256: 442-446, 1999.
12-Guerra B; Siemer S; Boldyreff B. and issinger OG.
Protein kinas CK2: evidence for a protein kinase CK2beta subunit fraction, devoid of the catalytic CK2alpha subunit, in mouse brain and testicles.
FEBS Lett; 462: 353-357, 1999.
13-St-Denis NA; Derksen DR. and Litchfield DW.
Evidence for regulation of mitotic progression through temporal phosphoryla¬tion and dephosphorylation of CK2{alpha}.
Mol Cell Biol; (in press), 2009.
|
| |
