| الملخص Abstract |
مقدمة: لا تزال معالجة داءُ اللِّيشْمانِيَّات تشكل مشكلة كبيرة، خاصة بعد تزايد حالات فشل المعالجة بمركبات الأنتموان، واستعراف سلالات لايشمانية مقاومة لهذه المركبات. لهذا هدفت هذه الدراسة إلى اختبار كفاءة التاموكسيفين، المستخدم في علاج سرطان الثدي، ضد الليشمانية في المختبر واختبار أثره على الاستجابة المناعية عند الفئران BALB/C المصابة بعدوى المُشَيِّقَات [طفيليات] (مرحلة من دورة حياة المثقبيات) الليشمانية.
المواد والطرق: استخدمنا في هذه الدراسة طفيليات الليشمانية المدارية التي عزلت من شاب يعيش في ريف دمشق. اختبرنا أثر التاموكسيفين على تكاثر المُشَيِّقَات (الأشكال المتحركة) الليشمانية المدارية، في وسط سائل أحادي الطور RPMI- 1640 بوجود تراكيز مختلفة من التاموكسيفين. عُينت النسبة المئوية للعَيُوشِيَّة (إمكانيَّةُ الحَيَاة بَعْدَ الوِلاَدَة) بواسطة عتيدة أملاح التترازوليوم tetrazolium XTT، واختبر أيضاً أثر التاموكسيفين على تكاثر طفيليات اللَيشُمانَة (الأشكال غير المتحركة) المدارية داخل الخلايا، باستخدام البلاعم الصفاقية للفئران BALB/C وعُين بالعد المجهري عدد الليشمانات، أُصيبت فئران BALB/C أيضاً بعدوى المُشَيِّقَات (الأشكال المتحركة) الليشمانية المدارية، وعولجت بجرعة 20 ملغ/ غ/ اليوم من التاموكسيفين لمدة 15 يوماً. وعُينت مستويات الإنترفيرون غاما في مصول الفئران المصابة بالعدوى جميعها بواسطة عتيدة ELISA.
النتائج: بينت نتائج هذه الدراسة أن التاموكسيفين، في المختبر، يثبط تكاثر المُشَيِّقَات (الأشكال المتحركة) لليشمانية المدارية، وبلغ التركيز المثبط لنصف عدد الطفيليات 6.19 µM. كما بينت هذه الدراسة أن التاموكسيفين يثبط أيضاً تكاثر اللَيشُمانَة (الأشكال غير المتحركة) المدارية داخل الخلايا، وبلغ التركيز المثبط لنصف الأشكال غير المتحركة 4.13 µM. أما في فئران BALB/C المصابة بعدوى المُشَيِّقَات (الأشكال المتحركة) الليشمانية المدارية، والمعالجة بجرعة 20 ملغ/ غ/ اليوم من التاموكسيفين لمدة 15 يوماً، فلقد بينت هذه الدراسة زيادة يعتد بها إحصائياً(P=0.00017) ، في تراكيز الإنترفيرون غاما.
الاستنتاج: يملك التاموكسيفين أثراً ضد تضاعف كلٍ من المُشَيِّقَات (الأشكال المتحركة) و اللَيشُمانَات (الأشكال غير المتحركة) لطفيليات الليشمانية المدارية، وينبّه المَناعَةٌ الفاعِلَة (Th1) لدى الفئران المصابة بعدوى الليشمانية المدارية.
|
Leishmaniasis treatment is still a great problem, especially after increasing of pentavalent antimonials treatment failure cases, and the identification of resistant leishmania strains to these compounds. Thus of this study aimed to test Tamoxifen, used in breast cancer treatment, efficacy against Leishmania in vitro and to test its effect on the immunoresponse in BALB/C mice infected with leishmania promastigotes.
Materials and Methods:
Parasites used in this study were isolated from a young man lives countryside Damascus. Tamoxifen effect on L. tropica promastigotes proliferation, in RPMI- 1640 medium, was tested in the presence of different concentrations of tamoxifen. Viability % was determined by salts tetrazolium XTT kit. Tamoxifen effect on L. tropica intracellular amastigotes proliferation was also tested, using BALB/C mice peritoneal macrophages and microscpic counting of amastigotes number was determined. BALB/C mice were also infected with L. tropica promastigotes, and treated with 20 mg/kg/d Tamoxifen for 15 days. Serum IFN-γ levels in all mice were determined by ELISA kit.
Results: Tamoxifen inhibits L. tropica promastigotes proliferation in vitro and IC50 was 6.19 µM. And Tamoxifen inhibits also L. tropica intracellular amastigotes proliferation and IC50 was 4.13 µM. BALB/C mice, infected with L. tropica promastigotes, and treated with 20mg/kg/d for 15 days led to a significant increase (P=0.00017) in serum interferon-gamma concentrations.
Conclusion: Tamoxifen has an effect against L. tropica prmastigotes and amastigotes multiplication, and stimulates an active immunity (Th1) in L. tropica infected mice.
|
| المقدمة introduction |
تنتشر طفيليات الليشمانية في سورية في عدة محافظات مثل دمشق وريفها، حلب، إدلب، الرقة، القنيطرة، درعا، حماة والساحل السوري. ولقد عرف داءُ اللِّيشْمانِيَّاتِ الجِلْدِيُّ في سورية منذ القدم، حيث انتشرت هذه الطفيليات واستوطنت في مدينة حلب، وسميت الإصابة الجلدية بحبة حلب (1-4).
داءُ اللِّيشْمانِيَّاتِ هو مجموعة من الآفات التي تصيب الجلد، والأغشية المخاطية والأحشاء، تسببها طفيليات من شعبة الحيوانات الأوالي Protozoa، تنتمي إلى جنس الليشمانية Leishmania. تنتقل طفيليات الليشمانية إلى الإنسان بواسطة ذبابات الرمل Sand Flies (5). تنتمي ذبابة الرمل إلى جنس الفواصد Phlebotomus في العالم القديم، وإلى جنس Lutzomyia في العالم الجديد (6). تمتلك هذه الطفيليات شكلين: لَيشُمانَة (شكل غير متحرك) amastigote يتواجد في خلايا الجملة الشبكية البطانية عند الإنسان، والثدييات الأخرى (7)، والمُشَيِّقَة (شكل متحرك) Promastigote متطاول يتواجد في المستنبتات الزرعية وذبابة الرمل ويمتلك سوطُاً حراً وحيدٌاً (7).
ترافق بقاء مركبات الأنتموان الخط الأول في معالجة داء الليشمانيات لفترة طويلة، مع ظهور عدد من الحالات التي فشل فيها العلاج بهذه المركبات، وسجلت الدراسات انخفاضاً في حساسية سلالات الليشمانية المعالجة بهذه الأدوية (8). وبالتالي وبناءً على ما سبق ونظراً للتأثيرات الجانبية للمعالجة بمشتقات الأنتموان (اضطرابات قلبية-وعائية واضطرابات كبدية واضطرابات كلوية) (8)، يكتسب البحث عن علاج آمن وفعال وجديد لمعالجة داء الليشمانيات أهمية كبيرة. يستخدم التاموكسيفين Tamoxifen بشكل شائع، منذ أكثر من 25 عاماً، في علاج سرطان الثدي والوقاية منه (9، 10)، وبينت دراسة حديثة أثره على تكاثر الأشكال المتحركة لطفيليات الليشمانية على سلالات في البرزيل ((11، مما شجعنا على دراسة أثره على سلالات الليشمانية السورية.
|
| المواد والطرق Materials and Methods |
الطفيليات المستخدمة في الدراسة
انتقيت إحدى العزلات بشكل عشوائي من شاب من ريف دمشق، يعاني منذ ثلاثة أشهر من إصابتين في الخد والذقن، ولم يتلق أية معالجة، وبين تنميطها أنها من نوع الليشمانية المدارية Leishmania tropica.
استخدم وسط Novy-Mac-Neal-Nicolle-Medium (N.N.N) ثنائي الطور، الذي جرى تحضيره من الآغار ودم الأرنب منزوع الفِبْرين، وقطرات من 1640- RPMI لعزل الطفيلي من العينة. جرى نقل الطفيليات من وسط N.N.N، بعد تحديد عدد الطفيليات النامية فيها بعدادة نيوباور، إلى وسط 1640- RPMI السائل لشركة Cytogen، الذي أضيف له مصل العجل الجنيني بنسبة 10%. تمت عملية نقل الطفيليات إلى أوساط سائلة جديدة كل ثلاثة أيام والحضن بدرجـة حـرارة 26°م للحفاظ على السـلالـة
المستخدمة وتكثيرها أثناء الدراسة.
|
اختبار كفاءة التاموكسيفين ضد تكاثر الأشكال المتحركة لطفيليات الليشمانية في المختبر:
جرى تحضير 12 مل من وسط 1640-RPMI، يحوي كل 1 مل منها 5 × 610 من الأشكال المتحركة لطفيليات الليشمانية المدارية. استخدمنا صفائح زرع تحوي 12 بئراً، من شركة cell star، وقمنا بتوزيع الوسط السابق على الآبار بمقدار 975 مكل في كل بئر. استخدمنا البئرين A1 و A2للشاهد، وخصصنا بئرين من الآبار المتبقية لدراسة أثر كل تركيز من التراكيز المختلفة للتاموكسيفين. قمنا بإضافة 25 مكل من الإيثانول للبئرين الشاهدتين. وجرى اختبار أثر تراكيز متزايدة من التاموكسيفين من خلال إضافة 25 مكل من محاليل التاموكسيفين، بحيث نحصل على تراكيز نهائية للتاموكسيفين في آبار الزرع تساوي التراكيز المطلوبة. حُضنت صفائح الزرع السابقة، بعد معالجتها كما ذكرنا سابقاً، بدرجة حرارة 26°م لمدة 24 ساعة، ثم قمنا بمقايسة عيوشية الخلايا Viability اعتماداً على انشطار أملاح التترازوليوم XTT ذات اللون الأصفر، لشركة Roche، نتيجة لاستقلابها من قبل الخلايا الحية، مما يؤدي إلى تشكل صبغة برتقالية اللون Formazon dye تتناسب شدة لونها طرداً مع عدد الخلايا الحية. ويمكن قراءة امتصاصية صبغة Formazon الذوابة في الوسط المائي في موجة طولها 450 نم بواسطة قارىء ELISA. جرى تطبيق تعليمات الشركة المنتجة، وقمنا بحساب النسبة المئوية للعيوشية في كل بئر من آبار الزرع المعالجة بتراكيز مختلفة من التاموكسيفين بالمقارنة مع الشاهد، وتعبّر النتيجة النهائية عن متوسط ثلاث مقايسات مختلفة، وتعّبر نتيجة كل مقايسة عن متوسط مقايسة البئرين.
اختبار كفاءة التاموكسيفين المثبطة لتكاثر الأشكال غير المتحركة ضمن البلاعم:
استخدمت فئران BALB/C، عمرها 6-8 أسابيع، كمصدر للبلاعم، حيث استحصل على هذه الخلايا منها وفقاً للبروتوكول المذكور في دراسة Danilo C. Miguel وزملائه (11)، ثم قمنا بعد البلاعم بعدادة نيوباور.
وضعنا ساترة معقمة في كل بئر من الآبار الإثني عشر لعلبة الزرع، ثم أضفنا 500 ألف من البلاعم الفأرية في كل بئر. وقمنا، بعد الحضن لمدة ساعتين بالدرجة 37°م وبوجود 5% CO2، بإزالة السائل الطافي وإضافة وسط RPMI-1640، ومن ثم إضافة الأشكال المتحركة المأخوذة من مزرعة في طور الاستتباب بمعدل 5 طفيليات لكل بلعم. ثم حضنت علب الزرع السابقة لمدة 3 ساعات وأزيلت الطفيليات غير الداخلة، ثم أضيف وسط زرعي جديد وقمنا بالحضن لمدة 24 ساعة.
بعد 24 ساعة من الحضن، أضيف 25 مكل من محاليل التاموكسيفين، بحيث نحصل على تراكيز نهائية 2.5 و 5 و 7.5 و 10 و 20 µM، وأضفنا الحجم نفسه من الإيثانول إلى الآبار الشاهدة، وحُضنت علب الزرع لمدة 24 ساعة إضافية. جرى بعد ذلك أخذ السواتر من كافة آبار الزرع ولونت الخلايا بملون Giemsa مما سمح بعد الأشكال غير المتحركة داخل البلاعم، حيث قمنا بعدها في 100 بلعم من كل بئر، وحساب الـعيوشية بالمقارنة مع الآبار الشاهدة.
اختبار أثر التاموكسيفين في الاستجابة المناعية عند الفئران المصابة بالليشمانية:
استخدمت فئران BALB/C، بعمر 6-8 أسابيع، لإجراء هذه الدراسة. جرت إصابة 10 فئران BALB/C بالعدوى بعدد من الطفيليات يعادل خمسة ملايين من الأشكال المتحركة للطفيليات، المأخوذة من طور الاستتباب من مزرعة لسلالة الليشمانية المدارية، وذلك بحقنها تحت الجلد في أسفل القدم اليسرى للفأر. انتظرنا لمدة ثلاثة أسابيع حتى بدأت الإصابات بالظهور، ثم قسمنا هذه الفئران إلى مجموعتين شاهدة، عولجت داخل البريتوان بجرعة يومية تساوي 200 مكرولتر من المصل الفيزيولوجي لمدة 15 يوماً، ومجموعة المعالجة التي تلقت جرعة يومية من التاموكسيفين تعادل 20 ملغ/ كغ/ يوم لكل فأر من فئران هذه المجموعة لمدة 15 يوماً. حيث حقن هذا الدواء، بعد حله بالمصل الفيزيولوجي، بواسطة سيرنغ 1 مل بحيث يحوي 200 مكرولتر من المحلول على تركيز الجرعة السابقة، وبحيث تكون الجرعة حديثة التحضير.
جرى سحب الدم من عين الفأر بواسطة ممص باستور، حيث جمعنا 0.5 مل من دم الفأر ووضعت في أنابيب جافة. نبذت العينات، خلال 45 دقيقة كحد أعلى من سحب الدم، بسرعة 4000 دورة/ دقيقة لمدة 10 دقائق، ثم حُفظت المصول في أنابيب ايبندروف في درجة حرارة 20-°م.
أخذت عينات الدم الأولى من الفئران بعد مرور 3 أسابيع على إصابتها بالعدوى، حيث تمثل عينة قبل بدء المعالجة. ثم أخذت عينات أخرى واحدة بعد أسبوع من بدء المعالجة وأخرى بعد انتهاء المعالجة مباشرة. جرت مقايسة الإنترفيرون? في كافة العينات المأخوذة من الفئران في نهاية التجربة دفعة واحدة. باستخدام عتيدة من شركة MABTECH لمقايسة الإنترفيرون الفأري mouse IFN-γ بواسطة الإليزا ELISA، حيث تسمح هذه العتيدة بمقايسة كمية لمستويات الإنترفيرون غاما الفأرية، وهي تسمح بقياس تراكيز تصل إلى 2 بكغ/ مل، في السوائل البيولوجية مثل المصل والبلازما وأوساط زرع الخلايا.
|
| النتائج Results |
نتائج اختبار فعالية التاموكسيفين على تكاثر الأشكال المتحركة لطفيليات الليشمانية المدارية:
يلخص الجدول 1 النتائج التي حصلنا عليها. ولقد أدت معالجة الأشكال المتحركة لطفيليات الليشمانية المدارية، بتراكيز 2.5 و5 Mµ إلى تثبيط تكاثرها بنسبة 20.2% و42.91% على الترتيب، في حين أدت معالجتها بتراكيز 7.5 و10 Mµ إلى تثبيط تكاثرها بنسبة 67.2% و78.97 % على الترتيب، بينما جرى تثبيط تكاثرها بنسبة 83.4 % عند معالجتها بتركيز 12.5 Mµ. ولقد أدت معالجتها بتركيز 20 Mµ إلى قتل الأشكال المتحركة كلها. تبين نتائجنا وجود علاقة ارتباط عكسية قوية جداً، معامل الارتباط (r>0.9)، بين تركيز التاموكسيفين وعيوشية الأشكال المتحركة. كما كان لهذه النتائج دلالة إحصائية، حيث بلغت قيمة P 0.007 أي أقل من 0.05؛ وبالتالي فلقد أظهرت دراستنا انخفاضاً يعتد به إحصائياً في عيوشية الأشكال المتحركة لطفيليات الليشمانية المدارية المعالجة لمدة 24 ساعة بالتاموكسيفين، بالمقارنة مع الشاهد الذي أضيف له الإيثانول فقط، وتزايد هذا الانخفاض طرداً مع تزايد تركيز التاموكسيفين. ولهذا يمكن القول إن التاموكسيفين يثبط تكاثر الأشكال المتحركة لطفيلي الليشمانية.
|
الجدول 1: نتائج اختبار معالجة الأشكال المتحركة لطفيليات الليشمانية المدارية، المزروعة على وسط RPMI-1640 .
تركيز التاموكسيفين (Mµ) |
% للعيوشية مقارنة مع الشاهد |
% للتثبيط مقارنة مع الشاهد |
المتوسط |
الانحراف المعياري SD) ) |
المتوسط |
الانحراف المعياري (SD ) |
0 |
100 |
- |
0 |
- |
2.5 |
0 79.8 |
3.37 |
20.2 |
3.37 |
5 |
57.09 |
2.76 |
42.91 |
2.76 |
7.5 |
32.80 |
1.36 |
67.2 |
1.36 |
10 |
21.03 |
1.22 |
78.97 |
1.22 |
12.5 |
16.6 |
1.2 |
83.4 |
1.2 |
20 |
0 |
0 |
100 |
0 |
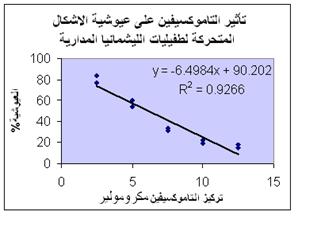
الشكل 1 : تناقص عيوشية الأشكال المتحركة لطفيليات الليشمانية المدارية المزروعة على وسط RPMI-1640 بتأثير تراكيز متزايدة من التاموكسيفين.
الجدول 2 : أثر التاموكسيفين على تكاثر الأشكال غير المتحركة للطفيليات في البلاعم البريتوانية الفأرية.
تركيز
التاموكسيفين
(Mµ) |
عدد الطفيليات
في 100 بلعم |
% لعيوشية الطفيليات
داخل البلاعم المعالجة
مقارنة مع الشاهد |
% لتثبيط تكاثر الطفيليات داخل البلاعم المعالجة مقارنة مع الشاهد |
المتوسط |
الانحراف المعياري SD) ) |
المتوسط |
الانحراف المعياري SD) ) |
المتوسط |
الانحراف المعياري SD) ) |
0 |
1368 |
136 |
100 |
0 |
0 |
0 |
2.5 |
1024 |
86 |
74.85 |
6.34 |
25.27 |
6.34 |
5 |
408 |
44 |
29.82 |
3.09 |
70.18 |
3.09 |
7.5 |
196 |
16 |
14.32 |
1.19 |
85.86 |
1.19 |
10 |
112 |
12 |
4 |
0.53 |
96 |
0.53 |
|
| سمح رسم المنحنى (الشكل (1، الذي يربط بين تناقص عيوشية الأشكال المتحركة لطفيليات الليشمانية المدارية المزروعة على وسط RPMI- 1640 وتأثير تراكيز متزايدة من التاموكسيفين، بالحصول على معادلة المنحنى، وبالتالي حساب التركيز IC50 للتاموكسيفين، الذي يثبط تكاثر 50% من الأشكال، حيث يبلـغ
6.19Mµ بانحراف معياري 0.62.
|
| اختبار أثر التاموكسيفين على الأشكال غير المتحركة داخل الخلوية:
يلخص الجدول 2 نتائج تعداد الطفيليات ضمن البلاعم قبل وبعد إضافة التراكيز المختلفة من التاموكسيفين. حيث أدت المعالجة بالتاموكسيفين |
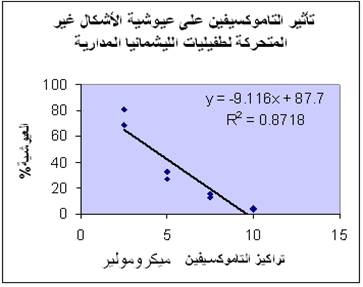
الشكل 2 : تناقص عيوشية الأشكال غير المتحركة للطفيليات الموجودة داخل البلاعم البريتوانية الفأرية بعد معالجتها لمدة 24 ساعة بتراكيز متزايدة من التاموكسيفين.
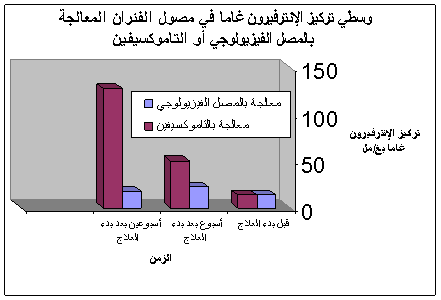
الشكل 3 : مقارنة بين تراكيز الإنترفيرون غاما في مصول الفئران المعالجة بالمصل الفيزيولوجي وبالتاموكسيفين.
|
| بتراكيز 2.5 و5 و7.5 و10 µM إلى تثبيط تكاثر الأشكال غير المتحركة داخل البلاعم، خلال 24 ساعة بنسبة 25.27% و 70.18% و 85.86 % و 96 % على الترتيب، مقارنة مع الشاهد الذي عولج بالإيثانول فقط.
أظهرت دراستنا وجود علاقة ارتباط عكسية قوية جداً بين تركيز التاموكسيفين وعدد الأشكال غير المتحركة داخل البلاعم البريتوانية الفأرية المعالجة بالتاموكسيفين (r>0.9)، وهي علاقة يعتد بها إحصائيا لأنً قيمP = 0.009 (أقل من (0.05. فلقد أدت المعالجة بالتراكيز السابقة إلى تثبيط تكاثر الأشكال غير المتحركة للطفيليات داخل البلاعم بنسب 25.27% و 70.18% و85.86% و 96%، على الترتيب، ويعكس المنحنى في الشكل 2 العلاقة السابقة، ولقد سمحت معرفة معادلة هذا المنحنى بتحديد تركيز التاموكسيفين IC50 المثبط لـ 50% من الطفيليات السابقة والذي بلغ 4.130.45± µM.
|
اختبار أثر التاموكسيفين على تطور الاستجابة المناعية عند الفئران:
قمنا بمقايسة الإنترفيرون غاما لدى الفئران جميعها قبل بدء المعالجة، أي بعد مرور ثلاثة أسابيع على إخماج الفئران بالطفيليات، وبعد مرور أسبوع وأسبوعين على بدء المعالجة. ولقد أُجريت مقايستان لكل عينة مصل مأخوذة من كل فأر، وبالتالي تمثل النتائج متوسط المقايستين. وتبين مقارنة هذه النتائج أن متوسط تركيز الإنترفيرون غاما قد بلغ 13.72±3.56 بيكوغرام/ مل في مصول فئران المجموعتين بعد ثلاثة أسابيع من إصابتها بالعدوى بγالأشكال المتحركة لطفيليات الليشمانية. أما بعد مرور أسبوع على بدء معالجة الفئران، فقد بلغ متوسط تركيز الإنترفيرون في مصول فئران المجموعة الشاهدة، المعالجة بالمصل الفيزيولوجي، مقدار 22.43±3.24 بيكوغرام/ مل، بينما بلغ50.59 ±8.91 بيكوغرام/ مل في مصول فئران المجموعة المعالجة بالتاموكسيفين. فيُلاحظ أن المعالجة بالتاموكسيفين ترافقت مع ارتفاع في تركيز الإنترفيرونγ بنسبة 225.55%، بعد أسبوع من بدء المعالجة، وذلك بالمقارنة مع المجموعة المعالجة بالمصل الفيزيولوجي فقط، وهي نتيجة يعتد بها إحصائياً ( P= 0.00113). أما بعد انتهاء معالجة الفئران مباشرة، فلقد بلغ متوسط تركيز الإنترفيرون? في مصول فئران المجموعة الشاهدة، المعالجة بالمصل الفيزيولوجي، 17.61±3.1 بيكوغرام/ مل، بينما بلغ 127.65±19.52 بيكوغرام/ مل في مصول فئران المجموعة المعالجة بالتاموكسيفين. وبالتالي ترافقت المعالجة بالتاموكسيفين مع ارتفاع في تركيز الإنترفيرون? بنسبة 724.89%، بعد أسبوعين من بدء المعالجة، وذلك بالمقارنة مع المجموعة المعالجة بالمصل الفيزيولوجي فقط، وهي نتيجة يعتد بها إحصائياً P)= 0.00017). |
| المناقشة Discussion |
| التاموكسيفين هو حاجب انتقائي لمستقبلات الإستروجين، يستخدم بشكل شائع في معالجة سرطان الثدي، وهو من الأدوية الآمنة الاستخدام عند الإنسان، والذي يمتاز بفعاليته بشكل خاص
على فطور المبيضات البيض (12).
أظهرت نتائجنا قدرة التاموكسيفين على تثبيط تكاثر الأشكال المتحركة لليشمانية المدارية في وسط RPMI-1640، وكانت هذه النتائج معتداً بها إحصائياً، حيث بلغت قيمة التركيز IC50 µM 6.19. كما بينا قدرة هذا الدواء على قتل الطفيليات عندما استعملناه بتركيز 20 µM. وتتوافق هذه النتيجة مع نتيجة الدراسة الوحيدة المنشورة عن تأثير هذا الدواء والتي بينت أثره القاتل لطفيليات الليشمانية الأمازونية (11).
كما بينا قدرة التاموكسيفين على تثبيط تكاثر الطفيليات ضمن البلاعم، حيث بلغت قيمة التركيز IC50 4.13 µM. يمكن فهم النتيجة السابقة وتفسيرها، من خلال مراجعة الأدب الطبي، حيث نُشرت الكثير من الدراسات التي تبين وجود خصائص بيولوجية للتاموكسيفين مستقلة عن ارتباطه بمستقبل الإستروجين. يمكن لتأثير التاموكسيفين المعدل للحموضة أن يكتسب أهمية كبيرة في تفسير أثره على طفيليات الليشمانية. حيث تقوم طفيليات الليشمانية بعد بلعمتها بتحويل درجة الـباهاء pH داخل البلاعم باتجاه الحموضة pH=5، وذلك خلال نصف ساعة من البلعمة. وتحافظ الليشمانية على هذه البيئة الحامضية من خلال إنزيمات ATPase H- الموجودة على الغشاء البلازمي للأشكال غير المتحركة للطفيلي، والمسؤولة عن التبادل الأيوني مع الوسط داخل البلعم للحفاظ على حياة الطفيليات الموجودة في حجرتها parasite vacuole داخل البلعم. وبالتالي من المحتمل أن تكون إنزيمات ATPase H- عند الطفيلي هدفاً لتأثير التاموكسيفين، مما يؤدي إلى قلونة ابتدائية تتبع بقطع التبادل الأيوني بين الطفيلي والبيئة المحيطة به (13)، وبالتالي يمكن لهذا الفعل المعدل للحموضة أن يسمح بتفسير أثر التاموكسيفين على تثبيط تكاثر شكلي هذه الطفيليات، حيث توجد هذه الإنزيمات أيضاً لدى الأشكال المتحركة ويمكن أن تقوم بتنظيم الـ pH داخل الخلوي لهذه الأشكال.
لكن وبما أن هذا الدواء يمتلك أثراً قاتلاً لهذه الأشكال فيفترض وجود آلية أخرى لفعل هذا الدواء على طفيليات الليشمانية، مما يظهر الحاجة إلى دراسات أخرى لفهم هذه الآلية. ولقد حاولنا فهم هذه الآلية من خلال دراستنا أثر التاموكسيفين على الاستجابة المناعية عند الفئران. واخترنا الفئران BALB/C لأنها سريعة التأثر بطفيليات الليشمانية، وهي صفة مطلوبة لدراسة كفاءة المعالجة من جهة، ولدراسة الاستجابة المناعية من جهة أخرى. وجرى انتقاء جرعة التاموكسيفين، تعادل 20 ملغ/ كغ/ يوم، وطريقة الإعطاء بحيث تسمح بالوصول إلى تراكيز تاموكسيفين، في مصل الفئران، تقارب مستوياته في مصول المرضى (14).
تعد الاستجابة المتواسطة بالخلايا الاستجابة المناعية الدفاعية الأهم في داء الليشمانيات. وتعتمد المناعة الفعالة ضد الليشمانية على إنتاج IL-12، الذي يحرض إنتاج الإنترفيرون غاما IFNγ من الخلايا NK القاتلة الطبيعية والخلايا التائية T-Cells، وبالتالي يؤدي دوراً جوهرياً في مقاومة العدوى، حيث يتوسط IFNγ إنتاج NO و NO2 في البلاعم، مما يعزز عملية القتل داخل البلاعم المصابة بالعدوى، للتخلص من الطفيلي (15، 16).
أظهرت دراستنا ارتفاعاً يعتد به إحصائياً في متوسط تركيز الإنترفيرون-غاما في مصل مجموعة الفئران المعالجة بالتاموكسيفين، بالمقارنة مع المجموعة الشاهدة، وذلك بعد أسبوع من بدء المعالجة بالتاموكسيفين. هذا وتعزز ارتفاع متوسط تركيز الإنترفيرون-غاما في مصل مجموعة الفئران المعالجة بالتاموكسيفين، بالمقارنة مع المجموعة الشاهدة، بعد أسبوعين من بدء المعالجة بالتاموكسيفين، أي في نهاية المعالجة وكان هذا الارتفاع معتداً به إحصائياً.
يمكن أن يشير ارتفاع الإنترفيرون غاما إلى أن التاموكسيفين يتداخل في تمايز الخلايا التائية غير المتمرسة مؤدياً إلى تحفيز طريقTh1، وهي الطريق الذي يؤدي إلى إنتاج كميات كبيرة من الإنترفيرون –غاما، الذي يلعب بدوره دوراً هاماً في عملية دفاع الجسم تجاه الطفيلي. وبالتالي يمكننا القول أن التاموكسيفين قد وجه الاستجابة المناعية للفئران المصابة بداء الليشمانيات الجلدي باتجاه مقاومة الطفيلي. لقد تطلب حدوث هذا التوجيه، بشكل واضح، وجوب معالجة الفئران بالتاموكسيفين يومياً لمدة أسبوعين بجرعة 20 ملغ/ كغ/ يوم، عن طريق الحقن داخل البريتوان. مما يوحي أن هذا التوجيه للاستجابة المناعية يحتاج إلى تراكم التاموكسيفين في مصول الفئران للوصول إلى التركيز الذي يستطيع تحريض الاستجابة السابقة. وبالتالي يمكن أن يحتاج بلوغ هذا التركيز تناول جرعات متعددة من التاموكسيفين، حتى تتراكم في مصول الفئران، لتصل في نهاية مدة المعالجة إلى التركيز المطلوب لتوجيه الاستجابة المناعية. لقد بينت دراسة برازيلية أن معالجة الفئران بالتاموكسيفين تترافق مع تحريض صانعات NO، وبالتالي زيادة إنتاج NO (17)، مما يسمح لنا بالقول أن أثر التاموكسيفين المضاد لليشمانية في الحي ينجم عن قدرته على زيادة إنتاج الإنترفيرون غاما والذي يحرض بدوره إنتاج NO.
بينت نتائجنا فعالية هذا الدواء ضد تكاثر الأشكال المتحركة وغير المتحركة لسلالة سورية لطفيليات الليشمانية المدارية، وقدرة هذا الدواء على تحريض استجابة من نمط Th1 عند الفئران.
|
| المراجع References |
1-Marouf M.
Distribution of cutaneous lishmaniasis in Damascus and its suburbs during 2002-2005.
Arab Journal of pharmaceutical sciences, 3(3): 39-51, 2006.
2-Gelpi AP.
Alexander Russell and the Aleppo ulcer.
Int J Dermatol, 26(2): 131-134, 1987.
3-Ashford RW; Rioux JA; Jalouk L; Khiami A. and Dye C.
Evedence for a long –term increase in the incidence of L. tropica in Aleppo,Syria Trans. Roy. Soc. Trop. Med. Hyg, 87(3): 247-249, 1993.
4- الكفري عبير
التوزع الجغرافي للفواصد في دمشق ودرعا والقنيطرة ومناطق من أريافها وتحري الليشمانية فيها ودراسة علاقتها الإحصائية بحالات الليشمانية الجلدية والحشوية في تلك المناطق. رسالة دكتوراه، كلية الطب – جامعة دمشق 2003.
5-Arfanul Bari
Choronology of cutaneous lishmaniasis: an overview of the history of the disease
Journal of Pakistan Association of Dermatologists; (16): 24-27, 2006.
6-Killiick-Kendrick R.
Phlebotomine vectors of the leishmaniasis.
Med. Vet. Entomol, (4): 1-24, 1990.
7-Kellina O.I.
On the dimensions of the leishmanial forms of L. major L. tropica and L. tropica minor. Medskaya parasitol, 3(1): 18-716, 1962.
8-Simon L. Croft and Alan H. Fairlamb
Drug Resistance in Leishmaniasis.
Clinical Microbiology Reviews, 1(19): 111-126, 2006.
9-Osborne CK.
Tamoxifen in the treatment of breast cancer.
N Engl J Med; 339: 1609-1618, 1998.
10-Fisher B; Costantino JP; Wickerham DL; Redmond CK; Kavanah M. and Cronin WM.
Tamoxifen for prevention of breast cancer: Report of the National Surgical Adjuvant Breast and Bowel Project P-1 Study.
J Natl Cancer Insts; 90: 1371-1388, 1998.
11-Danilo C. Miguel, Jenicer K.U. Yokoyama-Yasunaka1, Walter K. Andreoli, Silvia R. B. Uliana and Renato A. Mortara:
Tamoxifen is effective against Leishmania and induces a rapid alkalinization of parasitophorous vacuoles harbouring Leishmania (Leishmania) amazonensis amastigotes.
Journal of Antimicrobial Chemotherapy, 10(4): 1-9, 2007.
12-Danilo C. Miguel, Jenicer K.U. Yokoyama-Yasunaka and Silvia R.B. Uliana.
Tamoxifen is Effective in the Treatment of Leishmania amazonensis Infections in Mice. Public Library of Science Neglected Tropical Diseases, 2(6):1-5, 2008.
13-Beggs WH.
Drug protonation and pH in relation to the lethal action of tamoxifen on Candida albicans.
J Antimicrob Chemother, 37: 802-841, 1996.
14-Marchesini N. and Docampo R.
A plasma membrane P-typeH+ -ATPase regulates intracellular pH in Leishmania mexicana amazonensis.
Mol Biochem Parasitol; 119: 225-236, 2002.
15-Wang ZE; Reiner SL; Zhengs, Dalton DK. and Locksley KM.
CD4+ effector cells default to the Th2 pathway in interferon gamma-deficient mice infected with Leishmania major.
J Exp med; 179(4): 1367-1371, 1994.
16-Swihart K; Fruth U; Messmer N; Hug K; Behin R; Huang S; Del Giudice G. Aguet M. and Louis J.A.
Mice from a genetically resistant background lacking the interferon gamma receptor are susceptible to infection with Leishmania major but mount a polarized T helper cell 1-type CD4 T cell response.
J. Exp, Med. 181, 961-971, 1995.
17-Loo SA; Lesoon-Wood LA. and Cooney RV.
Effects of tamoxifen on nitric oxide synthesis and neoplastic transformation in C3H 10T1/2 fibroblasts.
Cancer Lett; 122, 67-75, 1998.
|
| |
| |
