| المجلد 6 ,
العدد 1
, ربيع الثاني 1432 - نيسان (أبريل) 2011 |
| |
| الفيكولينات: بروتينات جديدة في الاستجابة المناعية الخِلْقِيّة |
| Ficolins: Novel Proteins of the Innate Immune Response |
| د. أمال عساف |
| Amal Assaf |
كلية الطب البشري، جامعة دمشق
Damascus university, Faculty of medicine
(مقال مرجعي Review Article)
|
| الملخص Abstract |
يعد السبيل الثالث في تفعيل المتممة، والذي يسمى سبيل اللِيكْتِين الرابط للمانوز، آلية رئيسية في استجابة الطور الحاد للعدوى، إلا أن الاكتشاف الأحدث في هذا المجال هو وجود مجموعة من البروتينات تدعى الفيكولينات، التي تفعل المتممة بالسبيل نفسه، بالإضافة إلى وظائف بيولوجية أخرى، مما يعطي هذه البروتينات دوراً هاماً في المناعة الخِلْقِيّة. حاولنا في هذه المقالة إعطاء بعض المعلومات عن بنية هذه البروتينات وتآثراتها، وكذلك دور هذه البروتينات عند الإنسان ووظائفها.
The third pathway of complement activation, which is called Mannose-binding lectin (MBL), is a key mechanism for the acute phase response to infection, but the most recent discovery in this domain is group of proteins called Ficolins, which activate the complement in the same pathway, in addition to another biological functions and that give these proteins an important role in the innate immunity .We tried in this essay to present some information about structure, interaction, role and functions of these proteins in human. |
| المقدمة Introduction |
الفيكولينات Ficolins:
هي عائلة من البروتينات الذوابة، تعمل كجزيئات التعرف recognition molecules في نظام المتممة مشكلة بذلك جزءً من المناعة الخِلْقِيّة (الطبيعية) (18).
عرف الفيكولين، في البداية، كبروتين رابط لعامل النمو transforming growth factor (TGF)-b1-binding protein على غشاء باطن الرحم عند الخنزير (10)، ثم عزل الفيكولين الإنساني من البلازما وأشير إليه بالبروتين 35 (P35)، سمي فيما بعد L-ficolin (FCN-2) (17). ثم عزل الفيكولين البشري M-ficolin (FCN-1) من الدنا الجينومي وسمي P35-related protein (1)، بينما كشف الفيكولين H-ficolin (FCN-3) في مصل مرضى الذئبة الحمامية الجهازية، وحدد بوجود أضداد ذاتية عند هؤلاء المرضى، وسمي بالاسم القديم للمدينة التي كشف فيها هذا المستضد Hakata (11). إضافة إلى كشف وجود الفيكولين عند الإنسان، جرى كشفه عند عدد من الفقاريات، منها الجرذان (3)، والخنازير (21)، واللافقاريات كالحلزون (13).
بنية الفيكولينات Ficolins structure
تتشابه بنية الفيكولين مع بنية الجزء C1q من المتممة والليكتين الرابط للمانوزMBL) ) Mannose-binding lectin (18)، إذ يتألف الفيكولين من سلاسل ببتيدية متماثلة تحوي وحدات شبيهة بالفبرينوجين مشكلة رأساً كروياً، بينما يتألف الذيل من وحدات شبيهة بالكولاجين، تجتمع الأجزاء السابقة لتشكل البنية الوظيفية للفيكولين (الشكل (1 (17).
وبشكل مفصل أكثر البنية النموذجية للفيكولين بنية رباعية، تتألف من اجتماع 4 وحيدات subunits، تتضمن كل منها 3 سلاسل ببتيدية (الشكل 2)، وتتألف السلسلة الببتيدية في الفيكولين من الأجزاء التالية:
1- نهاية صغيرة NH2-terminal N تتصف بمنطقة تحوي ثمالات السيستيئين (نهاية N غنية بالسيستئين)، والتي تشكل جسوراً كبريتية مع السلاسل الأخرى لتشكيل البنية الرباعية، وذلك باجتماع الأشكال قليلة القسيمات (ثلاثية trimer) إلى شكل عديد القسيمات يشبه العنقود (17).
2- وحدات شبيهة بالكولاجين مسؤولة عن ارتباطه بالإنزيمات Mannose associated serine protease (MASP)، تضم كل سلسلة11 -19 تكراراً من الثلاثية (Gly-X-Y)، حيث يشير x، y إلى أحماض أمينية مختلفة، وعبر هذه الوحدات تتجمع السلاسل الببتيدية الثلاثة في الشكل المثلوث مشكلة وحيدة.
3- منطقة الرقبة وهي قصيرة بالمقارنة مع MBL.
4- نهاية COOH –terminus وهي وحدات شبيهة بالفبرينوجين (النهاية C الكروية الفبرينوجينية) والتي ترتبط بالبنية الهدف كونها مؤلفة من وحدات رابطة للسكريات.
هذا وإن البنية المتعددة الأقسام للفيكولين تؤمن ارتباط النهاية الفبرينوجينية بالكربوهيدرات الموجودة على سطح العوامل الممرضة (4).
هذا وتتشابه بنية الفيكولين 1 مع الفيكولين 2، إذ أن وزن الوحيدة في الفيكولين 1 و 2 هو 35 كيلودالتون، كما أن كليهما ذو بنية رباعية، ولكن عدد تكرارات الأحماض الأمينية Gly-Xaa-Yaa في الوحدات الشبيهة بالكولاجين في الفيكولين الثاني هو 15، ويرتفع إلى 19 في الفيكولين الأول، بسبب وجود إكسون إضافي في مورثته (4)، بينما للفيكولين 3 بنية سداسية بالمجهر الالكتروني. ويبلغ وزن وحيدته 34 كيلودالتون، أما عدد تكرارات Gly-Xaa-Yaa فهي 11. وفي ما يتعلق بعدد الأحماض الأمينية، يضم بروتين الفيكولين الأول 326 حمضاً أمينياً، والثاني 313، والثالث 299 (الجدول 1).
جينات الفيكولينات Ficolins Genes
عُزلت عند الإنسان 3 جينات للفيكولينات FCN1, FCN2, FCN3 والتي ترمز لـ:
Ficolin-1(المرادف للـ ficolin-M أو Ficolin/P35-related protein)؛
Ficolin-2 (المرادف للـ L-ficolin أوHucolin, Ficolin/P35 )؛
Ficolin-3 (المرادف للـ H-ficolin أو Hakata antigen).
تتوضع جين الـ FCN1 و FCN2 على الصبغي التاسع في الموقع 9q34، بينما ينسب الـ FCN3 للصبغي الأول في الموقع (1p36.11) (1، 5) (الجدول 1).
تضم جين الـ FCN1 9 إكسونات، بينما تضم جين الـ FCN2والـ FCN3 8 إكسونات.
مقرات التعبير عن الفيكولين Sites of ficolin expression
يُعبّر عن الفيكولين 1 بشكل أساسي في وحيدات
الدم المحيطي ونقي العظام، والقليل منه في الطحال والخلايا السنخية من النمط الثاني في الرئتين (1، 5، 7)، ولقد أثبت وجوده على سطح الخلايا وحيدات النوى وبذلك ترتبط درجة التعبير عن الـ FCN1 بنضج وحيدات النوى إلى بلاعم، ويقدر مستواه المصلي بين 0.04–0.11 مكروغرام/ مل (وسطياً 0.06) (الشكل 3) (7).
يعبر عن الفيكولين 2 FCN2 بشكل أساسي في الكبد (1، 8)، ووجدت كميات قليلة من mRNA الفيكولين 2 في نقي العظام واللوزات والأمعاء
(5)، يتراوح تركيز الفيكولين 2 الملي من 1-12 مكروغرام/ مل وتتراوح معظم القيم بين 3-6 مكروغرام/ مل (8).
يعبر عن الفيكولين 3 FCN3 في الكبد والرئتين، إذ يتم التعبير عنه في الكبد من قبل الخلايا الكبدية وخلايا القناة الصفراوية ويفرز منها إلى القناة الصفراوية والدوران، أما في الرئتين فتقوم بهذه المهمة خلايا ظهارة القصبات المهدبة والخلايا السنخية الظهارية من النمط الثاني، ويفرز منها إلى لمعة القصبات والمسافات السنخية، كما يعبر عنه أيضاً بكميات قليلة في القلب والكلية والبنكرياس (المعثكلة) والطحال والمشيمة، وكشف الـ mRNA الخاص به بكميات قليلة في الدماغ (5، 9)، أما تركيزه فيتراوح بين 3-54 مكروغرام/ مل والمتوسط 25 مكروغرام/ مل (7).
|
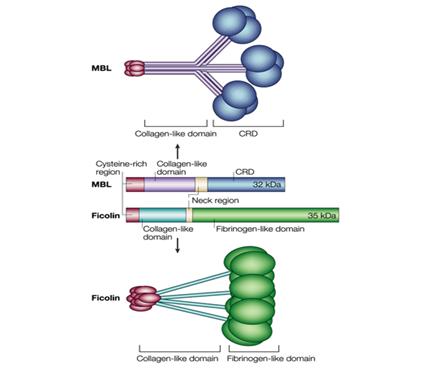
الشكل 1: مقارنة بين بنية الفيكولين والبروتين الرابط للمانوز: منطقة الرقبة قصيرة في الفيكولين بالمقارنة مع MBL ، تشكل النهاية C الوحدات الشبيهة بالفبرينوجين في الفيكولين، بينما هي وحدات تمييز الكربوهيدرات في MBL .
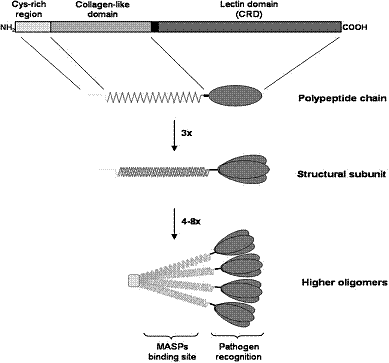
الشكل 2: البنية التفصيلية للفيكولين: تجتمع 3 سلاسل عديدة ببتيد عبر الوحدات الشبيهة بالكولاجين لتشكل وحيدة، وباجتماع 4 وحيدات عبر الجسور الكبريتية تتشكل البنية الوظيفية للفيكولين.
الجدول 1: مقارنة مواقع جينات الفيكولينات الثلاث والبروتينات الناجمة عنها، من حيث أماكن التعبير عن المورثة، وزن الوحيدة، عدد الأحماض الأمينية، أماكن تواجد البروتين وأهم وظائفه.
الفيكولين |
موقع الجين |
أماكن التعبير عن الـ mRNA |
وزن الوحيدة (kDa ) |
عدد الأحماض الأمينية |
أماكن تواجده |
عدد تكرارات الـ Gly-Xaa-Yaa |
الوظيفة |
FCN-1 |
9q34 |
وحيدات النوى المحيطية |
34 |
326 |
سطح وحيدات النوى |
19 |
مستقبل بلعمي+ تفعيل المتممة |
FCN-2 |
9q34 |
الكبد |
35 |
313 |
البلازما |
15 |
تفعيل المتممة +
الطهي |
FCN-3 |
1p36.11 |
الكبد، الرئتين |
35 |
299 |
البلازما |
11 |
تفعيل المتممة +
الطهي |
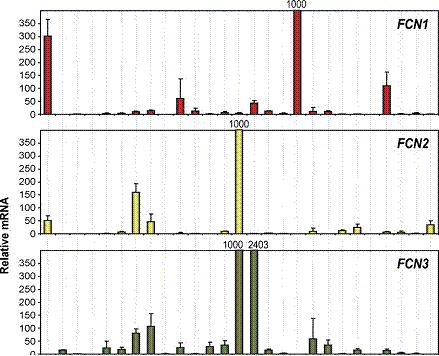

الشكل 3: التوزع النسيجي للفيكولينات (أماكن التعبير الأساسي للفيكولين 1 هو الكريات البيضاء المحيطية وكميات قليلة في نقي العظم والطحال، بينما يعبر عن الفيكولين 2 في الكبد، والفيكولين 3 في الرئة والكبد). |
تآثر الفيكوليناتInteraction of ficolins
يمكن لكل أنواع الفيكولينات أن ترتبط عبر النهاية الفبرينوجينية بمجموعة الأسيتيل سواء من الكربوهيدرات، مثل N-أسيتيل غلوكوز أمين GlcNAc، أو N-أسيتيل غالاكتوز أمين GalNAc، أو من مركبات أخرى مثل N-acetyl-glycine، أو مركبات صنعية تتضمن الأسيتيل، مثل acetylated albumins وacetylated LDL، ولكن بدرجات مختلفة فيما بينها. ولذلك فإن لكل فيكولين انحيازاً مختلفاً عن الآخر في ارتباطاته بالعوامل الممرضة، مما يشير إلى اختلاف طيف العوامل الممرضة التي تميزها الفيكولينات (17). ويبدو أنه باستطاعة الفيكولين 2 تمييز الطيف الأكبر من أنماط الجزيئات المرافقة للعوامل الممرضة pathogen-associated molecular patterns (PAMP)، والتي تقع غالباً في جدر العوامل الممرضة مثل: الليبوتكويك أسيد (LTA) في جدر إيجابيات الغرام، والببتيدوغليكان (PGN)، وعديد السكريد الشحمي lipopolysaccharide (LPS) في جدر سلبيات الغرام، و1,3-β-D-glucan في جدر الخمائر والفطور وال ـ Elastin والكورتيكوستيرويدات والـ DNA (18،14،19) (الجدول 2).
هذا وتشير البنية البلّورية للفيكولين1 و 3 إلى وجود موقع ارتباط واحد على الوحدات الشبيهة بالفبرينوجين، بينما يملك الفيكولين 2 أربعة مواقع، مما يدل على مجال ارتباطاته الواسع أكثر من الفيكولينات الأخرى (الشكل 4) (4). |
الجدول 2: أهم ارتباطات الفيكولينات
الفيكولين |
روابط الكاربوهيرات |
روابط أخرى |
الفيكولين 1 |
• GlcNAc
• GalNAc |
• sialic acid |
الفيكولين 2 |
• GlcNAc |
• N-acetylneuraminic acid
• lipoteichoic acid
• C-reactive protein
• fibrinogen
• fibrin
• 1,3-β-D-glycan
• DNA
• Elastin
• corticosteroid
• Peptidoglycan |
الفيكولين 3 |
• GlcNAc
• GalNAc
• Fucose |
• lipopolysaccharide
•polysaccharide |
الشكل 4: مقارنة مواقع الارتباط على الفيكولينات الثلاث (لوّن S1 بالأخضر، S2 بالأحمر، S3 بالأسود، S4 بالبرتقالي)، بينما تظهر أيونات الكالسيوم بشكل كرات ذهبية. |
Complement Activation تفعيل المتممة |
تعد جُمْلَةُ المُتَمِّمَة ذراعاً هاماً في المناعة الطبيعية، وتتواجد في الدوران بشكل شلال بروتياز مصلية، ويجري تفعيلها بطرق متعددة (الشكل 5)، أولها: السبيل التقليدي الذي يبدأ بتمييز المعقد المناعي من قبل الـ C1q والتفعيل المتتالي للبروتياز المصلية C1r و C1s ، بينما يتفعل السبيل الثاني، وهو السبيل البديل، من قبل العوامل الممرضة نفسها بدون إشراك الأضداد، أما السبيل الثالث فيسمى سبيل الليكتين الرابط للمانوز MBL pathway ويتفعل بمشاركة مجموعة من الإنزيمات، حيث أن البروتين الرابط للمانوز وعبر نهايته الكولاجينية يترافق مع إنزيم البروتياز MASP، الذي يشبه في بنيته C1r و C1s (الشكل 6). فعند ارتباط جزيئات التمييز الموجودة على MBL مع الجزيئات المرافقة للعوامل الممرضة PAMPs، مثل الكربوهيدرات أو مركبات الأسيتيل وغيرهاعلى سطح العوامل الممرضة أو الخلايا الميتة، فإن الـ MASP المرتبطة مع MBL تتفعل فينشطر الارتباط بين arginine-isoleucine (Arg-Ile)، وتنقلب من الشكل طليعة الإنزيم عديد الببتيد غير الفعال إلى الشكل الفعال المؤلف من سلسلتين عديد ببتيد مرتبطتين بروابط كبريتية ذات فعالية حالة بروتينية تجاه مكونات المتممة (16).
فبينما يشطر الـ MASP-1الـ C3, C2، يشطر الـ MASP-2 الـ C4, C2 MASP-3 والنتيجة تشكل الـ C4b و C2aالتي ترتبط مع
بعضها مشكلة الـ C3 convertaseالذي يشطر الـ C3إلى C3a و C3b، حيث يرتبط الـ C3b بشكل متكافئ ببروتينات سكرية glycoproteins موزعة على سطوح العوامل الممرضة، بالمقابل فإن البلاعم والمعتدلات تملك مستقبلات للـ C3b وبإمكانها ربط الخلايا المغلفة بالـ C3b، بعض الـ C3b يرتبط بالمعقد C4bC2a ويشطر C5 إلى C5a و C5bعندها يرتبط الـ C5b بالـ C6, C7, C8 والـ C9 مشكلة معقد مهاجمة الغشاء membrane attack complex (MAC) الذي يعمل على حل خلايا العوامل الممرضة.
إن التشابه في البنية والوظيفة بين الفيكولين والـ MBL يطرح سؤالا إن كانت الإنزيمات السابقة ترافق الفيكولين أيضاً؟ وبالفعل فقد أثبت التلطيخ والترسيب المناعي أن الفيكولين الثاني المعزول من مصل الإنسان يرتبط بالـ sMAP، MASP-1، MASP-2، MASP-3 (18)، وأن هذه الإنزيمات تكون بشكل طليعة غير فعال في المعقد ficolin/P35 complex وتنقلب إلى الشكل الفعال خلال تنقية ficolin/P35 x، كما أن لها فعالية حالة للبروتين تجاه الـ C4، C2، C3 (18).
وكما هو الحال بالنسبة للفيكولين 2 فإن الفيكولين 1 و 3 يرتبطان بالـ MASPs و sMAP ويفعلان المتممة بارتباطهما ببعض الكربوهيدرات وشطرها للـ C2, C4, C3 (15، 2، 20)، ولكن القدرة على تفعيل المتممة تختلف فيما بينها، حيث أن قدرة الفيكولين 1 أقل من الفيكولين 3 و 2 (9).
|
|
آليات عمل الفيكولين Functional mechanisms
يقود ارتباط الفيكولين بالعامل الممرض إلى إطلاق عمليات مناعية عديدة: كتفعيل المتممة والبلعمة وغيرها، وعلى ما يبدو فإن التأثير البيولوجي الأهم هو تفعيل المتممة، إذ أن الفيكولين وعبر نهايته الشبيهة بالكولاجين يترافق مع إنزيم البروتياز MASP الذي يشبه في بنيته C1r و C1s (19)، فعند ارتباط جزيئات التعرف الموجودة على النهاية الشبيهة بالفبرينوجين من الفيكولين مع الجزيئات المرافقة للعوامل الممرضة PAMPs فإن الـ MASP ينقلب من الشكل طليعة الإنزيم غير الفعال إلى الشكل الفعال القادر على شطر الـ C4، C2 ليبدأ تفعيل المتممة بسبيل الليكتين بدون تدخل الـ C1r و C1s (الشكل 6)، والذي يؤدي إلى الطهي غير المباشر عبر ترسب الأجزاء الطاهيةC4b ، C3b على العامل الممرض، مما يشجع تصفيتها وبلعمتها بوساطة التفاعل مع مستقبلات الـ C4b، C3b على سطح البلاعم (14)، أو القضاء على الهدف بتشكيل معقد مهاجمة الغشاء بدون تآثر مستقبلات الفيكولين على سطح البلاعم (16).
من جهة أخرى يمكن للفيكولينات أن تلعب بنفسها دور الطاهي، هذا وإن فعل الطهي هذا يتطلب تفاعلاً بين هذا البروتين والمستقبلات على سطح البلاعم، ومن المرجح أن تتشاطر الفيكولينات ومستقبلات الكالرِيتِيكُولِين (بروتين في النسيج الضام) calreticulin (CRT) وبعض أجزاء المتممة مثل cC1qR، والذي أثبت أن الفيكولين 2 و 3 يرتبط بها (6، 14)، وإن العديد من المستقبلات الأخرى مرشحة للعب هذا الدور، و منها CR3و FcR (الشكل 7).
كما أنه عند ارتباط الفيكولين بمستقبلات الكالرِيتِيكُولِين فإنه يفعل الخلايا المناعية لإفراز السيتوكينات مثل عامل نخر الورم ألفا TNF-a والإنترلوكينات IL-1 و IL-8(19).
وظائف أخرى للفيكولينات
يبدو أن الفيكولين 1 يعمل كبروتين طور حاد، فهو
يخزن بشكل مؤقت في الحبيبات الإفرازية للكريات البيضاء المعتدلة ووحيدة النوى، لذلك يوجد بتركيز قليل في المصل الطبيعي (7)، ولكن يمكن أن يفرز إلى المنطقة المجاورة لإتمام عمله في دفاعات الثوي لدى تحريضه عبر العوامل الممرضة أو السيتوكينيات (7)، ومن المثبت أيضاً أن الفيكولين 1 يعزز تمثل الجراثيم من قبل وحيدات النوى، بالإضافة إلى دوره كمستقبل بلعمي لتمييز العوامل الممرضة أيضاً (7)، ولقد جرى إثبات الدور الطاهي للفيكولين 1 أيضاً عن طريق بلعمة الخلايا U937 للإشريكية القولونية، حيث جرى تثبيط فعل البلعمة باستخدام أضداد الفيكولين 1 (7)، كما أنه بالإضافة لارتباط الفيكولين 1 بالـ GlcNAc والـ GalNAc فإنه يرتبط مع حمض السياليك الذي يلعب دوراً مهماً كمستقبل للجزيئات التي تنظم النمو والتمايز الخلوي، والاتصال الخلوي الخلوي والالتصاق (22). أما الفيكولين 2 فإنه يعمل كطاهٍ للبلعمة، حيث أنه يعزز تمثل جراثيم السَّلْمونيلَةُ التِّيفِيَّة TV119 وبلعمتها من قبل المعتدلات ووحيدات النوى (17). وبالإضافة إلى فعالية الطهي يستطيع الفيكولين 2 تفعيل المتممة بارتباطه مع MASPs و sMAP. هذا وإن طيف العوامل الممرضة التي يميزها الفيكولين 2 تزيد عن تلك
التي يميزها MBL (17).
بالإضافة إلى وظائفه في المناعة الخلقية فإن الفيكولين 2 يتدخل في عملية الاستماتة الخلوية apoptosis بتمييزه الـ DNA، إذ أنه يرتبط إلى الخلايا المتنخرة والخلايا الميتة بطورها المتأخر (41)، وإن طهي الخلايا المتنخرة المحفز بالفيكولين 2 يعزز التصاقها وتمثلها بوساطة البلاعم، كما يعزز تفعيل المتممة الذي ينتج عنه الجزء C3b الطاهي، أي أن للفيكولين 2 فعالية طاهية خلال عملية الاستماتة أيضاً (12، 14) وفعالية الطهي هذه للفيكولينات البشرية تتوسطها مستقبلات على البلاعم كـ CR1, cC1q receptor/calreticulin (16). وهكذا يبدو أن الوظيفة الجديدة للفيكولين 2 هو المساعدة في تمييز وتصفية خلايا المضيف الميتة فيكون بذلك جزيئة كانسة للحفاظ على استتباب الأنسجة.
كما يمكن للفيكولين أن يميز البروتين المُتَفاعِلُ C (CRP) المترسب، والـ CRPهو بروتين مصلي يرتبط إلى كربوهيدرات خاصة على سطح العوامل الممرضة، وإن الـ C1 يرتبط إلى CRP عبر الجزء C1q مفعلاً المتممة بالسبيل التقليدي، دون تدخل الغلوبولينات المناعية. وأثبتت الدراسات الحديثة أن الفيكولين 2 يرتبط مع البروتين المُتَفاعِلُ C في الانتانات والالتهابات الموضعية، وهذا الارتباط يقوي ارتباط الـ CRP بالعوامل الممرضة، وبالنتيجة يزيد تفعيل المتممة (23)، وهذه الموجودات تقترح التعاون بين الفيكولينات والـ CRP خلال طور الشدة الالتهابي في تهيئة الاستجابة الالتهابية وفي المناعة الطبيعية.
أما الفيكولين 3 فإنه يفعل المتممة كما ذكر سابقاً بارتباطه معMASP ، وكما هو الحال في الفيكولين 2 فإن الفيكولين 3 يرتبط بالخلايا الميتة (6، 14)، الأمر الذي قادنا إلى افتراض أن هذه الجزيئات تتدخل في إزالة الخلايا الميتة.
وكإستنتاج فإن للفيكولينات عملاً مشابهاً للـ MBL، إذ أنها تميز عوامل ممرضة مختلفة عبر وحداتها الرابطة للكربوهيدرات وتحذفها بوساطة الطهي، على ما يبدو بوساطة وحداتها الشبيهة بالكولاجين. إذاً فالأنواع الثلاثة من الفيكولينات تعمل كجزيئات تمييز وتصفية العناصر الغريبة، كالعوامل الممرضة والخلايا الميتة من الثوي عبر سبيل الليكتين، وكل ما سبق يقدم دليلاً على حقيقة أهمية هذه الجزيئات في المناعة الخِلْقِيّة اللانوعية.
|
| المراجع References |
1-Endo Y; Sato Y; Matsushita M. and Fujita T.
Cloning and characterization of the human lectin P35 gene and its related gene.
Genomics, 36: 515-521,1996.
2-Frederiksen PD; Thiel S; Larsen CB. and Jensenius JC.
M-ficolin, an innate immune defence molecule, binds patterns of acetyl groups and activates complement.
Scand J Immunol; 62: 462-473, 2005.
3-Fujimori Y; Harumiya S; Fukumoto Y; Miura Y;Yagasaki K; Tachikawa H. and Fujimoto D.
Molecular cloning and characterization of mouse ficolin-A.
Biochem. Biophys. Res Commun; 244: 796-800,1998.
4-Garlatti V. et al.
Structural insights into the innate immune recognition specificities of L- and H ficolins.
EMBO J; 26: 623-633, 2007.
5-Garred P; Honoré C; Ma Y J; Munthe-Fog L. and Hummelshj T.
MBL2, FCN1, FCN2 and FCN3-The genes behind the initiation of the lectin pathway of complement.
Molecular Immunology, 46 :2737-2744, 2009.
6-Honore C; Hummelshoj T; Hansen BE; Madsen HO; Eggleton P. and Garred P.
The innate immune component ficolin 3 (Hakata antigen) mediates the clearance of late apoptotic cells.
Arthrit Rheum; 56: 1598-1607, 2007.
7-Honore C. et al.
The innate pattern recognition molecule ficolin-1 is secreted by monocytes/ macrophages and is circulating in human plasma.
Mol Immunol; 45: 2782-2789, 2008.
8-Hummelshoj T; Munthe-Fog L; Madsen HO; Fujita T; Matsushita M. and Garred P.
Polymorphisms in the FCN2 gene determine serum variation and function of Ficolin-2. Human Mol Genet. 14:1651-1658, 2005.
9-Hummelshoj T; Munthe-Fog L; Madsen HO; Sim RB. and Garred P.
Comparative study of the human ficolins reveals unique features of Ficolin-3 (Hakata antigen).
Mol Immunol; 45, 1623-1632, 2008.
10-Ichijo H; Ronnstrand L; Miyagawa K; Ohashi H; Heldin CH. and Miyazono K.
Purification of transforming growth factor-beta 1 binding proteins from
porcine uterus membranes.
J. Biol. Chem. 266, 22459-64, 1991.
11-Inaba S; Okochi K; Yae Y; Niklasson F. and de Verder CH.
Serological studies of an SLE-associated antigen-antibody system discovered as a precipitation reaction in agarose gel: the HAKATA
antigen-antibody system.
Fukuoka Igaku Zasshi; 81: 284-291, 1990.
12-Jensen ML; Honore C; Hummelshoj T; Hansen BE; Madsen HO. and Garred P.
Ficolin-2 recognizes DNA and participates in the clearance of dying host cells.
Mol Immunol; 44: 856-865, 2007.
13-Kenjo A. et al.
Cloning and characterizationof novel ficolins from the solitary ascidian; Halocynthia roretzi.
J Biol Chem; 276: 19959-19965, 2001.
14-Kuraya M; Ming Z; Liu X; Matsushita M. and Fujita T.
Specific binding of L-ficolin and H-ficolin to apoptotic cells leads to complement activation.
Immunobiol; 209: 689-697, 2005.
15-Liu Y. et al.
Human M-ficolin is a secretory protein that activates the lectin complement pathway.
J Immunol; 175: 3150-3156, 2005.
16-Matsushita M.
Ficolins: Complement-Activating Lectins Involved in Innate Immunity.
J Innate Immun; 2: 24-32, 2010.
17-Matsushita M. et al.
A novel human serum lectin with collagen and fibirinogen-like domains that functions as an opsonin.
J Biol Chem; 271: 2448-2454,1996.
18-Matsushita M. and Fujita T.
Ficolins and the lectin complement pathway.
Immunol Rev; 180: 78-85, 2001.
19-Matsushita M; Fujita T. and Lee BL.
Human mannose-binding lectin and L-ficolin function as specific pattern recognition proteins in the lectin activation pathway of
complement.
J Biol Chem; 279: 25307-12, 2004.
20-Matsushita M; Kuraya M; Hamasaki N; Tsujimura M; Shiraki H. and Fujita T.
Activation of the lectin complement pathway by H-ficolin (Hakata antigen).
J Immunol; 168: 3502-3506, 2002.
21-Ohashi T. and Erickson HP .
Two oligomeric forms of plasma ficolin have differential lectin activity.
J Biol Chem; 272: 14220-14226, 1997.
22-Sotiropoulou G; Kono M; Anisowicz A; Stenman G; Tsuji S. and Sager R.
Identification and functional characterization of a human GalNAc [ ]2,6-sialyltransferase with altered expression in breast cancer.
Mol Med; 8: 42-55, 2002.
23-Zhang J; Koh J; Lu J; Thiel S; Leong BS; Sethi S; He CY; Ho B. and Ding JL.
Local inflammation induces complement crosstalk which amplifies the antimicrobial response.
PLoS Pathog; 5: e1000282, 2009.
|
| |
| |
| |
| |
| المجلد 6 ,
العدد 1
, ربيع الثاني 1432 - نيسان (أبريل) 2011 |
|
|
|
