| المجلد 6 ,
العدد 10
, شعبان 1434 - تموز (يوليو) 2013 |
| |
| تنميط جزيئي لسلالات اللِّيشْمانِيَّة الجلدية المعزولة من مرضى في اليمن
بطريقة التفاعل السلسلي للبوليميراز PCR
|
| Molecular Typing of Leishmania cutanea Strains Isolated from Patients in Yemen by PCR Technique |
| نبيل مجلي، شادي سكرية، سعاد العقلة، و محمود قويدر |
| Mogalli N; Chadi S; Al-Okla S. and Kweider M. |
كلية العلوم – جامعة دمشق
Faculty of Sciences, Damascus University
|
| الملخص Abstract |
| يعد داء الليشمانيات واحداً من الأمراض الطفيلية الرئيسية في الدول النامية، إذ ينتشر في العديد من مناطق الشرق الأوسط، كالعربية السعودية والأردن وسورية واليمن. يعرف لهذا الداء ثلاثة أشكال سريرية هي: الداء الجلدي والداء الجلدي المخاطي والداء الحشوي. ولقد جرى تطوير مجموعة من طرق التشخيص وتعيين نمط الطفيلي بهدف إعطاء العلاج المناسب. وتتضمن هذه الطرق التحليل الإيزوإنزيمي والطرق المصلية المناعية وتهجين DNA. ولعل الأداة الممتازة لتشخيص أنواع الليشمانية وتحديد خصائصها هي التفاعل السلسلي للبوليميراز PCR باستخدام DNA الجينومي أو الكينيتوبلاستي. عملنا في هذه الدراسة على عينات معزولة من مرضى يمنيين مصابين بداء الليشمانيات الجلدي. اعتمد التشخيص على الفحص المجهري المباشر للطاخات شق جلد أخذت من حافة الآفات. وعينا هوية أنواع الليشمانية باستخدام التفاعل السلسلي للبوليميراز PCR. فأظهرت نتائجنا أن الليشمانيا المدارية L. Tropica هي النوع المسبب لداء الليشمانيات الجلدي. |
| Leishmaniasis is one of the major parasitic diseases in under development country, widespread in many of the Middle East regions, Saudi Arabia, Jordan, Syria, and Yemen. The disease is present in three clinical forms: cutaneous, mucocutaneous and visceral leishmaniasis. A set of methods for diagnosis and identifying the type of parasite have been developed in order to give appropriate treatment. These methods include isoenzyme analysis, serological, immunological methods and DNA hybridization. The polymerase chain reaction (PCR), using genomic or kinetoplastid DNA; provides an excellent tool for diagnosis and characterization of leishmania species. In this study we worked on samples isolated from Yemeni patients affected with Cutaneous Leishmaniasis. The diagnosis was based on direct microscopic observation by skin slit smears taken from the edge of the Lesions. We identified leishmania species by polymerase chain reaction (PCR). Our results
showed cutaneous Leishmaniasis was caused by L.tropica.
|
| المقدمة Introduction |
يعرف داء اللشمانيات منذ قدم التاريخ بأنواعه الجلدي والجلدي المخاطي والحشوي ولقد وجد وصف له في العالم القديم منذ القرن الأول الميلادي. ويعد حالياً أحد أهم الأمراض الطفيلية العدوائية على مستوى العالم، نظراً لانتشاره في أربع قارات (آسيا، إفريقيا، أوروبا، أمريكا) واستيطانه في 88 بلداً، ويقدر عدد الإصابات به في كل عام بحوالي مليوني إصابة، كما يقدر عدد المعرضين لخطر الإصابة بحوالي 350 مليون شخصاً نظراً لوجودهم في أماكن انتشار الداء. تسجل أكثر من 90% من حالات الليشمانية الحشوية في العالم في بنغلادش، والبرازيل، والهند، والسودان. بينما 90% من حالات اللشمانية الجلدية أُحصيت في أفغانستان، البرازيل، إيران، المملكة العربية السعودية، الجمهورية العربية السورية، اليمن. في حين ينتشر الداء الجلدي المخاطي في مناطق محدودة من العالم كالبرازيل. وذلك بحسب إحصائيات منظمة الصحة العالمية Jose A; 2010)).
يسبب الداء طفيلي وحيد خلية من جنس الليشمانية Leishmania، إجباري التطفل داخل خلوي، حيث يتطفل عادة على أنواع البلاعم. ويصنف هذا الجنس من صف السوطيات Flagellate وفصيلة المثقبيات Trypanosomatidae، ويعرف منه حوالي ثلاثين نوعاً ممرضاً للإنسان والثدييات الأخرى، من أهم الأنواع المسببة للداء الجلدي الليشمانية المداريةL.tropica ، والليشمانية الكبرى L.major، والليشمانية الاثيوبية L.aetiopica والأنواع المسببة للداء الحشوي الليشمانية الطفلية L.infantum، والليشمانية الدونوفانية L. donovani. تُعد أنثى الفاصدة Phlebotomus أو ذبابة الرمل Sand fly الحشرة المسؤولة عن نقل الأنواع المختلفة من طفيلي الليشمانية إلى الإنسان.
تشخص عادة الإصابة بداء الليشمانيات الجلدي عن طريق الفحص المجهري المباشر لعينة ترفع من مكان الإصابة وتلون بملون غيمزاGiemsa . تبين أن حوالي 40% من الحالات السلبية بالفحص المجهري كانت إيجابية عند استخدام طرق أخرى، مما يعكس الحساسية المنخفضة لهذه الطريقة في كشف الطفيلي (Rodriguez et al; 1994). كما أن الفحص المجهري المباشر لا يسمح بتحديد نوع الطفيلي. بالمقابل، تتطلب معظم الطرق الأخرى مثل الدراسات الكيميائية الحيوية والمناعية والجزيئية استنبات الطفيليات لعدة أسابيع للحصول على كميات كافية. عادة ما تستخدم تقنية الرحلان الكهربائي الإنزيمي عديد المواقعMultilocus enzyme electrophoresis أو ما يعرف بالتحليل الإيزوإنزيمي Isoenzyme analysis لتحديد نوع الطفيلي (Aljeboori and Evans, 1980a; Aljeboori and Evans, 1980b; Bin et al; 2010). لكن هذا النمط من الاختبارات يتصف بكونه عالي الكلفة، ويحتاج إلى معدات نوعية ويتطلب فترة زمنية طويلة نسبياً. بينما تعد الاختبارات المناعية، المعتمدة على الأضداد وحيدة النسيلة التي تتعرف بشكلٍ نوعي على الأنواع المختلفة للطفيلي، غير دقيقة بسبب التشابه الكبير للمستضدات السطحية بين الأنواع المختلفة للطفيلي مما يؤدي إلى حدوث تفاعلات تصالبية بين الأنواع (Jaffe et al; 1984; Jaffe and McMahon-Pratt, 1987).
جرى في السنوات الأخيرة تطوير الكثير من التقنيات الجزيئية التي تعتمد على DNA في تشخيص وتحديد نوع الطفيلي المسبب لداء الليشمانيات، منها التقانات المعتمدة على التهجين مثل تلطيخ وزرن Southern blotting والتقانات التي تعتمد على التعددات الشكلية للمواقع الجينومية، مثل التعدد الشكلي لأطوال شدف التقييد restriction fragment length polymorphism (RFLP). ويعد التفاعل السلسلي للبوليميراز Polymerase Chain Reaction (PCR) أهم هذه التقنيات (Harris et al; 1998; Noyes et al; 1998)، حيث يتصف بالنوعية والحساسية العالية في تشخيص الإصابة، وتحديد نوع الطفيلي المسبب لها (Ashford et al; 1995; Osman et al; 1997). يعتمد هذا التفاعل إما على استخدام بعض المواقع الجينومية المتغايرة بين الأنواع مثل: التسلسلات المرمزة للـ rRNA الخاص بالوحدة الصغيرة للريبوزوم والذي يعرف بـ ssurRNA (Campino et al; 2000; de Lima et al; 2010; van Eys et al; 1992)، والتسلسلات الداخلية المنتسخة المباعدة بين الجينات المرمزة للـ rRNA internal transcribed spacer أو ما يعرف بالـ ITS (el Tai et al; 2000; Schonian et al; 2000)، أو على DNA الكينيتوبلاستي kinetoplasted DNA (kDNA). يعرف DNA الكينيتوبلاستي بهذا الاسم نسبة إلى العضية التي تحويه وهي الكينيتوبلاست kinetoplaste أو صانعة السوط، وهي عضية مميزة لصف السوطيات. تحوي هذه العضية في الليشمانية نوعين من DNA الحلقي: يعرف الأول بالحلقات الصغيرة Minicircles، حيث لا يتجاوز حجم هذه الحلقات 800 شفعاً من الأسس 800bp، ويبلغ عدد نسخ هذا النمط من DNA في الصانعة الواحدة حوالي عشرة آلاف. ويعرف الثاني بالحلقات الكبيرة Maxicircels الذي يتجاوز طوله عدة آلاف من أشفاع الأسس، وتحوي الصانعة الواحدة حوالي خمسين نسخة (Shlomai, 1994). تتصف الحلقات الصغيرة في كل أنواع جنس الليشمانية باحتوائها على تسلسلٍ محافظٍ، يتألف من 120 شفعاً من الأسس، يميز جنس الليشمانية عن باقي السوطيات، أما باقي التسلسل فهو متغاير في طوله بين الأنواع ويمكن الاعتماد على هذا التغاير في تحديد نوع الطفيلي باستخدام تقانة PCR. لذلك استخدمت الحلقات الصغيرة في تشخيص الإصابة بالليشمانية وتنميط الطفيلي (Laskay et al; 1995; Reale et al; 1999; Rodriguez et al; 1994).
على الرغم من الانتشار الواسع لداء الليشمانيات في اليمن إلا أن الدراسات الجزيئية والمناعية حول هذا الداء ما تزال قليلة. تعود أول الحالات الموثقة للإصابة بالداء الجلدي إلى عام 1933 (Sarnelli; 1933) ، وصفت بعدها بعض الحالات الجلدية والحشوية دون تحديد دقيق لنمط الطفيلي المسبب للداء (Rioux et al. 1986; Pratlong et al. 1995; AL-Shamahy h. et al. 1996; Khatri et al. 1999).
أظهرت مؤخراً دراستان، أنجزتا بهدف تحديد أنواع الليشمانية المسببة للداء الجلدي، باستخدام تقانتي PCR وRFLP، على عزلات جُمعت من بعض المناطق في اليمن، وجود عدة أنواع من الطفيلي، ساد فيها انتشار النوع المداري بشكلٍ واسع (Khatri, et al; 2009; Mahdy MAK, et al; 2010).
جرى في هذا البحث تشخيص مباشر للإصابة بالليشمانية الجلدية وتحديد نوع طفيلي المسبب للداء. حيث جرى استفراد DNA مباشرة من اللطاخة بعد دراستها مجهرياً، وجرى الاعتماد على kDNA في تحديد نوع الطفيلي المدروس باستخدام شفع من المشارع تتشافع مع تسلسلات محافظة، وتضخم شدفاً متغايرة الأطوال مميزة لنوع الطفيلي، وتبين بنتيجة هذه الدراسة أن جميع العزلات المدروسة هي من نوع الليشمانية المدارية L.tropica.
|
| المواد والطرق Materials and Methods |
الحصول عل العينات
أُخذت عينات هذه الدراسة من آفات جلدية لمرضى يقطنون في محافظة حجة، كبرى محافظات الجمهورية اليمنية، والتي تقع في الركن الشمالي الغربي للجمهورية على الحدود مع المملكة العربية السعودية. تناولت هذه الدراسة 32 حالة مصابة بالليشمانية الجلدية، 12 (37.5%) حالة من الإناث، و20 (62.5%) حالة من الذكور. راجع هؤلاء المرضى المستشفى السعودي اليمني بمحافظة حجة. وجرى تشخيص الحالات جميعها بالفحص المجهري المباشر عن طريق أخذ عينة من الآفة الجلدية للمرضى، بعد مسحها بالإيثانول 70%، بوساطة مشرط جراحي معقوف الرأس عقيم ذي استخدامٍ وحيد disposable. وضعت العينة على الصفيحة الزجاجية بشكل لطاخة وتركت لتجف ثم ثبتت بالميثانول لعدة ثواني ولونت بملون غيمزا الممدد 1:5 ضمن دارئة ملحية فسفاتية PBS. غُسلت الصفائح بالماء بعد التلوين وجُففت ثم فحصت مجهرياً.
الفحص المجهري المباشر
فُحصت العينات المثبتة والملونة باستخدام مجهر من نوع Olympus, Japan. على التكبير النهائي ×1000. اعتبرت العينات إيجابية عند العثور على طفيلي واحد على الأقل من الشكل عديم السوط داخل أو خارج البلاعم. التقطت الصور بوساطة آلة تصوير رقمية (OPTIKA, Italy) متصلة بحاسوب.
استخلاص DNA
جرى استخلاص DNA من اللطاخات المثبتة والملونة على الصفائح الزجاجية، بوساطة عتيدة خاصة صنع شركة (MN)، بعد تعديل بسيط على طريقة العمل الموصى بها من قبل الشركة الصانعة بما يتناسب مع الكميات القليلة من الخلايا المثبتة على الصفائح. فجرى تنظيف الصفائج بشكلٍ جيد بمسحها عدة مرات بالإيثانول المطلق للتخلص من زيت الأرز المستخدم في الفحص المجهري. وضعت كمية (180µL) من الدارئة المهيئة للحل prelysis buffer على اللطاخة وتركت عدة دقائق ثم كُشطت بشكلٍ جيد وسحبت الدارئة بما تحويه من خلايا معلقة إلى أنبوب ايبندورف، ثم أضيف إليها 25µL البروتياز K proteinase K 20mg/ µL. حُضن المزيج لمدة ساعة في درجة حرارة 56°C، ثم أضيف 200µL من دارئة الحل، حضن بعدها المزيج لمدة 10 دقائق في درجة حرارة 70 °C، ليفصل بعدها DNA باستخدام أعمدة كروماتوغرافيا بلاستكية صغيرة NucleoSpin column تحوي على طور ثابت من السيليكا الأليف للحموض النووية. يُمرر المزيج الحاوي على DNA بعد إضافة 210µL من الإيثانول المطلق ويتم التخلص من السائل بعملية التنبيذ لمدة دقيقة واحدة بسرعة دوران قدرها 11000g. يُغسل بعدها العمود عدة مرات بدارئة غسل Washing buffer، ثم يجفف ويشطف DNA باستخدام 50µL من دارئة الشطف Elution buffer. يحفظ بعدها DNA في درجة حرارة – 20 °C إلى حين الاستخدام.
مقايسة DNA
عُيّن تركيز DNA المستفرد بقياس الامتصاصية الضوئية للعينات جميعها باستخدام مقياس الطيف الضوئي Spectrophotometer T70 LTD PG، في موجة طولها 260nm. استخدم الماء المقطر لضبط قيمة صفر الجهاز، وقُرئت قيم الامتصاص لحجوم ممددة خمسين مرة لعينات DNA المختلفة.
التفاعل السلسلي للبوليميراز PCR
أُنجز تفاعل PCR على حوالي 50ng من DNA المستفرد في حجم نهائي قدره 30µL يحوي على دارئة خاصة بالإنزيم بتركيز 1X و1.5mM من MgCl2 و0.2mM من كل نكليوتيد ثلاثي فسفات منزوع الأكسجين dNTPs و25pmol من كل مشرع Primer و1.25U من GoTaq بوليميراز (Promega).
استخدم شفع من المشارع CSB1xR (ATTTTTCGCGATTTTCGCAGAACG)، وCSB1xF (CGAGTAGCAGAAACTCCCGTTCA) المحضرة من قبل شركة Alpha DNA الكندية.
أنجزت التفاعلات باستخدام جهاز PCR (PeQlab). وجرت برمجته لينجز 40 دورة تتألف كل منها من ثلاث مراحل مدة كل مرحلة 30 ثانية. جرى التسخين في المرحلة الأولى إلى الدرجة 95°C لفك ارتباط طاقي DNA، وفي الثانية إلى الدرجة 54µC لكي ترتبط المشارع بشكل نوعي مع DNA، وفي الثالثة إلى الدرجة 72?C لكي يقوم الإنزيم DNA Polymerase بعملية الإطالة.
الرحلان الكهربائي
حُللت نتائج PCR بتقنية الرحلان الكهربائي الأفقي على هلامة أغاروز (Promega) بتركيز 1%، حضرت باستخدام دارئة الرحلان TBE. جرى صب الهلامة في قوالب خاصة بجهاز الرحلان (PeQlab)، وأضيف الاتيديوم برومايد بتركيز نهائي قدره 0.5µg/ml. مزج 10µL من ناتج التفاعل مع 2µL من دارئة تحميل العينة Loading Buffer بتركيز 6X (Sigma)، ورحلت العينات وواصمات الأطوال المعيارية (Promega) بتطبيق تيار كهربائي قدره 100 فولت لمدة 30 دقيقة. وكشفت أَشْرِطَة الـ DNA باستخدام منبع أشعة فوق بنفسجية قصيرة الموجة (Cleaver)، ووثقت الهلامة باستخدام جهاز موثق الهلام Gel documentation (Cleaver) مزود بآلة تصوير رقمية تحوي مرشحة خاصة بالأشعة فوق البنفسجية.
|
| النتائج Results |
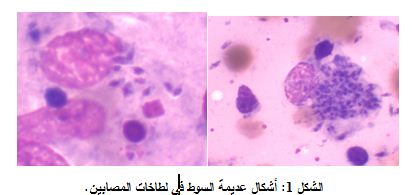
تناولت هذه الدراسه 32 حالة، لمرضى مصابين بداء الليشمانيات مراجعين للمستشفى السعودي اليمني بمحافظة حجة. جرى تشخيص جميع الحالات جميعها بالفحص المجهري المباشر، الذي بين أن كل الحالات المدروسة إيجابية وظهرت فيها عديمات السوط داخل وخارج البلاعم، كما تظهر اللطاخات في الشكل 1.
استفراد الـ DNA الكلي من الشرائح الملونة بملون غيمزا.
عُزل الـ DNA من اللطاخة المثبتة على الصفائح الزجاجية باستخدام عتيدة خاصة كما ذكر في الطرق. وذلك بهدف تنميط الطفيلي. أظهرت معايرة الـ DNA المعزول من كافة العينات بقراءة الامتصاصية الضوئية لكل عينة أن كمية DNA كانت وسطياً بحدود 100ng.
تحديد نوع الطفيلي بتقنية PCR
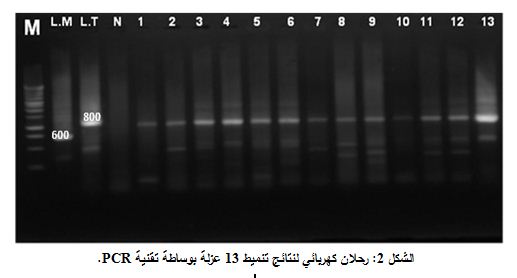
استخدمت تقنية PCR لتحديد نوع الطفيلي المسبب لداء الليشمانيات الجلدي، جرى انتقاء شفع من المَشارِع CSB2XF/CSB1XR الخاصة بتسلسلات محددة ومحافظة من kDNA في عدد كبير من أنواع الليشمانية تحصر بينها تسلسلاً متغايراً في طوله حسب النوع. وبتضخيم DNA المحصور بين هذه المَشارِع، نحصل على شدفة بطول 600 شفعاً تقريباً من الأسس في النوع L.major وحوالي 800 شفعاً من الأسس في النوع L.tropica و680 شفعاً من الأسس في النوع L.infantum. استخدمنا في هذه الدراسة تفاعل PCR على DNA المعزول من العينات جميعها، ومن سلالتين مرجعيتين من L.tropica و L.major (IRD مونبيلية - فرنسا) استخدمت كشاهد إيجابي، واستخدم شاهد سلبي يتألف من مكونات تفاعل PCR جميعها باستثناء DNA. رُحلت نواتج تفاعل PCR على هلامة أغاروز تركيزها 1% (الشكل 2)، فأظهرت السلالات المدروسة شريطاً بطول 800 شفعاً من الأسس، وبمقارنة طول هذه الشدفة مع أطوال الشدف المميزة للسلالات المرجعية، استنتجنا أن العينات جميعها (32 عينة) تنتمي لنوع الليشمانية المدارية L.tropica. ويبين الشكل 2 نتائج تنميط ثلاث
M واصمات جزيئية، L.M سلالة الليشمانية الكبرى المرجعية، L.T سلالة الليشمانية المدارية المرجعية، N شاهد سلبي، الأرقام 1-13 تدل على رقم العينة.
عشرة عينة، علماً أن العزلات جميعها أظهرت النتائج نفسها.
|
|
| المناقشة Discussion |
هدف هذا البحث إلى تحديد نوع الطفيلي المسبب لداء الليشمانيات الجلدي المعزولة من المرضى المراجعين للمستشفى السعودي بمحافظة حجة في اليمن باستخدام تقانة PCR. أظهرت نتائجنا أن العزلات المدروسة جميعها تنتمي لنوع الليشمانية المدارية L.tropica، مما يشير إلى أن هذا النوع هو المسبب الرئيس للإصابة بالداء الجلدي في منطقة الدراسة. تتوافق هذه النتائج مع ما توصلت إليه دراسة حديثة أشارت إلى الانتشار الكبير للليشمانية المدارية بالنسبة للأنواع الأخرى من الليشمانية Mahdy MAK. et al. 2010)).
تتصف تقانة PCR بدقتها العالية نظراً لنوعية المشارع المستخدمة في التفاعل والتي ترتبط في مكان محدد من DNA المدروس، كما تتميز هذه الطريقة بحساسيتها المرتفعة، حيث تسمح بالكشف عن أعدادٍ قليلة جداً من الطفيلي ويمكن إنجازها، كما هي الحال في هذه الدراسة، على كمية قليلة جداً من DNA المستخلص (بحدود 50ng). ولقد اعتمدت بعض الدراسات على هذه التقنية للكشف عن داء الليشمانيات الحشوي، بتحليل عينات من الدم المحيطي رغم احتوائها على عددٍ قليل من الطفيليات (da Silva et al; 2004; Deborggraeve et al; 2008). ويعد PCR تفاعلاً سريع الإنجاز في حال توفر المواد والأجهزة اللازمة. ومجمل هذه الصفات تجعل منه تفاعلاً يتفوق على كل الطرق التقليدية المستخدمة في تحديد نوع الطفيلي. إذ تعد التفاعلات المصلية أو المناعية، وخاصة استخدام الأضداد وحيدة النسيلة منخفضة النوعية نظراً للتشابه الكبير في الكثير من المستضدات العائدة للأنواع المختلفة للطفيلي، مما يؤدي إلى حدوث تفاعلات تصالبية تعطي نتائج تنميط غير دقيقة. بينما يعد الرحلان الكهربائي عديد المواقع أو ما يعرف بالرحلان الكهربائي الأيزوإنزيمي أكثر دقة، من الطرق المصلية والمناعية، في تعيين نوع الطفيلي، لكن انجازه يتطلب توفر كميات كبيرة من الطفيلي، ويحتاج هذا التحليل إلى وقت طويل نسبياً ومخابر بحثية مجهزة بأجهزة نوعية خاصة وإلى العديد من السلالات المرجعية.
استخدمنا في هذه الدراسة DNA المعزول من الشرائح الزجاجية، المعدة لتشخيص الإصابة بالفحص المجهري المباشر، لتعيين نوع الطفيلي. وتعد هذه الطريقة من أفضل الطرق لحفظ العينات بشكلٍ جيد ولفترات طويلة نسبياً، حيث تبقى المادة الجينية للخلايا المثبتة على هذه الصفائح عدة أشهر دون تبريد ودون إضافة أي مادة حافظة، مما يجعل من الممكن نقلها بسهولة من أماكن تحضيرها إلى مخابر إنجاز الدراسة، كما هي الحال في دراستنا.
نظراً لوجود اختلافات في التعبير الجيني الكمي والنوعي وفي بنية المستضدات بين أنواع طفيليات الليشمانية المختلفة، وبالتالي في نمط الاستجابة المناعية المحرضة تجاهها، يُعد تعيين نوع الطفيلي المسبب للإصابة ضرورياً في الدراسات البحثية والتطبيقية التي تهدف إلى تطوير استراتيجيات تلقيحية ناجعة (Brobey et al; 2006; Rohousova et al; 2005). كما تجدر الإشارة إلى أن تعيين نوع الطفيلي خطوةً أساسية قبل القيام بأي نوع من الدراسات الجزيئية والمناعية والكيميائية الحيوية التي يمكن أن تجرى لاحقاً على هذه السلالات. كما أنه مهم في التشخيص السريري للمرض وذلك لاختيار أسلوب المعالجة الملائم والأكثر نوعية (Navin et al; 1992).
|
| المراجع References |
1-Aljeboori T.I. and Evans D.A.
Leishmania spp. in Iraq. Electrophoretic isoenzyme patterns. I. Visceral leishmaniasis.
Trans R Soc Trop Med Hyg 74, 169-177, 1980a.
2-Aljeboori T.I. and Evans D.A.
Leishmania spp. in Iraq. Electrophoretic isoenzyme patterns. II. Cutaneous leishmaniasis.
Trans R Soc Trop Med Hyg 74, 178-184, 1980b.
3-AL-Shamahy H.
Seroprevalece of Kala –Azar among humans and Dogs in Yemen.
Annals of Saudi Medicine, 18, 1, 1998.
4-Ashford D.A. et al.
Comparison of the polymerase chain reaction and serology for the detection of canine visceral leishmaniasis.
Am J Trop Med Hyg 53, 251-255, 1995.
5-Bin D.S; Mostafa O.M; Abdoon A; Al-Quraishy S.A. and Alqahtani A.A.
Isoenzyme electrophetic characterization of Leishmania major, the causative agent of zoonotic cutaneous Leishmaniasis in North and West Saudi Arabia.
J Egypt Soc Parasitol, 40, 465-478. 2010.
6-Brobey R.K; Mei F.C; Cheng X. and Soong L.
Comparative two-dimensional gel electrophoresis maps for promastigotes of Leishmania amazonensis and Leishmania major.
Braz J Infect Dis 10, 1-6, 2006.
7-Campino L; Cortes S; Pires R; Oskam L. and Abranches P.
Detection of Leishmania in immunocompromised patients using peripheral blood spots on filter paper and the polymerase chain reaction.
Eur J Clin Microbiol Infect Dis 19, 396-398, 2000.
8-da Silva E.S; Gontijo C.M; Pacheco Rda S. and Brazil R.P.
Diagnosis of human visceral leishmaniasis by PCR using blood samples spotted on filter paper. Genet Mol Res 3, 251-257, 2004.
9-de Lima A.C; Zampieri R.A; Tomokane T.Y; Laurenti M.D; Silveira F.T; Corbett C.E; Floeter-Winter L.M. and Gomes C.M.
Leishmania sp. identification by PCR associated with sequencing of target SSU rDNA in paraffin-embedded skin samples stored for more than 30 years.
Parasitol Res, 2010.
10-Deborggraeve S; Boelaert M; Rijal S; De Doncker S; Dujardin J.C; Herdewijn P. and Buscher P.
Diagnostic accuracy of a new Leishmania PCR for clinical visceral leishmaniasis in Nepal and its role in diagnosis of disease.
Trop Med Int Health 13, 1378-1383, 2008.
11-El Tai N.O; Osman O.F; el Fari M; Presber W. and Schonian G.
Genetic heterogeneity of ribosomal internal transcribed spacer in clinical samples of Leishmania donovani spotted on filter paper as revealed by single-strand conformation polymorphisms and sequencing.
Trans R Soc Trop Med Hyg 94, 575-579, 2000.
12-Harris E; Kropp G; Belli A; Rodriguez B. and Agabian N.
Single-step multiplex PCR assay for characterization of New World Leishmania complexes.
J Clin Microbiol 36, 1989-1995, 1998.
13-Jaffe C.L; Bennett E; Grimaldi G. Jr. and McMahon-Pratt D.
Production and characterization of species-specific monoclonal antibodies against Leishmania donovani for immunodiagnosis.
J Immunol, 133, 440-447, 1984.
14-Jaffe C.L. and McMahon-Pratt D.
Serodiagnostic assay for visceral leishmaniasis employing monoclonal antibodies.
Trans R Soc Trop Med Hyg; 81, 587-594, 1987.
15-Jose A. Ruiz Postigo
Leishmaniasis in the World Health Organization Eastern Mediterranean Region.
International Journal of Antimicrobial Agents, 36S S62-S65. 2010.
16-Khatri ML. and Haider N.
Cutaneous leishmaniasis in Yemen.
Int J Dermatol 38: 587-590, 1999.
17-Khatri ML; Di Muccio T. and Gramiccia M.
Cutaneous leishmaniasis in North-Western Yemen: a clinico-epidemiologic study and Leishmania species identification by polymerase chain reaction-restriction fragment length polymorphism analysis.
J Am Acad Dermatol, 61: e15-21, 2009.
18-Laskay T. et al.
Detection of cutaneous Leishmania infection in paraffin-embedded skin biopsies using the polymerase chain reaction.
Trans R Soc Trop Med Hyg 89, 273-275, 1995.
19-Mahdy MAK. et al.
Molecular Characterization of Leishmania Species Isolated from Cutaneous Leishmaniasis in Yemen.
Plosone 5(9): e12879. doi: 10.1371/ Journal. pone. 0012879, 2010.
20-Navin T.R; Arana B.A; Arana F.E; Berman J.D. and Chajon J.F.
Placebo-controlled clinical trial of sodium stibogluconate (Pentostam) versus ketoconazole for treating cutaneous leishmaniasis in Guatemala.
J Infect Dis; 165, 528-534, 1992.
21-Noyes H.A; Reyburn H; Bailey J.W. and Smith D.
A nested-PCR-based schizodeme method for identifying Leishmania kinetoplast minicircle classes directly from clinical samples and its application to the study of the epidemiology of Leishmania tropica in Pakistan.
J Clin Microbiol 36, 2877-2881, 1998.
22-Osman O.F; Oskam L; Zijlstra E. E; Kroon N.C; Schoone G.J; Khalil E.T; El-Hassan A.M. and Kager P. A.
Evaluation of PCR for diagnosis of visceral leishmaniasis.
J Clin Microbiol, 35, 2454-2457, 1997.
23-Pratlong F; Bastien P; Perello R; Lami P. and Dedet JP.
Human cutaneous leishmaniasis caused by Leishmania donovani sensu stricto in Yemen.
Trans R Soc Trop Med Hyg; 89:398-399, 1995.
24-Reale S; Maxia L; Vitale F; Glorioso N.S; Caracappa S. and Vesco G.
Detection of Leishmania infantum in dogs by PCR with lymph node aspirates and blood.
J Clin Microbiol 37, 2931-2935, 1999.
25-Rioux JA; Daoud W; Pratlong F. et al.
Les complexes Leishmania donovani s st. Leishmania tropica et Leishmania major en Republique Arabe du Yemen.
In: Rioux JA, ed. Leishmania: Taxonomie-Phylogenese. Montpellier: Institut National de la Sante et de la Recherche Medicale: 357-363, 1986.
26-Rodriguez N; Guzman B; Rodas A; Takiff H; Bloom B.R. and Convit J.
Diagnosis of cutaneous leishmaniasis and species discrimination of parasites by PCR and hybridization. J Clin Microbiol 32, 2246-2252, 1994.
27-Rohousova I; Ozensoy S; Ozbel Y. and Volf P.
Detection of species-specific antibody response of humans and mice bitten by sand flies.
Parasitology 130, 493-499, 2005.
28-Sarnelli T.
Presenza di leishmaniosi muco-cutanee sugli altipiani dell'arabia sudoccidentale. Arch Italiano Scienze
Med Coloniali; 14: 227-228, 1933.
29-Schonian G. et al.
Genetic variability within the species Leishmania aethiopica does not correlate with clinical variations of cutaneous leishmaniasis. Mol Biochem Parasitol 106, 239-248, 2000.
30-Shlomai J.
The assembly of kinetoplast DNA.
Parasitol Today 10, 341-346, 1994.
31-Van Eys G.J; Schoone G.J; Kroon N.C. and Ebeling S.B.
Sequence analysis of small subunit ribosomal RNA genes and its use for detection and identification of Leishmania parasites.
Mol Biochem Parasitol 51, 133-142, 1992.
|
| |
| |
| |
| المجلد 6 ,
العدد 10
, شعبان 1434 - تموز (يوليو) 2013 |
|
|
|
