| المجلد 6 ,
العدد 2
, رجب 1432 - تموز (يوليو) 2011 |
| |
| دراسة الاستجابة المناعية ضد بعض المستضدات الرئيسة لليشمانية |
| Study for the Immune Response Against
Some Major Antigens of Leishmania
|
| ص. نتالي السلوم، أ.د. سعاد العقلة*، أ.د. محمود قويدر*، وأ.د. محمد معروف |
| Alammoury D; Kweider M;* Alokla S.* and Maarouf M. |
كلية الصيدلة، *كلية العلوم، جامعة دمشق
Faculty of pharmacy, *Faculty of science, Damascus University |
| الملخص Abstract |
يعد داءُ اللِّيشْمانِيَّات مستوطناً في سورية، ونظراً للآثار الجانبية التي تسببها الأدوية والمقاومة لها، فإن الوقاية هامة جداً للحد من انتشار المرض. لهذا هدفت دراستنا إلى تقييم دور الاستجابة المناعية الخلوية (INF-γ) و الاستجابة المناعية الخلطية (IgG) التي تكون محرضة بالخلاصة الكلية لليشمانية المدارية أو بمزيج المستضدين 43 و 63 كيلودالتون المأخوذين من الذُرِّيَّة ذاتها.
استخدمنا في هذه الدراسة خمسة عشر فأراً من فئرانBALB/c قسموا ضمن مجموعات ثلاث. مُنّعت المجنوعة الأولى بالخلاصة الكلية لليشمانية المدارية مع المساعد فروند الناقص (IFA)، ومُنّعت المجموعة الثانية بمزيج المستضدين 43 و 63 كيلودالتون مع المساعد فروند الناقص (IFA)، ولُقّحت مجموعة الشاهد بدارئة ملحية فسفاتية (PBS).
لاحظنا أن كل من الخلاصة الكلية ومزيج البروتينات يحرض استجابة مناعية خلوية من نمط Th1 ومن الممكن أن يحرض استجابة Th2، إلا أن هذه الاستجابة أقوى بشكل يُعتد به مع مزيج البروتينات (p= 3.6x10-5) لارتفاع عيار الـ INF-γ وعيار IgG (P=4.8x10-6) الذي يُعد إشارة إيجابية مشجعة لاستمرار الدراسة للوصول إلى لقاح مأمون وفعال.
|
| Leishmaniasis is condidered to be dispersed in Syria, and because of the side effects that caused by drugs and resistant to them, so the prevention is very important to stop dispersing the disease. For that, our study aimed to evaluate the role of cellular immune response (IFN-γ) and humoral immune response (IgG) that induced by the total extract of L. tropica or the mixed of 63 and 43 KDa antigens which are taken from the same strain.
In this study we used fifteen BALB/c mice divided into three groups. The first was immunized by total extract of L. tropica with incomplete frond adjuvant (IFA), and the second group was immunized with the mixed of two proteins. 43, 63 KDa with IFA, and the control group was inoculated with phosphate saline buffer (PBS). we observed that each total extract and mixed proteins induce Th1 response and possible Th2 response, but this response was significantly stronger with the mixed proteins p=3.6x10-5 for IFN-γ titer and p=4.8x10-6 for IgG titer which is considered a positive signal to continue studying to reach to an effective and safe vaccine.
|
| المقدمة Introduction |
أدواء الليشمانية هي مجموعة من الآفات تصيب الجلد والأغشية المخاطية والأحشاء، تسببها طفيليات من شعبة الحيوانات الأوالي Protozoa من جنس الليشمانية Leishmania (1).
طفيليات الليشمانية ذات تطفل داخل خلوي مجبر، وتتواجد بشكلين: إما المُشَيِّقَة (الشكل المتحرك) Promastigote والذي يتواجد في الوسط الزرعي وفي معي الحشرة الناقلة، أو اللَيشُمانَة (الشكل غير المتحرك) Amastigote والذي يتواجد داخل البلاعم (2).
تنتقل هذه الطفيليات إلى الإنسان بوساطة ذبابات الرمل Sand Flies (1). مسببة الإصابة بداء اللِّيشْمانِيَّاتِ الجِلْديّCutaneous leishmaniasis (CL) ، وداءُ اللِّيشْمانِيَّاتِ الجِلْديّ المخاطي (MCL) Mucocutaneous leishmaniasis، وداء اللِّيشْمانِيَّاتِ الحشوي (VL) Visceral leishaniasis (3).
يترافق الشفاء من المرض مع الاستجابة المناعية المتواسطة بالخلايا Th1 وإفراز السيتوكينات الخاصة بها وخصوصاً الانترفيرون غاما، وIL-12، بينما يترافق استفحال المرض وعدم الشفاء مع نمط الاستجابة Th2 (4، 5).
أما دور الأضداد في الوقاية أو الشفاء من داء الليشمانيات فلا يزال غير معروف. ولهذا فإن الدور المحتمل الذي يمكن أن تلعبه الأضداد في حماية الإنسان من الإصابة بالليشمانية يعكس مدى أهمية تحديد المستضدات التي يمكن أن تحرض إنتاج هذه الأضداد التي يمكن أن تلعب دوراً هاماً في وقاية الإنسان من الإصابة (6). ولقد أدت الآثار غير المقبولة الناتجة عن استعمال لقاحات حية مكونة من الطفيلي الكامل، إلى التوجه إلى استخدام خلاصات بروتينية للطفيلي أو مستضدات بروتينية أكثر أماناً (7، 8). وكان الهدف من دراستنا المساهمة في المحاولات التي تسعى إلى الوصول إلى لقاح فعال. ولقد استخدمنا في دراستنا مزيج المستضدين 43، 63 كيلودالتون وذلك بالمشاركة مع المساعد فروند الناقص المستخدم على نطاق واسع كمحفز مناعي قوي (9).
|
| المواد والطرق Materials and methods |
أ- طفيليات الليشمانية واستخلاص البروتينات ومعايرتها
استخدمت طفيليات الليشمانية المدارية L. tropica، تم عزلها من شاب من منطقة ريف دمشق بوساطة وسط NNN، وجرى تكثيرها على وسط RPMI-1640 من شركة Cytogen الألمانية المضاف له مصل البقر منزوع المتممة بنسبة 10% بدرجة حرارة 26°م. أخذت الطفيليات المستنبتة في طور الاستتباب وغسلت بالدارئة الفسفاتية الملحية ثلاث مرات مع النبذ، أُخذ الراسب وأضيف إليه دارئة الإذابة، ثم نُبذت وأخذ السائل الطافي الذي يحوي الخلاصة البروتينية وحفظ في الدرجة -20°م. جرت معايرة البروتينات بطريقة برادفورد باستخدام عتيدة لشركة Gentaur البلجيكية.
ب- الرحلان الكهربائي وعزل البروتينات
أُجري الرحلان الكهربائي للخلاصة البروتينية على هلامة بولي أكريلاميد حسب Laemmli (10)، ثم جرى تلوين الهلامة بأزرق الكومازي لإظهار العصابات، وبعد حساب الأوزان الجزيئية جرى قص العصابات الموافقة لـ 63, 43 كيلودالتون وحُفظت بالدرجة -20°م إلى حين الاستخدام.
ج- تلقيح الفئران
جرى استخدام خمسة عشر فأراً من سلالة BALB/c الحساسة للإصابة بالليشمانية، وقسمت الفئران ضمن ثلاث مجموعات تتألف كل منها من خمسة فئران. حقنت فئران المجموعة الأولى تحت الجلد بثلاث جرعات من الخلاصة البروتينية لطفيليات الليشمانية المدارية، حيث بلغت الجرعة الأولى 50 مكغ، بينما بلغت الجرعتين الثانية والثالثة 25 مكغ، 15 مكغ على الترتيب وأعطيتا بعد مرور أسبوعين وشهر على إعطاء الجرعة الأولى على الترتيب، ولقد جرى حقن كل الجرعات السابقة مع حجوم مساوية لها من مساعد فروند الناقص من شركة Sigma Aldrich.
حقنت فئران المجموعة الثانية بالطريقة السابقة نفسها و بالكميات نفسها من مزيج المستضدين43 ، 63 كيلودالتون ومساعد فروند الناقص.
أما فئران المجموعة الثالثة وهي المجموعة الشاهدة فلقد حقنت بالطريقة نفسها بالدارئة الفسفاتية فقط.
أُخذت عينات الدم من الفئران الخمسة عشر السابقة بعد مرور أسبوعين على الجرعة الثالثة.
د- دراسة الاستجابة المناعية الخلوية بمقايسة IFN-γ
جرت مقايسة الـ IFN-γ في مصول الفئران بالاعتماد على تقنية مُقَايَسَةُ المُمْتَزِّ المَناعِيِّ المُرْتَبِطِ بالإِنْزِيْم (ELISA) باستخدام عتيدة لشركة Mabtech السويدية، حيث جرى تخصيص بئرين لكل فأر، وقرئت الامتصاصية بموجة طولها 450 نانومتر.
هـ- دراسة الاستجابة المناعية الخلطية بمقايسة الـ IgG.
جرت المقايسة باستخدام مُقَايَسَةُ المُمْتَزِّ المَناعِيِّ المُرْتَبِطِ بالإِنْزِيْم (ELISA) حيث تغلل المستضدات على آبار صفيحة مكونة من ست وتسعين بئراً، ثم تحضن مع مصول الفئران حيث جرى تخصيص بئرين لمصل كل فأر، ثم تضاف الأضداد الثانوية الموسومة بالفسفاتاز القلوية لشركة Bethyl الأمريكية، وتضاف ركازة الإنزيم لشركة Pierce الأمريكية ويقرأ اللون بموجة طولها 405 نانومتراً.
|
| الدراسة الإحصائية |
| جرى التعبير عن القيم بالمتوسط الحسابي X والانحراف المعياري SD، واعتمد اختبار s t-test Student لتحديد في ما إذا كان الفارق بين المتوسطات ناجماً عن الحظ و المصادفة، أم أنه فارق جوهري يعتد به إحصائياً، اعتمدت P<0.05 كقيمة يعتد بها إحصائياً. |
| النتائج Results |
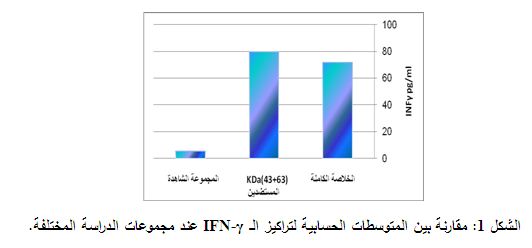
أ- دراسة رد الفعل الخلوي بتعيين قيم الانترفيرون-غاما IFN-γ عند مجموعات الدراسة
قورن متوسط مستويات الـINF-γ بين مجموعات الدراسة وذلك لتعيين قدرة البروتينات المدروسة على تحفيز استجابة مناعية خلوية Th1، بينت نتائجنا أن تركيز الانترفيرون غاما بلغ 5.52 بكغ/ مل لدى فئران المجموعة الشاهدة و 71.6 بكغ/ مل عند الفئران المحقونة بالخلاصة البروتينية الكاملة، و 79.59 بكغ/ مل عند الفئران المحقونة بمزيج المستضدين 43، 63 كيلودالتون (الشكل 1) ونلاحظ أن تركيز الانترفيرون غاما لدى المجموعة المحقونة بالخلاصة البروتينية الكاملة كان أعلى من تركيزه لدى المجموعة الشاهدة وكان هذا الفارق جوهرياً ويعتد به إحصائياً، حيث بلغت قيمة P= 2.6x10-10. كما وجدنا أن تركيز الانترفيرون غاما لدى مجموعة الفئران المحقونة بمزيج المستضدين أعلى من تركيزه لدى المجموعة الشاهدة أيضاً وكان هذا الفارق في التركيز معتداً به إحصائياً، حيث بلغت قيمة P=9 x10-9. كما أظهرت نتائجنا أن تركيز الانترفيرون غاما لدى مجموعة الفئران المحقونة بمزيج المستضدين أعلى من تركيزه لدى المجموعة المحقونة بالخلاصة البروتينة الكاملة وكان هذا الفارق في التركيز جوهرياً ويعتد به إحصائياً حيث بلغت قيمة P= 3.6x10-5.
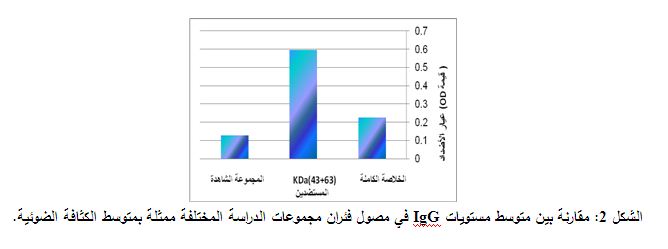
ب- دراسة رد الفعل الخلطي بمقارنة مستويات الأضداد IgG عند مجموعات الدراسة:
جرت مقارنة مسـتويات الأضداد IgG لدى الفئران
جميعها والتي تعكس القدرة المحفزة للاستجابة المناعية الخلطية لكل من الخلاصة البروتينية الكاملة ومزيج المستضدين 43، 63 كيلودالتون، ونظراً لعدم وجود محلول معياري متوفر للأضداد النوعية لهذه المستضدات ونظراً للتناسب الطردي بين تركيز الأضداد والكثافة الضوئية OD فلقد جرى التعبير عن تركيز الأضداد بدلالة الكثافة الضوئية، ففي حين بلغت قيمة الكثافة الضوئية 0.12 في مصول فئران المجموعة الشاهدة فلقد بلغت 0.22 في مصول الفئران المحقونة بالخلاصة البروتينية الكاملة، و 0.59 في مصول الفئران المحقونة بمزيج المستضدين 43، 63 كيلودالتون. وبالمقارنة بين متوسط مستويات الـ IgG عند مجموعات الدراسة تشير نتائجنا (الشكل 2) إلى ارتفاع مستويات الأضداد لدى المجموعة المحقونة بالخلاصة البروتينية الكاملة مقارنة مع المجموعة الشاهدة وكان هذا الفارق في التركيز معتداً به إحصائياً، حيث بلغت قيمة p 0.001. كما سجلنا أيضاً ارتفاعاً في مستويات الأضداد في مصول الفئران المحقونة بمزيج المستضدين بالمقارنة مع مستويات الأضداد في مصول المجموعة الشاهدة وكان الفارق المسجل بين المجموعتين معتداً به إحصائياً، حيث بلغت قيمة p=3.6x10-8. كما وجدنا أيضاً أن عيار الأضداد لدى مجموعة الفئران المحقونة بمزيج المستضدين كان أعلى من تركيزه لدى الفئران المحقونة بالخلاصة البروتينة الكاملة وكان هذا الفارق في التركيز جوهرياً ويعتد به إحصائياً حيث بلغت قيمة P= 3.6x10-8.
|
|
| المناقشة Discussion |
بما أن الإصابة بداء الليشمانيات ثم الشفاء منه ما تترك مناعة طويلة الأمد عادةً، فيعد داء الليشمانيات من الأمراض الواعدة في مجال تطوير اللقاحات (7، 11). تمتاز طفيليات الليشمانية بكونها طفيليات داخل خلوية مجبرة، ويترافق الشفاء منها بتطور استجابة مناعية متواسطة بالخلايا من نمط Th1 مع إفراز الانترفيرون غاما بشكل خاص، لكن وعلى الرغم من ذلك فلا يعد توليد الاستجابة Th1 شرطاً رئيسياً لنجاح اللقاح، حيث تؤدي العديد من اللقاحات البروتينية إلى توليد حماية عند حيوانات التجربة مع أنها تؤدي إلى توليد استجابة مناعية مختلطة Th1/Th2، كما أن هنالك لقاحات قد أدت إلى تحفيز استجابة Th1 ومع هذا لم تؤد إلى الحماية من الإصابة (7، 12).
تم إثبات القدرة المحفزة للمناعة بالنسبة للمستضد 63 (15-13)، وللمستضد 43 (16، 17) كل على حده ولكن لا توجد أية دراسة استخدمت مزيج الاثنين معاً.
أظهرت نتائجنا ارتفاعاً في قيم الـ IFN-γ والـ IgG لدى الفئران المحقونة بالخلاصة الكاملة لـ L. tropica، وهذا يدل على حدوث استجابة مناعية من نمط Th1 بسبب ارتفاع الـ IFN-γ وبما أن الأبحاث التي أجريت على خلاصات كاملة لطفيلي الليشمانية مثل دراسة Vilela وزملاءه عام 2007، حيث استخدموا خلاصة L. amazonesis مع Corynebacterium parvum كمساعد، قد أدت إلى تحفيز استجابة مختلطة Th1/Th2 عند فئران BALB/c (7)، فإن ذلك يرجح أن يكون سبب ارتفاع الأضداد IgG في دراستنا هو استجابة مناعية من النمط Th2 بالإضافة إلى Th1 ولكن تأكيد ذلك يتطلب معايرة الـ IL-4 وتعيين تحت صفوف Sub-Class الأضداد IgG.
كما أبدت الفئران المحقونة بمزيج المستضدين ارتفاعاً في مستويات الـ IFN-γ والـ IgG وبفارق جوهري عن المجموعة الشاهدة مما يؤدي إلى القول بأن مزيج المستضدين أدى إلى تحفيز استجابة مناعية من النمط Th1 بسبب ارتفاع الـ IFN-γ، وبما أن الأبحاث التي أجريت على البروتين 63 كيلودالتون بمفرده مثل دراسة Afrin وزملائه عام 2002 (13) ودراسة Bhowmick وزملائه عام 2008 (8) اللذان أثبتا أن البروتين 63 النقي المعزول من L. donovani و المٌمحفظ في ليبوزوم، حيث يعمل الليبوزم كعامل مساعد، يؤدي إلى تحفيز استجابة مختلطة Th1/Th2 عند فئران BALB/c. وكذلك الأبحاث التي أجريت على البروتين 43 كيلودالتون بمفرده مثل دراسة Badaro وزملائه عام 2001 والذين أثبتوا أن البروتين ذو الوزن الجزيئي 43 كيلودالتون والمعزول من L. Brasiliensis أدى إلى تحفيز استجابة مختلطة Th1/Th2 عند فئران BALB/c عند استخدامه مع GM-CSF (Granulocyte macrophage colony stimulating factor) كعامل مساعد 17))، فهذا يرجح أن تكون الاستجابة الناتجة عن مزيج هذين المستضدين من النمط Th1/Th2 وأن يكون ارتفاع الأضداد IgG في دراستنا هو استجابة مناعية من النمط Th2 بالإضافة إلى Th1 ولكن تأكيد ذلك يتطلب معايرة الـ IL-4 وتعيين تحت صفوف الأضداد IgG.
عند المقارنة بين المجموعة المحقونة بالخلاصة الكاملة والمجموعة المحقونة بمزيج المستضدين نجد أن المجموعة الأخيرة قد أبدت ارتفاعاً طفيفاً في إنتاج INF-γ عن المجموعة الأولى وهذا يدل على تحفيز استجابة Th1 أكبر بقليل، وقد يعود ذلك إلى أن الخلاصة تحوي مكونات أخرى تحفز إنتاج سيتوكينات تخفض التعبير عن IFN-γ (18) أو أن كمية البروتينات المحفزة مناعياً مثل 43، 63 كيلودالتون في الخلاصة قليلة وغير كافية لتحفيز استجابة قوية. هذا وبينت مقايسة أضداد المصل الكلية IgG بين فئران المجموعتين السابقتين أن فئران المجموعة المحقونة بمزيج المستضدين أبدت ارتفاعاً هاماً وجوهرياً عن فئران المجموعة الأولى، وقد يعود ذلك إلى أن المستضد النقي يحرض استجابة مناعية أقوى ونوعية أكثر من مجموعة متنوعة من المستضدات.
وبما أن عيار IgG الكلي وكذلك الـ INF-γ في المجموعة المحقونة بمزيج المستضدين كان أعلى مما هو عليه في المجموعة الأولى يمكننا الاستنتاج أن البروتينات 63 كيلودالتون و43 كيلودالتون هي بروتينات مسيطرة مناعياً Immunodominant. وهو ما ذهبت إليه عدة دراسات حيث بين Afrin وزملاؤه عام 2002 (13) و Rivier وزملاؤه عام 1999 (14) و Abdelhak وزملاؤه عام 1995 (15) أن البروتين 63 هو محفز مناعي قوي، كما بين Badaro وزملاؤه عام 2001 (16، 17) أن البروتين ذو الوزن الجزيئي 43 كيلودالتون هو محفز مناعي قوي.
|
| الاستنتاج |
| إن كل من الخلاصة ومزيج المستضدين قد حرضا استجابة مناعية خلوية وخلطية ولكن هذه الاستجابة كانت أشد عند حقن مزيج المستضدين مما يعطي مؤشرات إيجابية مشجعة لاستمرار العمل عليهما للوصول إلى لقاح مأمون وفعال. |
| المراجع References |
1-Dejeux P.
Leishmaniasis: current situation and new perspectives.
Comp. Immaunal. Microvial. Intect. Dis. 27(5): 18-305, 2004.
2-Kellina O.I.
On the dimensions of the leishmanial forms of L. major L. tropica and L. tropica minor.
Medskaya. Parazitol. 31: 18-716. 1962.
3-Kedzierski Y. Zhu and E. Handman.
Leishmania vaccines: progress and problem.
Parasitology, 133: 87-112. 2006.
4-Mossmann T.R. and Coffmann R.L.
Ann. TH1 and TH2 Cells: Different Patterns of Lymphokine Secretion Lead to Different Functional Properties.
Rev. Immunol. 7: 145-173, 1989.
5-Belkaid Y; Hoffman K.F; Mmendez S; Udey M C. wynn and Sacks DL.
The role of IL10 in persistence of leishmania major in the skin afer healing and therapeutic potential of IL-10 receptor antibody for sterile cure.
J. EXP. Med, 194: 10: 1497-1506, 2002.
6-Hatice Ozb; Aksoy A; Mehmet S. Gurel and Yazar S.
IgG and IgG subclass antibodies in patients with active cutaneous leishmaniasis.
J Med Microbial. 55(1): 1329-1331, 2006.
7-Vilela M ; Gomes D; Silva E; Serafim T; Afonso L. and Rezende S.
Successful vaccination against Leishmania chagasi infection in BALB/c mice with freeze-thawed Leishmania antigen and Corynebacterium parvum.
Acta Tropica, 104: 133-139, 2007.
8-Bhowmick S; Ravindran R. and Ali N.
gp63 in Stable Cationic Liposomes Confers Sustained Vaccine Immunity to Susceptible BALB/c Mice Infected with Leishmania donovani.
Infection and Immunity, 76: 1003-1015, 2008.
9-Lowell G; Amselem S; Friedman D. and Aviv H.
Submicron emulsions as vaccine adjuvants.
United states patent, 95: 51-70, 1995.
10-Laemmli UK.
Cleavage of structural proteins during the assembly of the head of bacteriophage T4.
Nature, 227(259): 680-685, 1970.
11-Lemesre JL; Holzmuller P; Cavaleyra M; Bras-Gonc¸ alves R; Hottin G. and Papierok G.
Protection against experimental visceral leishmaniasis infection in dogs immunized with purified excreted secreted anti-gens of Leishmania infantum promastigotes.
Vaccine, 23: 2825-2840, 2005.
12-Dumonteil D; Pratt D. and Price V.
Report on the fourth TDR/IDRI meeting on second generation vaccine against Leishmaniasis Merida, Yucatan, Mexixo, May 1-3, 2001.
Rev Biomed, 13(1): 53-83, 2002.
13-Afrin F; Rajesh R; Anam K; Gopinath M; Pal S. and Ali N.
Characterization of Leishmania donovani Antigens Encapsulated in Liposomes That Induce Protective Immunity in BALB/c Mice.
Infection and Immunity, 70: 6697-6706, 2002.
14-Rivier D; Bovay P; Shah R; Didisheim S.and Mauel J.
Vaccination against Leishmania major in a CBA mouse model of infection: role of adjuvants and mechanism of protection.
Parasite Immunology, 21: 461-473, 1999.
15-Abdelhak S; Louzir H; Timm J; Blel L; Benlasfar Z; Lagranderie M; Gheorghiu M; Dellagi K. and Gicquel B.
Recombinant BCG expressing the leishmania surface antigen Gp63 induces protective immunity against Leishmania major infection in BALB/c mice.
Microbiology, 141: 1585-1592, 1995.
16-Badaro R; Lobo I; Munos A; Netto EM; Modabber F; Campos-Neto A. et al.
Immunotherapy for drug-refractory mucosal leishmaniasis .
J Infect Dis, 194: 1151-1159, 2006;
17-Badaro R; lobo I; Nakatani M; Muinos A; Netto E.M; Coler R.N. and Reed S.G.
Successful use of a defined antigen/GM-CSF adjuvant vaccine to treat mucosal leishmaniasis refractory: acase report.
The brazilean journal of infectious diseases. 5(4): 223-232, 2001.
18-Skeiky Y.A.W; Kennedy M; Kaufman D; Borges M.M; Guderian J.A; Scholler J.K; Ovendale P.J; Picha K.S; Morrissey P.J; Grabstein K.H; Campos-Neto A. and Reed S.G. LeiF.
A Recombinant Leishmania Protein That Induces an IL-12-Mediated Th1 Cytokine Profile.
The Journal of Immunology, 161: 6171-6179, 1998.
|
| المجلد 6 ,
العدد 2
, رجب 1432 - تموز (يوليو) 2011 |
|
|
|
