| المجلد 6 ,
العدد 2
, رجب 1432 - تموز (يوليو) 2011 |
| |
| تحري الفِيزْيُولُوجْيا المَرَضِيَّة لفقر الدم لدى الأطفال المصابين بالسرطان |
| Inspection of The Pathophysiology of Anemia
Among Children with Cancer
|
| د. جمال الفيصل، أ.د. إياد طرفة* و أ.د. خليل القوتلي |
| AL- Faysal J., Turfah E*. and AL- Kwatly Kh. |
كلية الصيدلة، *كلية الطب، جامعة دمشق
Faculty of Pharmacy, Faculty of Medicine*, Damascus University |
| الملخص Abstract |
صنفت الفِيزْيُولُوجْيات المَرَضِيَّة لفقر الدم المرتبط بالسرطان على أنها مشابهة لتلك العائدة لفقر دم الأمراض المزمنة. إلا أن الدراسات الحديثة لاستقصاء الفِيزْيُولُوجْيا المَرَضِيَّة لفقر الدم لدى الأطفال المصابين بالسرطان تشير إلى فروقات واضحة عن تلك المشاهدة لدى البالغين. ففي حين جرى تأكيد أن عيباً في إنتاج الإريثروبويَتين هو سبب رئيس لفقر الدم لدى البالغين المصابين بأورام صلبة؛ يبدو أن فقر الدم لدى الأطفال المصابين بالسرطان يرتبط بنقص في نشاط نقي العظم المكون للكريات الحمر دون نقص إنتاج الإريثروبويَتين. قمنا بقياس قيم الهيموغلوبين، تراكيز الإريثروبويَتين المصلية، ومستقبل الترانسفيرين الذواب في المصل لمجموعات الأطفال المصابين بالسرطان والخاضعين للمعالجة الكيميائية والذين يعانون من أورام صلبة أو من خباثات دموية، بهدف تحري الفِيزْيُولُوجْيا المَرَضِيَّة لفقر الدم المرتبط بالسرطان لديهم؛ وذلك بتعيين قيم الإريثروبويَتين واستجابة نقي العظم.
شملت الدراسة 54 طفلاً وطفلةً يعانون جميعهم من السرطان، ولقد تراوحت أعمارهم بين 1 و 152 شهراً. قسم المرضى ضمن أربع مجموعات: مجموعتان مرضيتان بفقر الدم المرتبط بالسرطان (تبديان قيم هيموغلوبين أخفض من قيم المجالات المرجعية تبعاً للعمر)، مجموعة منهما للأورام الصلبة والأخرى للخباثات الدموية. ومجموعتان شاهدتان (تبديان قيم هيموغلوبين ضمن المجالات المرجعية تبعاً للعمر) إحداهما للأورام الصلبة والأخرى للخباثات الدموية. تشير نتائجنا إلى أن فقر الدم لدى الأطفال المصابين بالسرطان والخاضعين للمعالجة الكيميائية يعود أساساً إلى فشل داخلي المنشأ في نقي عظم وليس إلى نقص في إنتاج الإريثروبويَتين، الأمر الذي يعني أن هنالك فرقاً في الفِيزْيُولُوجْيا المَرَضِيَّة لفقر الدم لدى الأطفال المصابين بالسرطان عنها لدى البالغين.
|
The pathophysiologies of cancer-associated anemia has been categorized as being similar to those of anemia of chronic diseases. However, modern studies made for investigating the pathophysiology of anemia among children with cancer refer to obvious differences from that seen in adults. And as it has been confirmed that a defect in erythropoietin production is a principal cause of anemia among adults with solid tumors; it seems that anemia among children with cancer is associated with a decrease in bone marrow erythropoietic activity without a decrease in erythropoietin production. We have measured the values of haemoglobin, serum concentrations of erythropoietin and soluble transferrin receptor among groups of children with cancer undergoing chemotherapy, who have either solid tumors or haematological malignancies, to inspect the pathophysiology of cancer-associated anemia among them; by determining values of erythropoietin and bone marrow response.
The study included 54 children all suffering from cancer, their ages varied between 1 and 152 months. Patients was divided into four groups: Tow of them are for patients of cancer-associated anemia (showing haemoglobin values lower than values of reference ranges according to age), one of them is for solid tumors and the other is for haematological malignancies. The other two are control groups (showing haemoglobin values within the reference ranges according to age), one of them is for solid tumers and the other is for haematological malignancies. Our results indicate that anemia among children with cancer undergoing chemotherapy is mainly caused by an intrinsic failure in bone marrow and not by a reduction in erythropoietin production , which means that there is a difference in pathophysiology of anemia among children with cancer from that seen in adults.
|
| المقدمة Introduction |
الإريثروبويَتين Eythropoietin (EPO)
الإريثروبويَتين هو هرمون بروتيني سكري يُنتج بشكل أساسي من الكلية استجابة لنقص الأكسجة، تتحدد التراكيز المصلية للإريثروبويَتين بـ:
1- نسبة إنتاجه في الكلى؛
2- نسبة استهلاكه في نقي العظم والذي يرتبط مع كتلة الخلايا سَليفَةُ الحُمْر proerythrocyte (1).
يحفز الإريثروبويَتين تنظيم إنتاج الكريات الحمر البقيا، والتكاثر، وتمايز الخلايا سليفة الحمر بالارتباط إلى مستقبلات نوعية على هذه الخلايا وكبت استماتتها، التعبير عن Bcl-XL وBcl-2. يحرض الإريثروبويَتين أيضاً زيادة التعبير عن مستقبلات الترانسفيرين وقبط الحديد، المتواسط بمستقبل الترانسفيرين، إلى هذه الخلايا. إن خلايا النسيج النقوي التي تستجيب للإريثروبويَتين هي الخلايا السلفية الباكرة BFU-E والخلايا السلفية المتأخرة CFU-E وهي مرحلة السلائف التي تصبح فيها كثافة التعبير عن مستقبلات الإريثروبويَتين ومستقبلات الترانسفيرين أعظمية. يعتمد التوازن النهائي لإنتاج الخلايا الدموية على توازن دقيق بين عوامل النمو الدموي والعوامل المثبطة لتكون الدم. الجزيئات الأساسية التي تثبط اصطناع الكريات الحمر هي:
IL-1, TNF-α, TGF-β, IFN-gamma (2).
مستقبل الترانسفيرين الذواب
Soluble Transferrin Receptor (sTfR)
يتواجد لدى البالغين حوالي 80% من مستقبلات الترانسفيرين في نقي العظم ويمثل مُستقبل الترنسفيرين الذواب sTfR في المصل 5-6% تقريباً من الكتلة الإجمالية لمستقبلات الترانسفيرين النسيجية. إن المحدد الأكثر أهمية لتراكيز sTfR هو فعالية النقي مكون الكريات الحمر، والتي يمكن أن تسبب تبدلات تتراوح بين 8 أضعاف بالنقص، إلى 20 ضعفاً بالزيادة، نسبة لمتوسط القيم المرجعية (3)، لدى مرضى السرطان، ونتيجة تثبط نقي العظم خلال مراحل المرض المختلفة، لا سيما خلال فترات المعالجة الكيميائية، ظهر اهتمام بالمتثابتات المخبرية التي تعكس نشاط نقي العظم مكون الكريات الحمر لمراقبة مدى تأثرها. حيث اقترحت بعض الدراسات أن مستقبل الترانسفيرين الذواب sTfR يمكن أن يستخدم كواصم لفعالية إنتاج الكريات الحمر لدى الأطفال المصابين بخباثات والذين يتلقون معالجة كيميائية (1، 4). يعد قياس sTfR هو أول قياس قابل للكشف لتحديد استجابة نقي العظم للإريثروبويَتين المأشوب ويُلاحظ ارتفاعه قبل ملاحظة زيادة الشبكيات وقبل ارتفاع الهيموغلوبين بكثير (5).
فقر الدم المرتبط بالسرطان
يعد فقر الدم شائعاً لدى مرضى السرطان، ويتواجد لدى أكثر من 30% منهم (6)، وترتفع نسبة حدوث فقر الدم خلال تلقي علاجات السرطان إلى أكثر من 50% (7، 8). ويزيد وجود فقر الدم لدى مرضى السرطان الاختطار النسبي الإجمالي للموت إلى حوالي 65%، وينقص من مدة البقيا لديهم، إذ يؤدي نقص الأكسجة الناتج عن فقر الدم إلى تنشؤ أوعية دموية شاذة ومناطق نخر، وزيادة مقاومة الاستماتة بتعطيل الجين الكابح للورم P53، مع زيادة التعبير عن جينات عديدة مترافقة بتقدم الورم. ولفقر الدم أثر أيضاً على استجابة المريض للمعالجة الكيميائية الإشعاعية، إذ يصبح الورم بوجود فقر الدم أكثر مقاومة لتأثيرات الإشعاع وبعض أدوية المعالجة الكيميائية التي تعتمد في تأثيرها على الأكسجين. يعود التأثير الأساسي لفقر الدم لدى مرضى السرطان إلى آليات مناعية بين الجسم والورم تسبب فقر الدم المرتبط بالسرطان Cancer-related anemia (CRA) من جهة، وإلى المعالجة الورمية من جهة أخرى والتي تسبب فقر الدم الناجم عن المعالجة الكيميائية Chemotherapy-induced anemia (CIA) (6، 7).
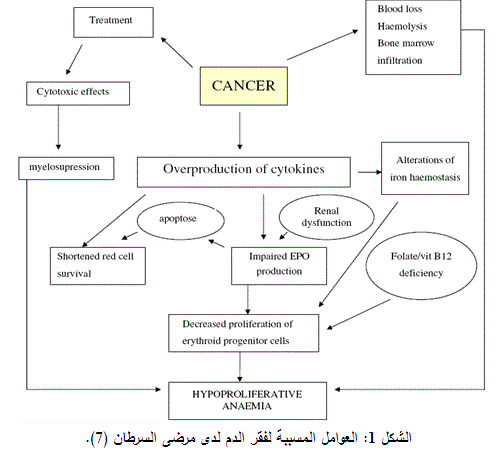
صنف فقر الدم المرتبط بالسرطان على أنه تابع لفقر دم الأمراض المزمنة، حيث تتوسط السيتوكينات إحداث تبدلات في كل من: استتباب الحديد، تكاثر خط الخلايا الحمر، إنتاج الإريثروبويَتين، مدة حياة الخلايا الحمر (2) (الشكل 1).
يحدث فقر الدم الناجم عن المعالجة الكيميائية نتيجة أثر المعالجة الكيميائية على اصطناع الكريات الحمر والبيئة الميكروية النقوية وأحياناً على إنتاج الإريثروبويَتين، وذلك بتأثير العوامل المسببة لاستنزاف الخلايا الجذعية المولدة للدم، وأدوية المعالجة الكيميائية الموقفة للنمو. كما تسبب المعالجة الكيميائية، لا سيما المكثفة، خللاً تنظيمياً للسيتوكينات في الخلايا السدوية، مما يؤثر على قدرة دعم السدى Stroma لتكون الدم؛ وتملك المركبات ذات السمية الكلوية بشكل حتمي أثراً سلبياً على إنتاج الإريثروبويَتين أيضاً (6، 9).
تحري الفِيزْيُولُوجْيا المَرَضِيَّة لفقر الدم المرتبط بالسرطان
يحدث طبيعياً تنظيم إنتاج الإريثروبويَتين عبر نظام تلقيم راجع بين نقي العظم والكلية وتزداد من خلاله مستويات الإريثروبويَتين بشكل أسي تبعاً لدرجة فقر الدم. يتزايد اصطناع الكريات الحمر بشكل نسبي لتحفيز الإريثروبويَتين و يرتفع sTfR بشكل أسي أيضاً استجابة لفقر الدم. وبالتالي يمكن تصنيف الفِيزْيُولُوجْيا المَرَضِيَّة لفقر
الدم بتحديد بسيط لهيموغلوبين المريض، إريثروبويَتين المصل وsTfR. حيث تمثل قيم sTfR المنخفضة والمترافقة بقيم هيموغلوبين منخفضة فعالية نقي عظم منخفضة بشكل غير ملائم لدرجة فقر الدم. قد يترافق هذا بإنتاج إريثروبويَتين مَعيب عنـدما تكون مستويات الإريثروبويَتين منخفضة (وهو ما يلاحظ لدى البالغين المصابين بفقر دم مرتبط بالسرطان) أو بفشل نقي جوهري عندما تكون مستويات الإريثروبويَتين سوية. وبخلاف البالغين يبدو أن الأطفال المصابين بالسرطان يمتلكون إنتاج إريثـروبويَتين ملائماً، إلا أن اصطناع الكريـات الحمر لديهم يكون مثبطاً بشدة (3).
|
 |
| المواد والطرق Materials and Methods |
الاعتيان Sampling
بُزل حوالي 4 مل من الدم من كل طفل/ طفلة مصابين بالسرطان في شعبة أمراض الدم والأورام بمستشفى الأطفال بدمشق ووزعت على الشكل التالي: 1 مل ضمن أنبوب EDTA لإجراء تعداد كامل لخلايا الدم مع تعداد الصفيحات والمناسب الدموية، 1.6 مل ضمن أنبوب حاوٍ على سيترات صوديوم لإجراء اختبار سُرْعَةُ تَثَفُّلِ الكُرَيَّاتِ الحُمْر يدوياً، بزل 1.4 مل ضمن أنبوب جاف وجرى التنبيذ بسرعة 3000 دورة/ دقيقة، ووزع المصل الناتج على أنبوبي إيبندورف حفظا بدرجة حرارة -80°م إلى حين إجراء مقايسات باقي المتثابتات.
مجموعات الدراسة Study groups
1- مجموعة المصابين بفقر دم مرتبط بالأورام الصلبة الخاضعين للمعالجة الورمية:
تألفت المجموعة من 14 طفلاً وطفلة، مشخصين سابقاً سريرياً، شعاعياً، ومخبرياً، بإصابتهم بأورام صلبة فيهم 9 ذكور و 5 إناث، خاضعين للمعالجة الورمية لمدة لا تقل عن أربعة أسابيع، قيم الهيموغلوبين لديهم أدنى من الحدود الدنيا لمجالات الهيموغلوبين المرجعية حسب العمر. ولقد جرى الاعتيان منهم خلال فواصل أشواط المعالجة الكيميائية بفاصل 15 يوماً على الأقل من تلقيهم آخر جرعة معالجة كيميائية.
2- مجموعة المصابين بفقر دم مرتبط بالخباثات الدموية الخاضعين للمعالجة الورمية:
تألفت المجموعة من 17 طفلاً وطفلة، مشخصين سابقاً، سريرياً وشعاعياً ومخبرياً، بإصابتهم بخباثات دموية، خاضعين للمعالجة الورمية لمدة لا تقل عن أربعة أسابيع، قيم الهيموغلوبين لديهم أدنى من الحدود الدنيا لمجالات الهيموغلوبين المرجعية حسب العمر. ولقد جرى الاعتيان منهم خلال فترات تلقيهم لجرعات المعالجة الكيميائية والدوائي المثبط لنقي العظم.
3- مجموعة المصابين بأورام صلبة ذوي قيم هيموغلوبين سوية – المجموعة الشاهدة 1:
تألفت المجموعة من 11 طفلاً وطفلة، مشخصين سابقاً، سريرياً وشعاعياً، ومخبرياً، بإصابتهم بأورام صلبة وفيهم 7 ذكور و 4 إناث، كانت قيم هيموغلوبين لديهم ضمن المجالات الطبيعية حسب العمر.
4- مجموعة المصابين بخباثات دموية ذوي قيم هيموغلوبين سوية – المجموعة الشاهدة 2:
تألفت المجموعة من 12 طفلاً وطفلة، مشخصين سابقاً، سريرياً وشعاعياً، ومخبرياً، بإصابتهم بخباثات دموية منهم 8 ذكور و4 إناث، كانت قيم هيموغلوبين لديهم ضمن المجالات الطبيعية حسب العمر.
|
| الطرق Materials |
- تعيين المتثابتات الدموية:
أجريت المقايسات التالية: الهيموغلوبين، تعداد الكريات الحمر، تعداد الكريات البيض والصيغة، تعداد الصفيحات، المناسب الدموية للكريات الحمر، وذلك باستخدام جهاز CELL-DYN 3500 لشركة Abbott Diagnostics.
- مقايسة مستقبل الترانسفرين الذواب (sTfR): جرت معايرة sTfR بمقياس الكدر بالجسيمات المحفزة particle-enhanced nephelometry باستخدام عتيدة وجهاز خاص بشركة Siemens-Dade Behring.
- مقايسة الإريثروبويَتين:
جرت المعايرة باستخدام طريقة مُقَايَسَةُ المُمْتَزِّ المَناعِيِّ المُرْتَبِطِ بالإِنْزِيْم (الإليزا) enzyme-linked immuno-sorbent assay (ELISA) باستخدام عتيدة لشركة Biomerica الألمانية التي تستخدم تقنية الشطيرة Sandwich.
|
| النتائج Results |
الهيموغلوبين
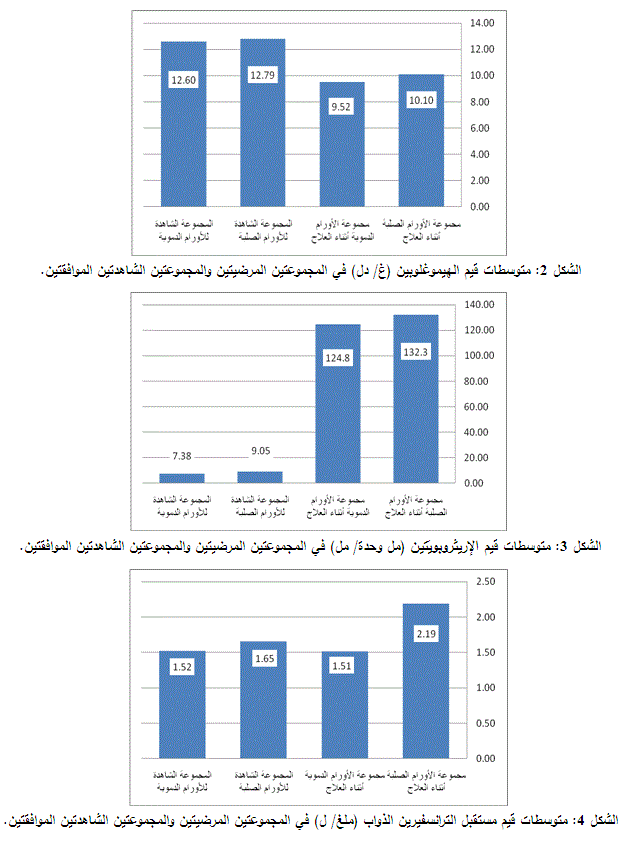
1- مجموعة المصابين بفقر دم مرتبط بالأورام الصلبة الخاضعين للمعالجة الورمية: تراوحت قيم الهيموغلوبين في هذه المجموعة بين 6.2 غ/ دل و 11.3 غ/ دل، بمتوسط حسابي قدره 10.1 غ/ دل وانحراف معياري قدره 1.37 غ/ دل.
2- مجموعة المصابين بفقر دم مرتبط بالخباثات الدموية الخاضعين للمعالجة الورمية: تراوحت قيم الهيموغلوبين في هذه المجموعة بين 5.8 غ/ دل و 11.5 غ/ دل، بمتوسط حسابي قدره 9.52 غ/ دل وانحراف معياري قدره 1.92 غ/ دل.
3- مجموعة المصابين بأورام صلبة ذوي قيم هيموغلوبين سوية – المجموعة الشاهدة 1: تراوحت قيم الهيموغلوبين في هذه المجموعة بين 11.3غ/ دل و 16.1 غ/ دل، بمتوسط حسابي قدره 12.79 غ/ دل وانحراف معياري قدره 1.41 غ/ دل.
4- مجموعة المصابين بخباثات دموية ذوي قيم هيموغلوبين سوية – المجموعة الشاهدة 2: تراوحت قيم الهيموغلوبين في هذه المجموعة بين 11.2غ/ دل و 14.8 غ/ دل، بمتوسط حسابي قدره 12.6 غ/ دل وانحراف معياري قدره 0.86 غ/ دل.
وبتطبيق اختبار T-Student، بين المجموعتين المرضيتين والمجموعتين الشاهدتين الموافقتين، وجدنا فارقاً يعتد به إحصائياً في الحالتين (P<0.05) (الشكل 2).
الإريثروبويَتين:
1- مجموعة المصابين بفقر دم مرتبط بالأورام الصلبة الخاضعين للمعالجة الورمية: تراوحت تراكيز الإريثروبويَتين في هذه المجموعة بين 1 ميلي وحدة/ مل و 665 ميلي وحدة/ مل، بمتوسط حسابي قدره 132.3 ميلي وحدة/ مل وانحراف معياري قدره 195.9 ميلي وحدة/ مل.
2- مجموعة المصابين بفقر دم مرتبط بالخباثات الدموية الخاضعين للمعالجة الورمية: تراوحت تراكيز الإريثروبويَتين في هذه المجموعة بين 2 ميلي وحدة/ مل و 524 ميلي وحدة/ مل، بمتوسط حسابي قدره 124.8 ميلي وحدة/ مل وانحراف معياري قدره 189.5 ميلي وحدة/ مل.
3- مجموعة المصابين بأورام صلبة ذوي قيم هيموغلوبين سوية – المجموعة الشاهدة 1: تراوحت تراكيز الإريثروبويَتين في هذه المجموعة بين 0 ميلي وحدة/ مل و52.5 ميلي وحدة/ مل، بمتوسط حسابي قدره 9.05 ميلي وحدة/ مل وانحراف معياري قدره 14.89 ميلي وحدة/ مل.
4- مجموعة المصابين بأورام دموية ذوي قيم هيموغلوبين سوية – المجموعة الشاهدة 2: تراوحت تراكيز الإريثروبويَتين في هذه المجموعة بين 0 ميلي وحدة/ مل و 50 ميلي وحدة/ مل، بمتوسط حسابي قدره 7.38 ميلي وحدة/ مل وانحراف معياري قدره 14.33 ميلي وحدة/ مل.
وبتطبيق اختبار T-Student، بين المجموعتين المرضيتين والمجموعتين الشاهدتين الموافقتين، وجدنا فارقاً يعتد به إحصائياً في الحالتين (P<0.05) (الشكل 3).
مستقبل الترانسفيرين الذواب:
1- مجموعة المصابين بفقر دم مرتبط بالأورام الصلبة الخاضعين للمعالجة الورمية: تراوحت تراكيز مستقبل الترانسفيرين الذواب في هذه المجموعة بين 0.759 ملغ/ ل و 3.62 ملغ/ ل، بمتوسط حسابي قدره 2.19 ملغ/ ل وانحراف معياري قدره 0.71 ملغ/ ل.
2- مجموعة المصابين بفقر دم مرتبط بالخباثات الدموية الخاضعين للمعالجة الورمية: تراوحت تراكيز مستقبل الترانسفيرين الذواب في هذه المجموعة بين 0.541 ملغ/ ل و2.97 ملغ/ ل، بمتوسط حسـابي قدره 1.51 ملغ/ ل وانحـراف معياري قدره 0.66 ملغ/ ل.
3- مجموعة المصابين بأورام صلبة ذوي قيم هيموغلوبين سوية – المجموعة الشاهدة 1: تراوحت تراكيز مستقبل الترانسفيرين الذواب في هذه المجموعة بين 1.13 ملغ/ ل و 2.73 ملغ/ ل، بمتوسط حسابي قدره 1.65 ملغ/ ل وانحراف معياري قدره 0.44 ملغ/ ل.
4- مجموعة المصابين بخباثات دموية ذوي قيم هيموغلوبين سوية – المجموعة الشاهدة 2: تراوحت تراكيز مستقبل الترانسفيرين الذواب في هذه المجموعة بين 0.409 ملغ/ ل و 2.59 ملغ/ ل، بمتوسط حسابي قدره 1.52 ملغ/ ل وانحراف معياري قدره 0.57 ملغ/ ل.
وبتطبيق اختبار T-Student، بين المجموعتين المرضيتين والمجموعتين الشاهدتين الموافقتين، وجدنا فارقاً يعتد به إحصائياً (P<0.05) بين متوسط تراكيز مستقبل الترانسفيرين الذواب لدى مجموعة الأورام الصلبة أثناء المعالجة ومتوسط تراكيزه لدى المجموعة الشاهدة الموافقة. وعدم وجود فارق ذي دلالة إحصائية (p >0.05) بين متوسط تراكيز مستقبل الترانسفيرين الذواب لدى مجموعة الخباثات الدموية أثناء المعالجة ومتوسط تراكيزه لدى المجموعة الشاهدة للخباثات الدموية (الشكل 4).
|
| المناقشة Discussion |
يشير الفارق المعتد به إحصائياً بين متوسط قيم الهيموغلوبين في كل من المجموعتين المرضيتين ومتوسط قيم الهيموغلوبين في المجموعة الشاهدة الموافقة إلى إصابة مرضى المجموعات المرضية بفقر دم مرتبط بالسرطان. في حين يشـير التباين
المعتد به إحصائياً بين متوسط تراكيز الإريثروبويَتين لدى مجموعتي المصابين بفقر دم مرتبط بالسرطان (الأورام الصلبة والخباثات الدموية) الخاضعين للمعالجة الورمية ومتوسط تراكيز الإريثروبويَتين لدى المجموعتين الشاهدتين الموافقتين إلى وجود استجابة للإريثروبويَتين لفقر الدم لدى مرضى هاتين المجموعتين. توافقت هذه النتيجة مع نتائج دراسات كورازا وزملائه عام 1998 (10)، وكيفيفوري وزملائها عام 1994 (4).
يشير وجود فارق معتد به إحصائياً بين متوسط تراكيز مستقبل الترانسفيرين الذواب لدى مجموعة المصابين بفقر دم مرتبط بالأورام الصلبة الخاضعين للمعالجة الورمية ومتوسط تراكيزه لدى المجموعة الشاهدة الموافقة (مجموعة المصابين بأورام صلبة ذوي قيم هيموغلوبين سوية) إلى وجود استجابة لنقي العظم لفقر الدم لدى مجموعة المصابين بفقر دم مرتبط بالأورام الصلبة الخاضعين للمعالجة الورمية. تُفسَّر هذه النتيجة بأن عينات هذه المجموعة بُزلت خلال فواصل أشواط المعالجة الكيميائية النبضية وبفاصل 15 يوماً على الأقل من إعطاء آخر جرعة معالجة كيميائية، وهو ما يدل على حدوث تراجع بمعدل انخفاض تراكيز مستقبل الترانسفيرين الذواب كنتيجة لزوال تثبط نقي العظم بتوقف المعالجة فترة أسبوعين على الأقل. تعارضت هذه النتيجة مع نتائج دراستي كورازا وزملائه عام 1998 (10). في حين يشير عدم وجود فارق معتد به إحصائياً بين متوسط تراكيز مستقبل الترانسفيرين الذواب لدى مجموعة المصابين بفقر دم مرتبط بالخباثات الدموية الخاضعين للمعالجة الورمية ومتوسط تراكيزه لدى المجموعة الشاهدة الموافقة (مجموعة المصابين بخباثات دموية ذوي قيم هيموغلوبين سوية) إلى عدم وجود استجابة لنقي العظم لفقر الدم لدى مجموعة المصابين بفقر دم مرافق للأورام الدموية الخاضعين للمعالجة الورمية. تتوافق هذه النتائج مع نتائج دراستي كورازا وزملائه عام 1998 (10).
|
| الاستنتاج Conclusion |
| تشير دراستنا إلى أن ضعف اصطناع الكريات الحمر لدى الأطفال المصابين بفقر دم مرتبط بالسرطان لا ينجم عن الإنتاج غير الكافي للإريثروبويَتين وإنما عن فشل نقي العظم عن الاستجابة له، وذلك بخلاف مرضى فقر الدم المرتبط بسرطان البالغين والذين يبدون نقصاً في إنتاج الإريثروبويَتين يعلل فشل نقي العظم. كما تشير دراستنا إلى حدوث زوال لتثبط نقي العظم بشكل تالٍ لتوقف المعالجة النبضي لمجموعة الأورام الصلبة لفترة أسبوعين على الأقل (خلال فواصل العلاج)، وهو ما يدل على أن فقر الدم لدى مرضى هذه المجموعة هو من النمط العكوس. |
 |
| المراجع References |
1-Dimitriou H; Stiakaki E; Markaki E-A; Bolonaki I; Giannakopoulou Ch. and Kalmanti M.
Soluble transferrin receptor levels and soluble transferrin receptor/log ferritin index in the evaluation of erythropoietic status in childhood infections and malignancy.
Acta Paediatr, 89: 1169-1173, 2000.
2-Nowrousian M.R.
Pathophysiology of cancer-related anemia, in "Recombinant human erythropoietin (rhEPO) in clinical oncology: scientific and clinical aspects of anemia in cancer.
Pub. Springer, 313-324, 2002.
3-Beguin Y.
Soluble transferrin receptor for the evaluation of erythropoiesis and iron status.
Clinica Chimica Acta, 329: 9-22, 2003.
4-Kivivuori S.M; Viinikka L; Teppo A.M. and Siimes M.A.
Serum transferrin receptor and erythropoiesis in children with newly diagnosed acute lymphoblastic leukemia.
Leuk Res, 18(11): 823-828, 1994.
5-Katodritou E; Terpos E; Zervas K; Speletas M; Kapetanos D; Kartsios C; Verrou E; Banti A; Effraimidou S. and Christakis J.
Hypochromic erythrocytes (%): a reliable marker for recognizing iron-restricted erythropoiesis and predicting response to erythropoietin in anemic patients with myeloma and lymphoma.
Ann Hematol, 86: 369-376, 2007.
6-Olle D.
Anemia in Cancer Patients.
www.suite101.com, 2004 Jul 31.
7-Grotto H.Z.W.
Anaemia of cancer: an overview of mechanisms involved in its pathogenesis.
Med Oncol, 25: 12-21, 2008.
8-Weiss G. and Goodnough L.T.
Anemia of Chronic Disease.
N Engl J Med, 352: 1011-1023, 2005.
9-Corazza F. and Sariban E.
Contribution à l’étude de la physiopathologie de l’anémie et de la thrombocytopénie associées à une affection néoplasique chez l’enfant. Faculté de Médecine.
Université Libre de Bruxelles, 7-14, 24-30, 2008.
10-Corazza F; Beguin Y; Bergmann P; Andre´ M. , Ferster A; Devalck C; Fondu P; Buyse M. and Sariban E.
Anemia in Children with Cancer is Associated with Decreased Erythropoietic Activity and Not with Inadequate Erythropoietin Production.
Blood, 92(5): 1793-1798, 1998.
|
| |
| المجلد 6 ,
العدد 2
, رجب 1432 - تموز (يوليو) 2011 |
|
|
|
