| المجلد 6 ,
العدد 2
, رجب 1432 - تموز (يوليو) 2011 |
| |
| شذوذات الصفيحات لدى المرضى السكريين من النمط الثاني |
| Platelets Abnormalities in Type II Diabetics |
| أ.د. ماهر المقداد |
| Dr. Maher Al-Mokdad |
جامعة ايبلا الخاصة، كلية الصيدلة، ادلب، سورية
Ebla Private University, Faculty of Pharmacy, Edleb, Syria
(مقال مُراجَعَة Review Article)
|
| الملخص Abstract |
يعد السكري من النمط الثاني مرضاً شائعاً، يشكل حوالي 90% من السكري ويصيب أكثر من 170 مليون شخص في العالم مع زيادة متوقعة إلى أكثر من 350 مليون إصابة بحلول عام 2030.
على الرغم من تحسن التحكم بعوامل الاختطار الأخرى المسببة للمرض القلبي الوعائي، إلا أن حدوث هذا المرض الذي يعزى إلى الداء السكري يزداد باضطراد. يلعب فرط تنشيط وفرط تكدس الصفيحات دوراً هاماً في تطور الاعتلال الوعائي لدى المرضى السكريين. حيث يحدث تبدل في العديد من آليات تنشيط الصفيحات لدى السكريين. تُظْهر صفيحات مرضى السكري من النمط الثاني إنتاجاً معززاً لأنواع الأكسجين التفاعلي داخلي المنشأ وتناقصاً في القدرة المضادة للتأكسد، مما يزيد من نشاط العديد من إنزيمات التيروزين كيناز، مثل Bruton's tyrosine kinase أو MAP kinases أو بروتينات عائلة SRC. يُساهم الإجهاد التأكسدي أيضاً في الاستتباب الشاذ للكالسيوم داخل الخلوي والملاحظ في صفيحات السكريين من النمط الثاني، الذي يتمثل بتركيز مُعَزز للكالسيوم العُصارِيٌّ الخَلَوِيّ في وضع الراحة وتحرر الكالسيوم ودخوله استجابة للنواهض agonists. بالإضافة إلى ذلك، يبدل السكريين التوافر الحيوي لأكسيد النتريت ضمن الصفيحات. حيث يتناقص نشاط إنزيم سينثاز أكسيد النتريك الأساسي في صفيحات مأخوذة من مرضى مصابين بالسكري من النمط الثاني. يمكن لدراسة هذه الشذوذات أن تساعد في تطوير استراتيجيات دوائية لإنقاص تنشيط الصفيحات في السكري من النمط الثاني.
|
Type 2 diabetes mellitus (DM) is a common disease, that accounts for about 90% of diabetes, and affects more than 170 million individuals worldwide and is rapidly increasing, with projections of >350 million by 2030.
With improved control over other cardiovascular risk factors, the burden of cardiovascular disease attributable to DM is increasing. Platelet hyperactivation and hyperaggregation play a pivotal role in the development of angiopathy in diabetic patients. A number of mechanisms involved in platelet activation are altered in diabetes. Platelets from type 2 diabetic patients show an enhanced endogenous reactive oxygen species production and a reduced antioxidant capability, which increase the activity of several tyrosine kinases, such as the Bruton's tyrosine kinase, MAP kinases or proteins of the SRC family. Oxidative stress is also involved in the abnormal intracellular calcium homeostasis observed in platelets from type 2 diabetics, including an enhanced resting cytosolic calcium concentration and calcium release and entry in response to agonists. Moreover, diabetes alters the bioavailability of nitric oxide in platelets. Basal nitric oxide synthase activity is reduced in of platelets obtained from patients with type 2 diabetes mellitus. The study of these abnormalities might be helpful in the development of new pharmacological strategies to reduce platelet activation in type 2 diabetes mellitus.
|
| المقدمة Introduction |
يعد السكري من النمط الثاني (T2DM) Type 2 diabetes mellitus مرضاً شائعاً يشكل ما نسبته حوالي %90 من السكري ويصيب حوالي 170 مليون شخص حول العالم (1)، مع زيادة متوقعة إلى أكثر من 350 مليون إصابة بحلول عام 2030. على الرغم من تحسن التحكم بعوامل الاختطار المسببة للمرض القلبي الوعائي cardiovascular diseases إلا أن حدوث هذا المرض الذي يعزى إلى السكري هو بازدياد مضطرد (2، 3).
يؤدي السكري من النمط الثاني إلى حدوث عدد من الاضطرابات القلبية الوعائية Cardio-vascular disorders، مثل الاعتلالات الوعائية Angiopathies والتي تعد السبب الرئيسي للمراضة Morbidity والموت Mortality في السكري من النمط الثاني (4، 5).
يترافق السكري Diabetes بشكل عام مع تصلب عصيدي Atherosclerosis متسارع ينتج عنه سريرياً مرض الشريان الإكليلي (CAD) Coronary artery disease وازدياد اختطار المرض الدِمَاغِيٌّ الوِعَائِيّ Cerebrovascular disease والمرض الوعائي المحيطي الوخيم Severe peripheral vascular disease (6). يملك مرضى السكري من النمط الثاني من زيادة 2-4 في اختطار الإصابة بمرض الشريان التاجي، كما أن مرضى السكري بدون احتشاء عضلة قلبية سابق Myocardial infarction يملكون الاختطار نفسه للإصابة بمرض تاجي حاد Acute coronary disease لاحق، كما هو الحال عند المرضى اللاسكريين الذين لديهم احتشاء عضلة قلبية سابق (7، 8). إن الحوادث الاقفارية الراجعة تكون أكثر تكراراً عند مرضى السكري من النمط الثاني بالمقارنة مع المرضى اللاسكريين (9-11). وعلى الرغم من أن الصفيحات لا تحتوي على نوى Nuclei وهي أصغر الخلايا البشرية الجوالة إلا أنها تلعب دوراً كاملاً ومعقداً في عملية الخُثار Thrombosis السوية والمرضية (الشكل 1).
يلعب تنشيط وتكدس الصفيحات دوراً مركزياً في إحداث الخثرة داخل التاجية Intracoronary thrombi، بعد انبثاق اللويحة العصيدية Atherosclerotic plaque التلقائي والذي يؤدي إلى إقفار العضلة القلبية Myocardial ischemia أو الاحتشاء Infarction في المتلازمات التاجية الحادة (ACS) Acute coronary syndromes أو بعد انبثاق اللويحة العصيدية الميكانيكي الناتج عن التداخل التاجي Coronary intervention عبر الجلد. تلتصق الصفيحات في البداية إلى الكولاجين وعامل فون فيليبراند von Willebrand factor في مكان اللويحة المنفتحة، مما يؤدي إلى تشكل طبقة وحيدة أولية من الصفيحات. بعد تنشيط الصفيحات تتحرر نواهض ثانوية Secondary agonists مثل الترومبوكسان Thromboxane A2 والأدينوزين ثنائي الفسفات (ADP) Adinosine diphosphate، وبمشاركة الثرومبين Thrombin المتولد بعملية التخثر يجري تنشيط واستدعاء صفيحات إضافية (12، 13) (الشكل 2).
يساهم العيب الوظيفي Dysfunction للصفيحات، من بين العديد من الآليات الأخرى في زيادة اختطار المضاعفات العصيدية الخُثارِيّة Atherothrombotic عند السكريين (16-14). يتظاهر مثل هذا التبدل في وظيفة الصفيحات بفرط التحسس Hypersensitivity للتكدس Aggregation والذي يرتبط مع فَرْطُ سُكَّرِ الدَّم Hyperglycemia (5) والذي ينبىء عن حدوث الخثار.
تعد صفيحات المرضى السكريين أكثر حساسية للعديد من النواهض Agonists وهي تظهر التصاقاً وتكدساً معززاً مع أو بدون إضافة العوامل المحرضة على التكدس (5، 17).
يتضمن تنشيط الصفيحات حدوث تبدل في شكل الصفيحات مع خروج أرجل كاذبة Pseudopodes، زيادة سطح الغشاء وتسهيل الالتصاق. وكنتيجة لتنشيط الصفيحات فإنه يتحرر
محتواها من الحبيبات مؤدياً إلى حدوث تنشيط ذاتي وتضخيم لعمليات التكدس والالتصاق وتسريع عمليات الانسداد الوعائي vascular occlusion (18، 19). كذلك يؤدي تآثر الصفيحات المنشطة مع بقية الخلايا مثل الخلايا البطانية والكريات البيضاء إلى تضخيم عمليات الاعتلالات الوعائية الصغيرة والكبيرة Micro- and Macro-angiopathies.
|
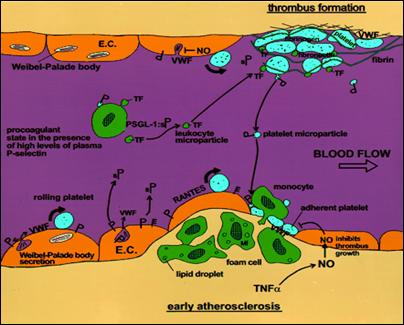
الشكل 1 : مشاركة الصفيحات الدموية في عملية تشكل الخثار
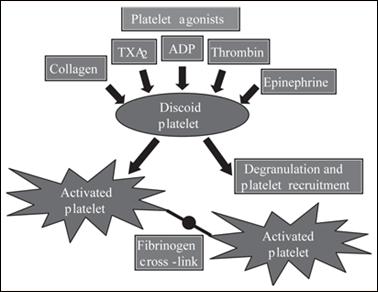
الشكل 2 : تنشيط الصفيحات الدموية بتأثير العديدمن النواهض
|
| الأثر المثبط للأنسولين على تكدس الصفيحات
Inhibitory Effect of Insulin on Platelets Aggregation
|
يملك الأنسولين تأثيراً مثبطاً مباشراً على تكدس الصفيحات والذي يعزى بشكل جزئي إلى تحرر أكسيد النتريت بتأثير سينثاز أكسيد النتريك NO2 Nitric oxide synthase. يسبب أكسيد النتريت تنشيط محلقة الغوانيلات Guanylate cyclase مع حدوث زيادة في الغوانوزين الحلقي أحادي الفسفات Cyclic guanosine monophosphate (cGMP) ذي التأثير المضاد للصفيحات (20). تكون صفيحات السكريين أقل حساسية للفعل المثبط للأنسولين (21).
يرتبط الأنسولين إلى مستقبلاته الصفيحية الغشائية وينقص استجابة الصفيحات إلى الترومبين والأدينوزين ثنائي الفسفات Adinosine diphosphate وحمض الأراشيدونيك Arachidonic acid (AA) والكولاجين Collagen والعامل المنشط للصفيحات Platelet- activating factor (PAF) (22). أكثر من ذلك يزيد الأنسولين من عدد مستقبلات البروستاغلاندين I2 (PGI2) في الصفيحات والذي يزيد من مستويات cAMP استجابة إلى PGI2 (23). كما ويوجد لدى مرضى السكري من النمط الثاني تناقص في عدد مستقبلات الأنسولين وفي أُلفتها Affinity (21) الذي يمكن أن يسبب تنشيط الصفيحات.
توجد العديد من الآليات ضمن الخلوية التي تؤدي إلى فرط نشاط الصفيحات المترافق مع حدوث الخثار والتصلب العصيدي (الشكل 3). يمكن لتحري الآليات المؤدية إلى فرط نشاط الصفيحات عند المرضى السكريين أن تؤدي إلى اكتشاف استراتيجيات دوائية جديدة لمنع أو لمعالجة المضاعفات الخثارية Thrombotic complications.
|
| آليات تنشيط الصفيحات لدى السكريين
Mechanisms of Platelet Activation in Diabetics
|
1- أنواع الأكسجين التفاعلي
Reactive oxygen species (ROS)
يترافق السكري مع زيادة الإجهاد التأكسدي Oxidative stress (24). تلعب أنواع الأكسجين التفاعلي مثل أيونات فوق الأكاسيد O2- وفوق أكسـيد الهيدروجين H2O2 دوراً مهماً في تنشيط الصفيحات (27-25).
يلعب الإجهاد التاكسدي دوراً هاماً في بدء وتقدم Progression الاضطرابات القلبية الوعائية المترافقة مع الأمراض المزمنة مثل السكري من النمط الثاني (28، 29).
يؤدي التجمع الشاذ لأنواع الأكسجين التفاعلي إلى حدوث عدم توازن بين إنتاج وإزالة (كنس) Scavenging أنواع الأكسجين التفاعلي. كما تؤدي عملية غلكزة البروتين Protein glycation وفرط غلوكوز الدم وتبدل استقلاب الغلوكوز إلى حدوث الإجهاد التأكسدي لدى السكريين (30، 31).
تحتوي صفيحات السكريين على مستويات متناقصة من مضادات التأكسد Antioxidants والتي تترافق مع فرط نشاط الصفيحات. يُحْدث السكري تبدلات في وظيفة الصفيحات ولكن الآليات ضمن الخلوية ودور أنواع الأكسجين التفاعلي في حدوث مثل هذه التبدلات ما تزال غير واضحة.
يتضمن المصدر الرئيسي لأنواع الأكسجين التفاعلي في الصفيحات البشرية فعالية إنزيمات مثل NADH/NADPH oxidase و Superocside -dismutase وإنزيم Cyclooxygenase المنشط أو استقلاب الفسفواينوزيتايد (34-32).
تنتج أنواع الجذور الفعالة وبشكل خاص أيونات فوق الأكاسيد وهيدروجين فوق الأكسيد بشكل مستمر ويتم إزالتها من الصفيحات البشرية. تزيد العديد من الشواد الفيزيولوجية من أنواع الأكسجين التفاعلي في الصفيحات البشرية (33، 35).
إن زيادة إنتاج الجذور الحرة المترافق مع فرط نشاط الصفيحات يمكن أن يلعب دوراً في زيادة المخاطر الخثارية عند السكريين. يمكن للتراكيز الزائدة من أنواع الأكسجين التفاعلي عند السكريين أن تلعب دوراً في تحوير وظيفة الصفيحات بطرق مختلفة كإحداث تبدلات في تحريك الكالسيوم زيادة فسفرة التيروزين والتعبير المفرط Overexpression للبروتينات السكرية على غشاء الصفيحات.
يعمل سوبر أكسيد الهيدروجين كمرسال ثانٍ عن طريق تنشيط تحرر مسالك حمض الأراشيدونيك والفسفوليباز C. بالإضافة إلى ذلك ينشط سوبر أكسيد الهيدروجين من فسفرة التيروزين عن طريق تنشيط العديد من الكينازات مثل Burton's tyrosine kinase (BTK) Map kinases JAK وبروتينات عائلة SRK (38-36).
تظهر كذلك صفيحات مرضى السكري من النمط الثاني تنشيطاً لتوليد أنواع الأكسجين التفاعلي داخلية المنشأ وزيادة أيونات الكالسيوم داخل الخلوية وفسفرة التيروزين استجابة للثرومبين بالمقارنة مع الصفيحات الطبيعية. بالإضافة إلى ذلك ينشط الإنتاج المرتفع لأنواع الأكسجين التفاعلي والأكسدة الفائقة للشحوم Lipid peroxidation من تنشيط الصفيحات والذي يزيد من تشكل القسيمات الدقيقة في صفيحات السكريين (39، 40).
|
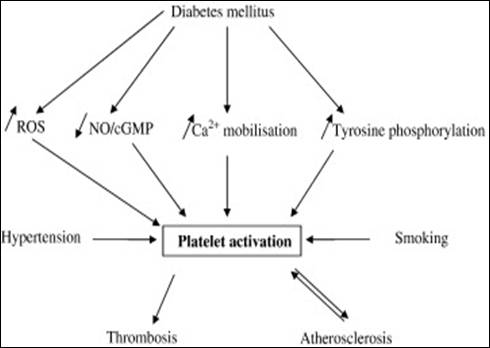
الشكل 3: الآليات المحتملة لتنشيط الصفيحات الدموية لدى مرضى السكري.
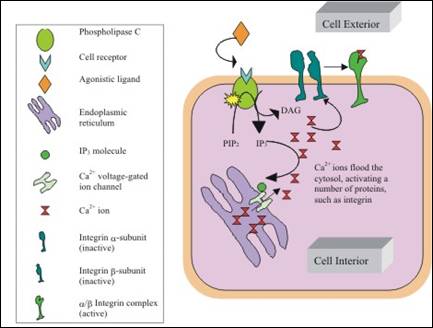
الشكل 4: ارتفاع تركيز أيونات الكالسيوم ضمن الخلية بتأثير ارتباط العديد من النواهض إلى مستقبلاتها على سطح الخلية.
|
2- إشارة الكالسيوم Calcium signalling
تعد أيونات الكالسيوم مرسالاً هاماً ضمن خلوي Intracellular messenger له دور في تنظيم عدد من وظائف الصفيحات مثل تبدل شكل الصفيحات الإفراز Secretion التكدس Aggregation وتشكيل الثرومبوكسان Thromboxane formation (41، 42). تصف العديد من الدراسات استتباب Homeostasis أيونات الكالسيوم في صفيحات المرضى السكريين، إلا أن الآليات الشاذة بقيت غير واضحة.
يوجد في الصفيحات مخزنين منفصلين للكالسيوم هما الجملة الأنبوبية الكثيفة (DTS) Dense tubular system والعضيات الحمضية Acidic organelles. تزيد نواهض الصفيحات من أيونات الكالسيوم الحرة عن طريق تحرير أيونات الكالسيوم من الأحياز ضمن الخلوية Intracellula compartments وعن طريق اِنْدِفاق Influx أيونات الكالسيوم عبر الغشاء البلازمي (43) (الشكل 4).
تتمثل الآلية الرئيسية التي تتحكم باِنْدِفاق أيونات الكالسيوم في الصفيحات البشرية بدخول الكالسيوم المحدث من قبل المخزن (SOCE) Store-operated Ca2+ entry العملية التي تنظم من قبل حالة ملء Filling state مخازن أيونات الكالسيوم ضمن الخلوية (44).
في ظروف الراحة وبعد التنشيط من قبل الثرومبين فإن صفيحات مرضى السكري من النمط الثاني تبدي تركيزاً لأيونات الكالسيوم الحرة أعلى مما تبديه الصفيحات الطبيعية (45). على الرغم من أن صفيحات مرضى السكري من النمط الثاني تظهر تراكماً لكميات من أيونات الكالسيوم مشابهة لما هي عليه الحال في صفيحات الأفراد الطبيعيين ضمن الأحياز داخل الخلوية، إلا أن الارتفاع الشاذ لأيونات الكالسيوم الحرة قد يعزى إلى إضعاف بثق Extrusion أيونات الكالسيوم (46، 47) وتنشيط SOCE (48)
يمكن لتنشيط تحريك الكالسيوم أن يكون مسؤولاً عن تنشيط الصفيحات وتكدسها، عن طريق تنشيط الاصطناع الحيوي للثرومبوكسان A2 Thromboxane A2. تحدث زيادة أيونات الكالسيوم الحرة زيادة في محتوى التيروزين المفسفر Phosphotyrosine في الصفيحات (49-51). بالإضافة إلى تبدلات تحريك الكالسيوم في الصفيحات فإن تراكيز المغنيزيوم ضمن الخلوية تتناقص ويزداد فرط تكدس والتصاق الصفيحات (52).
3- فسفرة وازالة فسفرة التيروزين Tyrosine phosphorylation/ dephosphorylation
يترافق تنشيط الصفيحات مع زيادة في فسفرة التيروزين للعديد من البروتينات الخلوية مثل SRC family و FAK وSYK (53).
تكون عملية فسفرة P38 mitogen-activated protein (MAP) kinase عند مرضى السكري من النمط الثاني أعلى بشكل معتد (54). يشترك P38 MAP kinase في فسفرة وتنشيط cPLA2 والذي يُعد ضرورياً لاصطناع حمض الأراشيدونيك (55).
تلعب عملية فسفرة التيروزين دوراً في العديد من وظائف الصفيحات المختلفة مثل التكدس تحريك أيونات الكالسيوم، واصطناع الثرومبوكسان. يكون محتوى الصفيحات من التيروزين في حالات الراحة وبعد التنشيط بالثرومبين زائداً (45).
بالإضافة إلى ذلك يوجد في صفيحات المرضى السكريين تحريك شاذ لأيونات الكالسيوم والذي يمكن أن يعزى إلى زيادة فعالية Tyrosine kinase pp60src المعدلة بتأثير فرط غلوكوز الدم (49).
يمكن أن يؤدي تثبيط إنزيمات Tyrosine phosphatases معينة من قبل هيدروجين فوق الأكسيد الى زيادة المحتوى من Phosphotyrosine المشاهد في صفيحات السكريين. أكثر من ذلك فإن فعالية إنزيم Ca2+ ATPase (PMCA) الموجود في الغشاء البلازمي تكون منخفضة عند صفيحات مرضى السكري من النمط الثاني والتي من الممكن أن تكون بسبب تناقص التعبير عن زيادة فسفرة التيروزين (56).
إن نقص التعبير وزيادة فسفرة PMCA الصفيحي عند مرضى السكري يؤدي إلى تناقص بثق أيونات الكالسيوم وزيادة الكالسيوم الحر ضمن الخلوي.
4- مسلكNO/cGMP NO/cGMP pathway
يُعد مسلك NO/cGMP آلية معروفة يجري من خلالها تثبيط الصفيحات. تمتلك الصفيحات البشرية NOS، الذي يعمل بشكل غير معتمد على أيونات الكالسيوم (57). يثبط أكسيد النتريت تنشيط الصفيحات وتكدسها عند طريق زيادة cGMP الهيولية (58).
تكون فعالية NOS في صفيحات مرضى داء السكري أخفض بشكل معتد به، بالمقارنة مع تلك المقاسة في صفيحات الأشخاص الأصحاء، مقترحاً ذلك بأن تناقص فعالية NOS ربما يلعب دوراً في إمراضية المضاعفات الوعائية للسكريين (59، 60).
تتناقص فاعلية NOS الأساسية Basal NOS activity في جناسات صفيحات السكريين (55، 56). أكثر من ذلك فإن تناقص فاعلية محلقة الغوانيلات Guanylate cyclase الصفيحية قد وجد عند مرضى السكري من النمط الثاني البدينين (61) والذي يمكن أن يعزز من قبل تراكيز أيونات الكالسيوم الحرة. يترافق كذلك ارتفاع تراكيز غلوكوز الدم مع تناقص في إنتاج أكسيد النتريت الصفيحي (62).
تنتج مقاومة، عند السكريين بشكل كبير، من إزالة NO من قبل أيونات الأكاسيد ومن عدم تنشيط محلقة الغوانيلات المنحلة. يساهم الفعل المضاد لتكدس الصفيحات في زيادة cGMP وcAMP المتواسط من قبل أكسيد النتريت (63).
يحدث NO فسفرة البروتين المفسفر المنشط للموسع الوعائي (VASP) vasodilator stimulated phosphoprotein من قبل محلقة الغوانيلات المعتمدة على NO وتنشيط PKG المتواسط من قبل cGMP التالي. تلعب فسفرة VASP المعتمدة على NO دوراً هاماً في تثبيط تنشيط الصفيحات (64) ولها علاقة بتثبيط ارتباط الفبرينوجين الى مستقبله GPIIb-IIIa (65).
|
| الاستنتاج Conclusion |
| يوجد دليل على تنشيط الصفيحات عند مرضى السكري وعلى مساهمة تنشيط الصفيحات في حدوث المضاعفات القلبية الوعائية المرافقة للسكري. يمكن لتبدل شكل الصفيحات ولوظيفتها أن تكون عوامل هامة في تسريع إمراضية الاعتلالات الوعائية الصغيرة والكبيرة عند المرضى السكريين. يمكن للعديد من المسالك الكيميائية الحيوية أن تتبدل في صفيحات السكريين. إن فهم الآليات المسببة لفرط نشاط الصفيحات يُعد ضرورياً لتطوير استراتيجيات لإنقاص فرط تكدس الصفيحات والمضاعفات القلبية الوعائية عند السكريين. |
| المراجع References |
1-M. Stumvoll, B.J. Goldstein and T.W. van Haeften. Type 2 diabetes: principles of pathogenesis and therapy. Lancet, 365:1333–1346, 2005.
2-Fox CS, Coady S, Sorlie PD, D'Agostino RB Sr, Pencina MJ, Vasan RS, Meigs JB, Levy D, Savage PJ. Increasing cardiovascular disease burden due to diabetes mellitus: the Framingham Heart Study. Circulation, 115:1544–1550, 2007.
3-Ford ES, Ajani UA, Croft JB, Critchley JA, Labarthe DR, Kottke TE, Giles WH, Capewell S. Explaining the decrease in U.S. deaths from coronary disease, 1980–2000. N Engl J Med, 356:2388–2398, 2007.
4-C. Cimminiello and M. Milani. Diabetes mellitus and peripheral vascular disease: is aspirin effective in preventing vascular events?. Diabetologia, 39:1402–1404, 1996.
5-A.B. Sobol and C. Watala. The role of platelets in diabetes-related vascular complications. Diabetes Res, Clin. Pract, 50:1–16, 2000.
6-Luscher TF, Creager MA, Beckman JA, Cosentino F. Diabetes and vascular disease: pathophysiology, clinical consequences and medical therapy. Circulation, 108:1655–1661, 2003.
7-Beckman JA, Creager M, Libby P. Diabetes and atherosclerosis: epidemiology, pathophysiology, and management. JAMA, 287:2570 –2581, 2002
8-Haffner SM, Lehto S, Ronnemaa T, Pyorala K, Laakso M. Mortality from coronary heart disease in subjects with type 2 diabetes and in nondiabetic subjects with and without prior myocardial infarction. N Engl J Med, 339:229 –234, 1998
9-Mak KH, Moliterno DJ, Granger CB, Miller DP, White HD, Wilcox RG, Califf RM, Topol EJ. Influence of diabetes mellitus on clinical outcome in the thrombolytic era of acute myocardial infarction: GUSTO-I Investigators: Global Utilization of Streptokinase and Tissue Plasminogen Activator for Occluded Coronary Arteries. J Am Coll Cardio, l30:171–179, 1997.
10-Barsness GW, Peterson ED, Ohman EM, Nelson CL, DeLong ER, Reves JG, Smith PK, Anderson RD, Jones RH, Mark DB, Califf RM. Relationship between diabetes mellitus and long-term survival after coronary bypass and angioplasty. Circulation, 96 :2551 –2556, 1997.
11-Abizaid A, Kornowski R, Mintz GS, Hong MK, Abizaid AS, Mehran R, Pichard AD, Kent KM, Satler LF, Wu H, Popma JJ, Leon MB. The influence of diabetes mellitus on acute and late clinical outcomes following coronary stent implantation. J Am Coll Cardio, l32:584–589, 1998.
12-McNicol A, Israels SJ. Platelets and anti-platelet therapy. J Pharmacol Sci, 93: 381–396, 2003.
13-Patrono C, Bachmann F, Baigent C, et al. Expert consensus document on the use of antiplatelet agents. The Task Force on the Use of Antiplatelet Agents in Patients with Atherosclerotic Cardiovascular Disease of the European Society of Cardiology. Eur Heart J, 25: 166–181, 2004.
14-Colwell JA, Nesto RW. The platelet in diabetes: focus on prevention of ischemic events. Diabetes Care, 26 :2181 –2188, 2003
15-Vinik AI, Erbas T, Park TS, Nolan R, Pittenger GL. Platelet dysfunction in type 2 diabetes. Diabetes Care, 24 :1476 –1485, 2001
16-Ferroni P, Basili S, Falco A, Davi G. Platelet activation in type 2 diabetes mellitus. J Thromb Haemost, 2 :1282 –1291, 2004
17-R. Gabbianelli, G. Falcioni, C.S. Dow, F.P. Vince and B. Swoboda, A new method to evaluate spontaneous platelet aggregation in type 2 diabetes by Cellfacts, Clin. Chim. Acta 329 (2003), pp. 95–102.
18-H. Holmsen. Platelet metabolism and activation. Hematol, 22: 219–240, 1985.
19-R.K. Andrews, Y. Shen, E.E. Gardiner and M.C. Berndt. Platelet adhesion receptors and (patho)physiological thrombus formation. Histol. Histopathol, 16: 969–980, 2001.
20-M. Trovati, P. Massucco, L. Mattiello, V. Piretto, F. Cavalot, E. Mularoni and G. Anfossi. The insulin-induced increase of guanosine-3,5-cyclic monophosphate in human platelets is mediated by nitric oxide. Diabetes, 45: 768–770, 1996.
21-M. Udvardy, G. Pfliegler and K. Rak. Platelet insulin receptor determination in non-insulin dependent diabetes mellitus. Experientia, 41: 422–423, 1985.
22- M. Trovati, G. Anfossi, F. Cavalot, P. Massucco, E. Mularoni and G. Emanuelli. Insulin directly reduces platelet sensitivity to aggregating agents. Studies in vitro and in vivo. Diabetes, 37: 780–786, 1988.
23-A.I. Vinik, T. Erbas, T.S. Park, R. Nolan and G.L. Pittenger, Platelet dysfunction in type 2 diabetes. Diabetes Care, 24:1476–1485, 2001.
24-B. Lipinski, Pathophysiology of oxidative stress in diabetes mellitus, J. Diabetes Its Complicat, 15 :203–210, 2001.
25-S. Chlopicki, R. Olszanecki, M. Janiszewski, F.R. Laurindo, T. Panz and J. Miedzobrodzki. Functional role of NADPH oxidase in activation of platelets, Antioxid. Redox Signal, 6 :691–698, 2004.
26-F. Krotz, H.Y. Sohn and U. Pohl, Reactive oxygen species: players in the platelet game. Arterioscler. Thromb. Vasc. Biol. 24 : 1988–1996, 2004.
27-P. Pignatelli, V. Sanguigni, L. Lenti, D. Ferro, A. Finocchi, P. Rossi and F. Violi, gp91phox-dependent expression of platelet CD40 ligand. Circulation, 110:1326–1329, 2004.
28- J.A. Colwell and R.W. Nesto, The platelet in diabetes: focus on prevention of ischemic events, Diabetes Care 26 (2003), pp. 2181–2188.
29-Y. Taniyama and K.K. Griendling, Reactive oxygen species in the vasculature: molecular and cellular mechanisms. Hypertension, 42 :1075–1081, 2003.
30-G. Leoncini, M.G. Signorello, A. Piana, M. Carrubba and U. Armani. Hyperactivity and increased hydrogen peroxide formation in platelets of NIDDM patients. Thromb. Res, 86: 153–160, 1997.
31-A. Ceriello. Hyperglycaemia: the bridge between non-enzymatic glycation and oxidative stress in the pathogenesis of diabetic complications. Diabet. Nutr. Metab, 12 : 42–46, 1999.
32-L. Iuliano, A.R. Colavita, R. Leo, D. Pratico and F. Violi. Oxygen free radicals and platelet activation. Free Radic. Biol. Med, 22: 999–1006, 1997.
33-T. Seno, N. Inoue, D. Gao, M. Okuda, Y. Sumi, K. Matsui, S. Yamada, K.I. Hirata, S. Kawashima, R. Tawa, S. Imajoh-Ohmi, H. Sakurai and M. Yokoyama. Involvement of NADH/NADPH oxidase in human platelet ROS production. Thromb. Res, 103:399–409, 2001.
34-B. Wachowicz, B. Olas, H.M. Zbikowska and A. Buczynski. Generation of reactive oxygen species in blood platelets. Platelets, 13:175–182, 2002.
35-A.J. Begonja, S. Gambaryan, J. Geiger, B. Aktas, M. Pozgajova, B. Nieswandt and U. Walter, Platelet NAD(P)H-oxidase-generated ROS production regulates alphaIIbbeta3-integrin activation independent of the NO/cGMP pathway. Blood, 106: 2757–2760, 2005.
36-J. Abe, M. Takahashi, M. Ishida, J.D. Lee and B.C. Berk. c-Src is required for oxidative stress-mediated activation of big mitogen-activated protein kinase 1. J. Biol. Chem, 15: 20389–20394, 1997.
37-T. Finkel. Oxygen radicals and signaling. Curr. Opin. Cell. Biol, 10: 248–253, 1998.
38-P.C. Redondo, N. Ben-Amor, G.M. Salido, A. Bertagi, J.A. Pariente and J.A. Rosado. Ca2+-independent activation of Bruton's tyrosine kinase is required for store-mediated Ca2+ entry in human platelets. Cell, Signal, 17 :1011–1021, 2005.
39-O. Morel, L. Jesel, B. Hugel, M.P. Douchet, M. Zupan, M. Chauvin, J.M. Freyssinet and F. Toti. Protective effects of vitamin C on endothelium damage and platelet activation during myocardial infarction in patients with sustained generation of circulating microparticles. J. Thromb. Haemost, 1 :171–177, 2003.
40-P. Ferroni, S. Basili, A. Falco and G. Davi. Platelet activation in type 2 diabetes mellitus. J. Thromb. Haemost, 2 :1282–1291, 2004.
41-Y. Li, V. Woo and R. Bose. Platelet hyperactivity and abnormal Ca2+ homeostasis in diabetes mellitus. Am. J. Physiol, Heart Circ. Physiol, 280:H1480–H1489, 2001.
42-I. Jardin, N. Ben Amor, J.M. Hern?ndez-Cruz, G.M. Salido and J.A. Rosado. Involvement of SNARE proteins in thrombin-induced platelet aggregation: evidence for the relevance of Ca2+ entry. Arch. Biochem. Biophys, 465:16–25, 2007.
43-J.A. Rosado and S.O. Sage. The ERK cascade, a new pathway involved in the activation of store-mediated calcium entry in human platelets. Trends Cardiovasc. Med, 12 :229–234, 2002.
44-J.A. Rosado and S.O. Sage. The actin cytoskeleton in store-mediated calcium entry. J. Physiol, 2 :221–229, 2000.
45-M. El Haouari, I. Jardin, H. Mekhfi, J.A. Rosado and G.M. Salido. Urtica dioica extract reduces platelet hyperaggregability in type 2 diabetes mellitus by inhibition of oxidant production, Ca2+ mobilization and protein tyrosine phosphorylation.
J. Appl. Biomed, 5:105–113, 2007.
46-J.A. Rosado, F.R. Saavedra, P.C. Redondo, J.M. Hernandez-Cruz, G.M. Salido and J.A. Pariente. Reduced plasma membrane Ca2+-ATPase function in platelets from patients with non-insulin-dependent diabetes mellitus. Haematologica, 89:1142–1144, 2004.
47-C. Chaabane, S. Dally, E. Corvazier, R. Bredoux, R. Bobe, B. Ftouhi, A. Raies and J. Enouf. Platelet PMCA- and SERCA-type Ca2+-ATPase expression in diabetes: a novel signature of abnormal megakaryocytopoiesis. J. Thromb. Haemost, 5:2127–2135, 2007.
48-P.C. Redondo, I. Jardin, J.M. Hern?ndez-Cruz, J.A. Pariente, G.M. Salido and J.A. Rosado. Hydrogen peroxide and peroxynitrite enhance Ca2+ mobilization and aggregation in platelets from type 2 diabetic patients. Biochem. Biophys. Res. Commun, 333:794–802, 2005.
49-F.R. Saavedra, P.C. Redondo, J.M. Hernandez-Cruz, G.M. Salido, J.A. Pariente and J.A. Rosado. Store-operated Ca2+ entry and tyrosine kinase pp60(src) hyperactivity are modulated by hyperglycemia in platelets from patients with non insulin-dependent diabetes mellitus. Arch. Biochem. Biophys, 432:261–268, 2004.
50-P. Sargeant, R.W. Farndale and S.O. Sage. The tyrosine kinase inhibitors methyl 2,5-dihydroxycinnamate and genistein reduce thrombin-evoked tyrosine phosphorylation and Ca2+ entry in human platelets.
FEBS Lett, 315:242–246, 1993.
51-P. Sargeant, R.W. Farndale and S.O. Sage. Calcium store depletion in dimethyl BAPTA-loaded human platelets increases protein tyrosine phosphorylation in the absence of a rise in cytosolic calcium. Exp. Physiol, 79:269–272, 1994.
52-M. Gawaz, I. Ott, A.J. Reininger and F.J. Neumann. Effects of magnesium on platelet aggregation and adhesion. Magnesium modulates surface expression of glycoproteins on platelets in vitro and ex vivo.
Thromb. Haemost, 72:912–918, 1994.
53-A. Salmeen, J.N. Andersen, M.P. Myers, T.C. Meng, J.A. Hinks, N.K. Tonks and D. Barford. Redox regulation of protein tyrosine phosphatase 1B involves a sulphenyl-amide intermediate. Nature, 423:769–773, 2003.
54-L. Coulon, C. Calzada, P. Moulin, E. Vericel and M. Lagarde. Activation of p38 mitogen-activated protein kinase/cytosolic phospholipase A2 cascade in hydroperoxide-stressed platelets. Free Radic. Biol. Med, 35:616–625, 2003.
55-A. Salmeen, J.N. Andersen, M.P. Myers, T.C. Meng, J.A. Hinks, N.K. Tonks and D. Barford, Redox regulation of protein tyrosine phosphatase 1B involves a sulphenyl-amide intermediate. Nature, 423 : 769–773, 2003.
56-J.A. Rosado, F.R. Saavedra, P.C. Redondo, J.M. Hernandez-Cruz, G.M. Salido and J.A. Pariente. Reduced plasma membrane Ca2+-ATPase function in platelets from patients with non-insulin-dependent diabetes mellitus.
Haematologica, 89:1142–1144, 2004.
57-V. Randriamboavonjy and I. Fleming. Endothelial nitric oxide synthase (eNOS) in platelets: how is it regulated and what is it doing there?.
Pharmacol. Rep, 57:59–65, 2005.
58-A. Schafer, F. Wiesmann, S. Neubauer, M. Eigenthaler, J. Bauersachs and K.M. Channon, Rapid regulation of platelet activation in vivo by nitric oxide. Circulation, 109:1819–1822, 2004.
59-V. Martina, G.A. Bruno, F. Trucco, E. Zumpano, M. Tagliabue, C. Di Bisceglie and G. Pescarmona, Platelet cNOS activity is reduced in patients with IDDM and NIDDM, Thromb. Haemost, 79: 520-522, 1998.
60-R.A. Rabini, R. Staffolani, P. Fumelli, B. Mutus, G. Curatola and L. Mazzanti. Decreased nitric oxide synthase activity in platelets from IDDM and NIDDM patients.
Diabetologia, 41: 101-104, 1998.
61-YuYu Chirkov, I.A. Tyshchuk and I.S. Severina. Guanylate cyclase in human platelets with different aggregability. Experientia, 46:697-699, 1990.
62-J.P. De La Cruz, M.M. Arrebola, M.A. Villalobos, A. Pinacho, A. Guerrero, J.A. Gonzalez-Correa and F. Sanchez de la Cuesta. Influence of glucose concentration on the effects of aspirin, ticlopidine and clopidogrel on platelet function and platelet–subendothelium interaction.
Eur. J. Pharmacol, 48:19–27, 2004.
63-M. Trovati, P. Massucco, L. Mattiello, V. Piretto, F. Cavalot, E. Mularoni and G. Anfossi. The insulin-induced increase of guanosine-3?,5?-cyclic monophosphate in human platelets is mediated by nitric oxide.
Diabetes, 45:768-770, 1996.
64-M. Eigenthaler, C. Nolte, M. Halbrugge and U. Walter, Concentration and regulation of cyclic nucleotides, cyclic-nucleotide-dependent protein kinases and one of their major substrates in human platelets. Estimating the rate of cAMP-regulated and cGMP-regulated protein phosphorylation in intact cells. Eur. J. Biochem, 205 : 471-481, 1992.
65-K. Horstrup, B. Jablonka, P. Honig-Liedl, M. Just, K. Kochsiek and U. Walter.
Phosphorylation of focal adhesion vasodilator-stimulated phosphoprotein at Ser157 in intact human platelets correlates with fibrinogen receptor inhibition.
Eur. J. Biochem, 225: 21-27, 199
|
| |
| المجلد 6 ,
العدد 2
, رجب 1432 - تموز (يوليو) 2011 |
|
|
|
