| الملخص Abstract |
يلعب عامل النمو الوعائي البطاني VEGF دوراً أساسياً في توليد الأوعية الدموية وتحريض النفوذية الوعائية، مما يجعله من أهم العوامل المشاركة في تطور الأورام الصلبة وحدوث النقائل. ونظراً لكون الخباثات الدموية لا تتطور ككتلة ورمية مكتنزة فالحاجة إلى تولد الأوعية ليس ظاهراً بوضوح كما في الأورام الصلبة. إلا أن عدة دراسات قدمت أدلة على تحريض تولد الأوعية في تكون أورام الخباثات الدموية بشكل مشابه لتولد الأوعية في الأورام الصلبة.
هدفت هذه الدراسة تقييم مستويات الـ VEGF المصلية لدى 149 مريضاً من مرضى الخباثات الدموية والذين قسموا إلى مجموعتين: مجموعة مستجيبة للعلاج وضمت 75 مريضاً ومجموعة غير مستجيبة للعلاج وضمت 74 مريضاً من خلال مقارنتهم مع المجموعة الشاهدة (26 شخصاً سوياً ظاهرياً).
كانت مستويات الـ VEGF المصلية في مرضى الخباثات الدموية الذين لم يستجيبوا للعلاج أعلى من مجموعة المرضى الذين استجابوا للعلاج ومن المجموعة الشاهدة بفارق يعتد به إحصائياً، مما يدل على تفعيل تحريض تولد أوعية إضافية في المَقَرَّات السائدة لتكون الأورام في معظم الخباثات الدموية وهي نقي العظم والنسج اللمفية.
|
Vascular endothelial growth factor VEGF plays a key role in angiogenesis and inducing vascular permeability, which make it one of the most important factors participating in solid tumors development and metastasis. And with regard to hematological malignancies do not develop as compact tumor mass, the necessity for angiogenesis was not as readily apparent as for solid tumors. However, several studies provide evidences for angiogenesis induction in neoplasias of hematological malignancies similar to angiogenesis in solid tumors.
This study was aimed to evaluate serum VEGF levels in 149 patients with hematological malignancies whom divided to tow groups: respond to therapy group which contain 75 patients and non respond to therapy group which contain 74 patients by comparing them with control group (26 apparently normal subjects).
Serum VEGF levels in hematological malignancies patients whom do not
respond to therapy were higher than whom respond to therapy and control group with statistically significant difference, that indicate to activating angiogenesis induction in the predominant sites for oncogenesis in most hematological malignancies which are marrow and lymphatic tissues.
|
| المقدمة Introduction |
يعد عامل النمو الوعائي البطاني من أقوى العوامل المولدة للأوعية وأكثرها شهرة (1). له تأثير قوي على النفوذية الوعائية، حيث دعي حين اكتشافه في ثمانينيات القرن الماضي بعامل النفوذية الوعائي Vascular permeability factor (VPF) (2).
ترتبط عائلة VEGF بنيوياً بالبروتينات السكرية المثنوية، التي تنتمي إلى عامل النمو المشتق من الصفيحات platelet-derived growth factor (PDGF) من طائفة عوامل النمو (3)، وتضم عائلة VEGF سبعة أعضاء: VEGF-A وVEGF-B وVEGF-C وVEGF-D وVEGF-E وVEGF-F وعامل النمو المشيمي PlGF، ويعد VEGF-A من أقوى أفراد العائلة فعالية وهو المقصود عند ذكر عامل النمو الوعائي البطاني VEGF بشكل عام.
ترتبط عائلة VEGF بألفة مختلفة بثلاث مستقبلات تيروزين كيناز: VEGFR-1 وVEGFR-2 وVEGFR-3 بالإضافة إلى مستقبلات مشتركة هي النوروبيلين-1 و-2 (NRPs) وكبريتات هيباران بروتيوغليكانات heparan sulfate proteoglycans HSPGs الرابطة للهيبارين على سطح الخلية (4). يشترك أكثر من نمط من هذه المستقبلات لإعطاء الاستجابة البيولوجية لعائلة VEGF.
يفرز VEGF من أنواع كثيرة من الخلايا وتتوضع مستقبلاته في أنسجة مختلفة فهو بالتالي يمتلك تأثيرات حيوية عديدة من أهمها النفوذية الوعائية: أول ما أكتشف VEGF كان من خلال تأثيره القوي على النفوذية الوعائية (2)، حيث دعي أول اكتشافه بعامل النفوذية الوعائية. كما يملك VEGF من خلال ارتباطه بمستقبلاته تأثيرين بيولوجيين أساسيين (5) هما: تأثير نظير غدي paracrine، على الخلايا الوعائية البطانية فيؤدي إلى تولد الأوعية وتأثير غدي ذاتي autocrine، على الخلايا الجذعية في نقي العظم يؤدي إلى تكون الدم hematopoiesis.
يعد VEGF المولد الرئيسي للأوعية في السرطانات الصلبة ويعبر عنه في أغلب الأورام، كما أن تعبيره مترافق مع تقدم الورم وحدوث النقائل (6)، ويتم التعبير عن VEGF ومستقبليه VEGFR1 وVEGFR2 في كل خلايا الخباثات الدموية الأساسية، حيث يرتبط التعبير المشترك عن الـ VEGF ومستقبليه مع تأثير الـ VEGF المباشر وغير المباشر على خلايا الخباثات الدموية. ولقد أثبتت هذه التأثيرات الدور الحيوي الذي يلعبه الـ VEGF في الملامح السريرية وفي إمراض pathogenesis هذه الخباثات (7). يتمثل التأثير المباشر للـ VEGF على خلايا الخباثات الدموية بتأثيره الغدي الذاتي، حيث يجري هذا التأثير من خلال التحريض المباشر للـ VEGF على بقيا survival خلايا الخباثات الدموية وتكاثرها وهجرتها (7).
يتمثل التأثير غير المباشر للـ VEGF بتحريض تولد أوعية دموية زائدة في أنسجة الخباثات الدموية (العقد اللمفية ونقي العظم) وهي ضرورية من أجل تطور المرض من خلال تأمين متطلبات تكاثر الخلايا الورمية (8)، ويعد الـ VEGF من أهم عوامل النمو المحرضة على تولد الأوعية في الخباثات الدموية من خلال تأثيره نظير الغدي.
تعمل هذه الدراسة على تحديد تراكيز الـ VEGF في مصول مرضى مجموعة الخباثات الدموية التي ضمت: الابيضاض اللمفاوي الحاد (ALL) Acute lymphoblastic leukemia والابيضاض النقوي الحاد (AML) Acute myeloid leukemia والابيضاض اللمفاوي المزمن (CLL) Chronic lymphoblastic leukemia والابيضاض النقوي المزمن (CML) Chronic myeloid leukemia وداء هودجكن Hodgkin's disease ولمفوما لا هودجكن non-Hodgkin's lymphoma وورم النقي المتعدد multiple myeloma، لمعرفة مدى ترافق تراكيزه المصلية مع تطور المرض عند عدم الاستجابة للعلاج ومع تراجع المرض (حدوث الهدأة) عند الاستجابة للعلاج.
|
| المواد والطرق Materials and Methods |
| أجريت هذه الدراسة في مخابر كلية الصيدلة بدمشق ومستشفى البيروني ما بين عامي 2005-2007 وشملت هذه الدراسة 175 فرداً توزعوا على الشكل التالي: 149 مريضاً (87 ذكراً، 62 أنثى) مصاباً بالخباثات الدموية جرى تشخيصهم مسبقاً من قبل أطباء اختصاصيين في أمراض الدم، تراوحت أعمارهم بين 3 و76 عاماً (37.6±21.5 عاماً)، وجرى تقسيم المرضى بحسب استجابتهم للعلاج إلى: مجموعة الاستجابة للعلاج، ضمت 75 مريضاً (44 ذكراً و31 أنثى)، ومجموعة عدم الاستجابة للعلاج، ضمت 74 مريضاً (43 ذكراً و 31 أنثى)، و 26 فرداً شاهداً من الأصحاء ظاهرياً (12 ذكراً و14 أنثى)، جرى انتقاؤهم من سكان مدينة دمشق وضواحيها، وليست لديهم أية شكوى حالية أو سابقة لمرض دموي. تراوحت أعمارهم بين 6 و 65 عاماً (15.6±31 عاماً).
بزلت عينات الدم من المرضى باستخدام نظام Vacutainer ونبذت العينات بسرعة 4000 g لمدة 15 دقيقة. وزع المصل الناتج في أنابيب إيبندورف Epindorf محكمة الإغلاق وحفظت في الدرجة 80-°م إلى حين إجراء المقايسات.
جرت مقايسة VEGF باستخدام طريقة المقايسة المناعية الإنزيمية بطريقة الشطيرة ذات الصفيحة الصلبة solid phase sandwich Enzyme Linked-Immuno-Sorbent Assay (ELISA)، باستخدام عتائد جاهزة لشركة Biosource تعتمد المبدأ التالي: تكون الآبار مغللة بأضداد نوعية متعددة النسائل للـ VEGF وعند إضافة المعياري والعينات إلى الآبار فإن مستضد الـ VEGF يرتبط بالأضداد المثبتة على جدران الآبار، ويجري التخلص من الركيزة الزائدة غير المرتبطة بالغسل الجيد، ثم تضاف أضداد نوعية متعددة النسائل للـ VEGF مرتبطة بإنزيم إلى الآبار، ثم يجري غسل الآبار لإزالة زيادة الأضداد المرتبطة بإنزيم ويضاف بعد ذلك محلول الركيزة ليتطور اللون بالتناسب مع كمية الـ VEGF الكلية، ثم يوقف التفاعل اللوني بإضافة محلول (2N) H2SO4 وتقاس الكثافة اللونية بموجة طولها 450 نانومتر.
حللت النتائج إحصائياً باستخدام برنامج الحاسوب Excel 2003 من شركة Microsoft، حيث اعتمد اختبار ستيودنت student's t-test للمقارنة بين مجموعات الدراسة وتقييم الفروقات بينها، واعتبرت قيمة (P<0.05) معتداً بها إحصائيا، كما استخدم (المتوسط ± الانحراف المعياري) لتحليل المعطيات العددية.
|
| النتائج Result |
تراوحت قيم الـ VEGF المصلية لدى المجموعة الشاهدة بين 100 و 290 بيكوغرام/ مل، حيث كانت قيمة المتوسط الحسابي له 188 بيكوغرام/ مل، وكان الانحراف المعياري 46.5 (46.5±188)، ولم يلاحظ وجود فارق يعتد به بين الذكور والإناث.
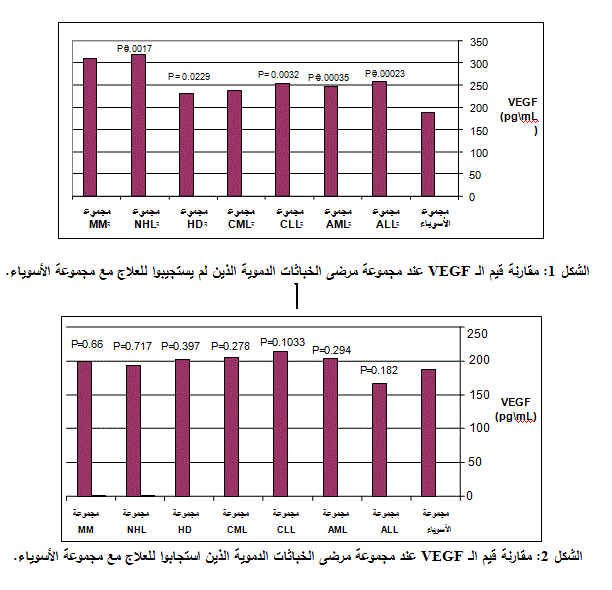
كان متوسط قيم الـ VEGF المصلية في مجموعة مرضى الخباثات الدموية الذين لم يستجيبوا للعلاج مرتفعاً بشكل ملحوظ مقارنةً مع المجموعة الشاهدة، حيث بلغ 257 بيكوغرام/ مل لدى مجموعة مرضى الابيضاض اللمفاوي الحاد ALL التي ضمت 13 مريضاً (5 ذكور و8 إناث) و247 بيكوغرام/ مل لدى مجموعة مرضى الابيضاض النقوي الحاد AML التي ضمت 12 مريضاً (4 ذكور و 8 إناث) و 254 بيكوغرام/ مل لدى مجموعة مرضى الابيضاض اللمفاوي المزمن CLL التي ضمت 13 مريضاً (10 ذكور و3 إناث) و237 بيكوغرام/ مل لدى مجموعة مرضى الابيضاض النقوي المزمن CML التي ضمت 15 مريضاً (10 ذكور و5 إناث) و232 بيكوغرام/ مل لدى مجموعة مرضى داء هودجكن HD التي ضمت 13 مريضاً (9 ذكور و4 إناث) و319 بيكوغرام/ مل لدى مجموعة مرضى داء لا هودجكن NHL التي ضمت 7 مرضى (4 ذكور و3 إناث) وذلك بفارق معتد به إحصائياً، حيث بلغت قيم P 0.00023 و0.00035 و0.0032 و0.011 و0.0229 و 0.0017، على الترتيب (الشكل 1). وفي مجموعة مرضى ورم النقي المتعدد والتي ضمت مريضاً واحداً وكانت قيمة VEGF المصل 310 بيكوغرام/ مل أي حوالي ضعف متوسط قيمته لدى المجموعة الشاهدة.
انخفض متوسط قيم الـ VEGF المصلية لدى مجموعة مرضى الخباثات الدموية الذين استجابوا للعلاج بشكل ملحوظ، مقارنةً مع المجموعة الشاهدة حيث بلغت 167 بيكوغرام/ مل لدى مجموعة مرضى الابيضاض اللمفاوي الحاد ALL التي ضمت 16 مريضاً (7 ذكور و 9 إناث) و 204 بيكوغرام/ مل لدى مجموعة مرضى الابيضاض النقوي الحاد AML التي ضمت 16 مريضاً (9 ذكور و 7 إناث) و 213 بيكوغرام/ مل لدى مجموعة مرضى الابيضاض اللمفاوي المزمن CL) التي ضمت 10 مرضى (8 ذكور و 2 إناث) و 205 بيكوغرام/ مل لدى مجموعة مرضى الابيضاض اللنقوي المزمن CML التي ضمت 10 مرضى (8 ذكور و2 إناث) و202 بيكوغرام/ مل لدى مجموعة مرضى داء هودجكن HD التي ضمت 13 مريضاً (6 ذكور و7 إناث) و 194 بيكوغرام/ مل لدى مجموعة مرضى داء لا هودجكن NHL التي ضمت 7 مرضى (5 ذكور و2 إناث) و200 بيكوغرام/ مل لدى مجموعة مرضى ورم النقي المتعدد MM التي ضمت 3 مرضى (ذكر وأنثيين) وذلك بفارق غير معتد به إحصائياً، حيث بلغت قيم P: 0.182 و0.294 و0.1003 و0.278 و0.397 و0.717 و0.66، على الترتيب (الشكل 2).
|
 |
| المناقشة Discussion |
إن ارتفاع مستويات الـ VEGF المصلية يدل على وجود تولد زائد لأوعية دموية جديدة، ولقد بينت دراستنا ارتفاعاً في قيم VEGF المصلية عند مرضى الخباثات الدموية عند عدم الاستجابة للعلاج مقارنةً مع قيمه لدى المجموعة الشاهدة. توافقت هذه النتائج مع دراسة أجريت في جامعة أتاتورك Ataturk في تركيا عام 2006، والتي تمت على 45 مريضاً و 20 شاهداً (9).
يمكن أن يفسر ذلك بأن خلايا الخباثات الدموية ـ المتكاثرة بسرعة في نقي العظم والنسج اللمفية للمرضى ـ تصطنع عامل النمو الوعائي البطاني VEGF داخل الخلايا الورمية، لأنه ضروري لبقيا وتكاثر وهجرة هذه الخلايا من خلال تأثيره الغدي الذاتي (7)، وهي تحرره إلى النسج المحيطة ليرتبط بمستقبلاته على سطح الخلايا البطانية، مما يؤدي إلى تفعيل انقسامها وبالتالي زيادة عدد الأوعية الدموية الدقيقة (تأثير نظير غدي). إن هذه الأوعية الدموية الإضافية الجديدة ضرورية لتأمين حاجات الخلايا الورمية المتزايدة من المواد الغذائية والأكسجين وكذلك للتخلص من النواتج الاستقلابية. يترافق تزايد عدد الخلايا الورمية مع تزايد مستويات الـ VEGF بشكل مفرط في نقي العظم والنسج اللمفية لمرضى الخباثات الدموية، ونعتقد أن الكمية الزائدة من الـ VEGF في نسج الخلايا الورمية تنتشر إلى الدوران الدموي، مما يزيد من تركيزه في المصل وتتناسب كميته مع ازدياد تشكل الأوعية الدقيقة في نقي عظم المرضى.
حين نكـس المرض، أو عند عـدم الاسـتجابة
للعلاج، كانت مستويات الـ VEGF أعلى بشكل ملحوظ من المرضى المشخص لديهم المرض حديثا (10)، مما يشير إلى حدوث ازدياد في تداخل العوامل المحرضة على إنتاج الـ VEGF خلال معالجة المرضى والتي تضم السيتوكينات ونقص التأكسج hypoxia (11).
عند الاستجابة للعلاج انخفضت مستويات الـ VEGF المصلية لدى المرضى إلى ما يقارب مستوياته لدى المجموعة الشاهدة، حيث لم نلاحظ وجود فارق يعتد به إحصائياً بين مجموعة الاستجابة للعلاج والمجموعة الشاهدة.
يمكن أن يعد انخفاض مستويات الـ VEGF المصلية مع تراجع تشكل الأوعية الشعرية عند استجابة المرضى مؤشراً إنذارياً على نجاعة efficacy العلاج المستخدم (12).
|
| الاستنتاج Conclusion |
| يمكن الاستفادة من مقايسة الـ VEGF في المصل لتحديد مرضى الخباثات الدموية الذين لم يستجيبوا للعلاج، حيث تكون مستوياته المصلية مرتفعة عند هؤلاء المرضى مقارنة مع الأسوياء، ومرضى الخباثات الدموية خلال مراحل العلاج، وكذلك لتقييم استجابة المرضى للعلاج، حيث تنخفض مستوياته المصلية نتيجة المعالجة الناجعة. |
| المراجع Reference |
1-Hoeben A. and Landuyt B.
Vascular Endothelial Growth Factor and Angiogenesis.
Pharmacol Rev; 56: 549-580, 2004.
2-Senger DR. and Galli SJ.
Tumor cells secrete a vascular permeability factor that promotes
accumulation of ascites fluid.
Science; 219: 983-985, 1983.
3-Tischer E; Gospodarowicz D. and Mitchell R.
Vascular endothelial growth factor: a new member of the platelet-derived growth factor gene family.
Biochem Biophys Res Commun; 65: 1198-12061, 1989.
4-Ferrara N; Gerber HP. and LeCouter J.
The biology of VEGF and its receptors.
Nat Med; 9: 669-676, 2003.
5-Gerber HP. and Ferrara N.
The role of VEGF in normal and neoplastic hematopoiesis.
J Mol Med; 81:20-31, 2003.
6-Folkman J.
Role of angiogenesis in tumor growth and metastasis.
Semin Oncol; 29(16):15-18, 2002.
7-Podar K. and Anderson KC.
The pathophysiologic role of VEGF in hematologic malignancies: therapeutic implications.
Blood; 105(4): 1383-1395, 2005.
8-Moehler TM; Neben K; Ho AD. and Goldschmidt H.
Angiogenesis in hematologic malignancies.
Ann Hematol; 80: 695-705, 2001.
9-Erdem F; Gündogdu M. and Kiziltunç A.
Serum vascular endothelial growth factor level in patients with hematological malignancies.
Euro J Gen Med; 3 (3): 116-120, 2006.
10-Koomagi R; Zintl F; Sauerbrey A. and Volm M.
Vascular endothelial growth factor in newly diagnosed and recurrent childhood acute lymphoblastic leukemia as measured by real-time quantitative polymerase chain reaction.
Clin Cancer Res; 7: 3381-3384, 2001.
11-Makeshova AB. and Levina AA.
Value of dynamic study of cytokines in serum and leukocytes in patients with acute leukemia.
Klin Lab Diagn; 12, 19-24, 2009.
12-Hussong JW; Rodgers GM. and Shami PJ.
Evidence of increased angiogenesis in patients with acute myeloid leukemia.
Blood; 95: 309-313, 2000.
|
| |
