| المجلد 6 ,
العدد 5
, جمادى الأولى 1433 - نيسان (أبريل) 2012 |
| |
| الموجودات المناعية النسيجية والتشريحية المرضية الجزيئية المحددة لحالة الجين الوَرَمِيّ HER2-neu/c-erbB-2 في سرطان الثدي الغازي |
| The Immunohistological and Molecular Pathological Findings to Determine the Status of HER2-neu/c-erbB-2 Oncogene in Invasive Breast Cancer |
| د. هفاف أبوقاسم، أ. د. موسى ملحم الموسى و أ. د. محمد إياد الشطي |
| Abou Kassem H; Almousa M. M. and Alchatty M. E. |
كلية الطب البشري - جامعة دمشق
Faculty of medicine-Damascus university |
| الملخص Abstract |
| هدف البحث إلى تأكيد أهمية الكِيمْياءُ النسيجية المَناعِيَّة Immunohistochemistry إلى جانب التهجين مُوَلِّدُ اللَّون في الموضع Chromogenic in situ hybridization (CISH) لتعيين الجين الورمي HER2-neu (c-erbB-2) في سرطانات الثدي الغازية. وإلى استخدام طريقة جديدة في التشريح المرضي الجزيئي بواسطة CISH، بالإضافة إلى كشف الموجودات التي تعين حالة HER2-neu باستخدام الكِيمْياءُ النسيجية المَناعِيَّة والتشريح المرضي الجزيئي. وهو دراسة عشوائية لـ 50 حالة سرطان ثدي غازٍ أُخذت من مختبر مستشفى البيروني الجامعي (عام 2010). ولقد دُرست هذه الحالات في قسم التشريح المرضي، كلية الطب، جامعة دمشق، بواسطة التهجين مُوَلِّدُ اللَّون في الموضع (FISH duo CISH) والكِيمْياءُ النسيجية المَناعِيَّة (IHC). وبالمقارنة مع دراسات عالمية أخرى نستنتج أن نتيجة IHC ذات أهمية كبيرة للتوجه إلى تعيين حالة HER2، إلا أن النتيجة النهائية تكون بواسطة CISH و IHC معاً. وإنه من الأهمية بمكان اعتماد طريقة CISH كفحص روتيني لمرضى سرطان الثدي الغازي إلى جانب طريقة الكِيمْياءُ النسيجية المَناعِيَّة وخاصة في الحالات الحدية. |
| The research aimed to confirm the importance of the immunohistochemestry with chromogenic in situ hybridization (CISH) to determine the HER2-neu (c-erbB-2) in invasive breast cancers. Use a new technique in molecular pathology by CISH، in addition to reveal the findings that are determined the HER2-neu status by used immunohistochemistry and molecular pathology. A random study of 50 cases of invasive breast cancer, which obtained from the laboratory of al-Birouni hospital (2010). These cases were studied in the pathology department, Faculty of medicine, Damascus university, by the Chromogenic in-situ Hybridization (FISH duo CISH) and Immunohistochemistry (IHC). And by comparison with other international studies, we conclude that the result of IHC is important for the orientation to determine HER2 status, but the final result is by CISH together with IHC. It is very important to consider the CISH technique as a routine examination for all invasive breast cancer patients along with the immunohistochemistry, especially in borderline cases. |
| المقدمة Introduction |
يعد سرطان الثدي مشكلة صحية هامة، لأنه كثير التواتر (1) وله انعكاسات اجتماعية ونفسية. وبحسب السجل الوطني للأورام في سورية* Syrian National Cancer Registry لعام 2008، سُجلت حوالي 3000 حالة سنوياً خلال السنوات الثلاث الماضية (المصدر: السجل الوطني للأورام في سورية Syrian National Cancer Registry لعام 2008).
على الرغم من التطور الحاصل في مجال تشخيص وعلاج سرطان الثدي، إلا أن التقنيات الجديدة والطرق المكتشفة حديثاً تطرح دائماً آفاقاً جديدة لتشخيص دقيق ومقاربة أفضل لحالات السرطان، فمثلاً كانت طريقة الكِيمْياءُ النسيجية المَناعِيَّة ولمدة 15 عاماً هي الطريقة المعتمدة لكشف حالة HER2، من خلال كشف زيادة عدد مسستقبلات عوامل النمو على سطح الخلايا الورمية والناتج عن التعبير المفرط للبروتين overexpression ضمن هيولى الخلية الورمية. أما اليوم فتعد طريقة التهجين في الموضع، بأساليبها المختلفة، طريقة واعدة لكشف الجين HER2 وتضخيمها amplification في النواة (2).
تكمن أهمية هذه الجين اليوم في كونها من أهم عوامل الإنذار (3-5) التي تتدخل في الخطة العلاجية مباشرة (6، 7)، من خلال المعالجة الهدفية Targeted therapy المطبقة على الحالات الإيجابية، دون أية فعالية لها تذكر على الحالات السلبية (8)، وما يحمل هذا العلاج من آثار جانبية محتملة وتكلفة مادية باهظة (إن كلفة علاج مريضة واحدة بهذا الدواء الخاص تتراوح بين 1-2 مليون ليرة سورية تقريباً التي بدورها تكفي لإجراء الفحص لأكثر من 120 مريضة سرطان ثدي) (9، 10) تجعل من الضروري أن يقتصر تطبيقه على هذه الحالات الإيجابية فقط.
بينت الدراسات أن حوالي 20-30% (11، 12) من سرطانات الثدي تكون إيجابية جين HER2 وتصل هذه النسبة في بعض المراجع إلى 40% (13).
أما في الحالات المرضية الإيجابية لجين c-erbB2 فإن نوى الخلايا الورمية تحوي عدداً أكبر من هذه النسخ (14)، حيث تصاب الجين في الخلايا الورمية بطفرات جسدية تحدث خلال حياة المريض وليس لها علاقة بالوراثة، مما يؤدي إلى زيادة تركيب البروتين ضمن الخلية وتراكمه في الهيولى (فرط التعبير over expression) (15)، الذي يسبب بدوره زيادة عدد مستقبلات عوامل النمو HER2 Human epithelial receptor 2 على سطح الخلايا، وزيادة في استقبال الخلية لأوامر الانقسام وبالتالي تسارع النمو الورمي مع اعتبار الورم عدواني (16).
|
| المواد والطرق Materials and Methods |
نوع الدراسة والاعتيان: دراسة عشوائية على 50 حالة سرطان ثدي واردة إلى مختبر التشريح المرضي - مستشفى البيروني خلال الفترة الممتدة بين الشهر العاشر 2009 وحتى الشهر السابع 2010.
مكان الدراسة: مختبر قسم التشريح المرضي –كلية الطب البشري- جامعة دمشق.
طريقة العمل: العينات عبارة عن مقاطع لسرطان ثدي مدمجة بالبرافين، جرى أخذ مقطعين لكل مكعب برافين على شرائح خاصة، لُوِّنت الشريحة الأولى بتقنية التلوينات المناعية النسيجية و لُوِّنت الشريحة الآخرى بتقنية التهجين بالموضع اللوني.
تقنية التلوينات المناعية النسيجية (IHC): تعتمد هذه الطريقة على كشف البروتين HER-2 protein الذي يلعب دور مستقبل على سطح الخلية السرطانية وعلى كشف ظاهرة فرط التعبير over expression. وهي تُجرى على عينات البرافين المحضرة من كتل ثدي مستأصلة أو من ثدي كامل مستأصل وتمر بالمراحل التالية: يحضر النسيج الورمي الخبيث للفحص بطريقة الإدماج، وبعد إزالة البرافين يعرض المقطع النسجي الرقيق لإزالة التقنيع demasking (محلول، target retrival pH=6) ومن ثم يعرض للأضداد (c-erbB-2) - بنسبة تمديد 1/200 ومدة حضن 20-30 دقيقة - والتي تقترن بدورها مع مستقبلات HER-2، ثم يتفاعل المركب (أضداد + مستقبلات HER-2) مع مادة كاشفة محدثة تبدلاً في لون الأنسجة (يمكن أن تحفظ بصور على الحاسوب) (17).
يقوم المشرح المرضي بتقدير شدة تلون الخلايا في العينة، وكذلك عدد ونسبة الخلايا الآخذة للون في المقطع الملون كما يلي (11):
• صفر، مستقبلات HER-2 سلبية: لايوجد تلون أو تلون خفيف في الأغشية الخلوية في أقل من 10% من الخلايا الورمية.
• 1+، تلون جزئي خفيف: ويعد سلبياً. يتلون جزء من الغشاء الخلوي في أكثر من 10% من الخلايا الورمية.
• 2+، إيجابية متوسطة أو حدية: تلون خفيف إلى متوسط الشدة في معظم الغشاء الخلوي في الخلايا الورمية في أكثر من 10% من الخلايا الورمية. وجرى تعديلها بحسب الجمعية الأمريكية للمشرحين المرضيين والجمعية الأمريكية لعلم الأورام السريري (ASCO\CAP) (17) عام 2007 إلى إيجابية شديدة حلقية غشائية على أقل أو يساوي 30% من الخلايا الورمية (واعتبرت مُلْتَبِسة equivocal).
• 3+، إيجابية شديدة: تلون شديد واضح للغشاء الخلوي في أكثر من 10% من الخلايا الورمية. وعدلت من قبل ASCO\CAP إلى إيجابية شديدة حلقية غشائية على أكثر من 30% من الخلايا الورمية.
ملاحظة: اتبعنا في دراستنا المعايير المقترحة من قبل ASCO\CAP في تقييم العينات وقبول أو استبعاد النتائج.
التهجين مولد اللون في الموضع CISH ((Chromogenic In Situ Hybridization لُوِّن السلايد الآخر بتقنية التهجين ثنائي اللون في الموضع Dual color CISH protocol، أحدث من الطريقة السابقة، وهي مزاوجة بين التهجين في الموضع ISH مع مولد اللون النسجي الكيميائي Chromogen. كما يمكن الاحتفاظ بها وإعادة تقييمها وتمر بالمراحل التالية (18): بعد تحضير العينات المحفوظة بالفورمالين تعالج بالحرارة والهضم الإنزيمي ثم التهجين في الموضع بإضافة مسبار لـ HER-2 (مسبار الـ FISH ثم مسبار الـ CISH) إحدى مكونات هذا المسبار (Anti-FITC/HRP) موجهة للجين HER-2 والمكونة الأخرى Anti-Texas Red/AP موجهة للجزء المركزي للصبغي 17 المتواجدان ضمن النواة. ثم يضاف خليط أضداد الـ CISH Horseradish peroxidase المقترن مع الأضداد + الفسفاتاز القلوية مع أضداد Texas red (CISH antibody mix containing an HRP-conjugated antibody to FITC and an AP-conjugated antibody to Texas Red). ومن ثم يضاف الملون الأحمر الذي يلون الفسفاتاز القلوية مع أضداد Texas red والمحلول الأحمر الذي يلون Horseradish peroxidase المقترن مع الأضداد، وأخيراً يقرأ الـ CISH بالمجهر الضوئي، بعد تلوينه بالهيماتوكسلين وبتكبير(10× 40) أو (10× 60) (18).
تفسير نتائج التهجين ثنائي اللون في الموضع dual color CISH
• تأخذ كل نسخة من الجين اللون الأحمر بشكل نقطة منفصلة عن الأخرى وقابلة للعد من قبل الباحث (11)، وكذلك الجزء المركزي للصبغي والذي يأخذ إشارة بلون أزرق.
• نقوم بتحديد نسبة الجين إلى الصبغي في كل خلية، ويتم العد في 40 خلية سرطانية. وتدون نسبة الجين HER-2 إلى الجزء المركزي للصبغي 17 في كل الخلية (7، 8، 11).
• تعد النتيجة سلبية عند وجود نسخة واحدة من الجين على كل من ذراعي الصبغي 17.
• كما تعد النتيجة سلبية أيضاً في حال كون نسبة الجين/ الجزء المركزي للصبغي أقل من 1.8، حيث تكون الخلية في حالة انقسام (11).
• بينما يكون الفحص إيجابياً عندما تكون نسبة الجين إلى الصبغي أكثر أو تساوي 2.2 (?2.2) مثلاً (2.5 أو 3.2)
• أما إذا كانت بين 1.8-2.2 فإنها تطرح مشكلة في تقييم مثل هذه الحالات. لذلك يوصى بإعادة الفحص أو التقييم (إعادة العد) وعندها تشخص بحذر.
|
| النتائج Results |
قُرئت النتائج، كما جرى تصنيفها ومقارنتها وتحديد النسبة المئوية للحالات الإيجابية والسلبية لكل طريقة من الطريقتين المطبقتين (IHC والـ CISH).
تراوحت أعمار أفراد الدراسة بين 25 و72 عاماً (المتوسط 45 عاماً)، 2 ذكور و48 أنثى (19). تراوح حجم الورم بين 1.5-12 سم (متوسط الحجم 5.5 سم). الأنماط النسيجية: 40 حالة سرطانة قنوية غازية و10 حالات سرطانة فصيصية غازية.
نتائج تقنية التلوينات المناعية النسيجية (IHC) (الجدول 1):
إيجابية شديدة (+3): 12/50 حالة بنسبة 24%.
إيجابية متوسطة (+2): 9 حالات بنسبة 18%.
إيجابية خفيفة (+1): 14 حالة بنسبة 28%.
سلبية تماماً (صفر): 15 حالة بنسبة 30%.
نتائج تقنية التهجين مولد اللون في الموضع (CISH) (الجدول 2): إيجابية عنقودية (>2.2): 12/50 حالة بنسبة 24%.
مُلْتَبِسة equivocal أي بين 1.8-2.2: 9 /50 بنسبة 10%، سلبية (أقل من 1.8): 29 حالة بنسبة 58%.
وبالمقارنة بين نتائج التقنيتين:
12 حالة أبدت إيجابية غشائية شديدة بتقنية IHC (+3) عشرة حالات منها أبدت إيجابية عنقودية شديدة بتقنية CISH وحالتان مُلْتَبِستان (بين 2.2-1.8) (الجدول 3).
9 حالات أبدت إيجابية غشائية متوسطة الشدة (+2) بتقنية IHC، حالتان منهما سلبيتان بتقنية CISH وحالتان إيجابيتان (>2.2) وخمس حالات مُلْتَبِسة (بين 1.8 و2.2) (الجدول 4).
14 حالة أبدت إيجابية غشائية خفيفة الشدة (+1) بطريقة IHC. 12 حالة منها سلبية بتقنية CISH (<1.8) واثنتان مُلْتَبِستان (بين 1.8-2.2). 15 حالة سلبية (صفر) متوافقة تماماً مع نتائج CISH (الجدول 5).
أما حالتي الذكور فكانت واحدة منهما إيجابية والأخرى سلبية في الدراسة مع توافق النتيجة بالطريقتين المستخدمتين.
|
| المناقشة Discussion |
اعتمدت دراستنا على الدقة في معرفة نسبة إيجابية الـ HER2 في الحالات الواردة إلى مستشفى البيروني، من خلال توخي الحذر والدقة في تطبيق التقنيتين المذكورتين سابقاً ودراستهما ومقارنتهما بدقة عالية، كما ستجري مقارنة نتائجنا مع نتائج دراسات عالمية: كالدراسة الإسبانية عام 2010 (18) وهي تشبه إلى حد
بعيد دراستنا، من حيث المواد والطرق المستخدمة. وكذلك الدراسة الصينية 2006 (20)، والانكليزية 2007 (21)، والألمانية 2009 (22).
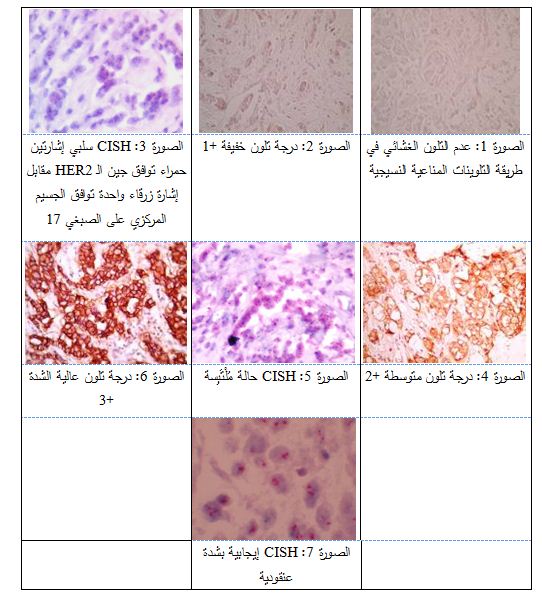
اعتمدنا في إجراء التلوينات المناعية النسيجية أضداد الـ LSAB system-HRP، حيث عبرت السلبية عن عدم وجود تلون في أغشية الخلايا الورمية كلياً (الصورة 1)، بينما عبرت الدرجة +1 عن شدة تلون خفيفة ونسبة خلايا قليلة (الصورة 2)، وتعد هاتان القيمتان سلبيتان من الناحيتين العملية والسريرية. تقابل هاتان القيمتان سلبية في طريقة التهجين مولد اللون في الموضع CISH (الصورة 3)، بنسبة توافق 100% في دراستنا، وهي تقارب ما خلصت إليه الدراسة الإسبانية (98.9%) والألمانية (98.5%) والانكليزية (99.4%) و يعود الفارق البسيط إلى اختلاف حجم العينة.
عبرت درجة التلون +2 عن درجة تلون متوسطة (الصورة 4)، وهي أدق وأصعب الحالات نظراً لكونها مُلْتَبِسة equivocal، مما يحتم تقييمها باستخدام تقنية IHC والـ CISH معاً (الصورة 5). ولقد أبدت نتائج هاتين التقنيتين توافقاً بنسبة 55.55% في دراستنا. والجدير ذكره هنا أن معظم الدراسات العالمية لم تركز على هذه المجموعة من النتائج، فيما عدا الدراسة الصينية التي بلغت فيها النسبة 56.5% وهي متوافقة مع دراستنا.
عبرت درجة التلون+3 عن درجة تلون شديدة جداً (الصورة 6)، وتوافق إيجابية شديدة في الـ CISH وأحياناً عنقودية Cluster (الصورة 7)، وهي تعد إيجابية سريرياً. وبلغت نسبة التوافق في دراستنا 83.33%، في حين كانت 92.6% في الدراسة الإسبانية و82.5% في الدراسة الألمانية، بينما بلغت 93.8% في الدراسة الانكليزية و91.6% في الدراسة الصينية. نلاحظ توافق نتائج دراستنا بشدة مع الدراسة الألمانية وتقاربها مع نتائج الدراسات الإسبانية الانكليزية والصينية.
|
الجدول 1: نتائج تقنية التلوينات المناعية النسيجية للعينات المدروسة.
درجة التلون في تلوينات المناعة النسيجية |
صفر |
+1 |
+2 |
+3 |
المجموع |
عدد الحالات |
15 |
14 |
9 |
12 |
50 |
النسبة المئوية |
30% |
28% |
18% |
24% |
|
الجدول 2: نتائج تقنية التهجين مولد اللون في الموضع للعينات المدروسة.
حالة الجين HER2 بتقنية التهجين مولد اللون في الموضع |
طبيعية
< 1.8 |
مُلْتَبِسة equivocal
1.8-2.2 |
إيجابية
>2.2 إلى عنقودية |
المجموع |
عدد الحالات |
29 |
9 |
12 |
50 |
النسبة المئوية |
58% |
18% |
24% |
|
الجدول 3: نتائج تقنية التهجين مولد اللون في الموضع على الحالات الإيجابية الغشائية الشديدة +3 بطريقة IHC .
حالة الجين HER2 بتقنية التهجين مولد اللون في الموضع |
طبيعية
<1.8 |
مُلْتَبِسة equivocal
1.8-2.2 |
إيجابية
>2.2 إلى عنقودية |
المجموع |
عدد الحالات |
- |
2/12 |
10/12 |
12 |
النسبة المئوية |
- |
16.66% |
83.33% |
|
الجدول 4: نتائج تقنية التهجين مولد اللون في الموضع على الحالات الإيجابية الغشائية المتوسطة +2 بطريقة IHC .
حالة الجين HER2 بتقنية التهجين مولد اللون في الموضع |
طبيعية
< 1.8 |
مُلْتَبِسة equivocal
1.8-2.2 |
إيجابية
>2.2 إلى عنقودية |
المجموع |
عدد الحالات |
2/9 |
5/9 |
2/9 |
9 |
النسبة المئوية |
22.22% |
55.55% |
22.22% |
|
الجدول 5: نتائج تقنية التهجين مولد اللون في الموضع على الحالات السلبية صفر و +1 بطريقة IHC .
حالة الجين HER2 بتقنية التهجين مولد اللون في الموضع |
طبيعية
< 1.8 |
مُلْتَبِسة equivocal
1.8-2.2 |
إيجابية
>2.2 إلى عنقودية |
المجموع |
عدد الحالات |
27/29 |
2/29 |
- |
29 |
النسبة المئوية |
93.1% |
7.9% |
- |
|
|
| الاستنتاجات والتوصيات Recommendations Conclusions and |
| نظراً لأهمية النتائج المعروضة آنفاً وبناءً على المناقشة السابقة، نلاحظ أهمية إجراء التلوينات المناعية النسيجية لكل حالات سرطان الثدي واعتبارها موجهة إلى حد بعيد في نظرتنا لحالة الجين HER2. لكن النتيجة الأخيرة تكون لقراءة طريقة التهجين مولد اللون في الموضع بالترافق طبعاً مع التلوينات المناعية النسيجية. لذلك نقترح تطبيق تقنية التهجين مولد اللون في الموضع على كل حالات سرطان الثدي الغازي إلى جانب طريقة التلوينات المناعية النسيجية وخاصة في الحالات المُلْتَبِسة. والربط بين نتائج التقنيتين معاً للوصول إلى تقييم أكثر دقة لحالة الـ HER2 وما يترتب على ذلك سريرياً وعلاجياً. |
| المراجع References |
1-Salim EI, Moore MA, Bener A, et al.
Cancer epidemiology in South-West Asia - past, present and future. Asian Pacific journal of cancer prevention APJCP.
Asian Pac J Cancer Prev. 2010; 11 Suppl 2: 33-48.
2-Gong Y, Sweet W, Duh YJ. et al
Performance of chromogenic in situ hybridization on testing HER2 Status in breast carcinomas with chromosome 17 polysomy and equivocal (2+) herceptest results: a study of two institutions using the conventional and new ASCO/CAP scoring criteria.
Am J Clin Pathol. 2009; 132(2): 228-236.
3-Rosai J.
Akerman's Breast -breast cancer- Pprognosis Rosai and Akerman's surgical pathology–MOSBY AN Affiliate of elsevier- volume two ninth edition 2004, p.1824-1827
4-Scotlet F, Colonna P, Anderieu J.M.
Cancer du sein- cancerologie- reussir L'internat ellipses, 2007, P181.
5-Peir? G, Aranda FI, Adrover E et al.
Analysis of HER2 by chromogenic in situ hybridization and immunohistochemistry in lymph node-negative breast carcinoma: Prognostic relevance human pathology 2007 Jan; 38(1): 26-34. Research Unit, Hospital General Universitari d'Alacant, 03010 Alacant, Spain.
6-Carlson RW, Moench SJ, Hammond MEH et al.
HER2 testing in breast cancer.
J Natl Compr Canc Netw. 2006; 4 suppl 3: S1-S-22. NCCN Task Force report and recommendations.
7-Goddard KA, Weinmann S, Richert-Boe K, et al.
HER2 Evaluation and Its Impact on Breast Cancer Treatment Decisions. Public Health Genomics. 2011 May 3.The Center for Health Research, Kaiser Permanente Northwest, Portland, Oreg; USA.
8-Arteaga CL, O'Neill A, Moulder SL, et al.
A phase I-II study of combined blockade of the ErbB receptor network with trastuzumab and gefitinib in patients with HER2 (ErbB2)-overexpressing metastatic breast cancer.
Clin Cancer Res. 2008 Oct 1; 14(19): 6277-6283. Vanderbilt-Ingram Comprehensive Cancer Center, Vanderbilt University, 2200 Pierce Avenue, Nashville, TN 37232, USA.
9-Hiroyuki Kumamoto, Hironobu Sasano, Takahiro Taniguchi et al.
Chromogenic in situ hybridization analysis of HER-2/neu status in breast carcinoma: Application in screening of patients for trastuzumab (Herceptin®) therapy Volume 51 Issue 8, Pages 579-584 Journal compilation © 2009 Japanese Society of Pathology.
10-Eundeok Chang, Anhi Lee, Eunjung Lee, Hekyung et al.
HER-2/neu Oncogene Amplification by Chromogenic in situ Hybridization in 130 Breast Cancers Using Tissue Microarray and Clinical Follow-up Studies.
The Korean Academy of Medical Sciences.
J Korean Med Sci; 2004; 19: 390-396 ISSN 1011-8934
11-Juan Rosai and Akerman's breast cancer 2004; p.1819
12-Wolff AC, Hammond ME, Schwartz JN. et al.
Guideline Recommendations for Human Epidermal Growth Factor Receptor 2 Testing in Breast Cancer.
Arch Pathol Lab Med. 2007; 131: 18-43 American Society of Clinical Oncology/College of American Pathologists
13-Daniel J. Spitz; Paolo Gattuso.
Breast-infiltrating Ductal carcinoma page 613. Differential diagnosis in surgical pathology 2002.
14-Rohit Bhargava, William LGerald, Allan RLi QiuluPan et al.
EGFR gene amplification in breast cancer: correlation with epidermal growth factor receptor mRNA and protein expression and HER-2 status and absence of EGFR-activating mutations.
Modern Pathology, 2005, 18, 1027-1033
15-Guido Sauter, James Lee, John M.S. et al.
Guidelines for Human Epidermal Growth Factor Receptor 2 Testing: Biologic and Methodologic Considerations Journal of Clinical Oncology, Vol 27, No 8 (March 10), 2009: pp. 1323-1333, American Society of Clinical Oncology..
16-Joensuu H, Sperinde J, Leinonen M, Huang W, Weidler J, Bono P, Kataja V, Kokko R, Turpeenniemi-Hujanen T, Jyrkki? S, Isola J, Kellokumpu-Lehtinen PL, Paquet A, Lie Y. and Bates M.
Very high quantitative tumor HER2 content and outcome in early breast cancer,
Ann Oncol. 2011 Feb 1.
17-Antonio C. Wolff M. Elizabeth H. Hammond Jared N. Schwartz et al.
American Society of Clinical Oncology/College of American Pathologists
Guideline Recommendations for Human Epidermal Growth Factor Receptor 2 Testing in Breast Cancer.
Journal of Clinical Oncology, Vol 25, No 1, 2007: pp. 118-145.
18-Tom?s Garc?a-Caballero, Dorthe Grabau, Andrew R Green, John Gregory, Arno Schad, Elke Kohlwes,Ian O Ellis, Sarah Watts, and Jens Mollerup.
Determination of HER2 amplification in primary breast cancer using dual-colour chromogenic in situ hybridization is comparable to fluorescence in situ hybridization: a European multicentre study involving 168 specimens.
Histopathology. 2010 March; 56(4): 472-480.
19-Hayashi H, Kimura M, Yoshimoto N et al.
A case of HER2-positive male breast cancer with lung metastases showing a good response to trastuzumab and paclitaxel treatment.
Breast Cancer. 2009; 16(2): 136-140.
20-Zhang GH, Shi DR, Liang XM. et al.
arision of HER2/neu oncogene detected by chromogenic in-situ hybridization and immunohisto-chemistry in breast cancer.
Zhonghua Bing Li Xue Za Zhi.
Chinese journal of pathology 2006 Oct; 35(10): 580-583.
21-Di Palma, N Collins, C Faulkes et al.
2007 Chromogenic in situ hybridisation (CISH) should be an accepted method in the routine diagnostic evaluation of HER2 status in breast cancer.
Journal of Clinical Pathology 2007; 60: 1067-1068.
22-Mayr D, Heim S, Weyrauch K. et al.
Chromogenic in situ hybridization for Her-2/neu-oncogene in breast cancer: comparison of a new dual-colour chromogenic in situ hybridization with immunohistochemistry and fluorescence in situ hybridization.
Histopathology, 2009 Dec; 55(6): 716-723.
|
| |
| المجلد 6 ,
العدد 5
, جمادى الأولى 1433 - نيسان (أبريل) 2012 |
|
|
|
