| الملخص Abstract |
أظهرت دراسة سابقة لنا على جروح تجريبية على السطح الداخلي لأذن الأرنب، وعلى جروح متقرحة مفتوحة محرضة على ظهر أرانب حُقنت بمزيج من مستضد معين مع مساعد "فروند" التام، وعلى جروح عَرَضية على يد الإنسان، أن التضميد لمرة واحدة بغلالة coat رقيقة من جزء الببتيد 14 كيلو دالتون (المكون الرئيسي المعزول من خلاصة جلد الضفدع Rana esculenta) أنقص زمن التئام الجرح إلى النصف مقارنة مع الشواهد.
استخدمنا في هذه الدراسة تقنيات مختلفة من الاستشراب تعتمد على مبادئ مختلفة بغية الحصول على أعلى نقاوة ممكنة من 14 كيلو دالتون. جرت تنقية هذا الببتيد على مرحلتين، تضمنتا استخدام تقنية الاسْتِشْرابٌ بتَبادِلِ الأَيونات على عمود Q-Sepharose وبالتَرْشيحٌ الهُلاَمِيّ على عمود Superdex 75 للتخلص من أكبر قدر من البروتينات المرافقة. بالإضافة إلى إن التحليل بالرحلان الكهربائي SDS–PAGE على هلامة تركيزها 15%، أظهر عصابتي بروتين هاجرتا متجاورتين وفي مستوى الببتيد 14 كيلو دالتون نفسه. وفي مساق الفصل على SDS–PAGE، استخدمت تراكيز مختلفة لهلامة البولي أكريلاميد، كما جرى تطبيق أزمنة مختلفة لفصل مكونات هذه العصابة المضاعفة قبل تعيين تتالي الأحماض الامينية.
|
Our previous study on experimental wounds on the inner side of the rabbit's ear, and on open ulcerated wounds induced on the back of rabbits injected by a mixture of known antigen with complete "Freund" adjuvant, and on accidental wounds on human hands showed that the dressing for one time with fine coat of the fraction 14 KDa peptide (major constituent isolated from the skin extract of the frog Rana esculenta) reduced the time of healing by to half compared with controls.
In this study, we are used different chromatographical techniques based on different principles to attain the highest possible purity of the 14 KDa. This peptide was purified at the best by a 2 steps protocol involving ion-exchange chromatography onto Q-Sepharose column and gel filtration onto Superdex 75 column in order to eliminate the accompanying proteins. In addition, SDS–PAGE analysis on 15% gel, revealed two closely migrating bands at the same level of the 14 KDa peptide. In the course of separation on SDS-PAGE, different concentrations of polyacrylamide gel were used, and the gels were run at different times to separate this doublet band prior to sequencing.
|
| المقدمة Introduction |
يمر عادة الالتئام الطبيعي للجرح بثلاث مراحل:
1. الهجرة الموجهة والمتتالية للعدلات ووحيدات النوى والخلايا الكيراتينية والأرومة الليفية إلى داخل الجرح، ويكون ذلك خلال الأيام الأولى التي تلي القطع.
2. تكاثر الأرومة الليفية، وتفعيلها مع بلعميات الجرح، مما يؤدي إلى تركيب جديد لعوامل نمو وسيتوكينات وبروتينات المطرس خارج الخلايا extracellular matrix، وإفراز مكونات ذات كتل جزيئية منخفضة نسبياً، تنتج عن تخرب الصفيحات الدموية، أو عن الأوعية الدموية المتأذية، أو من المصل، وتحدث هذه السيرورة كاملة خلال الأسابيع 2-3 التي تلي القطع.
3. إعادة بناء النسج بالكولاجين الفعال، وذلك بعد القطع بأسبوعين وحتى السنة (1، 2).
إن البرهان على دور السيتوكينات وعوامل النمو كوسائط للعديد من السيرورات المتممة في ترميم النسج حث على دراسة أهمية تطوير علاجات محتملة تزيد من ترميم الأنسجة المعوزة. ومن المحتمل أن يؤدي انخفاض تراكيز بعض السيتوكينات وعوامل النمو دون عتبة دنيا في أثناء سيرورة التئام الجرح إلى تثبيط هذه السيرورة. لذلك استعملت في الماضي ضمادات للجرح، تحتوي على بعض عوامل النمو. ويوجد عاملا نمو ]عامِلُ نُمُوِّ البَشَرَة ( (EGF epidermal growth factor، وعامل النمو العصبي [neural growth factor (NGF) وسيتوكينات (الانترلوكين-1، والانترلوكين-6، والانترلوكين-8) تعد مرشحة لتستعمل كمواد علاجية، وذلك لأن تطبيقها على الجروح يسرع التئامها، إلا انه حتى الآن لم يتم تحديد عناصر دوائية تسرع التئام الجروح يمكن إنتاجها بكميات دوائية، مما وجه الاهتمام إلى ببتيدات البرمائيات كجزيئات بديلة تستعمل لترميم الجروح (3).
تشكل الببتيدات الدوائية والببتيدات المضادة للمكروباتpharmacological and antimicrobial peptides نظاماً دفاعياً كيميائياً مميزاً لدى البرمائيات. وتركب الغدد في أدمة جلد الضفادع تنوعاً كبيراً من الببتيدات العصبية والهرمونات المشابهة للهرمونات البشرية، وتفرز هذه المكونات إلى خارج الجسم (4، 5). أوضحت الدراسات التي قامت بتحليل مفرزات جلد أنواع عديدة من البرمائيات أن جلدها يحتوي على عدد كبير من الببتيدات المضادة للمكروبات التي تشكل الجزيئات الفاعلة للمناعة الطبيعية لدى هذه الفقاريات (6-9). وتختلف هذه الببتيدات بين الضفادع وفقاً للفصيلة التي تنتمي لها، وكذلك الجنس والنوع وحتى تحت النوع (10). وعلى الرغم من وجود أنواع عديدة من البرمائيات في الطبيعة؛ فلقد جرى توصيف القليل من الببتيدات المضادة للجراثيم والببتيدات الدوائية المستخلصة من جلدها.
يشكل ضفدع R. esculenta النوع المنتشر في سورية، وهو عبارة عن هجين من النوعين
R. ridibunda و R. Lessonae، الأمر الذي يجعله من الناحية الوراثية نوعاً بينياً أكثر من كونه نوعاً عادياً نموذجياً. ولقد جرى عزل العديد من الببتيدات المضادة للجراثيم من مفرزات هذا النوع، ثم نُقِّيَت ووصِّفت، وسُميت، مثل brevinin-1 E، وbrevinin-2 E، وesculentin. لقد اقترحت الأبحاث وجود تعدد شكلي كبير بين أفراد عينات التجمعات المختلفة للنوع البيني R. esculenta (11، 12)، ومع ذلك؛ فإنه لا توجد أية دراسات على ببتيدات دوائية تسرع الالتئام استخلصت من جلد هذا النوع من الضفادع. ولقد قمنا في دراسة سابقة بتنقية جزئية لببتيد منخفض الوزن الجزيئي (14 كيلو دالتون)، مستخلص من خلاصه جلد الضفدع R. esculenta. وجرى البرهان على دوره في تسريع التئام جروح تجريبية وطبيعية على طرز حيوانية وعلى الإنسان؛ فالجرح المعالج بهذا الببتيد كان يلتئم خلال نصف المدة اللازمة لالتئام الجرح الشاهد (13). وبالنظر إلى الفاعلية العالية لهذا الببتيد في التئام الجروح، فإنه من المفيد إنتاجه بكميات دوائية باستعمال طرق DNA المأشوب. ولتحقيق ذلك كان لابد من تحديد هوية هذا الببتيد بتحديد تتالي الأحماض الأمينية. وللتوصل إلى ذلك، كان لابد من الحصول على هذا الببتيد بأعلى نقاوة ممكنة. لذلك هدف هذا البحث إلى زيادة الميز في نقاوة الببتيد 14 كيلو دالتون باستعمال تقنيات مختلفة من الاستشراب تعتمد على مبادئ مختلفة، قد تفيد أيضاً في التعرف على بعض خصائصه.
|
| المواد والطرق Materials and Methods |
1- استخلاص البروتينات من الجلد
استخلصت البروتينات الكلية من جلد ظهر ضفادع من النوع R. esculenta باستعمال دارئة فسفاتية تحتوي على التريتون X-100 (Triton X-100) كمذيب عضوي، وباستعمال مزيج من مثبطات إنزيمات البروتياز (Pefabloc Sc 2mM) (Calbiochem Protease inhibitor Cocktail Set II)، يتكون من: 100 ميلي مول من PMSF، و80 ميلي مول من Aprotinin، و5 ميلي مول من Bestatin، و15 ميلي مول من E64، و2 ميلي مول من Leupeptin Hemisulfate، و1 ميلي مول من Pepstanin A، وذلك بمعدل 1 مل لكل 20 غرام من النسيج. وجرت معايرة البروتينات الكلية في الحلالة الخلوية باستعمال طريقة "برادفورد Bradford"، وحفظت هذه البروتينات في الدرجة -80 مئوية، أو جفدت لتركيزها وحفظها في الدرجة 4 مئوية إلى حين استعمالها.
2- تنقية الببتيد 14 كيلو دالتون
للتخلص من أكبر قدر ممكن من البروتينات المرافقة وربما للكشف عن بعض خصائص الببتيد 14 كيلو دالتون، اختُبِرَت أنواع مختلفة من الاستشراب التي تعتمد على مبادئ مختلفة للفصل من شحنة البروتين أو حجمه أو ألفة ارتباطه.
2-1- الاسْتِشْرابٌ بتَبادِلِ الأَيونات
Ion Exchange Chromatography
استخدمت تقنية الاسْتِشْرابٌ بتَبادِلِ الأَيونات السالبة والموجبة لتنقية الببتيد 14 كيلو دالتون؛ حيث جرى اختبار هلامة Q-sepharose (مبادلات أيونات سالبة) (Sigma) وهلامة CM-sepharose (مبادلات أيونات موجبة) (Pharmacia). أُجرِيَت تجارب تحضيرية على أعمدة استشراب صغيرة (10 مل). ومُرِرت عينة البروتينات بتركيزين مختلفين (20 ملغ، و40 ملغ)، بسرعة جريان قدرها 0.5 مل/الدقيقة، وغُسِلَت الأعمدة بثلاثة أضعاف حجم العمود من الدارئة PB (تركيزها 20 ميلي مول أضيف إليها 1 ميلي مول من مزيج مثبطات البروتياز) للتخلص من المكونات غير المرتبطة، وفُصِلَت البروتينات المرتبطة باستعمال تدرج خطي من محلول KCl تركيزه 0-1 مول. جُمِعَت الأجزاء fractions بحجم قدره 2 مل في عدد من الأنابيب بالاستعانة بمجمع الأجزاء.
بعد تحديد الشروط الملائمة من نوعية الهلامة وتركيز البروتينات لأفضل تنقية للببتيد 14 كيلو دالتون، وللحصول على درجة نقاوة أعلى للبروتين المعني وبتركيز مرتفع، رُزِم عمود كبير يحوي 100 مل من هلامة Q-Sepharose، وجرت موازنته، ومن ثم تمرير 240 ملغ من البروتينات.
وللتخلص من أكبر قدر ممكن من البروتينات المرافقة للببتيد 14 كيلو دالتون، جُمِعَت المكونات البروتينية التي تمثل البروتينات غير المرتبطة إلى هلامة هذا العمود والتي تحوي هذا الببتيد، وجرى تركيزها باستعمال أعمدة صغيرة خاصة تحوي مرشحاتCentricon Centrifugal Filter ، ومررت على عمود mono-Q HR 5/5 باستعمال تقنية الاستشراب للفصل السريع للبروتيناتFast Protein Liquid Chromatography (FPLC).
2-2- استشراب الفصل السريع للبروتينات
حُقِن 25 ملغ من العينة البروتينية المركزة في حجم نهائي قدره 9 مل من الدارئة PB في عمود mono-Q HR 5/5 (30 سم طولاً، و10 مم قطراً، و1 مل حجماً)، يوجد في محطة عمل آلية للاستشرابautomated chromatographic works station (Bio-CAD SPRINT, Applied Biosystems Inc., MA, USA) وذلك بشكل مماثل للشروط التي استعملت في تجاربنا السابقة (13).
2-3- الاستشراب بالترشيح الهلامي
Gel Filtration Chromatography
في تجارب أخرى، حقنت العينة التي جرى تركيزها في نوعين من أعمدة الترشيح الهلامي (حجم العمود 2.4 مل)، تختلف عن بعضهما البعض بقطر مسامات حبيبات الهلامة (Superdex-75، وSuperdex-200)، توجد في محطة عمل آلية للاستشراب. جرى في البداية موازنة العمودين بدارئة فسفاتية PB تركيزها 50 ميلي مول ورقمها الهدروجيني 7.4 pH، بسرعة جريان ثابتة قدرها 0.1 مل/دقيقة ولمدة ساعة. حقنت العينة البروتينية، في عمود Superdex-75، وفُصِلَت البروتينات بالدارئة الفسفاتية PB ذات التركيز 50 ميلي مول، وجمعت المكونات الناتجة عن عملية الفصل بحجم قدره 0.1 مل، بسرعة جريان قدرها 0.1 مل/دقيقة. وفي تجربة أخرى، مررت العينة البروتينية على عمودSuperdex-200 ، وجمعت أجزاء بحجم قدره 0.05 مل بسرعة جريان قدرها 0.05 مل/دقيقة.
وبما أن أفضل طرق الاستشراب للتنقية تعتمد على إمكان ارتباط البروتين المراد تنقيته إلى هلامة العمود ومن ثم شطفه بدارئة خاصة، فلقد أجري اختبار استشراب التآثرات الكارهة للماء Hydrophobic Interaction Chromatography (HIC) التي تعتمد على عدم ألفة بعض البروتينات للماء.
2-4- استشراب التآثرات الكارهة للماء
رُزِمَت أعمدة بحجم قدره 5 مل من هلامة phenyl-agarose باستعمال دارئة NaCl أو دارئة سلفات الامونيوم (NH4)2SO4 كدارئة تساعد على الارتباط بالهلامة، وجرت موازنتها بخمس أضعاف حجم العمود بدارئة فسفاتية PB ذات التركيز 20 ميلي مول والرقم الهدروجيني pH 7.5، تحتوي 0.5 مول NaCl أو (NH4)2SO4، بسرعة جريان قدرها 0.5 مل/دقيقة. مرر على العمود 20 ملغ من عينة البروتينات الكلية، ثم غسل بخمس أضعاف حجمه بالدارئة الفسفاتية PB التي تحتوي 0.5 مول NaCl أو (NH4)2SO4، ثم غسل بالدارئة الفسفاتية PB فقط، ثم بالماء المقطر، وفي النهاية غسل العمود بمحلول اليوريا في الماء المقطر، بتركيز 6 مول. جُمِعَت المكونات البروتينية الناتجة عن عملية التجزئة بحجم قدره 2 مل.
تجدر الإشارة إلى أن مراحل التنقية جميعها في تقنيات الاستشراب المختلفة أنجزت في غرفة مبردة درجة حرارتها 4ْم، وجرت معايرة البروتينات الكلية والبروتينات في السائل الناتج عن عملية التجزئة بطريقة "برادفورد"، وفُصِلَت محتوياتها من البروتينات بالرحلان الكهربائيsodium dodecyl sulphate polyacrylamide gel electrophoresis (SDS-PAGE).
3-2- فصل البروتينات بالرحلان الكهربائي SDS-PAGE
عولجت العينات البروتينية بدارئة خاصة بالرحلان الكهربائي SDS-PAGE، تتألف من تريس ذي التركيز 25 ميلي مول Tris-HCl وpH=8، وتحتوي على EDTA بتركيز 1 ميلي مول، وثنائي الثيوتريتولdithiothreitol 15 ميلي مول، ويوريا 8 مول بدرجة حرارة 90 ْم لمدة 5 دقائق، ثم وضعت في الآبار الخاصة في هلامة البولي أكريلاميد تركيزها 15%، بتأثير تيار كهربائي شدته 150 فولت (30 ميلي أمبير). في التجارب المتعلقة بفصل مكونات العصابة المضاعفة للببتيد 14 كيلو دالتون، جرى تبديل شروط الرحلان الكهربائي باستعمال تركيزين مختلفين لهلامة الفصل (15 و17%)، وترحيل العينة البروتينية الناتجة عن الفصل على عمود Q-Sepharose والتي تحوي الببتيد 14 كيلو دالتون، بتطبيق تيار كهربائي شدته 30 ميلي أمبير، وخلال فترات زمنية متزايدة (ساعة، وساعة ونصف، وساعة وخمسة وأربعين دقيقة). وجرى إظهار العصابات البروتينية بتلوين الهلامة بملون أزرق الكومازي المتألق Coomassie Brilliant Blue R-250)).
|
| 3- النتائج Results |
3-1- تنقية الببتيد 14 كيلو دالتون
بينت نتائج الفصل الأولية عدم ارتباط الببتيد 14 كيلو دالتون إلى كل من هلامة CM-Sepharore أو هلامة Q-Sepharose. ويبين الشكل 1 نتائج تجزئة العينة البروتينية الكلية (40 ملغ) على عمود Q-Sepharose (الشكل 1، أ)؛ حيث حصلنا على 65 جزء fraction، وجرت مقايسة البروتينات في كل منها، ومثلت بيانياً. أظهرت النتائج وجود قمتين رئيستين، توافق القمة الأولى الأنابيب ذات الأرقام 6-21؛ والتي تمثل البروتينات غير المرتبطة التي جرى الحصول عليها في سائل غسل العمود، وتوافق القمة الثانية الأنابيب 40-52؛ التي تمثل البروتينات المرتبطة التي جرى الحصول عليها بشطف العمود. ويظهر في الشكل 1، ب التمثيل البياني لتراكيز البروتينات في الأنابيب المختلفة الناتجة عن الاستفراد على عمود CM-Sepharose؛ حيث بدت قمتان رئيستان، توافق القمة الأولى الأنابيب ذات الأرقام 5-33؛ والتي تمثل البروتينات غير المرتبطة إلى الهلامة، وتوافق القمة الثانية الأنابيب 34-47؛ التي تمثل البروتينات المرتبطة.
|
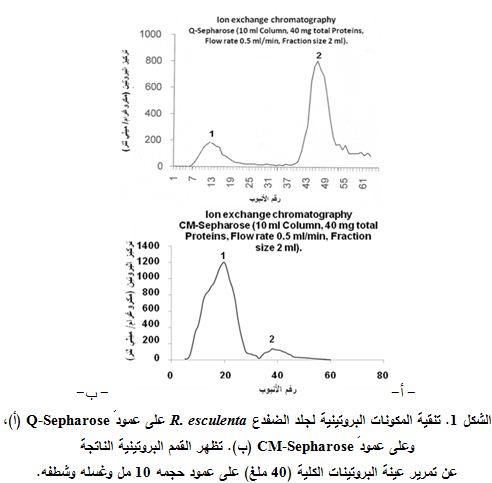 |
جرى فصل المكونات البروتينية في الأنابيب المختلفة الناتجة بترحيلها على هلامة عديد الأكريلاميد، وتبين أن التركيز الأفضل للبروتينات الكلية هو 40 ميلي غرام، ويبين الشكل 2 نتائج الرحلان الكهربائي SDS-PAGE للمكونات البروتينية بعد تجزئتها على عمود Q-Sepharose؛ حيث يظهر الببتيد 14 كيلو دالتون مترافقاً مع البروتينات غير المرتبطة بهلامة العمود والتي تشكل مكونات القمة الأولى (الأنابيب 6- 20).
ويبين الشكل 3 نتائج فصل البروتينات الناتجة عن التجزئة على عمود CM-Sepharose، حيث بدأ ظهور الببتيد 14 كيلو دالتون اعتباراً من الأنبوب 11 واستمر حتى الأنبوب 33، وهي تمثل جميعها البروتينات غير المرتبطة. وبالنتيجة، يبدو أن الببتيد 14 كيلو دالتون لم يتثبت على هلامة العمود حيث وجد هذا الببتيد في سائل تمرير العينة البروتينية وغسل العمود.
وبمقارنة نتائج الفصل في كلتا الحالتين يتبين أن الببتيد 14 كيلو دالتون يشكل أحد مكونات القمة الأولى، إلا أن الفصل على عمود Q-Sepharose يؤدي إلى الحصول على هذا الببتيد بتركيز أعلى، كما يجري التخلص من عدد كبير من البروتينات الأخرى المرافقة، لذلك اعتمدت هذه الهلامة في المرحلة الأولى من تنقية الببتيد 14 كيلو دالتون في التجارب اللاحقة.
|
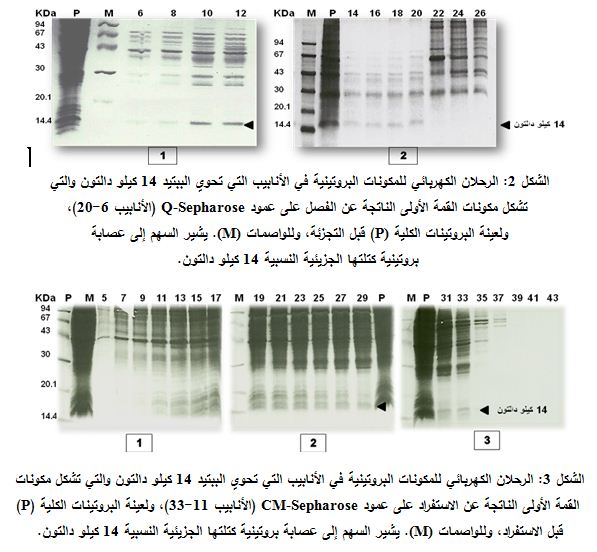 |
وفي محاولة لتنقية الببتيد 14 كيلو دالتون حتى التجانس وبتركيز مرتفع، قمنا في المرحلة الأولى بجمع الأجزاء الناتجة عن الفصل على عمود Q-Sepharose حجمه 100 مل والتي تحوي تركيزاً مرتفعاً من هذا الببتيد ورُكزت، وجرت تجزئتها في المرحلة الثانية بتقنية FPLC، وحصلنا على ما مجموعه 52 أنبوباً. قيست الكثافة الضوئية بموجتين أطوالهما 230 و 280 نانومتراً فظهرت المكونات البروتينية الناتجة عن التجزئة على شكل قمتين رئيستين؛ توافق القمة الأولى البروتينات غير المرتبطة إلى هلامة العمود، وتمثل القمة الثانية البروتينات المرتبطة (الشكل 4، أ). رُحلت العينات الناتجة عن التجزئة على هلامة البولي أكريلاميد، فظهر الببتيد 14 كيلو دالتون في الأنابيب 35-41 الموافقة للحقن وغسل العمود، مما يشير إلى عدم تثبت هذا الببتيد على هلامة عمود mono-Q HR 5/5 (الشكل 4، ب).
وفي نمط آخر من التجارب، أنجزت المرحلة الثانية من التنقية على عمود Superdex-75 الخاص بالاسْتِشْرابٌ التَرْشيحِيٌّ-الهُلاَمِيّ وحصلنا على عدد من القمم أهمها القمة الأولى (الشكل 5، أ). فُصلت البروتينات بالرحلان الكهربائي SDS-PAGE، وأظهرت نتائجنا وجود الببتيد 14 كيلو دالتون في الأنابيب الثلاث الأولى التي تشكل مكونات القمة الأولى (13-15) مترافقاً مع بروتينات أخرى مرتفعة الكتلة الجزيئية النسبية (الشكل5، ب)، كما حصلنا على نتائج مشابهة لدى الفصل على عمود Superdex-200 (الشكل 5، ج).
وفي التجارب الخاصـة بالفصـل على عمـود
phenyl agarose في الدارئة NaCl، حصلنا على 83 أنبوباً ظهرت على شكل ثلاث قمم: توافق القمة الأولى الأنابيب 7-26 ، وتوافق القمة الثانية الأنابيب 27-67، وتوافق القمة الثالثة الأنابيب 68-83 (الشكل 6، أ). جرى تركيز
المكونات البروتينية في عدد من الأنابيب التي توافق المراحل المختلفة من فصل عينة البروتينات الكلية بهذه التقنية، ورُحِلَت على هلامة بولي أكريلاميد كبيرة، فظهر الببتيد 14 كيلو دالتون بتركيز مرتفع في الأنابيب التي تحتوي المكونات البروتينية الناتجة عن غسل العمود بالماء المقطر (الأنبوب رقم 69) (الشكل 6، ب). وباستعمال الهلامة ذاتها ولكن في دارئة (NH4)2SO4 حصلنا على نتائج مشابهة، حيث ظهر الببتيد 14 كيلو دالتون بأعلى تركيز أيضاً في الأنبوب الذي يوافق غسل العمود بالماء المقطر (الأنبوب 73) (الشكل 6، ج).
بالنتيجة، لم نتوصل في هذا البحث إلى استفراد الببتيد 14 كيلو دالتون حتى درجة التجانس. وذلك لما يبديه من خصائص حالت دون ارتباطه بأنواع مختلفة من الهلامات المستعملة في الاستشراب بتبادل الأيونات واستشراب التآثرات الكارهة للماء، كما أن هذا الببتيد يشكل تكتلات مع بروتينات أخرى مرتفعة الكتلة الجزيئية النسبية حالت أيضاً دون إمكان استفراده بالاستشراب الترشيحي-الهلامي. ولكن بينت نتائجنا أن استخدام تقنية الاستشراب على عمود Q-Sepharose متبوعة بالاستشراب الترشيحي-الهلامي على عمود Superdex-75 هو أفضل السبل للتخلص من أكبر قدر ممكن من البروتينات المرافقة للببتيد 14 كيلو دالتون والحصول عليه بتركيز مرتفع.
|
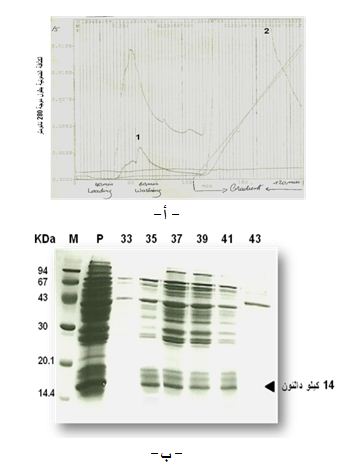 |
الشكل 4: فصل الببتيد 14 كيلو دالتون بتقنية FPLC. أ، القمم البروتينية الناتجة عن تجزئة العينة البروتينية المركزة التي تحوي الببتيد 14 كيلو دالتون على عمود mono-Q HR 5/5.
ب، الرحلان الكهربائي للمكونات البروتينية في الأنابيب التي تحوي الببتيد 14 كيلو دالتون والتي تشكل مكونات القمة الأولى الناتجة عن الفصل على عمود mono-Q HR 5/5، ولعينة البروتينات المركزة P))، وللواصمات (M). يشير السهم إلى عصابة بروتينية كتلتها الجزيئية النسبية 14 كيلو دالتون.
|
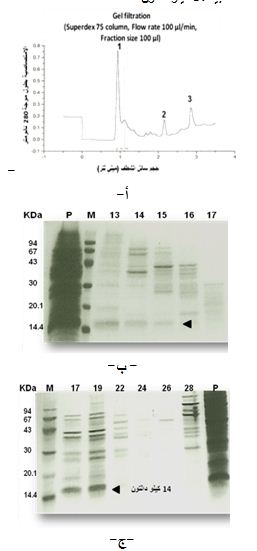 |
| الشكل 5: تنقية الببتيد 14 كيلو دالتون بالترشيح الهلامي. أ، القمم البروتينية الناتجة عن تجزئة العينة البروتينية المركزة التي تحوي الببتيد 14 كيلو دالتون على عمود superdex-75. ب، الرحلان الكهربائي للمكونات البروتينية للقمة الأولى (الأنابيب 13-15) الناتجة عن الفصل على عمود superdex-75. ج، الرحلان الكهربائي للمكونات البروتينية للقمة الأولى (الأنابيب 17-19) الناتجة عن الفصل على عمود superdex-200، ولعينة بروتينية مركزة P)) قبل تجزئتها بالترشيح الهلامي، وللواصمات (M). يشير السهم إلى عصابة بروتينية كتلتها الجزيئية النسبية 14 كيلو دالتون. |
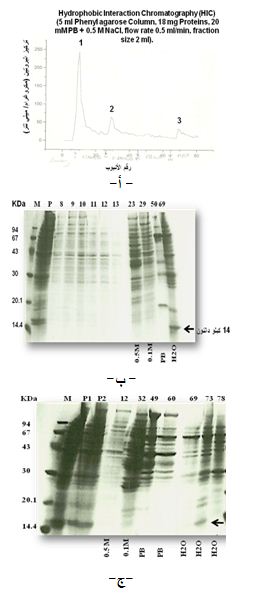 |
| الشكل 6. تنقية المكونات البروتينية لجلد الضفدع R. esculenta على عمود phenyl agarose. أ- القمم البروتينية الناتجة عن تجزئة العينة البروتينية الكلية باستعمال الدارئة PB تركيزها 20 ميلي مول +0.5 مول NaCl. الرحلان الكهربائي للمكونات البروتينية لبعض الأنابيب الناتجة عن الفصل باستعمال دارئة NaCl (ب)، وباستعمال الدارئة (NH4)2SO4 (ج)، ولعينة البروتينات الكلية P قبل التجزئة على العمود، وللواصمات (M). يشير السهم إلى عصابة بروتينية كتلتها الجزيئية النسبية 14 كيلو دالتون. |
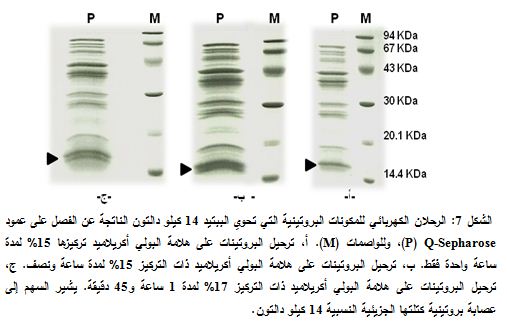 |
2-3- فصل العصابة المضاعفة للببتيد 14 كيلو دالتون بالرحلان الكهربائي SDS-PAGE
إن الرحلان الكهربائي SDS–PAGE على هلامة تركيزها 15% لنواتج بعض عمليات الفصل التي أجريت في هذا البحث (الشكل 3) أظهر وجود عصابتين بروتينيتين تهاجران متجاورتين وفي المستوى نفسه، تبلغ الكتلة الجزئية النسبية لكل منهما حوالي 14 كيلو دالتون، لذلك جرى في هذا البحث فصل مكونات هذه العصابة المضاعفة لدراسة تتالي الأحماض الامينية لكل منهما. رُكزت المكونات البروتينية التي تحوي الببتيد 14 كيلو دالتون الناتجة عن التجزئة على عمود Q-Sepharose حجمه 100 مل، وفصلت على هلامة البولي أكريلاميد (15 و17%)، ورُحِلت خلال فترات زمنية متزايدة.
يبين الشكل 7، أ نتائج الفصل على هلامة البولي أكريلاميد ذات التركيز 15% وترحيلها بتطبيق تيار شدته 30 ميلي أمبير في الدرجة 4 مئوية لمدة ساعة واحدة فقط؛ حيث ظهرت عصابة واحدة ذات تركيز مرتفع للببتيد 14 كيلو دالتون. وبالترحيل بالشروط المذكورة أعلاه نفسها، لكن خلال مدة زمنية تصل إلى ساعة ونصف، حصلنا على عصابتين منفصلتين (الشكل 7، ب). وبالترحيل على هلامة تركيزها 17% بتطبيق تيار شدته 30 ميلي أمبير وفي خلال 1 ساعة و45 دقيقة حصلنا على عصابتين منفصلتين وبشكل أفضل (الشكل 7، ج).
|
| المناقشة Discussion |
شملت هذه الدراسة محاولة لتحديد الشروط الأمثل لفصل الببتيد 14 كيلو دالتون، كما جرى فصل مكونات العصابة المضاعفة لهذا الببتيد المستخلص من جلد ضفدع R. esculenta، الذي يتميز بفاعلية واضحة في التئام الجروح العادية والمفصلية. فلقد استفرد هذه الببتيد على مرحلتين: جرت المرحلة الأولى بالاستشراب بتبادل الأيونات على عمود Q-Sepharose، وأنجزت المرحلة الثانية بالترشيح الهلامي على عمود Superdex-75 للتخلص من أكبر قدر من البروتينات الأخرى المرافقة. وبإجراء الرحلان الكهربائي SDS–PAGE، بدت عصابة غالبة للببتيد 14 كيلو دالتون. إن استعمال تقنيات مختلفة من الاستشراب سمح بالتعرف على الخصائص التي تميز هذا الببتيد، فهو لم يرتبط إلى مبادلات الأيونات السالبة أو الموجبة. ومن المعروف أن شحنة الببتيدات المضادة للأحياء الدقيقة ترتبط بآلية تأثيرها في قتل الأحياء الدقيقة؛ فمعظم الببتيدات المضادة للجراثيم الموجبة الشحنة بما فيها الببتيدات المشتقة من جلد البرمائيات مثل magainin (14) وdermaseptins (15) تمارس فاعليتها المضادة للمكروبات من خلال جعل الغشاء الهيولي أكثر نفوذية permeabilization وتثبيط تركيب DNA، مما يؤدي إلى تليف filamentation الخلايا. بينما تبين حديثاً أن عدداً من الببتيدات المضادة للمكروبات موجبة الشحنة تقوم بقتل الجراثيم بآليات بديلة (16). وعند محاولة تنقية الببتيد 14 كيلو دالتون بالترشيح الهلامي ظهر الببتيد في الأنابيب الثلاثة الأولى مترافقاً مع بروتينات أخرى مرتفعة الكتلة الجزيئية النسبية، في حين كان ينتظر أن ينفصل في الأنابيب الأخيرة بسبب دخول الببتيدات ذات الكتل الجزيئية النسبية المنخفضة إلى داخل حبيبات الهلامة حسب مبدأ الفصل بالاستشراب الترشيحي-الهلامي. إن هذا السلوك غير العادي للببتيد خلال عملية الفصل بهذا النوع من الاستشراب يشكل مؤشراً لارتباط هذا الببتيد إلى تكتلات أدت إلى تشكل كداسة aggregate (17)، خاصة وأن نتائج الفصل بالترشيح الهلامي كانت متشابهة باستعمال هلامة Superdex-75 أوهلامة Superdex-200 اللتين تختلفان عن بعضهما البعض بقطر مسامات حبيبات الهلامة.
وبالمقارنة بين الكتلة الجزيئية النسبية لعائلات الببتيدات االمضادة للأحياء الدقيقة، المعزولة من الجنس Rana والمدروسة حتى الآن، وبين الكتلة الجزيئية النسبية للببتيد 14 كيلو دالتون (حوالي 127 حمضاً أمينياً)، يتبين أن هذا الببتيد لا ينتمي إلى الببتيدات المضادة للجراثيم التي تتكون عادة من عدد أقل من الأحماض الأمينية؛ حيث يبلغ عدد الأحماض الأمينية في مجموعة من الببتيدات الصغيرة سميت temporins حوالي 13 ثمالة حمض أميني (18)، كما وُصِّفَت مجموعة أخرى من الببتيدات تتضمن البريفينين brevinins التي تتكون من 24 ثمالة حمض أميني والاسكلنتين esculentins وتتكون من 46 ثمالة حمض أميني، ومن ثم، فإن الفاعلية الترميمية التي يتميز بها هذا الببتيد ليست ناتجة عن فاعلية مضادة للأحياء الدقيقة، وإنما عبر آليات أخرى تحتاج إلى دراسة معمقة قد تعود إلى التأثير في الخلايا التي تسهم عادة في سيرورة التئام الجرح، أو من خلال تحريض تركيب وإفراز عدد من عوامل النمو والسيتوكينات التي تعمل على تسريع سيرورة الالتئام، أو أن الفعل المرمم لهذا الببتيد يعود إلى كلا التأثيرين. ومن ثم، فإن هذا الببتيد لا يبدي أي تشابه في الخصائص والوزن الجزيئي مع أي من الببتيدات المضادة للجراثيم المدروسة والمعزولة من الضفادع، مما يقترح الكشف عن ببتيد جديد مرمم للجروح مستخلص من جلد الضفدع R. esculenta. مع ذلك فإن هذا الاستنتاج يحتاج إلى توثيق بسلسلة نهايته الأمينية؛ حيث تُعد سلسلة الأحماض الامينية للنهاية الأمينية الطريقة التحليلية التي تقدم معظم المعلومات المتعلقة بهوية البروتينات اعتباراً من كميات صغيرة. إن تتالي 10 أحماض أمينية أو أكثر يكفي لإعطاء معلومات وافية عن هذا البروتين للبحث في المعطيات المتوفرة في بنوك خاصة بالبروتينات.
كما جرى في هذه الدراسة فصل عصابتين بروتينيتين تهاجران متجاورتين وفي المستوى نفسه، تبلغ الكتلة الجزيئية النسبية لكل منهما حوالي 14 كيلو دالتون ليجري لاحقاً دراسة تتالي الأحماض الأمينية في النهاية الأمينية لكل منهما وتحديد هويتهما.
|
| 5- الاستنتاجات Conclusions |
تشير هذه الدراسة إلى أن جلد الضفدع يشكل مصدراً للعديد من الببتيدات ذات الفعاليات الدوائية المختلفة، ومن ثم يمكن أن تحل الببتيدات المرممة للجروح المستخلصة منه محل عوامل النمو والسيتوكينات وتكون ذات كلفة منخفضة، وذلك لما تتميز به هذه الببتيدات من فعاليات استثنائية وكتل جزيئية نسبية منخفضة، الأمر الذي يسمح بتحضير هذه الببتيدات باستخدام تقنية DNA المأشوب. يمكن عندئذ تحضير هذا الببتيد بكميات صيدلانية بغية استعماله في المعالجات الدوائية السريعة والمنخفضة الكلفة.
كلمة شكر: أتوجه بالشكر الجزيل للدكتور Girish SAHNI رئيس مخبر التقانة الحيوية في معهد التقانة البكتيرية IMTECH في مدينة تشانديغار في الهند لاستقبالي في مخبره، ولإتاحة الفرصة لي لإجراء هذا البحث بعد موافقتهم على إجراء بحث بعنوان "بروتينات دوائية معزولة من نسيج حيواني" وإيفادي من قبل الجامعة من خلال تبادل الخبراء وتدريبهم في مجال التقانة الحيوية بين سورية والهند.
|
| المراجع References |
1-Clark R.A; Tonnesen M.G; Gailit J. and Cheresh D.A.
Transient functional expression of alphaVbeta 3 on vascular cells during wound repair.
Am J Pathol 148, 1407-1421, 1996.
2-Martin P.
Wound healing-aiming for perfect skin regeneration.
Science 276, 75-81, 1997.
3-Raghavan M. and Linden P.K.
Newer treatment options for skin and soft tissue infections.
Drugs 64, 1621-1642, 2004.
4-Erspamer V. et al.
Deltorphins: a family of naturally occurring peptides with high affinity and selectivity for delta opioid binding sites.
Proc Natl Acad Sci U S A 86, 5188-5192, 1989.
5-Lazarus L.H. and Attila M.
The toad, ugly and venomous, wears yet a precious jewel in his skin.
Prog Neurobiol 41, 473-507, 1993.
6-Simmaco M; Mignogna G. and Barra D.
Antimicrobial peptides from amphibian skin: what do they tell us?
Biopolymers 47, 435-450, 1998.
7-Boman H.G.
Peptide antibiotics and their role in innate immunity.
Annu Rev Immunol 13, 61-92, 1995.
8-Mangoni M.L. et al.
Structure-function relationships of temporins, small antimicrobial peptides from amphibian skin.
Eur J Biochem 267, 1447-1454, 2000.
9-Mangoni M.L. et al.
Structure-function relationships in bombinins H, antimicrobial peptides from Bombina skin secretions.
Peptides 21, 1673-1679, 2000.
10-Vanhoye D; Bruston F; Nicolas P. and Amiche M.
Antimicrobial peptides from hylid and ranin frogs originated from a 150-million-year-old ancestral precursor with a conserved signal peptide but a hypermutable antimicrobial domain.
Eur J Biochem 270, 2068-2081, 2003.
11-Simmaco M; Mignogna G; Barra D. and Bossa F.
Novel antimicrobial peptides from skin secretion of the European frog
Rana esculenta. FEBS Lett 324, 159-161, 1993.
12-Ali M.F; Knoop F.C; Vaudry H. and Conlon J.M.
Characterization of novel antimicrobial peptides from the skins of frogs of the Rana esculenta complex.
Peptides 24, 955-961, 2003.
13-Rizk H.K; Massouh L. and Al-Okla S.
A 14 KDa Wound-Healing Peptide from the Skin of the Frog Rana esculenta.
Arab Journal of Pharmaceutical Sciences, in press.
14-Csordas A. and Michl H.
Primary structure of two oligopeptides of the toxin of Bombina variegata L. Toxicon 7, 103-108, 1969.
15-Barra D. and Simmaco M.
Amphibian skin: a promising resource for antimicrobial peptides.
Trends Biotechnol 13, 205-209, 1995.
16-Lucas T. et al.
Differential roles of macrophages in diverse phases of skin repair.
J Immunol 184, 3964-3977, 2010.
17-Dassouli A. et al.
76 and 14 kDa polypeptides, two major components released from amphibian urinary bladder epithelium. Localization and potential role.
Biol Cell 66, 131-143, 1989.
18-Simmaco M. et al.
Temporins, antimicrobial peptides from the European red frog Rana temporaria.
Eur J Biochem 242, 788-792, 1996.
|
| |
