| المجلد 6 ,
العدد 6
, شعبان 1433 - تموز (يوليو) 2012 |
| |
| دراسة مستويات أوستيوبونتين البلازما لدى مرضى فشل القلب |
| Study of plasma osteopontin levels in heart failure patients |
| د. رغد فيصل، أ.د. إميل شاهين، أ.د. فايزة القبيلي |
| Faisal R; Chahin E. and AL-Quobaili F. |
كلية الصيدلة، جامعة دمشق.
Faculty of pharmacy, Damascus University.
|
| الملخص Abstract |
الخلفية:
الأوستيوبونتين (الذي يرمز له اختصاراً OPN)، بروتين سكري يتألف من 300 ثمالة حمض أميني، يزن حوالي 400 كيلودالتون، عُرف أول مرة عام 1986 في بانيات العظم، وهو بروتين بنيوي خارج خلوي من أفراد عائلة بروتينات المطرس خارج الخلوي.
الهدف: هدف بحثنا إلى دراسة مستويات الأوستيوبونتين البلازمية لدى مرض الفشل القلبي، ثم تقييم ما إذا كانت هذه المستويات هامة من أجل التنبؤ بدرجة تطور المرض، كما هدفنا من دراستنا أيضاً إلى مقارنة مستويات الأوستيوبونتين OPN باعتباره سيتوكين التهابي مع مستويات أهم السيتوكينات الالتهابية الأخرى (IL-6 و TNF-α) في حالة الفشل القلبي.
المواد والطرق: بُزلت عينات دم من 112 مريضاً شُخص لديهم حالة فشل قلبي (باختلاف أسبابه)، جرى تصنيفهم بحسب تصنيف NYHA الوظيفي للفشل القلبي. كما بُزلت عينات دم من 26 فرداً صحيحاً ظاهرياً كمجموعة شاهدة. قيست مستويات الأوستيوبوتين وIL-6 و TNF-α البلازمية باستخدام مقايسة الممتز المناعي المرتبط بالإنزيم ذات الشطيرة Sandwich ELISA.
النتائج: كانت مستويات الأوستيوبونتين البلازمية أعلى بدرجة يعتد بها لدى مرضى الفشل القلبي مقارنة مع مستوياته لدى المجموعة الشاهدة، كما كانت هذه الزيادة في مستويات الأوستيوبوتين البلازمية متوافقة أيضاً مع تطور درجة المرض، مما يفيد في التنبؤ بخطورة الحالة. كما أظهرت دراستنا ارتفاع مستويات IL-6 و TNF-α لدى مرضى الفشل القلبي مقارنة مع المجموعة الشاهدة، لكن هذه المستويات الزائدة لم تكن مضبوطة وذات مُعَوَّلِيَّة من أجل التنبؤ بالاختطار، خاصة في المراحل المتقدمة من المرض.
الاستنتاج: أظهرت دراستنا بأن بروتين الأوستيوبونتين الذي هو سيتوكين التهابي يلعب دوراً هاماً في الحالة الالتهابية للفشل القلبي، يمكن أن يستخدم من أجل تقييم اختطار الحالة وتعيين درجة تطور المرض لأنه يتفوّق على السيتوكينات الالتهابية الأخرى، خاصة في المراحل المتقدمة من المرض.
|
Background: The osteopontin (OPN), is a glycoprotein composed of 300 amino acid residues, and it weighs about 400 kDa, it was identified for the first time in 1986 in osteoblasts, it is an extracellular structural protein and a member of an extracellular matrix proteins family.
The aim: Our research aimed to study the plasma levels of osteopontin in patients with heart failure, and then evaluate if these levels are important in order to predict the degree of the disease progression , we aimed also from our study to compare the levels of OPN as an inflammatory cytokine with the levels of other most important inflammatory cytokines (IL-6 and TNF-α) in this case of heart failure.
Materials and methods: Blood samples were drawn from 112 heart failure patients (whatever its causes), they have been classified according to the NYHA functional classification of heart failure. Other blood samples was also drawn from 26 apparently healthy subjects as a control group. OPN, IL-6 and TNF-α were measured using sandwich ELISA assay.
Results: OPN plasma levels in heart failure patients were significantly higher than those in control group, also these increased plasma levels of OPN were compatible with the degree of the disease, which is useful in predicting the seriousness of the situation. Our study also showed significantly increased levels of IL- 6 and TNF-α in patients with heart failure compared with the control group, but these increased levels were not accuracy and reliability in order to predict the risk, especially in the advanced stages of the disease.
Conclusion: Our study showed that the OPN protein is an inflammatory cytokine which plays an important role in the inflammatory condition in the heart failure disease, it can be used to evaluate the risk of the situation and to determine the degree of the disease progression because of its distancing on the other inflammatory cytokines, especially in the advanced stages of the disease.
|
| المقدمة Introduction |
الفشل القلبي هو متلازمة سريرية ناتجة عن عدم قدرة القلب على ضخ كميات كافية من الدم لتلبية حاجات الجسم والرئة من الأكسجين والمغذيات الأخرى. ويحدث هذا بشكل شائع عندما يكون النتاج القلبي منخفضاً (حيث يقوم القلب في الحالة الطبيعية بضخ حوالي 5 لتر في الدقيقة أي ما يعادل 70-80 مل في الضربة الواحدة)، وغالباً ما يشار إلى هذا المصطلح بمصطلح آخر هو Congestive Hear Failure (فشل القلب الاحتقاني) وذلك لأن الجسم يصبح محتقناً بالسوائل (1).
وطبقاً لإحصائيات أجريت عام 2006 من قبل جمعية القلب الأمريكية، فإن هنالك 81100000 شخص في الولايات المتحدة لديهم نمط أو أكثر من أنماط الأمراض القلبية الوعائية، التي تشمل ارتفاع الضغط ومرض القلب التاجي والفشل القلبي والسكتة القلبية، 5800000 شخص منهم مصابون بالفشل القلبي (1، 2).
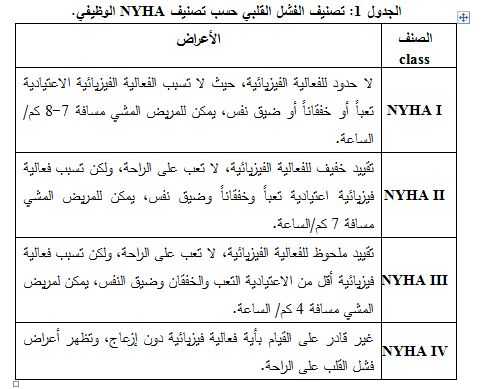
يقوم الأطباء بتصنيف مرحلة الفشل القلبي بحسب التصنيف الوظيفي NYHA (New York Heart Association) وذلك من أجل تحديد العلاج الأمثل، يربط هذا التصنيف الأعراض بالفعاليات الفيزيائية اليومية ونمط حياة المريض. لهذا التصنيف أربعة درجات موضحة حسب الجدول 1 (3، 4).
الأوستيوبونتين، الذي يرمز له اختصاراً OPN، هو غليكوبروتين يتألف من 300 ثمالة حمض أميني، يزن حوالي 400 كيلودالتون، عُرف لأول مرة عام 1986 في بانيات العظم، وهو بروتين بنيوي خارج خلوي من أفراد عائلة بروتينات المطرس خارج الخلوي، يتواجد في السوائل خارج الخلوية وفي مواقع الالتهاب وفي المطرس خارج الخلوي للنسج المعدنية (5). تتوضع جين الأوستيوبونتين عند البشر على الذراع الطويل للصبغي الرابع، في المنطقة 13 (4q13). يجري تصنيع الأوستيوبونتين من قبل العديد من الأنسجة المتنوعة، من ضمنها: خلايا الأرومات الليفية fibroblasts - بانيات العظم osteoblasts- الخلايا العظمية osteocytes- بعض خلايا نقي العظام bone marrow cells- البلاعم macrophages- العدلات neutrophils- اللمفاويات التائية والبائية T&B cell- العضلات الملساء smooth muscles- أرومة العضلات الهيكلية skeletal muscle myoblasta- الخلايا البطانية endothelial cells (6، 7).
جرى في عام 2010 التعرف على دور الأوستيوبونتين في العملية الالتهابية للفشل القلبي (على اعتبار أنه سيتوكين التهابي)، كما جرى إثبات أن خلايا العضلة القلبية هي أيضا مصدر هام للأوستيوبونتين في تضخم البطين الأيسر، كما تبين بأن الأوستيوبونتين يزداد في العضلة القلبية البطينية في الفشل القلبي عند الجرذان، الأمر الذي اقترح بأن الأوستيوبونتين يزداد لدى مرضى الفشل القلبي، كما أن هذه الزيادة تشير إلى درجة تطور المرض (8).
وبالتالي فإن زيادة التعبير عن الأوستيوبونتين في الفشل القلبي هي على مستويين:
1– زيادة التعبير عنه في المطرس خارج الخلوي نتيجة لعمليات إعادة التشكل remodeling والتليف
Fibrosis والتضخم Hypertrophy (5).
2- زيادة التعبير عنه على مستوى الخلايا القلبية نتيجة لفرط الحمل الديناميكي على أجواف القلب. تخضع العضلة القلبية خلال عملية الفشل القلبي إلى إعادة تشكيل متطور، كما تعمل سيتوكينات موضعية مرافقة للالتهاب، مثل TNF-α وIL-6، على تفاقم هذه العملية، من خلال تحريض الالتهاب المزمن في القلب chronic inflammation (8).
|
 |
| المواد والطرق Materials and Methods |
مجموعات الدراسة: مجموعة مرضى الفشل القلبي، التي شملت 112 مريضاً، 84 من الذكور و28 من الإناث، كان متوسط العمر لديهم 57±14 عاماً. ولقد جرى توزيعهم إلى مجموعات حسب تصنيف NYHA الوظيفي على الشكل التالي: NYHA II شملت 40 مريضاً، NYHA III: شملت 43 مريضاً، NYHAIV: شملت 29 مريضاً، أما المجموعة NYHA I فلم نتمكن من الحصول على عينات لها لأن مرضى هذه المجموعة عديمي الأعراض ولا يراجعون المستشفيات. أخذت عينات مجموعة الدراسة هذه من مرضى جرى تشخيص حالة فشل قلبي لديهم، بالاعتماد على الأعراض السريرية والقصة المرضية ومخطط صدى القلب، ولقد جرى انتقاء مرضى الفشل القلبي الأيسر على وجه الخصوص بصرف النظر عن سببه. استبعدنا في دراستنا العديد من المرضى الذين يعانون من حالات مرضية تؤثر على المتثابتات المدروسة بشكل كبير، وهي: الأمراض المناعية الذاتية - الذئبة الحمامية - الأورام بأنواعها - الفشل الكلوي - الداء السكري بنمطيه الأول والثاني- الروماتيزم والتهاب المفاصل - أمراض العظام - الأمراض المناعية الجلدية - العداوى الحادة والمزمنة.
المجموعة الشاهدة: شملت 26 شخصاً، من الذكور والإناث، وكان متوسط أعمارهم 41±7.5 عاماً. وجرى انتقاء عينات هذه المجموعة من الأشخاص الأصحاء عند تبرعهم بالدم، مع مراعاة التوافق في المرحلة العمرية مع مجموعات المرضى.
الاعتيان: بُزلت عينات الدم خلال 9 أشهر (من 5 أيار 2010 إلى 20 كانون الثاني 2011) من مرضى الأقسام والمراكز القلبية لمستشفيات في دمشق، سورية (مستشفى المواساة - مركز جراحة القلب - مستشفى الأسد الجامعي - مركز الباسل لأمراض وجراحة القلب)، حيث بُزل 5مل من دم المريض الكامل على EDTA كمادة مضادة للتخثر، ثم ثُفلت العينات مدة 15 دقيقة بسرعة 1000xg، خلال مدة أقصاها 30 دقيقة من بزلها. أُخذت البلازما الطافية وقسمت في أنابيب ايبندورف، ثم حُفظت في الدرجة -80م إلى حين إجراء المقايسات.
مقايسة العينات: جرت مقايسة العينات في مختبر بنك الدم التابع لجامعة دمشق باستخدام جهاز ELISA من نمط ABBOTT- tecan- sun rise. حيث جرت مقايسة OPN بطريقة الممتز المناعي المرتبط بالإنزيم ذات الشطيرة Sandwich ELISA، باستخدام عتيدتين kits مصنعتين من قبل شركة R&D systems الأمريكية، والتي تعتمد على استخدام نوعين من الأضداد وحيدة النسيلة والنوعية للأوستيوبونتين.
جرت مقايسة IL-6 بطريقة Sandwich ELISA أيضا باستخدام عتيدتين مصنعتين من قبل شركة Hycultbiotech الهولندية، كما جرت مقايسة TNF-α بطريقة Sandwich ELISA أيضاً وذلك باستخدام عتيدتين مصنعتين من قبل شركة Demidetec الألمانية.
التحليل الإحصائي Statistical analysis استخدمنا برنامجي Excel 2007 وSPSS 18 من أجل الدراسة الإحصائية. وحُسبت التراكيز من خلال معادلة المنحنى المعياري لسلاسل معياريات المتثابتات المدروسة والتي رُسمت باستخدام برنامج Excel 2007. جرى التعبير عن القيم باستخدام المتوسط الحسابي ± الانحراف المعياري، ثم استخدم معامل ارتباط بيرسون Person لمعرفة شدة الارتباط وجهته ما بين المتغيرات. كما استخدم اختبار T test لمعرفة ما إذا كان الفارق بين المتغيرات يعتد به إحصائياً (في حال كانت قيمة P value أصغر من 0.05) أم أنه فارق ناتج عن الحظ أو المصادفة (في حال كانت قيمة P value أكبر من 0.05).
|
| النتائج Results |
تراوحت مستويات الأوستيوبونتين لدى المجموعة الشاهدة بين 16.9-133.5 نانوغرام/مل، بمتوسط حسابي قدره 61.6 نانوغرام/مل وانحراف معياري 28 نانوغرام/مل، كما جرت مقايسة قيم الأوستيوبوتين لدى 112 مريضاً بالفشل القلبي فوجد أنها تتراوح ما بين 16.5- 473.4 نانوغرام/ مل، بمتوسط حسابي قدره 137 نانوغرام/مل وانحراف معياري 84 نانوغرام/مل. ولقد جرى توزيعهم حسب تصنيف NYHA الوظيفي كما هو مبين في الجدول 2.
ولدى مقايسة تراكيز الانترلوكين-6 تبين أن متوسط قيمه لدى مجموعة مرضى الفشل القلبي كانت 4.6 بيكوغرام/مل بانحراف معياري 4.3، كما جرت مقايسته لدى المجموعة الشاهدة فكان متوسط قيمه والانحراف المعياري هو 2.9 ± 0.7 بيكوغرام/مل.
وعند مقايسة تراكيز TNF-α عند مجموعات المرضى، تبين أن متوسط تراكيزه والانحراف المعياري عند المجموعة الشاهدة كان 2.9 ± 0.3 بيكوغرام/مل، أما لدى مجموعة مرضى الفشل القلبي فلقد بلغ متوسط تراكيزه والانحراف المعياري 4.2 ± 1.3 بيكوغرام/مل.
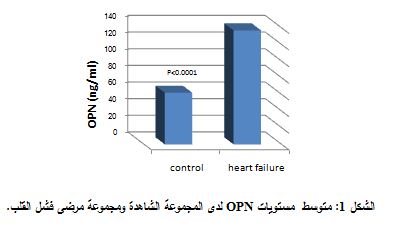
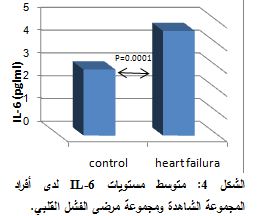
لدى تطبيق اختبار T-test، من أجل مقارنة تراكيز الأوستيوبونتين ما بين مجموعات الدراسة، وجد ارتفاع يعتد به إحصائياً في تراكيز الأوستيوبونتين لدى مجموعة مرضى الفشل القلبي عنها لدى المجموعة الشاهدة (P<0.0001) (الشكل 1).
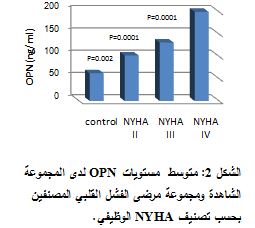
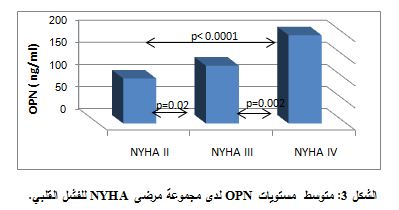
ولدى تطبيق اختبار T-studentمن أجل مقارنة تراكيز الأوستيوبونتين ما بين المجموعة الشاهدة ومجموعة مرضى الفشل القلبي، بعد أن جرى تصنيفهم حسب تصنيف NYHA الوظيفي، وجد فارق يعتد به إحصائياً بين المجموعة الشاهدة ومجموعات مرضى الفشل القلبي NYHA II وNYHA III وNYHA IV، حيث كانت قيم P بالنسبة للمجموعات الثلاث، على الترتيب، هي: 0.002 - 0.0001 - 0.0001 (الشكل 2). كما وجد أيضاً فارق يعتد به إحصائياً بين تراكيز الأوستيوبونتين لدى مجموعة مرضى NYHA II
وتراكيزه لدى مجموعة مرضى NYHA III (P=0.02)، كذلك وجد فارق يعتد به إحصائياً بين مجموعة مرضى NYHA III وNYHA IV، حيث كانت P=0.002، ووجد أيضاً فارق إحصائي هام بين مجموعة المرضى NYHA II وNYHA IV (P<0.0001) (الشكل 3). ولدى تطبيق اختبار T-student، من أجل مقارنة تراكيز IL-6 بين مجموعات الدراسة، وجد فارق يعتد به إحصائياً بين تراكيزه لدى المجموعة الشاهدة ومجموعة مرضى الفشل القلبي (P=0.0001) (الشكل 4).
|
الجدول 2: متوسط قيم الأوستيوبونتين لدى مرضى الدراسة المصنفين تبعاً لتصنيف NYHA الوظيفي.
تصنيف NYHA |
عدد المرضى |
متوسط قيم OSP (ng/ml ) |
الانحراف المعياري |
I |
0 |
----- |
----- |
II |
40 |
115.8 |
53.5 |
III |
43 |
120.9 |
64.4 |
VI |
29 |
180 |
99 |

|
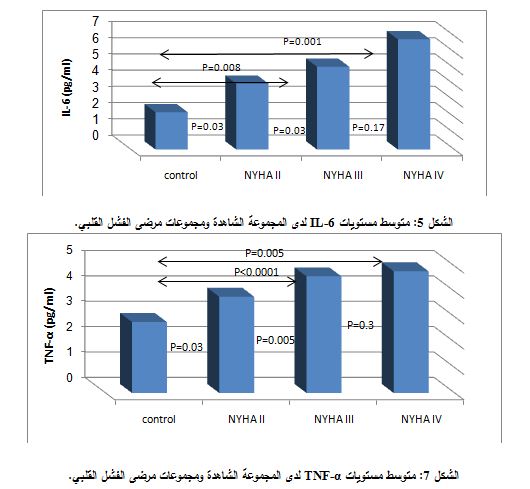
كما جرى تطبيق اختبار T-student من أجل مقارنة تراكيز IL-6 بين المجموعة الشاهدة ومجموعة مرضى الفشل القلبي، بعد أن جرى تصنيفهم بحسب تصنيف NYHA الوظيفي، فوجد فوارق يعتد بها إحصائياً ما بين المجموعة الشاهدة ومجموعات مرضى NYHA II وNYH III وNYHA IV، كما هو موضح في الشكل 5. كما وجد فارق يعتد به إحصائياً ما بين مجموعة NYHA II وNYHA III (P=0.03). بينما لم يوجد فارق يعتد به إحصائياً بين مجموعتي NYHA III وNYHA IV (P=0.17).
ولدى مقارنة تراكيز TNF-I ما بين مجموعات الدراسة، وجد فارق يعتد به إحصائياً ما بين المجموعة الشاهدة ومجموعة مرضى الفشل القلبي (P<0.0001) (الشكل 6).
وعند مقارنة مستويات TNF-α ما بين المجموعة الشاهدة ومجموعة مرضى الفشل القلبي، بعد أن جرى تصنيفهم حسب تصنيف NYHA الوظيفي، وجد فارق يعتد به إحصائياً ما بين المجموعة الشاهدة ومجموعات مرضى NYHA II وNYHA III وNYHA IV، حيث كانت قيم P
في الحالات السابقة جميعها 0.03– 0.0001 – 0.005، على الترتيب، كما هو موضح في الشكل 7. كما وجد فارق يعتد به إحصائياً بين مجموعة مرضى NYHA II وNYHA III (P=0.005)، بينما لم يوجد فارق يعتد به إحصائياً ما بين مجموعتي NYHA III وNYHA IV (P=0.3) (الشكل7).
|
| المناقشة Discussion |
| ارتفعت مستويات الأوستيوبونتين البلازمية لدى مرضى الفشل القلبي، بغض النظر عن سببه، مقارنة مع المجموعة الشاهدة، وذلك بفارق يعتد به إحصائياً (p<0.0001)، واتفق هذا مع الأبحاث التي درست دور بروتين الأوستيوبونتين كأحد السيتوكينات الالتهابية التي ترتفع لدى مرضى الفشل القلبي (9، (10. وكذلك توافقت نتائج دراستنا هذه مع دراسة Mark Rosenberg وزملائه في عام 2008 (11) ودراسة Stawowy وزملائه في عام 2002 (12).
يمكن تفسير ارتفاع مستويات الأوستيوبونتين البلازمية عند مجموعة مرضى الفشل القلبي بزيادة الإجهاد الميكانيكي mechanical stress بسبب فرط الحمل الضغطي أو اعتلال العضلة القلبية أو احتشاء العضلة القلبية أو تزايد مستويات الأنجيوتنسين II والذي يزيد بدوره في حالة الفشل القلبي ويعمل على تحريض إنتاج الأوستيوبونتين في خلايا العضلة القلبية والأرومات الليفية مسهماً في عملية إعادة تشكل remodeling العضلة القلبية والتليف (11).
بيّنت نتائج دراستنا أن مستويات الأوستيوبونتين البلازمية لدى مرضى الفشل القلبي ترتفع بشكل متزامن مع تطور درجة المرض، وذلك بعد أن جرى تصنيف عينات هذه المجموعة بحسب تصنيف NYHA الوظيفي، على اعتبار أن مجموعة مرضى NYHA II يبدون أعراضاً أقل شدة من مجموعة مرضى NYHA III والذين يبدون بدورهم أعراضاً أقل شدة من مجموعة مرضى NYHA IV، ولقد كان هذا الارتفاع المتزامن مع تطور شدة المرض هاماً من الناحية الإحصائية.
توافقت نتائج دراستنا هذه مع دراسة Marguerite Schipper وزملائها عام 2011 (13)، ودراسة Mark Rosenberg وزملائه في عام 2008 (11) وكذلك دراسة Stawowy وزملائه في عام 2002 (12)، حيث أظهرت هذه الدراسات أن مستويات الأوستيوبونتين البلازمية لدى مجموعة NYHA IV هي أعلى منها لدى المجموعة NYHA III والتي بدورها كانت أعلى منها لدى المجموعة NYHA II. يفسّر هذا الارتفاع في مستويات الأوستيوبونتين البلازمية المتوافق مع شدة المرض بزيادة التأثيرات السيئة على خلايا العضلة القلبية مع تطور الحالة المرضية كنتيجة لفرط الحمل الضغطي المتزايد، حيث يتزايد التعبير عن الأوستيوبونتين كلما زادت المناطق المتأذية من العضلة القلبية، إذ أن الأوستيوبونتين يُنتج من قبل مصدرين هامين في هذه الحالة، هما البلاعم في المناطق المتأذية، وخلايا الأرومات الليفية، مع تطور عملية تليف العضل القلبي، أضف إلى ذلك تزايد التعبير عن السيتوكينات الالتهابية بتطور حالة الفشل القلبي والتي بدورها تعمل عل تحريض التعبير الجيني لبروتين الأوستيوبونتين (10، 14، 15).
تؤثر الحالة الالتهابية على وظيفة العضلة القلبية بشكل مباشر. إذ تتضمن عملية الفشل القلبي كما ذكرنا زيادة مستويات السيتوكينات الالتهابية والتي تلعب دوراً هاماً في العملية الإمراضية للفشل القلبي وذلك بالتأثير على قلوصية العضلة القلبية contractility وإحداث التضخم hypertrophy وإعادة تشكل العضلة القلبية وتحريض الاستماتة الخلوية (16).
بيّنت نتائج دراستنا تزايد مستويات IL-6 وTNF-α لدى مرضى الفشل القلبي مقارنة مع الأشخاص الأسوياء. توافقت نتائج دراستنا مع دراسة Kalogeropoulos وزملائه في عام 2010 (17)، ودراسة Aukrust وزملائه عام 18) 2005)، ودراسة Wollert وزملائه عام 2001 (19)، حيث أبدت هذه الدراسات جميعها تزايد التعبير عن السيتوكينات الالتهابية ومستقبلاتها الذوابة في الدوران استجابة لتفعيل عناصر المناعة المتوضعة في القلب أو الدوران أو كلاهما عند مرضى الفشل القلبي ودور هذه السيتوكينات الهام في تقييم اختطار الحالة.
أما بالنسبة لتزايد مستويات السيتوكينات الالتهابية بالتوافق مع تطور شدة المرض فهو موضوع جدل الكثير من الدراسات. فلقد بيّنت دراستنا تزايد مستويات TNF-α و IL-6 عند مجموعة مرضى NYHA II بالمقارنة مع مجموعة مرضى NYHA III وذلك بفارق يعتد به إحصائياً، بينما لم تبد دراستنا تزايداً في مستويات TNF-α وIL-6 عند مجموعة مرضى NYHA IV بالمقارنة مع مجموعة مرضى NYHA III. ولقد توافقت هذه النتائج مع نتائج دراسة Anita Deswal وزملائها في عام 2001 (20) في جانب واختلفت معها في جانب آخر، حيث شملت دراسة Anita Deswal عدداً أكبر من العينات (ألفاً ومئتي مريض بالفشل القلبي)، كما أبدت تزايداً في مستويات IL-6 عند مرضى NYHA IV بالمقارنة مع مرضى NYHA III. ولكن لم تبد هذه الدراسة تزايداً ملحوظاً بالنسبة لمستويات TNF-α عند مجموعة مرضى NYHA IV بالمقارنة مع مجموعة مرضى NYHA III، مما دعاهم لاستنتاج أن السيتوكينات المرافقة للالتهاب ليس لها دور دقيق وموثوق عند مرضى المرحلة النهائية للفشل القلبي، ولقد توافقت نتائج دراستنا مع نتائج دراسة Anita Deswal بالنسبة لمستويات TNF-α والتي لم تكن متزايدة بشكل ملحوظ عند مرضى مجموعة NYHA IV عنها عند مرضى مجموعة NYHA III. وربما يعزى ذلك إلى أن IL-6 في المراحل المتقدمة يعمل على تثبيط إفراز TNF-α، مما يقلل من أهميته الانذارية للمرض في المراحل المتقدمة.
أما بالنسبة لمستويات IL-6 فلقد اختلفت نتائج دراستنا مع دراسة Anita Deswal (20) ودراسة Koller وزملائه عام 1998 (21)، حيث لم تبد دراستنا تزايداً ملحوظاً في مستويات IL-6 عند مجموعة مرضى NYHA IV عنها عند المجموعة NYHA III وربما يعزى ذلك إلى قلة عدد مرضانا مقارنة مع عدد مرضى الدراستين السابقتين، بالإضافة إلى قلة عدد مرضى مجموعة NYHA IV مقارنة مع عدد مرضى المجموعة NYHA III بحيث لم يتضح هذا الفارق بشكل جيد.
|
| الاستنتاج Conclusion |
| إن حالة الفشل القلبي هي مشكلة صحية شائعة وتتزايد باستمرار ويعتمد التدبير الناجح للمرض على التشخيص السريع والدقيق وعلى التنبؤ بالاختطار من أجل معرفة المرضى المعرضين له أكثر من غيرهم. ولقد أثبت بحثنا هذا ارتفاع المستويات البلازمية لواصم حديث (الأوستيوبونتين) لدى مرضى الفشل القلبي مع إمكانية ربط هذا الارتفاع بدرجة تطور المرض، باعتباره سيتوكين التهابي لا يقل أهمية عن السيتوكينات الالتهابية الأخرى. |
| المراجع References |
1-Jessup M.
Focused update: ACCF/AHA guidelines for the diagnosis and management of heart failure in adults.
Circulation, 119, 1977, 2009.
2-Riegel B.
Promoting self-care in persons with heart failure: A scientific statement from the American Heart Association.
Circulation, 120, 1141, 2009.
3-Malcolm O. and Arnold M.
Heart failure. in: Cardiovascular disorders. 9th Ed. Boston,
The Criteria Committee of the New York Heart Association. 2009.
4-Swedberg K; Cleland J. and Dargie H.
Guidelines for the diagnosis and treatment of chronic heart failure.
Eur Heart J; 26, 1115-1140, 2005.
5-Wang K. and Denhardt D.
Osteopontin: role in immune regulation and stress responses.
Cytokine Growth Factor Rev, 19, 333-345, 2008.
6-Ashizawa N; Graf K. and Do Y.
Osteopontin is produced by rat cardiac fibroblasts and mediates A (II)-induced DNA synthesis and collagen gel contraction.
J. Clin. Invest, 98 (10), 2218-2227, 1996.
7-Uaesoontrachoon K; Yoo H; Tudor E; Pike R; Mackie E. and Pagel C.
Osteopontin and skeletal muscle myoblasts: Association with muscle regeneration and regulation of myoblast function in vitro.
Int. J. Biochem. Cell Biol. 40 (10), 2303-2314, 2008.
8-Waller H; Sanchez Ross; Monica, M; Kaluski E. and Klapholz M.
Cardiology, 18, Issue 3: 125-131. 2010.
9-Sergey V; Ivanov K; Alla V; Ivanova S; Chandra M; Goparaj U; Yuanbin C; Amanda B. and Harvey I.
Tumorigenic properties of alternative osteopontin. isoforms in mesothelioma.
Biochemical and Biophysical Research Communications , 382, Issue 3, 8, 514-518, 2009.
10-Philipp S; Florian B; Peter P; Stephan G; Frank L; Brigitte W; Eckart, F. and Kristof G.
Increased myocardial expression of osteopontin in patients with advanced heart failure.
European Journal of Heart Failurem 4, Issue2, 139-146, 2002.
11-Rosenberg M; Zugck C; Nelles M; Juenger C; Frank D; Remppis Giannitsis A; Katus H. and Frey N. Osteopontin, a New Prognostic Biomarker in Patients With Chronic Heart Failure.
Circulation, 1, 43-49, 2008.
12-Stawowy P. and Blaschke F;
Pfautsch P; Goetze S; Lippek F; Wollert-Wulf B; Fleck E. and Graf K.
Increased myocardial expression of osteopontin in patients with advanced
heart failure.
Eur J Heart Fail, 4, No 2, 146-139, 2002.
13-Schipper M; Scheenstra M; Kuik J; Wichem D; Weide P; Dullens H; Lahpor J; Jonge N. and Weger R.
Osteopontin: A potential biomarker for heart failure and reverse remodeling after left ventricular assist device support.
The Journal of Heart and Lung Transplantation, 30, No 7, 805-810. 2011.
14-Waller H; Sanchez Ross; Monica M; Kaluski E. and Klapholz M.
Cardiology, 18 - Issue 3, 125-131, 2010.
15-Singh K.
Osteopontin: Role in myocardial remodeling.
PMC journal, 103, 2002.
16-Bethany J; Holycross S. and Judith Radin M.
Cytokines in Heart Failure: Potential Interactions with Angiotensin II and Leptin.
Molecular interventions, 2, no. 7, 424-427, 2002.
17-Kalogeropoulos A.et al.
Inflammatory Markers and Incident Heart Failure Risk in Older Adults.
The Health ABC, 55, 2129-2137, 2010.
18-Aukrust P; Gullestad L; Ueland T; Dam?s J. and Yndestad A.
Inflammatory and anti-inflammatory cytokines in chronic heart failure: potential therapeutic implications.
Ann Med, 37 (2), 74-85, 2005.
19-Wollert K. and Drexler H.
The role of interleukin-6 in the failing heart. National institutes of health, 6 ( 2), 95-103, 2001.
20-Deswal A; Petersen N; Feldman A; Young J; White B. and Mann D.
Cytokines and Cytokine Receptors in Advanced Heart Failure. An Analysis of the Cytokine Database from the Vesnarinone Trial (VEST). Circilation, 103, 2055-2059, 2001.
21-Koller S; Pacher R; Frey B; Kos T; Woloszczuk W. and Stanek B.
Circulating tumor necrosis factor-α levels in chronic heart failure : Relation to its soluble receptor II, interleukin-6, and neurohumoral variables.
The journal of heart and lung transplantation, 17 (4), 356-362, 1998.
|
| |
| المجلد 6 ,
العدد 6
, شعبان 1433 - تموز (يوليو) 2012 |
|
|
|
