| المجلد 6 ,
العدد 7
, ذو القعدة 1433 - تشرين أول (أكتوبر) 2012 |
| |
| دراسة مستويات البيروكسيداز النقوية البلازمية لدى مرضى فشل القلب |
| Study of Plasma Myeloperoxidase levels
in patients with Heart Failure
|
| د. ديما وسوف، أ. د. مصطفى العموري وأ. د. فايزة القبيلي |
| Wassouf D; AL Amoury M. and AL Quobili F. |
كلية الصيدلة، جامعة دمشق
Faculty of Pharmacy, Damascus University
|
| الملخص Abstract |
البيروكسيداز النقوية (MPO) إنزيم هيمي، يجري التعبير عنه بشكل بارز بوساطة العدلات مُفَصَّصَةُ النَّواة (PMNs). وهو يحفّز توليد تلك المؤكسدات الفعالة التي تشارك في المناعة الطبيعية، بالإضافة إلى دورها في تطور الأمراض القلبية الوعائية، كالتصلب العصيدي والفشل القلبي ((HF. تقترح الدراسات الحديثة أن الالتهاب والإجهاد التأكسدي الإضافي الناجم عن MPO عوامل أساسية في تكوّن وترقي فشل القلب. لهذا هدف بحثنا إلى دراسة مستويات MPO في الفشل القلبي وارتباطها مع وخامة المرض والخَلَلٌ الوَظيفِيّ القلبي المُتَقَدِّم.
جرت مقايسة المستويات البلازمية للبيروكسيداز النقوية لدى 137 شخصاً (25 من الأشخاص الأصحاء ظاهرياً و112 من مرضى مصابين بفشل القلب). واستناداً لتصنيف جمعية نيويورك للقلب (NYHA)، جرى تصنيف المرضى من الناحية السريرية إلى مرضى NYHA II (40 مريضاً)، NYHA III (42 مريضاً)، NYHA IV (30 مريضاً). اعتمدت قيم المتوسط Mean والخطأ المعياري Standard Error (SE) لتوضيح النتائج. أظهرت دراستنا أن مستويات MPO البلازمية كانت زائدة بشكل يعتد به (0.0001P<) لدى مرضى فشل القلب بالمقارنة مع مجموعة الشاهد (:SE±X 63.98±2.16 نغ/ مل مقابل 25.21±1.64 نغ/ مل). ازدادت مستويات MPO البلازمية بالتوازي مع تقدم تصنيف NYHA، حيث كانت لدى NYHA IV أعلى بشكل يعتد به (P=0.0032) من NYHA III والتي كانت بدورها أيضاً أعلى بشكل يعتد به (P=0.0011) من NYHA II (81.83±3.54، 66.58±3.36، 52.20±2.34 نغ/ مل، على الترتيب).
|
Myeloperoxidase (MPO) is a heme enzyme, predominately expressed by polymorphonuclear neutrophils (PMNs). It catalyzes the generation of reactive oxidants that contribute to innate immunity, in addition to the evolution of cardiovascular diseases, such as Atherosclerosis and Heart failure (HF). Recent studies suggest that inflammation and additional oxidative stress due to MPO, are essential factors in genesis and progression of HF. Thus, our research aimed to study MPO levels in heart failure and their relation to disease severity and advanced cardiac dysfunction.
Plasma levels of Myeloperoxidase were measured in 137 subjects (25 apparently
healthy persons, and 112 heart failure patients). According to the New York Heart Association (NYHA), the patients were clinically classified to NYHA II (40 patients), NYHA III (42 patients), and NYHA IV (30 patients). Mean values and Standard Error SE were used to demonstrate results.
Our study showed that plasma levels of MPO were significantly elevated (P<0.0001) in heart failure patients compared with the control group (X±SE: 63.98±2.16 vs 25.21±1.64 ng/ml). Plasma MPO levels increased in parallel with increasing NYHA classification; in NYHA IV were significantly higher (P=0.0032) than NYHA III, which also in tern were significantly higher (P=0.0011) than NYHA II (81.83±3.54, 66.58±3.36, 52.20±2.34 ng/ml, respectively).
|
| المقدمة Introduction |
| يعد الفشل القلبي Heart failure المرحلة النهائية لأغلب الأمراض التي تصيب القلب وهو سبب أساسي للمراضة morbidity والموت mortality في أغلب المجتمعات (1). يعرّف الفشل القلبي بأنه متلازمة سريرية clinical syndrome تبدأ بأذية أولية في وظيفة العضلة القلبيةcardiac dysfunction ، تسبب إما تراجعاً في قدرة القلب على ضخ كمية كافية من الدم تتناسب مع حاجات الجسم، أو ارتفاعاً في ضغوط امتلاء البطينات وما يرافقها من أعراض الاحتقان congestion الدموي، أو كلتا الحالتين معاً وهو الأكثر شيوعاًً (2). استناداً لما يتصف به من إنذار سيء للمريض، فلقد توجه العلماء إلى دراسة آليات مرضية جديدة واستهدافها علاجياً لتحسين حالته السريرية، ومن أهم هذه الآليات الإجهاد التأكسدي oxidative stress، الذي أثبتت التجارب ارتفاع مستويات واصماته وتناسبها مع تزايد شدة المرض، وهذا يعطي أهمية كبيرة لدراسة مستويات البيروكسيداز النقوية كرابط بين الالتهاب والإجهاد التأكسدي لدى مرضى الفشل القلبي. |
| البيروكسيداز النقوية Myeloperoxidase (MPO) |
MPO عبارة عن بروتين هيمي hemoprotein وأحد إنزيمات الجسيمات الحالة Lysosomal Enzymes المشتقة من الكريات البيضاء عند البشر(3). ولقد اشتق اسمه انطلاقاً من خاصتين: الأولى كونه يخلّق خلال المرحلة سَليفَةُ النِّقْوِيَّة promyelocytic، من تمايز الطلائع النقوية إلى عدلات neutrophils، أي مرحلة تشكل الحبيبات اللازوردية azurophilic granules التي يتركز بداخلها؛ والثانية كونه أحد أفراد عائلة ضخمة من إنزيمات البيروكسيداز البشرية(4). يتواجد إنزيم MPO بتراكيز عالية داخل العدلات، وبتراكيز أقل في الوحيدات وبعض البلاعم النسيجية الفعالة ويتحرر منها خلال تفعيلها(4).
يخضع تخليق MPO إلى سيطرة جين مفردة single gene تتوضع على الذراع الطويل للصبغي 17 17q22.23)). وينتج عنه جزيئة مفردة من الرنا المرسال m-RNA يكون ناتج ترجمتها الأولي هو طليعة ببتيدية مفردة single-peptide precursor، تخضع إلى مراحل عديدة من المعالجة(5)، بحيث يأخذ البروتين الهيمي الناضج من MPO شكلاً مثنوياً dimer، يقدر وزنه الجزيئي بحوالي 140 كيلودالتون، مؤلف من نصفين متطابقين، يتألف كل نصف منهما من سلسلتين عديدتي الببتيد polypeptide. تحوي إحداهما 108 حمضاً أمينياً وتدعى السلسلة الخفيفة light chain، وتحوي الأخرى 466 حمضاً أمينياً وهي السلسلة الثقيلة heavy chain(6). يعد MPO جزءاً رئيسياً مشاركاً وهاماً جداً في نظام المناعة الطبيعية innate immunity لخلايا المضيف، فعندما تتعرف العدلات على العوامل الممرضة تقوم ببعلمتها phagocytosis في البدء، وتتفعل بداخلها الهبة التنفسية respiratory burst التي تتمثل باستهلاك سريع للأكسجين وإرجاعه إلى بيروكسيد الهيدروجين H2O2، وهذا الأخير هو ركيزة MPO المناسبة الذي يتحرر من حبيباته ويحفَز أكسدة شوارد الهاليدات halides وخاصة chloride بوجود H2O2 لإنتاج حمض تحت الكلوروس Hypochlorous acid (HOCL)، الذي يعد مركباً أساسياً من أنواع الأكسجين التفاعلية Reactive oxygen species (ROS) ذات الفعالية المضادة للمكروبات (7). تشير الأدلة العلمية إلى وجود ارتباط قوي بين MPO وكل من الالتهاب والتظاهرات الحادة والمزمنة للداء القلبي الوعائي cardiac vascular disease (CVD)، حيث تساهم مشتقات تحفيز MPO في أكسدة صميم البروتين الشحمي بيتا-100 (apolipoprotein B-100) وتسريع قبط الشكل المؤكسد، الناتج من البروتين منخفض الكثافة Low density lipoprotein (LDL)، من قبل مستقبلات CD36 على الخلايا الكانسة Scanvenger cells وتشكيل الخلايا الرغوية foam cells في جدار الشريان، وأكسدة صميم البروتين الشحمي A1 (( apo-A1، بشكل يتناسب مع تناقص في قدرة جزيئة البروتين مرتفع الكثافةHigh density lipoprotein (HDL) على تحريض خروج الكوليستيرول المعتمد على ناقل العليبة المرتبط بجزيء الطاقة ATP-Binding cassette transporter (ABCA-1) وبالتالي تراكمه (8). وبحسب دراسات في المختبر in vitro، فإن HOCL يقوم بتفعيل بروتيناز المطرس المعدني Matrixmetalloproteinase -7 (MMP-7) المتراكم ضمن لويحة العصيدة، مما يحرض تحطم القلنسوة الليفية Fibrous cap المحيطة باللويحة وتحولها إلى الشكل غير الثابت vulnerable(8).
يتصف MPO بقدرته على تحريض خلل الوظيفة البطانية Endothelial dysfunction، حيث يتم قبطه بسرعة من قبل الخلايا البطانية ويتراكم في الفراغ تحت البطاني subendothelial ويستهلك تحفيزياً غاز NO كركازة له، منقصاً توافره الحيوي وما يترتب على ذلك من شذوذ في الاِرْتِخاءٌ الوِعائِيّ المعتمد على البطانة endothelial-dependent vasorelaxation، ونقص تروية العضلة القلبية(9). تشير الأدلة العلمية الحديثة إلى تزايد تراكيز MPO عند مرضى الفشل القلبي، بالإضافة إلى وجود علاقة وثيقة بين ارتفاع المستويات البلازمية للبيروكسيداز النقوية وتراجع وظيفة البطين الأيسر left ventricle(LV)(10)، حيث أظهرت الدراسات المجراة على نماذج حيوانية وجود علاقة بين MPO وإعادة هيكلة البطين الأيسر LV remodelling، فلقد أبدت MPO-knockout mice تناقصاً ملحوظاً في ارتشاح الكريات البيضاء إلى القلب وتراجع تمدد LV، وتعزيزاً في الوظيفة القلبية للبطين الأيسر، بعد احتشاء العضلة القلبية Myocardial Infarction (MI) (11). وانطلاقاً من ذلك توجه العلماء إلى محاولة تطوير استراتيجيات علاجية تستهدف تثبيط MPO دون التأثير السلبي على الاستجابة المناعية للمريض(8)، فلقد أثبتت التجارب في المختبر أن مركبات الستاتين Statins تثبّط وبقوة التعبير الجيني عن MPO عند الفئران والبشر، كما أن atorvastatin يساهم في إنقاص المؤكسدات المشتقة من فعالية MPO بشكل مستقل عن تأثيره الخافض للشحوم (11).
|
| المواد والطرق Materials and Methods |
شملت دراستنا 137 فرداً من الذكور والإناث، تراوحت أعمارهم بين 28 و85 عاماً. جرى أخذ عينات المرضى من مركز الباسل لأمراض وجراحة القلب، مركز جراحة القلب، مستشفى الأسد الجامعي، ومستشفى المواساة، خلال فترة امتدت 8 أشهر (من 5 أيار عام 2010 إلى 8 كانون الأول عام 2010). ووزع أفراد الدراسة على النحو التالي:
- مجموعة الأصحاء ظاهرياً (مجموعة الشواهد) وعددهم 25 فرداً.
- مجموعة مرضى الفشل القلبي وعددهم 112 مرضى.
سُجِّلت بيانات المرضى والشواهد جميعهم في بطاقات استبيان خاصة، متضمنة القصة المرضية والعادات الشخصية من تناول كحول وتدخين، الأدوية المتناولة وبيانات صورة صدى القلب Echocardiography. وجرى استبعاد مرضى الداء السكري، مرضى القصور الكلوي، مرضى الأورام والمرضى المصابين بالالتهابات وأمراض المناعة الذاتية، لأنها تؤثر على مقايسة MPO بشكل كبير.
|
1. مجموعة الشواهد
شملت 25 فرداً (18 ذكراً + 7 إناث) أصحاء ظاهرياً ولا يعانون من أمراض قلبية أو ضيق في النفس ولا يراجعون أي مركز طبي، وبلغ المتوسط الحسابي X والانحراف المعياري SD للعمر (X±SD) 41±7.5 عاماً.
2. مجموعة مرضى الفشل القلبي
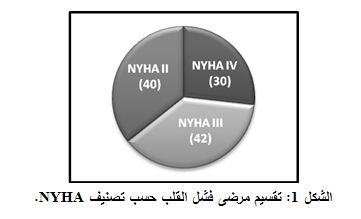
شملت 112 مريضاً (79 ذكراً + 33 أنثى)، وكان متوسط أعمارهم±الانحراف المعياري 57.53±14.32 عاماً، وقُسِّم المرضى من الناحية السريرية إلى 4 مجموعات بحسب تصنيف NYHA الوظيفي:
• NYHA Class I: لم نستطع الحصول على أي مريض، إذ تكون الأعراض خفيفة ونادراً ما يراجع المستشفى قبل تكرر الأعراض، وعندما تتكرر يكون المريض غالباً قد انتقل إلى المرحلة الثانية.
NYHA Class II •: 40 مريضاً.
NYHA Class III •: 42 مريضاً.
NYHA Class IV •: 30 مريضاً. ويمثل الشكل 1 هذا التقسيم.
أُخِذت عينات الدم الصيامي لكل من المرضى والشواهد ضمن أنبوب يحوي EDTA كمضاد تخثر ووضع الدم المجموع حديثاً في الثلج. وجرى فصل البلازما بالتنبيذ بسرعة 4000 دورة/ دقيقة بالدرجة 4+°م لمدة 15 دقيقة، ونقل جزء من البلازما الناتجة إلى أنبوب بولي بروبيلين وأعيد تنبيذها بالطريقة نفسها، ثم جرى فصل البلازما من المرحلة الأخيرة وحفظها في أنابيب إيبندورف بالدرجة -80°م إلى حين إجراء المقايسة.
عُينت قيم MPO البلازما بمقايسة الممتز المناعي المرتبط بالإنزيم(ELISA) Enzyme- Linked Immuno-sorbent Assay المعتمدة على مبدأ الشطيرة Sandwich باستخدام عتيدة Kit من شركة BioVendor التشيكية.
|
| النتائج Results |
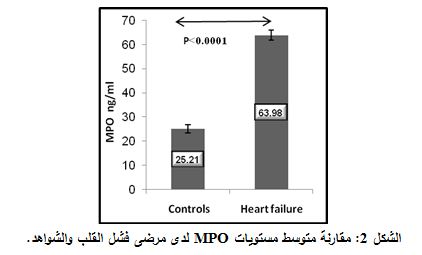
كان متوسط قيم MPO لدى مجموعة الشواهد 25.21 نغ/ مل والخطأ المعياري 1.64 نغ/ مل (X±SE) 25.21±1.64 نغ/ مل. وكان المتوسط والخطأ المعياري لدى مجموعة مرضى فشل القلب (X±SE) 63.987±2.16 نغ/ مل، وبتطبيق اختبارT- Student لتحري الفروقات بين المجموعتين، تبين وجود فارق يعتد به إحصائياً بين مستويات MPO لدى مجموعة الشواهد ومجموعة مرضى فشل القلب (P< 0.0001) (الشكل 2).
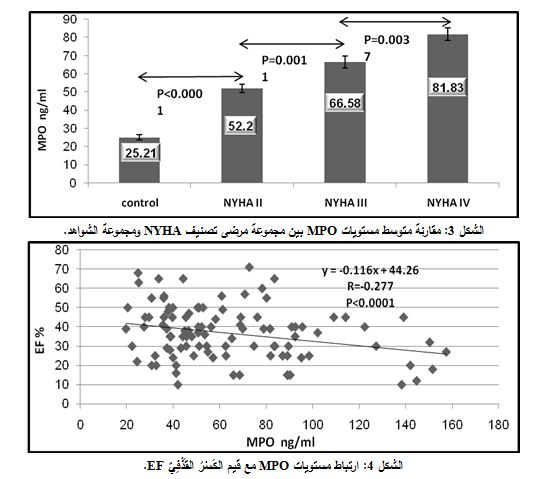
بينت نتائج مقايسة مستويات MPO البلازمية لدى مجموعة مرضى الفشل القلبي، تبعاً لتصنيف NYHA الوظيفي، أن متوسط القيم والخطأ المعياري (SE±X) لدى مرضى NYHA II هو 52.20±2.34 نغ/ مل، ولدى مرضى NYHA III هو 66.58±3.36 نغ/ مل، ولدى مرضى NYHA IV هو 81.83±3.54 نغ/ مل.
وبتطبيق اختبار T-Student للمقارنة بين مستويات MPO، تبعاً لمراحل فشل القلب، تبين ازدياد مستويات MPO بالتوازي مع تقدم تصنيف NYHA (ازدياد شدة فشل القلب) وبفارق يعتد به بين مرحلة وأخرى؛ حيث كان الفارق معتداً به إحصائياً بين مستويات MPO البلازمية لدى الأسوياء ومرضى NYHA II (P<0.0001)، كما ارتفعت مستويات MPO لدى مرضى NYHA III أكثر منها لدى مرضى II NYHA وبفارق يعتد به إحصائياً (P=0.0011)، وارتفعت مستويات MPO لدى مرضى NYHA IV عنها لدى مرضى NYHA III وبفارق يعتد به إحصائياً (P=0.0037) (الشكل 3).
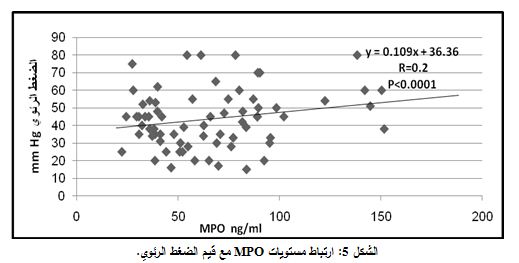
اعتمد معامل الارتباط person لتعيين الارتباط بين مستوى MPO وقيم الكَسْرُ القَذْفِيّ، فبينت دراستنا أن مستويات MPO متناسبة عكساً مع قيم EF ((R=-0.277. وكانت النتيجة معتداً بها إحصائياً (P<0.0001) (الشكل 4). بينما كانت مستويات MPO متناسبة طرداً مع قيم الضغط الرئوي (R=0.2) وكانت النتيجة معتداً بها إحصائياً أيضاً (P<0.0001) (الشكل 5).
|
 |
| المناقشة Discussion |
أظهرت دراستنا ارتفاع متوسط تراكيز MPO البلازمية لدى مرضى فشل القلب. وارتبط هذا الارتفاع إيجابياً مع ازدياد شدة الفشل وتوافق مع بيانات صورة صدى القلب، حيث ارتبطت قيم التراكيز سلبياً مع قيم الكسر القذفي %EF وإيجابياً مع قيم الضغط الرئوي.
تشير الأدلة العلمية الحديثة إلى ارتفاع تراكيز MPO لدى مرضى فشل القلب، حيث يتناقص
معدل استماتة العدلات مُفَصَّصَةُ النَّواة PMNs)) لدى مرضى فشل القلب بالمقارنة مع الأسوياء، تحت تأثير حالة الالتهاب والتفعيل المناعي الجارية والمترافقة مع نقص الأكسجة وزيادة تحرر الانترلوكين-6 والعامل المنبه لمستعمرات البلاعم والمحببات GM-CSF؛ مما يؤدي إلى إطالـة مدى عمر PMNs في الدوران المحيطي وتعزيز قدرتها الوظيفية لإنتاج وتحرير محتوياتها
الإنزيمية ومنها MPO وبالتالي ارتفاع مستوياته(12). فلقد أظهرت دراسة Tracchi I. وزملائها عام 2009(12) ارتباط تأخر معدل استماتة PMNs لدى مرضى فشل القلب طرداً مع تقدم تصنيف NYHA الوظيفي وعكساً مع قيم EF. وهذا يمكن أن يفسر نتائج دراستنا المتفقة أيضاً مع نتائج دراسة Rudolph V. وزملائه عام 2007، التي أشارت إلى وجود زيادة واضحة في مستويات التعبير الجيني عن الرنا المرسال mRNA للبيروكسيداز النقوية في الكريات البيضاء المأخوذة من دم مرضى مصابين بخلل وظيفة البطين الأيسر والذي جرى التعبير عنه بتناقص قيم %EF، كما اقترحت زيادة التفعيل الجهازي للكريات البيضاء، تزايد انتساخ mRNA وتعزيز إفراز MPO(13). ويدعم هذا التفسير أن مستويات MPO ارتبطت مع قيم الضغط الرئوي التي ترتفع نتيجة وجود فشل قلبي وتزداد مع تزايد وخامته وتقدمه للأسوأ.
من جهة أخرى ترتبط المستويات المرتفعة من MPO مع ازدياد إنتاج مشتقات أكسجينية فعالة وخاصة HOCL، الذي يتواسط تشكيل اللويحات العصيدية(8)، كما يستهلك MPO تحفيزياً غاز NO• كركازة له، منقصاً توافره الحيوي ومحرضاً خلل الوظيفة البطانية والتقبض الوعائي ونقص تروية العضلة القلبية(9). ويرتبط خلل الوظيفة البطانية عند مرضى الفشل القلبي المزمن مع تزايد تواتر دخول المستشفى وزرع القلب والموت عند مرضى II NYHA III – NYHA(14)، كما ترتبط المستويات المرتفعة من MPO مع خلل الوظيفة البطانية التي ترتبط مع الإنذار السيء عند مرضى فشل القلب(15). وأكثر من ذلك يحرض MPO تفعيل الشلالات الحالة للبروتين من خلال التثبيط التأكسدي لمثبط مفعل مولد البلازمين -1 PAI-1))Plasminogen activator inhibitor – 1 المتوضع في العضلة القلبية بواسطة HOCL وبالتالي زيادة فعالية البلازمين النسيجية وتعزيز تدرك المطرس matrix degradation، المتورط بدوره في تمدد البطين الأيسر وتناقص ثخانة جداره بعد نوبات الإقفار(16) وبالتالي يلعب MPO دوراً أساسياً في ترقي الفشل القلبي إلى الأسوأ. لكن تبعاً لنتائج دراسة Andreou I. وزملائه عام 2009 التي أظهرت تناقص مستويات MPO لدى مرضى الفشل القلبي المزمن بعد المعالجة قصيرة الأمد بمركب rosuvastatin(11) وباعتبار MPO يرتبط بالعملية الالتهابية المتواسطة بالكريات البيضاء ويولد الإجهاد التأكسدي وتترافق مستوياته البلازمية المرتفعة مع تراجع الحالة السريرية للمريض(17)، فإنّ استهدافه علاجياً بالستاتينات كمضادات أكسدة قد يفيد في تنظيم العملية الالتهابية وتحسين النتائج السريرية لمرضى الفشل القلبي (11).
توافقت نتائج دراستنا أيضاً مع دراسةW.H. Wilson Tang وزملائه عام 2006(15) والتي بينت ازدياد مستويات MPO البلازمية مع تزايد تصنيف NYHA الوظيفي لدى مرض فشل القلب، ومع دراسة Volker Roudolph V. وزملائه عام 2007(13) التي ارتبطت فبها مستويات MPO مع قيم %EF.
|
| الاستنتاج Conclusion |
|
| ترتفع مستويات MPO البلازمية عند مرضى فشل القلب ويتوافق ازديادها مع وخامة المرض. وينصح بمقايسة MPO البلازما كواصم لترقي الإصابة بفشل القلب وتقييم الحالة الإنذارية للمريض، حيث يعكس ارتفاع مستويات MPO ازدياد تراجع الوظيفة القلبية وازدياد اختطار المرض. ويقترح ذلك استهدافه علاجياً لإنقاص الإجهاد التأكسدي الناتج عنه وتحسين النتائج السريرية للمريض وإطالة البُقيا. |
| المراجع References |
1-Gibbs C.R; Davies M.K. and Lip Y.H.
ABC of heart failure 1st ed’ Eds. Gibbs C.R; Davies M.K; and Lip G.Y.H.
Pub. BMJ; 1-46, 2000.
2-Dyke D.B. and Koelling T.M.
Heart failure due to left ventricular systolic dysfunction; Baliga R.R. and Eagle K.A; Practical cardiology: evaluation and treatment of common cardiovascular disorders 2nd ed, Eds. Baliga R.R. and Eagle K.A.
Pub. Lippincott williams& wilkins; 246-285, 2008.
3-De Motellano PR.
Peroxidases.
Comprehensive toxicology 2nded. 4: 169-184, 2010.
4-Meunier B; Heme-peroxidases; Mccleverty J.A. and Meyer TH.J;
Comprehensive coordination chemistry II: from biology to nanotechnology, vol 8 2nd ed, Eds. Que L. Jr. and Tolman W.B.
Pub. Elsevier; pp: 261-280, 2005.
5-Gullberg U; Andersson E; Garwicz D; Lindmark A. and Olsson I.
Biosynthesis, processing and sorting of neutrophil proteins: insight into neutrophil granule development.
European journal of heamatology, 58: 137-153, 1997.
6-Fiedler TJ; Davey CA. and Fenna RE.
X-ray crystal structure and characterizatization of halid-binding sites of human myeloperoxidase at 1.8 A?resolution.
Journal of biological chemistry, 275: 11964-11971, 2000.
7-Roitt I.M. and Delves P.J.
Innate immunity, Roitt's essential immunology 10th ed, Eds. Roitt I.M. and Delves P.T.
Pub. Blackwell; 1-20, 2001
8- Nicholls SJ. and Hazen SL.
Myeloperoxidase and cardiovascular disease.
Journal of the American heart association, 25: 1102-1111, 2005.
9-Vita JA; Brennan ML; Gokce N; Mann ShA; Goormaste M; Shishehbor MH; Penn MS; Keaney JF. and Hazen SL.
Serum myeloperoxidase levels independently predict endothelial dysfunction in humans.
Circulation, 110(9): 1134-1139, 2004.
10-Shining C; Schnabel R; Peacock WF. and Blankenberg S.
Up and coming markers: myeloperoxidase, a novel biomarker or test of heart failure and acute coronary syndrome application?
Journal of congestive heart failure, 14: 46-48, 2008.
11-Andreou I; Tousoulis D; Miliou A; Tentolouris C; Zisimos K; Gounari P; Siasos G; Papageorgiou N; Papadimitriou CA; Pimopoulos MA. and Stefanadis C.
Effects of rosuvastatin on myeloperoxidase levels in patients with chronic heart failure: a randomized placebo controlled study.
Atherosclerosis, 210: 194-198, 2009.
12-Trrachi I; Chigliotti G; Mura M; Garibaldis S; Spallarossa P; Barisione C; Boasi V; Brunelli M; Corsiglia L; Barsotti A. and Brunelli C.
Increased neutrophil life span in patients with congestive heart failure.
European journal of heart failure, 11: 378-385, 2009.
13-Roudolph V; Roudolph TK; Herrings CH; Blankenberg S; Schnabel R; Steven D; Haddad M; Knittel K; Wenda S; Wenzel J; Münzel Th; Heitzor Th; Meinertz T; Hübner C. and Baldus SL.
Activation of polymorphonuclear neutrophils in patients with impaired left ventricular function.
Free radical biology and medicine, 43(8): 1189-1196, 2007.
14-Shechter M; Matetzky Sh; Arad M; Feinberg MS. and Freimark D.
Vascular endothelial function predicts mortality risk in patients with advanced ischaemic chronic heart failure.
European journal of heart failure, 11: 588-593, 2009.
15-Wilson Tang WH; Brennan ML; Philip K; Tong W; Mann S; Lente FV. and Hazen SL.
Plasma myeloperoxidase levels in patients with chronic heart failure.
American journal of cardiology, 98: 796-799, 2006.
16-Vasilyev N; Williams T; Brenna ML; Unzek S; Zhou X; Heinecke JW; Spitz DR; Topol EJ; Hazen SL. and Penn MS.
Myeloperoxidase generated oxidants modulate left ventricular remodeling but not infarct size after myocardial infarction.
Circulation, 112: 2812-2820, 2005.
17-Wilson Tang WH; Shrestha Kevin; Troughton RW; Borowski AG. and Klein AL.
Integrating plasma high-sensitivity C-Reactive Protein and Myeloperoxidase for risk prediction in chronic systolic heart failure.
Congestive heart failure, 17: 105-109, 2011.
|
| |
| |
| |
| |
| |
| |
| |
| |
| |
| |
| |
| المجلد 6 ,
العدد 7
, ذو القعدة 1433 - تشرين أول (أكتوبر) 2012 |
|
|
|
