| المجلد 6 ,
العدد 8
, صفر 1434 - كانون الثاني (يناير) 2013 |
| |
| دراسة مستويات الكادميوم لدى المدخنين من مرضى سرطان الرئة
ومرضى الفشل الكلوي المزمن
|
| Study of Cadmium Levels in Smoked Patients
with Lung Cancer and Chronic Renal Failure
|
| حسينة خضور، وأ. د. خليل القوتلي، وأ. د. مصطفى العموري |
| Khaddour H; Al-Quatli Kh. and Al-Ammori M. |
كلية الصيدلة، جامعة دمشق
Faculty of Pharmacy, Damascus University.
|
| الملخص Abstract |
الكادميوم (Cd) معدن ثقيل، يتواجد كملوث بيئي من مصدرين طبيعي وصناعي. أظهرت دراسات عدة إمكان تعرض الأشخاص للكادميوم من تدخين السجائر التي تعد مصدراً رئيسياً له. للكادميوم نصف عمر حيوي طويل يتراوح بين 10-30 عاماً. وهوسام للكلية من الدرجة الأولى، حيث يتراكم فيها مع مرور الزمن وقد يسبب سوء وظيفة كلوية. صنفت الوكالة الدولية لأبحاث السرطان الكادميوم كمادة مسرطنة بشرية (من الفئة I). كما ربطت معطيات أحدث إحصائياً زيادة اختطار الإصابة بسرطان الرئة عند الأشخاص المعرضين للكادميوم في المجتمع، حيث يتداخل الكادميوم مع العديد من الآليات الاستقلابية الهامة. استخدمنا في هذه الدراسة مقياس طيف الامتصاص الذري الغرافيتي (GFAAS) لكشف مستويات الكادميوم المصلية، وطريقة مقايسة الممتز المناعي المرتبطة بالإنزيم ELISA لتقييم الغلوبولين الصغري Β2 (Β2M) والبروتين الجنيني ألفا (AFP) لمصول 126شخصاً (40 مريض سرطان رئة مدخن، 40 مريض فشل كلوي مزمن مدخن، 23 سليماً مدخناً، 23 سليماً غير مدخن).
تشير الموجودات إلى أن هنالك ارتفاعاً في مستويات كادميوم المصل لدى مرضى سرطان الرئة المدخنين ومرضى الفشل الكلوي المزمن المدخنين، أكثر من الأصحاء المدخنين وغير المدخنين. لكن مستويات البروتين Β2M كانت أعلى في مصول المدخنين المصابين بالفشل الكلوي المزمن، منها لدى مرضى سرطان الرئة المدخنين والأصحاء المدخنين وغير المدخنين. ولم تُسجل في هذه الدراسة أية علاقة بين مستويات Cd ومستويات AFP.
|
|
Cadmium (Cd) is a heavy metal, found as an environmental contaminant, both through natural and industrial sources. Many studies showed that people may expose to Cadmium from smoking the cigarettes, which are the main sources. Cadmium has a long biological half-life ranging from 10 to 30 years. Cadmium is primarily toxic to the kidney, it accumulates over time and may cause renal dysfunction. The International Agency for Research on Cancer has classified Cadmium as a human carcinogen (Group 1). Newer data on human exposure to cadmium in the general population have been statistically associated with increased risk of lung cancer, since Cadmium interferes with various important metabolic mechanisms. In this study, The Graphite furnace Atomic Absorption Spectrometry (GFAAS) was used to detect Cadmium levels, and The ELISA technique to evaluate the protein Β2M and Alpha-Fetoprotein (AFP) in serum of 126 subjects (40 lung cancer smoked patients, 40 smoked chronic renal failure, 23 smoked healthy subjects and 23 non smoked healthy subjects). The present findings suggest that there is an increase in serum cadmium levels of smoked patients with lung cancer and chronic renal failure, more than smoked and non-smoked healthy subjects. However, protein Β2M levels were higher in the serum of smokers with chronic renal failure, more than smokers of lung cancer patients and healthy smokers and non-smokers. In this study, no correlation was reported between Cd and AFP levels.
|
| مقدمة Introduction |
أوردت منظمة الصحة العالمية WHO أن نسبة الذكور المدخنين في الجمهورية العربية السورية عام 2006 بلغت 42.9%. وهي النسبة الأعلى في منطقة الشرق الأوسط التي بلغت 32%، ويعّد التدخين المصدر الرئيسي للكادميوم عند المدخنين الذين لا يتعرضون له مهنياً (1). يتراكم الكادميوم في الكلية مسبباً أذية واضطراباً في وظائفها. صنفت الوكالة الدولية لأبحاث السرطان International Agency for Research on Cancer (IARC)، في عام 1993، الكادميوم ومركباته كمواد مسرطنة بشرية (من الفئة I)، وسرطان الرئة بشكل خاص (2). يعمل الكادميوم على مَثْيَلة Methylazation الحمض النووي (إضافة مجموعة ميثيل إلى حلقة السيتوزين)، حيث تقوم مواقع المَثْيَلة بتنظيم الانتساخ. وتلعب مَثْيَلة الدنا DNA الشاذة زيادة أو نقصاناً دوراً هاماً في الآلية المسببة للتسرطن (3). كما يسبب التعرض
لتراكيز منخفضة من الكادميوم ولفترات طويلة زيادة في الإجهاد التأكسدي Oxidative stress (4)، من خلال تشكيل جذور حرة، وحدوث الانسمام المباشر للعديد من الإنزيمات التي تقوم بتخفيف الإجهاد التأكسدي، مثل الكاتالاز Catalase (CAT) ومُخْتَزِلَةُ الغلُوتاثَيون Glutathione reductase (GR) وبِيروكْسيدازُ الغلُوتاثَيون Gglutathione peroxidase وفوق أكسيد ديسموتاز (SOD) superoxide dismutase والغلوتاثيون glutathione (GSH). ونعلم أن الإجهاد التأكسدي يسبب تخريب الدنا DNA، والبروتينات والشحوم الغشائية، والاستماتة Apoptosis، وهي حدثيات ترتبط مع الأذية المتقدرية محدثة التسرطن. أما على مستوى البروتين، فيحرض الكادميوم إنتاج بروتينات الصدمة الحرارية HSPs)) heat shock proteins (5) والبروتينات المُتَمسِّخة، وذلك من خلال تفاعله مع مجموعات الثيول، أو عن طريق التبادل مع الزنك في جزيئات البروتين الحاوية على هذا العنصر (إشارة تحريض HSP) (5).
كما يؤثر الكادميوم على كل من الانتساخ transcription، الترجمة translation، وعلى تركيز واستتباب الكالسيوم داخل الخلية، من خلال قدرته على تعديل المستقبلات التي تستشعر الكالسيوم خارج الخلية (CaSR) Calcium-sensing receptor (5).
يحث الكادميوم على إنتاج أنواع الأكسجين التفاعلي (ROS) Reactive Oxygen Species بطرق غير مباشرة (6)، حيث يزيد من عمليات الأكسدة الفائقة للشحوم Lipid peroxidation والتي تسبب زيادة في إفراغ المستقلبات الشحمية في البول، واستنزاف المواد والإنزيمات المضادة للأكسدة كالغلوتاثيون، ومجموعات السلفهيدريل المرتبطة مع البروتينات، مما يتسبب في حدوث تلف في الدنا DNA، وإنتاج بروتينات شاذة، بالإضافة إلى زيادة معدل الطفرات، وتبدل نظم الإشارة الخلوية والاستماتة (7). كما يؤثر الكادميوم على التعبير الخلوي للانترلوكين-6 (IL-6)، Cox-2 والوسائط المتعلقة بهما، مسبباً التهاباً رئوياً شديداً (8).
يملك الكادميوم عمراً نصفياً طويلاً (بين 10- 30 عاماً) (9)، ويُخزن نصف الكادميوم الممتص في الكلية مسبباً تبدلات هيكلية ووظيفية فيها. وتتمثل بالأذية النبيبية وزيادة إفراز البروتينات منخفضة الوزن الجزيئي في البول (البيلة البروتينية)، كالغلوبولين الصغري beta 2-microglobulin (Β2M) والبروتين الرابط للريتينول retinol-binding protein. أما التعرض طويل الأمد للكادميوم فيسبب أذية الغشاء الكبيبي، وانخفاض معدل الرشح الكبيبي GFR وإفراز بروتينات عالية الوزن الجزيئي في البول مثل: الألبومين، والغلوبولينات الكبرية غاما وalpha2–macroglobulin. ويشير انخفاض معدل الرشح الكبيبي وزيادة تركيز الكرياتينين في المصل والمرتبطان مع جرعة Cd إلى اعتلال الوظيفة الكبيبية (10).
هدفت دراستنا إلى معرفة دور الكادميوم في سرطان الرئة لدى المدخنين، من خلال دراسة مستوياته المصلية لدى مرضى سرطان الرئة المدخنين. ومعرفة ما إذا كان له دور في الفشل الكلوي المزمن، بمقايسة قيمه المصلية لدى مرضى الفشل الكلوي المزمن المدخنين. وكذلك هدفت الدراسة إلى معرفة في ما إذا كانت هنالك علاقة ما بين ارتفاع مستوى الكادميوم وارتفاع مستوى الواصم السرطاني alpha-feto protein (AFP) في مصل مرضى سرطان الرئة، وارتفاع البروتين Β2M في مصل مرضى الفشل الكلوي المزمن، بالمقارنة مع المجموعة الشاهدة من المدخنين وغير المدخنين من الفئات العمرية نفسها.
|
| المواد والطرق Materials and Methods |
مجموعات الدراسة: شملت الدراسة 126 فرداً ذكراً. وجُمعت العينات في الفترة ما بين شباط 2010 وآذار2011. كما جرى انتقاء الأصحاء المدخنين ومرضى سرطان الرئة ومرضى الفشل الكلوي المزمن، من المستمرين في عادة التدخين، إلى حين جمع العينات، بمقدار يزيد عن 20 سيجارة في اليوم ولأكثر من15 عاماً.
وزعت عينات الدراسة إلى ثلاث مجموعات:
1- المجموعة الأولى، ضمت 40 مريضاً مدخناً مصاباً بسرطان رئة، تم الحصول عليهم من مستشفى البيروني الجامعي، وكان متوسط أعمارهم 59.5±11.8عاماً، ومشخّص لديهم سرطان رئة صغير الخلايا وغير صغير الخلايا، وأُخذت العينات الدموية قبل مرحلة بدء العلاج.
2- المجموعة الثانية، ضمت 40 مريضاً مدخناً مصاباً بفشل كلوي مزمن، أُخذوا من مستشفى الكلية الجراحي، وكان متوسط أعمارهم 48±13.4عاماً.
3- المجموعة الثالثة، ضمت المجموعة الشاهدة وهي مؤلفة من 23 شخصاً مدخناً سليماً متوسط أعمارهم 54 عاماً، و23 شخصاً سليماً غير مدخنٍ بلغ متوسط أعمارهم 55.2عام.
الاعتيان: جرى جمع 5 مل من الدم المحيطي لأفراد الدراسة في أنبوب جاف عقيم، ثمّ نُبذت العينات بسرعة 3000 دورة/ دقيقة لمدة 10 دقائق. وحُفظت المصول في أنابيب إيبندورف في درجة حرارة – 80°م إلى حين إجراء المقايسة، كما لم يُطلب من المريض الصيام أو القيام بأي تحضيرات خاصة.
المواد والأجهزة: استخدم مقياس طيف الامتصاص الذري الغرافيتي (GFAAS) Graphite furnace Atomic absorption spectrometer لتحديد مستويات الكادميوم في المصل، وهو موجود في كلية الصيدلة- جامعة دمشق، قسم دراسات المراقبة الدوائية. واستخدمت مقايسة الممتز المناعي المرتبط بالإنزيم ELISA نمط الشطيرة (Sandwich-ELISA) لتحديد مستوى الغلوبولين الصغري Β2M والبروتين الجنيني ألفا AFP في مصل أفراد الدراسة، باستخدام عتيدة من شركة DRG Instrument GmbH الألمانية.
الدراسة الإحصائية
جرى التعبير عن قيم Cd المصلي بالمتوسط الحسابي والانحراف المعياري، كما اعتمد اختبار LSD وANOVA واختبارT-Student، لتحديد ما إذا كان الفارق بين المتوسطات ناجماً عن المصادفة أم حقيقاً، واعتمد معامل الارتباط Person لدراسة علاقة الارتباط بين المتثابتات المدروسة. كما جرى استخدام برنامج Microsoft excel 2007، و SPSS الإصدار 19 لتحليل البيانات إحصائياً.
|
| النتائج Results |
مستويات الكادميوم المصلي
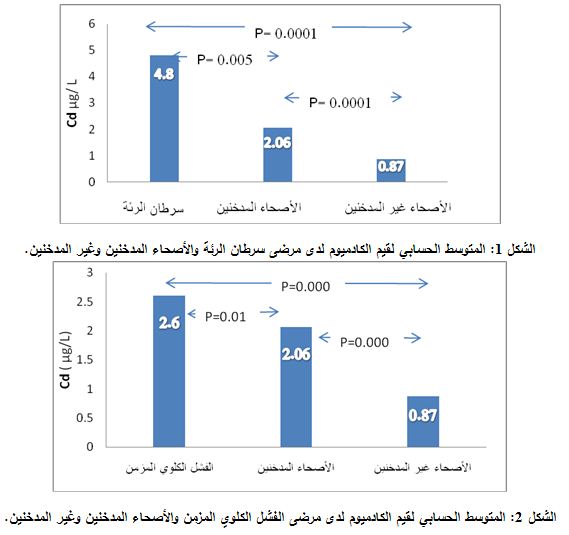
أظهرت النتائج ارتفاع قيم الكادميوم في مصول مرضى سرطان الرئة المدخنين، فكان المتوسط الحسابي ± الانحراف المعياري 4.8±5 مكغ/ل. بينما كان المتوسط الحسابي ± الانحراف المعياري في مصول المدخنين الأصحاء 2.06±1.04 مكغ/ل، في حين كانت قيمه سوية في مصول الأصحاء غير المدخنين، فبلغ المتوسط الحسابي ± الانحراف المعياري لديهم 0.87±0.43 مكغ/ل.
ولقد تبين بتطبيق اختبارT-Student، وجود فارق معتد به إحصائياً (P = 0.005) بين مجموعة سرطان الرئة المدخنين والأصحاء المدخنين. وبين مجموعة سرطان الرئة والأصحاء غير المدخنين (P = 0.0001). وكان الفارق معتداً به إحصائياً أيضاً بين الأصحاء المدخنين وغير المدخنين في المجموعة الشاهدة (P =0.0001) (الشكل 1).
كانت قيم الكادميوم مرتفعة أيضاً عند مرضى الفشل الكلوي المزمن المدخنين مقارنة مع مجموعة الأصحاء المدخنين وغير المدخنين، حيث كان المتوسط الحسابي ± الانحراف المعياري 2.6±0.84 مكغ/ ل. ولقد أظهرت طريقة T-Student وجود فارق يعتد به إحصائياً بين مرضى الفشل الكلوي المزمن والأصحاء المدخنين (P = 0.012). وبين مجموعة الفشل الكلوي المزمن والأصحاء غير المدخنين (P=0.0001) (الشكل 2).
|
قيم البروتين Β2M في المصل
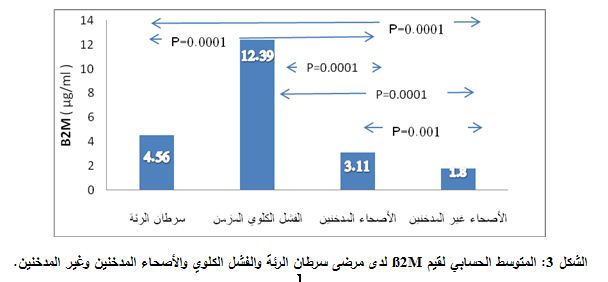
كان المتوسط الحسابي ± الانحراف المعياري لقيم Β2M في مصول مرضى سرطان الرئة المدخنين 1.73±4.56 مكغ/ مل. ولدى مرضى الفشل الكلوي المزمن 12.39± 0.68 مكغ/ مل، وكانت هذه القيم 3.11±0.92 مكغ/ مل لدى مجموعة الأصحاء المدخنين، ولدى الأصحاء غير المدخنين 1.8±0.54 مكغ/ مل (الشكل 3).
لقد وجد بتطبيق اختبار Student- Tفارق يعتد به إحصائياً (P=0.0001) بين كلّ من مجموعة سرطان الرئة ومجموعة الأصحاء المدخنين وغير المدخنين في المجموعة الشاهدة.
ووجد فارق معتد به إحصائياً (P=0.0001) بين مرضى الفشل الكلوي المزمن والأصحاء المدخنين وغير المدخنين (P=0.0001) (الشكل 3).
وبحساب معامل الارتباط بيرسون لمعرفة العلاقة بين قيم Β2M وعمر المريض، وجد فارق معتد به إحصائياً (P =0.001) لدى الأصحاء المدخنين، فكان معامل الارتباط ((0.473=R، والعلاقة طردية ومتوسطة الشدة بين قيمة Β2M وعمر المدخن غير المريض، حيث ترتفع قيم Β2M المصلية مع تقدم المدخن بالعمر. في حين لم نجد فارقاً يعتد به إحصائياً (P = 0.270( بالنسبة لارتباط Β2M مع العمر في باقي المجموعات المدروسة.
قيم البروتين الجنيني ألفا AFP المصلية
بلغ المتوسط الحسابي ± الانحراف المعياري لقيم البروتين الجنيني ألفا AFP لدى مجموعة سرطان الرئة 4.82±4.26 وحدة دولية /مل، ولدى الأصحاء المدخنين 4.70±1.52 وحدة دولية /مل، ولدى الأصحاء غير المدخنين 3.63±1.63 وحدة دولية/ مل. وبتطبيق اختبار T-Student لم نجد فارقاً يعتد به إحصائياً P)=0.324( بين مجموعة سرطان الرئة المدخنين والأصحاء المدخنين وغير المدخنين. وكذلك لم يكن الفارق معتداً به إحصائياً بين AFP وعمر مرضى سرطان الرئة P)= 0.969)، وبين AFP وقيم الكادميوم عند هؤلاء المرضى P)= 0.730). |
| المناقشة Discussion |
أظهرت نتائجنا ارتفاعاً واضحاً في مستويات الكادميوم المصلية لدى مجموعة سرطان الرئة المدخنين، مقارنة مع المجموعة الشاهدة وبفارق معتد به إحصائياً (P=0.0001)، حيث أن القيمة السوية للكادميوم في مصل غير المدخنين تكون أقل من 1 مكغ/ ل. وهي تتراوح بين 1.4 و4.2 مكغ/ ل في مصول المدخنين. ولقد توافقت نتائج دراستنا مع دراسة T.G. Kazi وزملائه في الباكستان عام 2008، والتي جرى فيها قياس تراكيز الكادميوم في دم 120 مريضاً ذكراً مدخناً مصاباً بسرطان الرئة، باستخدام مقياس طيف الامتصاص الذري (ETAAS)، ثم مقارنة النتائج مع تراكيز الكادميوم لدى 150 شاهداً سليماً مدخناً وغير مدخنٍ، من الفئات العمرية نفسها (40-70 عاماً)، حيث أظهـرت النتائج ارتفاع تركيز Cd لـدى مرضى سرطان الرئة المدخنين مقارنة مع المجموعة الشاهدة وبفارق معتد به
إحصائياً (P <001) (11). وكان الفارق معتداً به إحصائياً في قيم الكادميوم بين الأصحاء المدخنين وغير المدخنين (P=0.0001)، وتوافقت هذه النتائج مع دراسة T.G. Kazi وزملائه عام 2008 (11). ومع دراسة تركية أجراها Omar EL-Agha وزملائه عام 2002 على مجموعة مؤلفة من119 ذكراً، تراوحت أعمارهم بين17 و77 عاماً، لتحري الكادميوم في مصولهم باستخدام جهاز طيف الامتصاص الذري، فكان متوسط تركيزه عند المدخنين أعلى من متوسط تركيزه عند غيرالمدخنين، وبفارق معتد به إحصائياً (0.004=P) (12). وتوافقت نتائج دراستنا أيضاً مع دراسة بريطانية عام 1988، حيث كانت مستويات الكادميوم عند مدخنين، لأكثر من 20 سيجارة/ اليوم، أكبر من الأصحاء غير المدخنين (13). ويفسر ذلك بأنّ تدخين السجائر سبب ارتفاع تراكيز الكادميوم في دم المدخنين مقارنة مع غير المدخنين، لما تحويه لفافة التبغ من كادميوم ومن ثمّ تأثيره الثاني في الطريق التنفسي عموماً والرئة خصوصاً، فامتصاص كميات قليلة منه عبرهذا الطريق تكون شديدة الفعالية والسمية على الرئة.
كما ارتفعت مستويات الكادميوم لدى مجموعة المصابين بالفشل الكلوي المزمن المدخنين مقارنة مع المجموعة الشاهدة بفارق معتد به إحصائياً 0.0001=P)). وتوافق ذلك مع دراسة Chen B في الصين عام 2002 والتي أظهرت ارتفاع تراكيزالكادميوم في مصل 81 مريضاً مصاباً بفشل كلوي مزمن، مقارنة مع تراكيزه في مصول 42 شخصاً سليماً، وبفارق معتد به إحصائياً (p<0.05) (14)، كما أظهرت دراسة Satarug S وزملائه على 96 رجلاً تايلاندياً عام 2004، ارتفاع مستوى الكادميوم عند 30-50% من المدخنين مقارنة مع غير المدخنين، بفارق يُعتد به إحصائياً (P<0.05)، والذي ارتبط مع اضطراب شديد في الكبيبات الكلوية (15). ويفسر ذلك بأن تدخين علبة سجائر واحدة يعطي كمية أكبر بعشر مرات من تلك التي يتوقع الجسم أن يتعامل معها. ويسبب التعرض طويل الأمد للكادميوم عن طريق التدخين أذية الغشاء الكبيبي وانخفاض معدل الترشيح الكبيبي، مما يؤدي إلى إفراز بروتينات عالية الوزن الجزيئي في البول وبيلة بروتينية وزيادة في تركيز الكرياتينين والبروتين Beta2-microglobulin (Β2M) في المصل (10). ولقد حاولنا دراسة مستويات الكادميوم والبروتين Β2M في البول، لكن ندرة البول عند مرضى الفشل الكلوي المزمن أعاقها.
كما أظهرت دراستنا ارتفاع تراكيز Β2M في مصول مرضى الفشل الكلوي المزمن المدخنين، مقارنة مع الأصحاء المدخنين وغيرالمدخنين وبفارق معتد به إحصائياً (P=0.0001)، "حيث تتراوح القيم السوية للبروتين Β2M في المصل بين 0- 3.0 مكغ/ مل". كما أظهرت مصول مرضى سرطان الرئة المدخنين تراكيز أكبر لهذا البروتين، مقارنة مع الأصحاء المدخنين وغير المدخنين من المجموعة الشاهدة وبفارق معتد به إحصائياً 0.0001=P)). وأظهرت دراستنا وجود علاقة طردية بين ارتفاع قيم البروتين Β2M في المصل وارتفاع كلٍّ من مستوى الكادميوم المصلي، وزيادة عمر الأصحاء المدخنين من المجموعة الشاهدة (ترتفع قيم البروتين Β2M في المصل مع تقدم المدخن بالعمر).
تبين من خلال دراستنا عدم وجود علاقة بين الكادميوم والبروتين الجنيني ألفا AFP، حيث كانت قيمه ضمن المجال السوي "أقل من 10 وحدة دولية/ مل"، ولم تسجل علاقة ارتباط بينه وبين باقي المتثابتتات المدروسة. |
 |
| الاستنتاج Conclusion |
يشير ارتفاع تراكيز الكادميوم المصلية لدى المدخنين المرضى والأصحاء، مقارنة مع غير المدخنين، إلى أن التدخين مصدرهام للتعرض للكادميوم. ويشير ارتفاعه لدى مرضى سرطان الرئة المدخنين إلى تأثيره السام في السبيل التنفسي وخاصة الرئة، وإلى دوره في إحداث سرطان الرئة.
توجدعلاقة بين ارتفاع تراكيز الكادميوم وأذية الكلية، التي تظهر بالبيلة البروتينية. ويعود ذلك إلى تخريب الكادميوم للأنابيب الكلوية وأثره على الامتصاص، فلقد وجدنا ارتفاع مستويات البروتين Β2M المصلي المترافق مع ارتفاع تراكيز الكادميوم المصلي، لدى مرضى الفشل الكلوي المزمن ولدى مرضى سرطان الرئة المدخنين والمدخنين الأصحاء، مقارنة مع الأصحاء غير المدخنين.
|
| المراجع References |
1-Hyesook Kim, Hee Jung Lee, Ji-Yun Hwang, Eun-Hee Ha, Hyesook Park, Mina Ha, et.al.
Blood cadmium concentrations of male cigarette smokers are inversely
associated with fruit consumption.
The Journal of Nutrition. 140 (6):1133-8 June, 2010.
2-IARC (International Agency for Research on Cancer), Beryllium, Cadmium, Mercury and Exposures in the Glass Manufacturing Industry. IARC Monographs on the Evaluation of Carcinogenic Risk of Chemicals to Humans, vol. 58. Lyon, France. 444: 119-237, 1993.
3-Calvisi D.F; Ladu, S; Gorden A; Farina M; Lee J.S; Conner E.A; Schroeder I; Factor V.M; Thorgeirsson, S.S.
Mechanistic and prognostic significance of aberrant methylation in the molecular pathogenesis of human hepatocellular carcinoma.
J. Clin. Invest. 117, 2713-2722, 2007.
4-Nakadaira H. and Nishi S.
Effects of low-dose cadmium exposure on biological examinations.
Sci Total Environ, 308 (1-3), 49-62, 2003.
5-Bertin G. and Averbeck D.
Cadmium: cellular effects, modifications of biomolecules, modulation of DNA repair and genotoxic consequences (a review).
Biochimie, 88: p. 1549-1559, 2006.
6-Jacquelyn Jo Bower.
Mechanisms of environmental carcinogenesis and metal-induced cellular signaling.
Dec 28, 2011.
7-Frank Henkler, Joep Brinkmann and Andreas Luch
The Role of Oxidative Stress in Carcinogenesis Induced by Metals and Xenobiotics.
Thielallee 88-92, 14195 Berlin, Germany; Cancers, 2, 376-396; doi:10.3390/cancers2020376, 2010.
8-Harris RE; Beebe-Donk J. and Alshafie GA.
Cancer chemoprevention by cyclooxygenase 2 (COX-2) blockade: results of case control studies.
Subcell Biochem , 42: 193-212, 2007.
9-J?rup L; Rogenfelt A; Elinder CG; Nogawa K. and Kjellstrom T.
Biological half-time of cadmium in the blood of workers after cessation of exposure.
Scandinavian Journal of Work Environment & Health 9 (4): 327-331, 1983.
10-Jan Alexander, Diane Benford, Andrew Cockburn, Jean-Pierre Cravedi and Eugenia Dogliotti
Cadmium in food, Scientific Opinion of the Panel on Contaminants in the Food Chain.
The EFSA Journal, 980, 1-139, 2009.
11-T.G. Kazi, A.R. Memon, H.I. Afridi, M.K. Jamali, M.B. Arain, N. Jalbani.
Determination of cadmium in whole blood and scalp hair samples of Pakistani male lung cancer patients by electrothermal atomic absorption spectrometer. 25 January; 389 (2-3): 270-276, 2008.
12-Omar EL-Agha and Jnci G. Gokmen.
Humana Press Inc: Smoking Habits and Cadmium Intake in Turkey, Ankara, Vol. 88, 2002.
13-Pocock SJ, Delves HT, Ashby D, Shaper AG. and Clayton BE.
Blood cadmium concentrations in the general population of British middle-aged men.
Royal Free Hospital School of Medicine, London, Mar; 7(2): 95-103, 1988.
14-Bing Chen, Ludwig V. Lamberts, Geert J. Behets, Tingting Zhao, Mingxiang Zhou, Gang Liu, Xianghua Hou, Guangju Guan and Patrick C. D’Haese.
Selenium, Lead, and Cadmium Levels in Renal Failure Patients in China.
Biological Trace Element Research, Vol. 131, N. 1, 1-12, DOI: 10.1007/s12011-009-8340-y, 2009.
15-Satarug S, Ujjin P, Vanavanitkun Y, Nishijo M, Baker JR, Moore MR.
Effects of cigarette smoking and exposure to cadmium and lead on phenotypic variability of hepatic CYP2A6 and renal function biomarkers in men.
Toxicology, Nov 15; 204(2-3): 161-73, 2004.
|
| |
| المجلد 6 ,
العدد 8
, صفر 1434 - كانون الثاني (يناير) 2013 |
|
|
|
