| المجلد 6 ,
العدد 8
, صفر 1434 - كانون الثاني (يناير) 2013 |
| |
| تحري ذات الرئة المُسبّبة بالمكورات العقديّة الرّئويّة
باستخدام تقانة التفاعل السلسلي للبوليميراز في الزمن الحقيقي
|
| Detecting Pneumonia Caused by Streptococcus Pneumoniae
by Using Real-Time PCR Technique
|
| د. رنا شامي، وأ. د. شادن حداد، وأ. د. خليل القوتلي |
| Shami R; Haddad Sh. and Al-Quatli Kh. |
كلية الصيدلة، جامعة دمشق
Faculty of Pharmacy, Damascus University
|
| الملخص Abstract |
تُعدّ جراثيم S. pneumoniae سبباً هامّاً للالتهاب الرئويّ المجتمعي المُكتسب. لكن يبقى التشخيص الدقيق لهذه العداوى تحدّياً صعباً بسبب الحساسية غير الكافية للاختبارات التشخيصية الاعْتِيادِيّة. ولقد اعتُبرت زروعات القشع غير مُعول عليها، لعدم قدرتها تفريق الاستعمار عن العدوى. وكان هدفنا تقييم الفائدة السريرية الكامنة لاستخدام المُقايسة الكمية السريعة للتفاعل السلسلي للبوليميراز في الزمن الحقيقي لجرثومة S. pneumoniae في عينات قشع لدى مرضى مصابين بالالتهاب الرئوي المجتمعي المُكتسب.
تضمنت الدراسة 59 مريضاً، ممن أُثبت لديهم الالتهاب الرئوي بالبينة السريرية والتصويرية الشعاعية. واخُتبرت عينات القشع من أجل تحديد تواجد جرثومة S. pneumoniae، باستخدام طريقة Real-Time PCR كمية. كما قُورنت مَوجودات الـ PCR مع نتائج زروعات القشع/ الدم. وحُسِبت المساحة تحت المُنْحَنَى (AUC) والقيمة الحدّية للدنا DNA التي تحقق الحساسية والنوعية العظمى.
أوضح تحليل منحنى ROC أن المساحة تحت المُنحنى تساوي 0.938، وكانت القيمة الحدّية للدنا 3.8x410 نسخة/ مل، والحساسية والنوعية %100 و%96.8، على الترتيب. ووُجد أن %39 من العينات إيجابية لجرثوم S. pneumoniae باستخدام QRT-PCR، في حين وُجد أن %20.3 من النتائج كانت إيجابية الزرع. ووجد أن 18.7% من العينات سلبية الزرع وإيجابية QRT-PCR.
الاستنتاج: يُقدم تفاعل Real-Time PCR الكمي طريقة حساسةً وكُفْء وسريعة لاكتشاف العِقْدِيَّةُ الرِّئَوِيَّة S. pneumoniae.
|
Streptococcus pneumoniae is an important cause of community-acquired pneumonia. However, the accurate diagnosis remains a challenge due to an inadequate sensitivity of conventional diagnostic tests. Sputum cultures have been considered unreliable, due to their inability to differentiate colonization from infection. Our objective was to evaluate the potential clinical utility of a rapid quantitative real-time PCR assay using sputum samples for Streptococcus pneumoniae in adult patients with community- acquired pneumonia.
The study included 59 patients, with clinical and radiographic evidence of pneumonia. Sputum samples were tested for the presence of S. pneumonia, by using a quantitative Real-Time PCR. PCR findings were compared with sputum/blood cultures. The area under the curve (AUC), and DNA cutoff value, which provides the maximal sensitivity and specificity, were calculated.
ROC curve analysis demonstrated an AUC of 0.938, DNA cutoff point was 3.8×104 copy/ml, and Sensitivity and specificity were 100% and 96.8%, respectively. Of the specimens, 39% were found to be positive to S. pneumoniae by QRT- PCR, while 20.3% were found to be positive by culture, and 18.7% were found to be negative by culture and positive by QRT-PCR.
Conclusion: Quantitative Real-time PCR offers a sensitive, efficient, and rapid method for the detection of S. pneumoniae.
|
| المُقدمّة Introduction |
تتواجد جراثيم العقديات الرئويّة Streptococcus Pneumoniae بشكل لاعرضي في البلعوم الأنفي للإنسان، حيث تشكل جزءاً هاماً من الجراثيم الفموية المُطاعمة Commensal Bacteria، ولكنها على الرغم من ذلك تُعد سبباً رئيساً للمَراضَة والوفيّات، إذ تُشكِّل سبباً رئيساً للالتهاب الرئويّ المجتمعي المُكتسب (Greiner et al; 2001)، بالإضافة الى طيف واسع من العداوى تتضمن: عداوى المُخاطيِّة (مثل التهاب الجيوب، التهاب الأذن الوسطى)، الْتِهاب المَفْصِلArthritis وغيرها، بالإضافة إلى عداوى غزوّية وخيمة مثل الْتِهاب السَّحايا والإِنْتان الدَمَوِيّ، ..الخ (Obaro et al; 2002) (Musher et al; 2000).
وعلى الرغم من أن معظم المضادات الحيوية التقليدية ماتزال فعالة، إلا أن نشوء ذرارٍ مُقاوِمةٍ للبنسلين وذرارٍ مُتعددة المُقاومة أدى الى ازدياد حالات المراضة والوفيات بهذه الجراثيم (McAvin et al; 2001).
يعتمد تشخيص جراثيم S. pneumoniae بشكل رئيسي، على الزرع الجرثومي المُترافق مع اختبارات الاستعراف الكيميائية الحيوية والكيميائية المناعية (Chalasani et al. 1995). ويعد زرع القشع أحياناً غير مفيد، نتيجة حدوث تلوث بجراثيم النبيت الجرثومي normal Flora المُطاعمة ، مما يجعل كشف الجرثومة كعامل مسبب أكثر صعوبةً، هذا بالإضافة إلى طول المدة الزمنية التي يحتاجها زرع القشع لعزل الجرثومة وإجراء التحسس على المضادات الحيوية الملائمة، بالإضافة إلى احتمال كون المريض تعاطى مضادات حيوية، خلال أو قبل أخذ العينة، مما يؤدي الى تثبيط نمو الجراثيم على الأوساط الزرعية (van Haeften et al; 2003). وظهرت مؤخراً اختبارات حديثة مثل كشف مستضدات S. pneumoniae في البول، لكنها تمتلك حساسية منخفضة (%70)، لذلك يجب أن تُستخدم بالمشاركة مع اختبارات أخرى (Dowell et al. 2001) (Gutierrez et al. 2003).
من هنا نشأت الحاجة الى إيجاد طرق تشخيصية تتمتع بنسبة عالية من الحساسية والنوعية تجاه جرثومة S. pneumoniae، مما يساهم في تأكيد التشخيص وتطبيق العلاج المناسب بأسرع وقت.
في عام 1987 بدأ استخدام طرق التشخيص الجزيئية في تشخيص جرثومة S. pneumoniae، ومن أهم هذه الطرق التفاعل السلسلي للبوليميراز (PCR) التقليدي، الذي يُعد وسيلةً هامةً لكشف الالتهاب الرئوي المُسبّب بجراثيم S. pneumoniae، بسبب عدم اعتماده على عيوشيّة Viability الجرثومة، بالإضافة الى حساسيته العالية. جرى استخدام الـ PCR في كشف S. pneumoniae في عينات الدم والسائل النخاعي CSF، كما لجأ بعض الباحثين Butler et al. 2003 وMurdoch et al. 2003 إلى تقييم فائدة الـ PCR في كشف S. pneumoniae، في العينات التنفسية وأكدوا وجود صعوبات في معرفة ما إذا كانت نتائج الـ PCR الإيجابية تمثل حالة استعمار البلعوم الأنفي أو عدوى السبيل التنفسي السفلي. ومن هنا تبرز أهمية مُقايسة Real-Time PCR، حيث يمكن بواسطة هذه الطريقة تحديد كمية الجراثيم الموجودة في العينة وبالتالي تساعد على التمييز بين حالتي استعمار البلعوم الأنفي والعدوى، بالإضافة إلى سرعة هذه الطريقة ودقتها. ولقد أجرت عدة دراسات تقييماً لهذه التقنية في تشخيص عداوى S. pneumoniae (Murdoch et al. 2004) (Schaad et al. 2002).
تهدف هذه الدراسـة، الى تقييم التفاعل السلسلي الكمي للبوليميراز في الزمن الحقيقي Quantitative real-time PCR، في الكشف عن جرثومة S. pneumoniae في عينات القشع لدى مرضى الالتهاب الرئوي، ومقارنتها مع طريقة الزرع الجرثومي الاعتيادية.
|
| المواد والطرق Materials and Methods |
الاعتيان Sampling
أُخذت عينات القشع من مرضى لديهم دليل سريري وشعاعي على وجود التهاب رئوي، حيث جُمِعت 59 عينة قشع، وذلك في الفترة الواقعة بين أيلول 2009 ونيسان 2010 من قسمَي الإسعاف والصدرية في مستشفى المواساة وقسم الصدرية في مستشفى الأسد الجامعي، كما تم تسجيل حالات زرع الدم الإيجابية لجرثومة S. pneumoniae في حال وجودها. ومن بين هذه العينات وُجِدت 15 عينة (25.4%)، أُخذت من مرضى أثناء معالجتهم بالمضادات الحيوية، وكان 26.1% من المرضى لديهم ربو، 21.7% لديهم الدَّاءُ الرِّئَوِيُّ المُسِدُّ المُزْمِن COPD، وبلغت نسبة المدخنين 61%. وكان 22% من المرضى قد تجاوزوا سن الستين.
مُعاملة العينات
أُجري الفحص العياني للعينات وصُنِّفَت إلى عينات قشع قيحيَّة (تحوي قيحاً مع/ أو بدون مُخاط، أو لعاب، أو دم) وعينات قشع غير قيحيّة (لا تحوي قيحاً)، كما جرى تسجيل حجم القشع ولونه، ثم جرى ضبط جودة عملية اعتيان القشع وذلك للتأكد أن العينة هي قشع حقيقي، حيث تُؤخذ كمية من القشع وتلوّن بتلوين غرام وتُفحص باستخدام المجهر (10x)، ثم يجري تعيين عدد الكريات البيض مُقابل عدد الخلايا الظهارية في كل ساحة مجهرية. تُعد العينة جيدة إذا ما احتوت
على أكثر من 10 كريات بيض مقابل كل خلية ظهارية.
الزرع الجرثومي Bacterial Culture
تُؤخذ أخيذة مناسبة من القسم المقيّح من القشع وتُزرع بوساطة عروة زرع معقّمة على مستنبت الآغار بالدم %5، ويُحضن المستنبت في وسط معزّز بغاز CO2 بنسبة %5 بالدرجة 37°م لمدة 24 إلى 48 ساعة، ثم يُحفظ القسم المتبقي من القشع في المجمدة (-70°م) لمتابعة عملية عزل الحمض النووي.
تعيين هوية الجرثومة
S. pneumoniae Identification
اعتمدنا في استعراف جراثيم S. pneumoniae على الخطوات التالية:
1- فحص لطاخة تلوين غرام للعينة المرضية: جرى البحث عن مكورات إيجابية الغرام متوضعة بشكل ثنائيات (تشبه اللهب) متقابلة بالنهاية المُستدقة.
2- اختبار التحسس على الأوبتوشين Optochin: جرى تحديد تحسس مستعمرات الجراثيم المعزولة على الأبتوشين باستخدام أقراص 5 mg (Abtek, UK).
3- اختبار التراص مع المصل الضدي: باستخدام عتيدة Slidex pneumo Kit شركة (Biomeriux,France)، وهي عبارة عن اختبار تراص على اللاتكس سريع للكشف عن S. pneumoniae.
عزل الحمض النووي الجرثومي
Isolation of Bacterial Nucleic Acid
قبل عزل الحمض النووي، أُجريت عملية هضم عينات القشع من أجل تسهيل عزل الحمض النووي. وجرى ذلك باستخدام عتيدةBBL Mycoprep Specimen Digestion Kit (BD; USA)، حيث عُزل الدنا DNA وجرت تنقيته باستخدام عتيدة QIAamp DNA (Qiagen, Germany) mini kit باستخدام طريقة الأعمدة Column، وفق تعليمات الشركة المُصنعة، باستخدام بروتوكول سوائل الجسم والأنسجة، بالإضافة إلى بروتوكول الجراثيم إيجابية الغرام. وذلك باستخدام إنزيم خاص هو إنزيم الليزوزيم Lysozyme (Carl Roth, Germany) لحلّ الجدار الخلوي الصلب متعدد الطبقات للجرثومة، حيث يُضاف 180 مكرولتر من محلول الليزوزيم Lysozyme (بتركيز 20 mg/ml) إلى الراسب الناتج من عملية هضم القشع وتُحضن بدرجة حرارة 37°م لمدة نصف ساعة على الأقل، ثم تُتابع عملية العزل.
مُقايسة الدنا الجرثومي باستخدام التفاعل السلسلي للبوليميراز في الزمن الحقيقي Real Time PCR
جرَت مُقايسة الحمض النووي الجرثومي باستخدام عتيدة (Primer Design Quantification Kit for Streptococcus Pneumoniae) (من شركة Primer Design, UK)، باستخدام جهاز Smart Cycler في مُختبر مستشفى الأسد الجامعي وفق تعليمات الشركة المصنعة. كما جرى استخدام مزيج التفاعل السلسلي للبوليميراز الرئيسي، وهو Mix Primer Design 2x Precision Master. حُضِّر مزيج التفاعل بعد تعديل الكميات، بحيث يصبح الحجم النهائي للمزيج 25 µl (الحجم المناسب لجهاز Smart Cycler)، حيث استُخدِمت لكل عينة الكميات التالية: مزيج التفاعل 12.5 مكرولتر، المَشَارِع والمسابير الخاصة بالجرثومة 1.25 مكرولتر، ماء ثنائي التقطير 5 مكرولتر، ثم تُضاف خلاصة عزل عينات القشع بمقدار 6.25 مكرولتر. وجرت برمجة الدورات الحرارية لتفاعل PCR، بحيث تبدأ مرحلة تفعيل الإنزيم عند 95°م ومدتها 10 دقائق، تليها 50 دورة تَمَسُّخ Denaturation عند 95°م مدة 10 ثوانِ، ثم تجميع المُعطيات (قياس إشارة التألق) في الدرجة 60°م مدة 60 ثانية ويتبعها مرحلة دراسة منحنى الانصهار Melting Curve Analysis. أما المُقايسة الكمية للدنا الجرثومي فلقد جرت باستخدام العتيدة السابقة نفسها وبالخطوات المتبعة نفسها في المُقايسة الكيفية، بالإضافة الى استخدام المعياريات التي يجري تحضيرها ابتداءً من الشاهد الإيجابي (الذي تركيزه 2 x107 نسخة مُجَيْن في المكرولتر)، يجري بعد ذلك تحليل هذه السلسلة المعيارية وتشكيل المُنحنى المعياري الذي يمكن بواسطته التحديد الكمّيّ لعدد نسخ DNA الجرثومي في كافة العينات.
التحليل الإحصائي Statistical Analysis
أجريت كافة التحاليل الإحصائية باستخدام برنامجSPSS . وجرى تلخيص البيانات في منحنى (ROC) Receiver Operating Characteristic ، وذلك لتحديد القيمة التشخيصية للمقايسة، بالإضافة الى حساب مساحة المنطقة تحت المُنحنى Area Under the Curve (AUC) وبحدود ثقّة %95 CI: 95%))، كما جرى تحديد القيم الحدّية Cut-off لتركيز الدنا الجرثومي في 1 مل قشع والتي تعطي أعلى قيمة حساسية ونوعية للطريقة المدروسة. واستُخدِم مُعامِل ارتباط سبيرمان Spearman's Correlation لتقييم الترابط بين نتائج الزرع الجرثومي وطريقة QRT-PCR.
|
| النتائج Results |
أبدى الزرع الجرثومي إيجابية الـ S. pneumoniae في 12 عينة (20.3%)، بينما أظهرت المُقايسة الكيفية باستخدام تقنيةReal Time PCR وجود S. pneumoniae DNA في 46 عينة قشع.
مجموعات الدراسة: قُسِّمت مجموعة المرضى إلى مجموعتين:
- مجموعة الحالات المرضية: وعددها 15 مريضاً وتمثل الحالات التي تمتلك تشخيصاً مؤكداً (بزرع دم إيجابي) أو تشخيصاً مُحتملاً (بزرع قشع إيجابي) للالتهاب الرئوي بجرثومة S. pneumoniae، حيث كان لدينا 11 مريضاً لديهم زرع قشع إيجابي فقط و3 مرضى فقط لديهم زرع دم إيجابي، ومريضاً واحداً منهم لديه زرع دم وزرع قشع إيجابي، وبالتالي فإن العدد الإجمالي 15 عينة.
- المجموعة الشاهدة: وعددها 31 مريضاً، وهي مجموعة المرضى الذين لديهم نتائج زرع الدم وزرع القشع سلبية (الشكل 1).
|
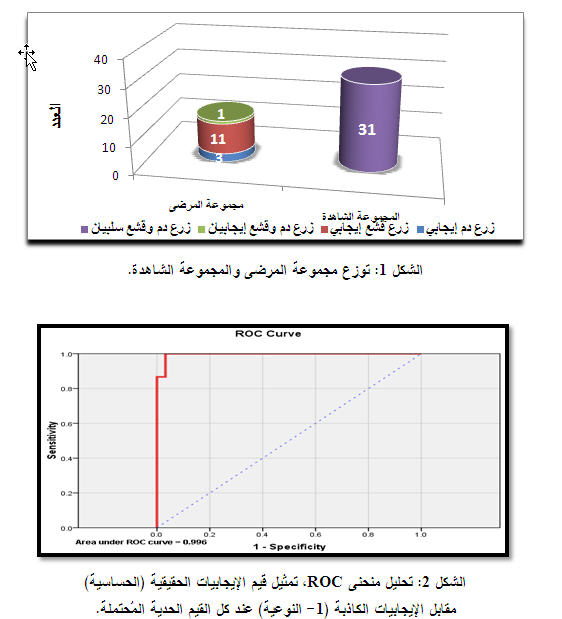 |
| نتائج تحديد تركيز الدنا الجرثومي الذي يمثل القيمة الحّدية للتمييز بين حالتي الاستعمار والعدوى. |
جرى رسم منحنى ROC وحساب المساحة تحت المُنحنى (AUC) وكانت AUC=0.938 وبمُعامِل ثقة (CI=95%). وبالاعتماد على تحليل منحنى ROC كانت قيمة الدنا الجرثومي التي أعطت أعلى قيمة حساسية ونوعية هي 3.8x410 نسخة جينوم جرثومي/ 1 مل من القشع (الشكل 2)، وعند هذه القيمة الحدّية كانت حساسية الطريقة المُتبعة هي %100، أما النوعية فكانت %96.8.
واعتماداً على النتائج السابقة، اعتُبرت جراثيم S. pneumoniae سبباً للمراضة عند البالغين عند وجود أكثر من 3.8x410 نسخة جينوم جرثومي/ 1 مل. وبالتالي يصبح عدد العينات الإيجابية المؤكدة هو 23 (38.98%)، إذ يتراوح عدد النسخ الجينومية الموجودة في هذه العينات بين 4.8x410 وx6.2610 نسخة جينوم جرثومي/مل.
|
| مُقارنة نتائج الزرع والمُقايسة الكمية للحمض النووي Quantitative Real-Time PCR. |
كما ذكرنا سابقاً، أُخِذت 59 عينة منها 23 (38.89%) إيجابية لجرثومة S. pneumoniae بواسطة QRT-PCR، وبالزرع أبدت 12 (20.3 %) عينة إيجابية (P<0.0001)، حيث كانت جميعها إيجابية بـ QR-PCR، أي أن 100% من العينات الإيجابية بالزرع أعطَت نتيجة إيجابية باستخدام PCR. كما أعطى الزرع الجرثومي 47 (79.7%) عينة سلبية، 11 عينة منها أعطت إيجابية باستخدام QR-PCR، وبالتالي أعطى QR-PCR إيجابية بنسبة 23.4% في العينات سلبية الزرع (الجدول 3).
وتشكل هذه العينات الـ 11 نسبة 18.7% من إجمالي العينات. والجدير بالذكر أن 7 مرضى منهم كانوا يتناولون المضادات الحيوية وقت أخذ العينة (الشكل 4). الانتباه إلى تصحيح الكتابة داخل الشكل 4 على محور السينات.
وبالنسبة للعينات التي أُخذت من المرضى أثناء معالجتهم بالمضادات الحيوية (n=15)، وجدنا أن 3 منها أظهرت نتيجة زرع إيجابي لجرثومة S. pneumoniae، بينما أعطت 7 منها نتائج إيجابية باستخدام QR-PCR لوحده.
|
 |
| المناقشة وتفسير النتائج Discussion |
يُعد التشخيص الدقيق للالتهاب الرئوي بجرثومة S. pneumoniae محدوداً لانخفاض حساسية الطرق المخبرية المُتبعة (Nomanpour, 2011). في هذا البحث، لجأنا الى كشف جرثومة Streptococcus pneumoniae في عينات القشع لمرضى الالتهاب الرئوي، باستخدام التفاعل السلسلي للبوليميراز في الزمن الحقيقيQRT-PCR . حيث تسمح الصفة الكمية لهذه الطريقة بالتمييز بين التلوث والعدوى الحقيقية. وذلك اعتماداً على قيمة حدية لتركيز الدنا الجرثومي في القشع والتي تُعد الحد الفاصل بين حالتي استعمار البلعوم الأنفي والعدوى بجرثومةS. pneumoniae (Guclu et al; 2005) (Yang et al; 2005). وكان الهدف الرئيسي من البحث هو تقييم الفائدة السريرية من تقنية QRT-PCR، في كشف الالتهاب الرئوي بجرثومة S. pneumonia في العينات التنفسية ومقارنتها مع طرق التشخيص التقليدية.
واعتماداً على القيمة الحدية (3.8x410) نسخة جينوم جرثومي/ مل والتي حصلنا عليها من تحليل منحنى ROC، فقد أكدت هذه الدراسة وجود فارق يُعتدّ به إحصائياً بين طريقَتي الزرع الجرثومي وRT-PCR في تشخيص جرثومة S. pneumoniae (P< 0.0001)، حيث تمكنا من كشف الجرثومة باستخدام الزرع في 20.3% من إجمالي العينات، في حين أعطت طريقة QRT-PCR إيجابية بنسبة 39% من إجمالي عينات القشع، وتتوافق نتائجنا مع دراسة Stralin K. وزملاؤه (Stralin et al; 2006) ودراسة Guclu A. وزملاؤه (Guclu et al; 2005)، حيث أكدت هاتان الدراستان وجود فارق يعتد به بين الطريقتين. يمكن تفسير هذا التبايُن بين نتائج الزرع الجرثومي ونتائج RT-PCR بعدة عوامل: منها كون المريض يتناول المضادات الحيوية وقت أخذ العينة، مما يثبط النمو الجرثومي في الأوساط الزرعية، أو حدوث انحلال ذاتي للجراثيم (Bayram et al; 2006) (Nomanpour et al; 2011)، كما يوجد تفسير آخر لهذا التبايُن وهو وجود بعض ذراري S.pneumoniae المُقاومة للأبتوشين، والتي تعطي نتائج سلبية كاذبة بواسطة الزرع الجرثومي (Greiner et al; 2001).
- وجدنا في دراستنا أن كافة عينات القشع لدى البالغين، التي أعطَت نتائج إيجابية باستخدام الزرع الجرثومي أعطَت أيضاً نتائج إيجابية باستخدام RT-PCR. وتتقارب نتائج دراستنا مع دراسة Bayram A. وزملاؤه في تركيا (Bayram. 2006)، حيث وجد أن هذه النسبة تساوي 97.2%.
- أظهرت دراستنا أيضاً أن 47.8% (23/11) من العينات التي أبدت إيجابية باستخدام QRT-PCR أعطت نتيجة سلبية باستخدام الزرع الجرثومي، و58.3% منها أُخذت من مرضى يتناولون المضادات الحيوية وقت أخذ العينة. وأعطت دراستنا نتائج مُقاربة لدراسة (Johansson et al; 2008) وزملائه في السويد (النسبة %50)، لكنها كانت أعلى من النسبة التي أعطتها دراسة (Bayram et al; 2006) وزملاؤه والتي كانت %28.1. ويمكن تفسير هذه النسبة المُرتفعة في دراستنا بوجود نسبة كبيرة من المرضى الذين يتناولون المضادات الحيوية وقت أخذ العينة، مما يمنع نمو الجراثيم على الاوساط الزرعية. وبالتالي تكون نتيجة الزرع سلبية (Stralin et al; 2006) (الشكل 5).
|
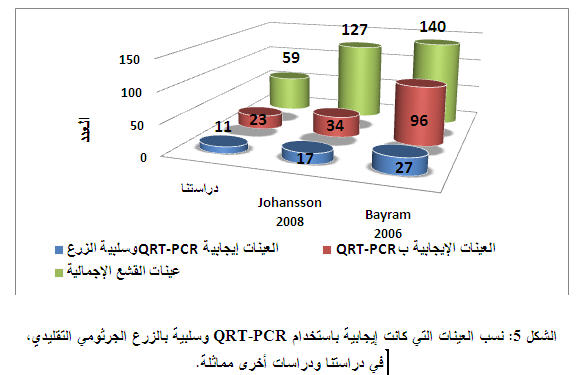 |
| الاستنتاج Conclusion |
| نستنتج من خلال هذه الدراسة أن مُقايسة Ouantitative Real Time PCR هي أكثر حساسية من تقنية الزرع الجرثومي التقليدي في كشف جراثيم S. pneumonie، بالإضافة إلى قدرة هذه المُقايسة الكمّية على التمييز الواضح بين حالتَي استعمار البلعوم الأنفي وعداوى الالتهاب الرئوي اعتماداً على قيم حدّية Cut-off خاصة وبالتالي فإن هذه المُقايسة تستطيع أن تُشخّص بدقة الالتهاب الرئوي بجرثومة S. pneumoniae، وتبرز أهميتها في الحالات الحرجة أو في حالة مرضى وحدات العناية المركزة والذين لايمكن إيقاف معالجتهم بالمضادات الحيوية بهدف إجراء الزرع الجرثومي. |
| المراجع References |
1-Bayram A; Kocoglu E; Balci I; Filiz A. and Eksi F.
Real-time polymerase chain reaction assay for detection of Streptococcus pneumonia in sputum samples from patient with community-acquired pneumonia.
J Microbiol Immunol Infect; 39: 452-457, 2006.
2-Butler J. et al.
Classical and latent classanalysis evaluation of sputum PCR and urine antigen testing for diagnosis ofpneumococcal pneumonia in adults.
J. Infect. Dis; 187: 1416-1423, 2003.
3-Chalasani N; Valdecanas M; Gopal A; McGowan J. and Jurado R.
Clinical utility of Blood culture in adult patients with community-acquired pneumonia without defined underlying risks.
\
Chest; 108:932-936, 1995.
4-Dowell S; Garman R; Liu G; Levine O. and Yang Y.
Evaluation of Binax NOW, an assay for the detection of pneumococcalantigen in urine samples, performed among pediatric patients.
Clin. Infect.Dis; 32: 824-825, 2001.
5-Greiner O; Day P; Bosshard P; Imeri F; Altwegg M. and Nadal D.
Quantitative detection of Streptococcus Pneumoniae in nasopharyngeal secretions by Real Time PCR.
J Clin Microbiol; (39): 3129-3134, 2001.
6-Guclu A; Baysallar M; Gozen A; Kilic A; Balkan A. and Doganci L.
Polymerase chain reaction vs. conventional culture in detection of bacterial pneumonia agent.
Annals of Microbiology; 55: 313-316, 2005.
7-Johansson N; Kalin M; Giske C. and Hedlund J.
Quantitative detection of Streptococcus pneumoniae from sputum samples with real-time quantitative polymerase chain reaction for etiologic diagnosis of community-acquired pneumonia.
Diagnostic Microbiology and Infectious Disease; 60: 255-261, 2008.
8-McAvin J; Reilly P; Roudabush R; Barnes W; Salmen M. and Jackson G.
Sensitive and Specific method for Rapid Identification of Streptococcus Pneumoniae using Real-Time fluorescence PCR.
J Clin Microbiol; (39): 3446-3451, 2001.
9-Murdoch D; Trevor P; Anderson T;
Beynon K; Chua A; Fleming A; Laing R; Mills G; Chambers S. and Jennings L.
Evaluation of PCR Assay for Detection of Streptococcus Pneumoniae in Respiratory and nonrespiratory samples from Adult with Community-Acquired pneumonia.
J Clin Microbiol; (41): 63-66, 2003.
10-Murdoch D.
Molecular Genetic Methods In Diagnosis of Lower Respiratory Tract Infection.
APMIS; 112:713-727, 2004.
11-Musher D.
Streptococcus Pneumoniae. In "Principles and Practice of infectious Disease.
5th ed; Mandell G; Bennett J. and Dolin R.
Elsevier. 2128-2147, 2000.
12-Obaro S. and Adegbola R.
The Pneumococcus: Carriage, Disease and Conjugate Vaccine.
J Med. Microbiol; (51): 98-104, 2002.
13-Nomanpour B; Ghodousi A; Babaei Mousavi S; Asadi S. and Feizabadi M.
Detection and quantification of Streptococcus pneumoniae from Iranian patients with pneumonia and individual carriers by real time PCR.
African Journal of Biotechnology, (60): 12826-12832, 2011.
14-Schaad N. and Frederick R.
Real-Time PCR and Its Application for rapid disease diagnostics.
Can J. Plant Pathol; 24: 250-258, 2002.
15-Stralin K; Tornqvist E; Kaltoft M; Olcen P. and Holmber H.
Etiologic Diagnosis of adult bacterial pneumonia by culture and PCR applied to respiratory tract samples.
J Clin. Microbiol; 44: 643-645, 2006.
16-van Haeften R. et al.
Quantitative LightCycler PCR to detect streptococcus Pneumoniae in Blood and CSF.
Diagn Microbiol Infect Dis; 47: 407-414, 2003.
17-Yang S. et al.
Quantitative PCR assay using sputum samples for rapid diagnosis of pneumococcal pneumonia in adult emergency department patients.
J Clin. Microbiol; 43: 3221-3226, 2005.
|
| |
| المجلد 6 ,
العدد 8
, صفر 1434 - كانون الثاني (يناير) 2013 |
|
|
|
