| المجلد 6 ,
العدد 8
, صفر 1434 - كانون الثاني (يناير) 2013 |
| |
| تقييم استخدام التفاعل السَّلْسلي للبوليميراز في الزمن الحقيقي
لتشخيص داءُ البروسِيلات البشرية
|
| Evaluation of the use of real-time polymerase chain reaction assay in the diagnosis of human brucellosis |
| د. يارا السيد وأ.د. فوزة منعم |
| Alsayed Y. and Monem F. |
كلية الصيدلة، جامعة دمشق
Faculty of Pharmacy, Damascus University.
|
| الملخص Abstract |
| يعتمد تشخيص داء البروسيلات في سورية على الأعراض السريرية وإيجابية اختبارات التراص. اعتبرت كل من CDC وWHO مؤخراً كشف DNA البروسيلَة في العينة السريرية بالتفاعل السلسلي للبوليميراز كأحد المعايير المخبرية لتشخيص داء البروسيلات. ولذلك هدفت دراستنا إلى تقييم هذه الطريقة في تشخيص داء البروسيلات، ودراسة جدوى استخدامها عندما تفشل الطرق التقليدية في تشخيص المرض. جرى فحص 76 عينة دم من مرضى يشتبه سريرياً بإصابتهم بداء البروسيلات الحاد أو المزمن أو الناكس، باختبارات التراص، وزرع الدم، ومقايسة real-time PCR. كُشفت الإصابة بداء البروسيلات عند 48/76 مريضاً، اعتماداً على التَشْخيصٌ السَريرِيّ والنتائج الإيجابية للاختبارات المخبرية. فكانت حساسية اختبارات التراص، وزرع الدم، ومقايسة real-time PCR في تشخيص داء البروسيلات الحاد 86%، 57%، 48%، على الترتيب. وفي تشخيص داء البروسيلات المزمن أو الناكس 100%، 15%، 4%، على الترتيب. كُشفت الإصابة لدى 3 حالات باختبار real-time PCR مع سلبية كلٍ من اختباري التراص والزرع. وأظهرت نتائجنا أنه يمكن استخدام التفاعل السلسلي للبوليميراز في الزمن الحقيقي لدعم التشخيص في حالات سلبية نتائج اختبارات التراص. |
| Brucellosis diagnosis in Syria relies on the presence of compatible symptoms combined with positive agglutination tests’ results. The detection of Brucella DNA in clinical sample by PCR was recently considered as one of the laboratory criteria for brucellosis diagnosis of CDC and WHO. Therefore, our study aimed at evaluating this method for the diagnosis of brucellosis, and studying the advantage of applying it when traditional methods fail. Seventy-six blood samples from patients with clinical indication of acute, relapsed or chronic brucellosis were examined by agglutination tests, culture and real-time PCR. Brucellosis was detected in 48/76 patients, based on clinical diagnosis and positive laboratory tests’ results. The sensitivities of agglutination tests, blood culture and real-time PCR in diagnosing acute brucellosis were 86%, 57%, 48%, respectively, and in diagnosing chronic or relapsed brucellosis were 100%, 15%, 4%, respectively. Three cases were positive by real-time PCR but not by culture or agglutination tests. Our results showed that real-time PCR could be utilized to support the diagnosis in cases with negative agglutination tests results. |
| المقدمة Introduction |
يتظاهر داء البروسيلات بأعراض غير وصفية تشابه الإصابة بكثير من الأمراض المنتشرة في البلدان النامية كالسل والحمى المعوية والملاريا. وقد يُبدي المريض أعراضاً تشابه أعراض الإنفلونزا كالحمّى، وألم المفاصل، والتعرق. الأمر الذي يستدعي دوماً اقتران التشخيص السريري مع الدليل المخبري على وجود البروسيلات لتأكيد الإصابة بالمرض (7). يعتمد تشخيص وزارة الصحة السورية لداء البروسيلات على ترافق وجود أعراض دالة على هذا المرض مع إيجابية اختبارات التراص. تشكك بعض الدراسات في قدرة هذه الاختبارات على كشف حالات الإصابة الفعلية بداء البروسيلات جميعها (3). لذا كان لا بد من البحث عن طرق جديدة تمكننا من كشف الحالات التي أغفلت تشخيصها اختبارات التراص، تلافياً لمساوئ تأخر كشف هذا الداء، وما لذلك من أثر سلبي على نوعية حياة المريض وازدياد إمكان تحول المرض إلى شكله المزمن.
حديثاً، جرى اعتبار النتيجة الإيجابية لمقايسة DNA جرثوم البروسيلا، باستخدام PCR، كأحد المعايير المخبرية العالمية المُعتَمدة لتشخيص البروسيلات من قِبل مراكز مكافحة الأمراض CDC، في حين اعتبرتها منظمة الصحة العالمية WHO كأحد الدلائل الداعمة للتشخيص (4، 5). ونظراً للمعوّقات التي تعاني منها طرق التشخيص المتبعة حالياً، فقد هدفت دراستنا إلى تقييم مقايسة التفاعل السلسلي للبوليميراز في الزمن الحقيقي، من خلال مقارنتها مع اختبارات التراص والزرع، وتحري ما إذا كانت إضافتها إلى جانب الطرق المُعتمدة حالياً في التشخيص ستقلل من الحالات التي تفلت من يد التشخيص بهذه الطرق.
|
| المواد والطرق Materials and Methods |
أجريت الدراسة على 76 مريضاً من الذكور والإناث، تراوحت أعمارهم بين 4-73 عاماً، جرى تشخيصهم سريرياً من قبل الأطباء في المستوصفات والمستشفيات، ومن ثم جرى توجيههم إلى مختبر الحمى المالطية في مركز مخابر وزارة الصحة السورية في دمشق، في الفترة الواقعة بين أيار- كانون الأول 2010 لإجراء اختبارات التراص. وقُسم مرضى الدراسة إلى مجموعتين وفق قرائن الإدخال التالية:
المجموعة الأولى (المشتبه بإصابتهم بداء البروسيلات n=34): يشترك مرضى هذه المجموعة بوجود أعراض سريرية دالة على الداء وقصة تعرّض لأحد المصادر المُحتملة للجرثوم، وعدم تعرض مسبق للإصابة بداء البروسيلات.
المجموعة الثانية (المشتبه بإصابتهم بداء البروسيلات المزمن أوالناكس n=42): عاودت أعراض داء البروسيلات ظهورها لدى مرضى هذه المجموعة بعد فترة أقل من عام (إصابة ناكسة) أو أكثر من عام (إصابة مزمنة) بعد تلقي العلاج النوعي الكامل لداء البروسيلات.
سُحبت من كل مريض عينة دم كامل، مقدارها 10-17 مل (5-10 مل من الدم الكامل في مستنبت زرع الدم، و5-7 مل من الدم الكامل في أنبوب جاف، نبّذت بسرعة 3000 دورة/ دقيقة لمدة 10 دقائق، واستُعمل المصل لإجراء اختبارات التراص وكشف الـ DNA الجرثومي باستخدام تفاعل Real-time PCR).
اعتمد التشخيص النهائي بناءً على ترافق التشخيص السريري مع إيجابية أحد الطرق المدروسة (اختبارات التراص، زرع الدم، كشف الـ DNA الجرثومي بتفاعلreal-time PCR ) وذلك حسب المعايير العالمية الموضوعة من قبل منظمة WHO ومركز الـ CDC لتشخيص البروسيلَة (4، 5)، وجرى تقييم الطرق المتبعة بالمقارنة مع هذا التشخيص النهائي.
|
اختبارات التراص Agglutination tests
شملت اختبارات التراص اختبار الأنبوب المعياري Standard Agglutination Test (SAT) (لكشف الأضداد من النمط IgM وIgG) متبوعاً باختبار كومبس coombs’ test (لكشف الأضداد غير الراصة Non agglutinating antibodies والحاجبة Blocking antibodies من النمط IgG) فقط في حال كانت نتيجة اختبار SAT سلبية، وجرى تبني نتائج هذه الاختبارات من ملفات المرضى.
اختبار زرع الدم Blood culture
أُجري اختبار زرع الدم في مستشفى الأسد الجامعي، حيث حضنت مُستنبتات الدم في جهاز زرع الدم الآلي بدرجة 37°م لمدة 21 يوماً (Bactec 9050 Becton Dickenson, USA)، أُجري خلالها الزرع الثانوي Subculture من هذه المستنبتات، كل أسبوع على مُستنبت الآغار بالدم، وأجري زرعاً ثانوياً للعينات الإيجابية على مُستنبتات الآغار بالدم، آغار البروسيلة، وماكونكي، كما جرى استعراف جرثوم البروسيلة بوساطة خصائص النمو واختبارات الاستعراف Identification Tests، التي تضمنت تحري نمو الجرثوم على وسط الآغار بالدم، والبروسيلة آغار، بعد 2-3 أيام من الحضن بالدرجة 37مْ وعدم نموه على وسط ماكونكي، وإجراء تلوين غرام Gram stain لمستعمرة نامية على طبق الآغار، وإجراء كلٍ من اختبارات الأكسيداز، والكاتالاز، والتراص مع المصل الحاوي على أضداد البروسيلة.
مقايسة الـ DNA الجرثومي باستخدام التفاعل السلسلي للبوليميراز real-time PCR
استخلص الـ DNA الجرثومي من 200 مكل من المصل وذلك باستخدام عتيدة QIA amp DNA blood Mini kit Qiagen, Hilden, Germany))، في حين جرى الكشف الكيفي عن وجود DNA البروسيلة باستخدام عتيدة Fast Start DNA Master Hybridization Probe (Roche Diagnostics, Penzberg, Germany) الحاوية على مزيج التفاعل، وعتيدة Light Mix Kit Brucella Genus TIB Molbiol, Berlin, Germany)) الحاوية على مشارع Primers ومسابير Probes، بالإضافة إلى كاشف داخلي (IC) Internal Control لمراقبة تفاعل real-time PCR، حسب تعليمات الشركة المصنعة، وعلى جهاز الدوار الحراري (Light Cycler Roche Diagnostics, Penzberg, Germany).
أُجري الاستخلاص وتفاعل Real-time PCR في مستشفى الأسد الجامعي، وجرى تحضير تفاعل real-time PCR بحجم تفاعل نهائي 20 µl. كما أُجري تفاعل real-time PCR إضافي لجميع العينات التي أظهرت نتيجة سلبية لدى إجراء التفاعل الأول، تلافياً لإمكان انخفاض الحمولة الجرثومية load المعروف في بعض حالات العدوى بداء البروسيلات.
التحليل الإحصائيStatistical analysis
أُجريت الدراسة الإحصائية باستخدام PASW Statistics version 18 SPSS, Inc, Chicago, USA. حُسبت الحساسية والنوعية للطرق المدروسة، مقارنة مع التشخيص النهائي، كما استُخدم اختبار Student’s t-test لدراسة وجود فروقات حقيقية وجوهرية في الحساسية للطرق المدروسة، واستُخدم منحنى Receiver Operating Characteristic curve (ROC) وقُدّرت المساحة المحصورة تحته Area Under the Curve (AUC)، للمقارنة بين القيم التشخيصية للطرق المخبرية المطبقة في الدراسة. اعتبرت قيمة P-value ≤ 0.05 معتداً بها احصائياً.
|
| النتائج Results |
نتائج اختبارات المرضى المشتبه بإصابتهم بداء البروسيلات
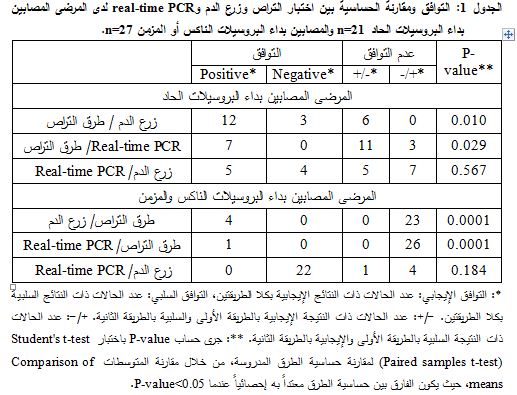
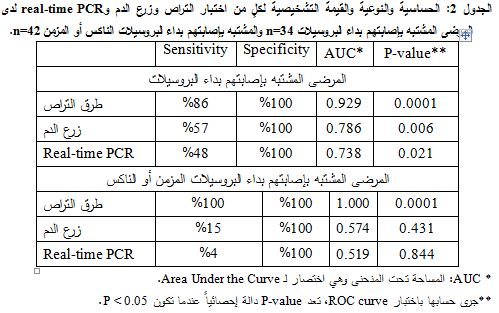
لدى اعتماد المعايير العالمية في التشخيص (التشخيص النهائي) تبيّن إصابة 21/34 فرداً (62%)، وكانت مدة ظهور الأعراض قبل التشخيص عند 90% منهم أقل من شهرين (داء البروسيلات الحاد). كشفت اختبارات التراص وجود أضداد راصة لجرثوم البروسيلة في 18/34 عينة (53%)، بينما أظهر اختبار زرع الدم نمواً إيجابياً لجرثوم البروسيلة في 12/34 عينة (35%)، جميعها إيجابية باختبارات التراص. في حين جرى كشف DNA البروسيلة بمقايسة real-time PCR في 10/34 عينة (29%)، 7 منها كانت إيجابية باختبارات التراص و5/10 إيجابية باختبار زرع الدم. من الحالات المصابة بداء البروسيلات (21 حالة)، جرى كشف 18 حالة باستخدام اختبارات التراص و3 حالات باستخدام تفاعل real-time PCR (الجدول 1). تتالت حساسية اختبارات التراص والزرع وreal-time PCR بالقيم 86%، 57%، 48%. أما نوعية هذه الاختبارات فكانت 100%، 100%، 100% على الترتيب (الجدول 2).
بتطبيق اختبارStudent's t-test تبين وجود فارق إحصائي معتد به بين حساسية طرق التراص وحساسية كل من real-time PCR (P=0.029) وزرع الدم (P=0.010)، بينما تساوت حساسية كل من مقايسة real-time PCR وزرع الدم، حيث كان الفارق غير معتد به إحصائياً (P-value=0.567) (الجدول 1).
بتطبيق اختبار ROC curve تبين أن قيمة المساحة تحت المنحنى AUC لطرق التراص (0.929) أعلى من قيمتها لكل من real-time PCR (0.786) وزرع الدم (0.738)، أي أن طريقة التراص قد أظهرت قيمة تشخيصية أعلى من الطرق المذكورة. ولقد بينت قيم المساحة تحت المنحنى AUC المتقاربة لكلٍ من real-time PCR (0.738) وزرع الدم (0.786) تقارباً في القيمة التشخيصية لهذه الاختبارات. بلغت قيمة P-value المحسوبة باختبار ROC curve للطرق المدروسة جميعها قيماً أقل من 0.05. وبهذا يمكن الاستنتاج أن الفحوص المدروسة جميعها قادرة على التمييز ما بين حالات الإصابة الفعلية والحالات الشاهدة (الجدول 2).
نتائج اختبارات المرضى المشتبه بإصابتهم بداء البروسيلات الناكس أو المزمن:
لدى اعتماد المعايير العالمية في التشخيص (التشخيص النهائي) تبيّن إصابة 27/42 فرداً (64%). كشفت اختبارات التراص وجود أضداد راصة لجرثوم البروسيلة في 27/42 (64%) عينة، بينما أظهر اختبار زرع الدم نمواً إيجابياً لجرثوم البروسيلة في 4/42 عينة (10%)، في حين جرى كشف DNA البروسيلة في 1/42 عينة (2%) (الجدول 1). كانت حساسية اختبارات التراص وزرع الدم والـ DNA الجرثومي باستخدام تفاعل real-time PCR، بالمقارنة مع التشخيص النهائي 100%، 15%، 4%، على الترتيب، ونوعيتها 100% ،100%، 100% على الترتيب (الجدول 2).
بتطبيق اختبارStudent's t-test تبين وجود فارق إحصائي معتد به بين حساسية طرق التراص وحساسية كلٍ من real-time PCR (P-value=0.000) وزرع الدم (P-value=0.000)، وعدم وجود فارق إحصائي معتد به (P-value=0.184) بين حساسية real-time PCR وزرع الدم (متساويان في الحساسية) (الجدول 1).
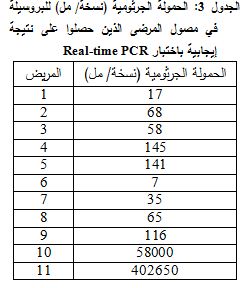
بتطبيق اختبار ROC curve، بلغت قيمة المساحة تحت المنحنى AUC لطرق التراص (1.000)، حيث كانت أعلى من قيمتها لكلٍ من real-time PCR (0.519) وزرع الدم (0.574)، مما يدل على أن اختبارات التراص تتمتع بقيمة تشخيصية أعلى من الطرق المذكورة. كما تبيّن أن قيمة المساحة تحت المنحنى AUC متقاربة لكل من real-time PCR وزرع الدم وهذا يظهر تقارب هاتين الطريقتين في قيمتهما التشخيصية. كانت قيمة P-value المحسوبة باختبار ROC curve لاختبارات التراص أقل من 0.05 (1P=0.000)، أي أن هذه الاختبارات كانت قادرة على التمييز ما بين حالات الإصابة الفعلية والحالات الشاهدة، في حين كانت قيمة P-value لطرق real-time PCR (P=0.844) وزرع الدم (P=0.431) أعلى من 0.05، مما يدل على أن هذين الاختبارين غير قادرين على التمييز ما بين حالات الإصابة الفعلية والحالات الشاهدة (الجدول 2). تم حساب الحمولة الجرثومية من خلال القياس الكمي لأعداد النسخ باختبار Real-time PCR، بحيث تراوحت الحمولة الجرثومية لدى 9/11 مريضاً بين (7-145 نسخة/ مل) وبلغت قيمتها في مريضين (58000، 402650 نسخة/ مل) (الجدول 3).
|
|
| المناقشة والاستنتاج
Discussion and Conclusion
|
في ما يتعلق بالمرضى المُشتبه بإصابتهم بداء البروسيلات، أظهرت نتائج دراستنا حساسية عالية قدرها 86%، باستخدام اختبارات التراص المُعتَمدة من قبل وزارة الصحة السورية، مقارنة مع فحوص زرع الدم وكشف الـ DNA باستخدام real-time PCR، الأمر الذي يؤكد أهمية إجراء اختبارات التراص أولاً باعتبارها الأعلى حساسية، بالإضافة إلى كونها سهلة الإجراء وزهيدة الكلفة، إلا أن إغفالها لثلاث حالات (14%)، ثبت من تشخيصها النهائي أنها إصابة بالبروسيلة، يجعل من الضروري إجراء اختبارات إضافية للحالات التي كانت نتيجتها سلبية باختبارات التراص، وخصوصاً في حال الشك ووجود القصة السريرية واستمرار الأعراض، وهذا ما أكدته دراسة Celik 2010 (3).
بيّنت نتائج دراستنا عدم وجود فارق معتد به إحصائياً بين حساسية كشف DNA البروسيلة بتفاعل real-time PCR (48%) وحساسية الزرع (57%)، مما يضع هذه الفحوص في مرتبة متساوية، لدى استخدامها لكشف الحالات التي لم تكشفها اختبارات التراص. ولقد أوضحت نتائجنا قدرة مقايسة DNA باستخدام تفاعل PCR real-time على كشف الحالات التي أغفلت اختبارات التراص تشخيصها (3 حالات).
إن النتائج السلبية لعدد من المرضى (11/21) بتقنية real-time PCR، على الرغم من إيجابية الزرع لدى البعض منهم (5/11)، هو أمر يثير التساؤل، إذا أخذنا بعين الاعتبار أن ذلك لم يكن ناتجاً عن تثبيطٍ حصل أثناء إجراء تفاعل real-time PCR بفعل مثبطاتٍ موجودةٍ في المصل، أو من الأدوات والأنابيب المستخدمة، وذلك لأن الشاهد الداخلي Internal Control (IC) أعطى إشارة إيجابية في حجرات العينات المفحوصة جميعها. ومن الممكن تفسير ذلك بتواجد جرثوم البروسيلة بحمولة جرثومية منخفضة في الدم، حتى في الحالات الحادة، حيث ذكرPappas 2007 وجود الجرثوم بكمية تتراوح بين 10-100 جرثوم/ مل (8)، وهذا التكهن تدعمه مشاهداتنا، حيث تراوحت قيم الحمولة الجرثومية في عينات دراستنا لدى قياسها الكمي بطريقة real-time PCR بين 7-145 جرثوم/ مل لدى 9/11 عينات إيجابية، كما جرى كشف ثلاث عينات إيجابية بعد إعادة إجراء كشف DNA البروسيلة باستخدام تفاعل real-time PCR على العينات نفسها، التي لم يبدُ فيها وجود DNA عند الإجراء الأول للتفاعل، نظراً لضآلة التركيز الكلي للجرثوم في العينة، وهذا ما أكدته نتائج دراسة Queipo-Ortuno عام 2005 (9).
لدى مقارنة نتائجنا، عند استخدام تفاعل real-time PCR لكشف DNA البروسيلة في مجموعة المرضى المشتبه بإصابتهم بالبروسيلة، مع نتائج الدراسات الأخرى المشابهة (1، 6، 9، 10)، لاحظنا تبايناً في حساسية تفاعل real-time PCR في هذه الدراسات (56%-100%) مع حساسية تفاعل real-time PCR (48%) في دراستنا، ويمكن أن يعود ذلك إلى ختلاف المنطقة الجينية المختارة، أو اختلاف حدود كشف الـ DNA باستخدام تفاعل الـ real-time PCR، أو اختلاف نوع العينة المستخدمة.
أما في ما يتعلق بالمرضى المشتبه بإصابتهم بداء البروسيلات الناكس أو المزمن، فلقد أظهرت نتائج دراستنا حساسية لاختبار زرع الدم قدرها 15% ولتفاعل الـ real-time PCR قدرها 4%، و ربما يعود هذا إلى غياب فترة تجرثم الدم Bacteremia في هذه الحالات، وانخفاض الحمولة الجرثومية (8)، ولم تتفق نتيجتنا مع نتيجة Castano, 2009 (2) فيما يتعلق بتفاعل الـ real-time PCR (حصل على حساسية تعادل 100%)، وقد يعود هذا إلى اختلاف المنطقة الجينية المستهدفة، وإلى انخفاض حدود كشف الـ DNA بطريقة real-time PCR المُتبعة في دراسته (ا نسخة DNA/ مل) مقارنة مع دراستنا (10 نسخ DNA/ مل)، وكذلك إلى أنه كرر الاختبار على 209 عينات مصل ودم كامل مأخوذة من 17 مريضاً فقط، وبهذا زادت احتمالات كشف الـ DNA بعد تكرار الاختبار، في حين لم نستطع تكرار الاختبار إلا مرة واحدة.
يمكن تفسير الفارق الملحوظ في حساسية تفاعل real-time PCR عند إجرائه على مجموعتي الدراسة (المصابين بداء البروسيلات الحاد 48%، المصابين بداء البروسيلات المزمن أو الناكس 4%) بانخفاض الحمولة الجرثومية للبروسيلة في داء البروسيلات الناكس والمزمن، مقارنة مع الحاد، وذلك نتيجة تطبيق العلاج النوعي لداء البروسيلات، بالإضافة إلى هروب الجرثوم إلى مناطق من الجسم تقل فيها المراقبة المناعية كنقي العظم والبؤر الأخرى البعيدة عن الدوران، وهذا موافق لما وجده Taleski 2010 وتكهّن به (10).
تخلص دراستنا إلى التأكيد على القيمة التشخيصية المُعتبرة لاختبارات التراص المُتّبعة في سورية، من أجل تشخيص كلٍ من الحالات الحادة والمزمنة والناكسة، وإلى ضرورة إضافة اختبار real-time PCR و/ أو زرع الدم في حال استمرار الاشتباه بالحالات الحادة رغم ظهور نتائجها السلبية باختبارات التراص.
|
| المراجع References |
1-Debeaumont C. Falconnet P.A. and Maurin M.
Real-time PCR for detection of Brucella spp. DNA in human serum samples.
Eur J Clin Microbiol Infect Dis 24: 842-845, 2005.
2-Casta?o M.J. and Solera J.
Chronic Brucellosis and Persistence of Brucella melitensis DNA.
J Clin Microbiol 47(7): 2084-2089, 2009.
3-Celik A.D; Yulugkural Z; Kilincer C; Hamamcioglu MK; Kuloglu F. and Akata F.
Negative serology: could exclude the diagnosis of brucellosis?
Rheumatol Int, 2010. doi: 10. 1007 /s00296-010-1453-y.
4-Centers for Disease Control and Prevention.
Brucellosis (Brucella spp.): 2010 Case Definition. CSTE Position Statement Number: 09-ID-14. Available: http://www.cdc.gov/osels/ph_surveillance/nndss/print/brucellosis_current.htm. Accessed 21 February 2012.
5-Corbel MJ.
Brucellosis in humans and animals.
WHO Press Geneva, Switzerland, p 89, 2006.
6-Kattar M.M; Zalloua P.A; Araj G.F; Samaha-Kfoury J; Shbaklo H; Kanj S.S; Khalife S. and Deeb M.
Development and evaluation of real-time polymerase chain reaction assays on whole blood and paraffin-embedded tissues for rapid diagnosis of human brucellosis.
Diagn Micr Infec Dis; 59 (1): 23-32, 2007.
7-Mantur B.G; Amarnath S.K; and Shinde R.S.
Reviw of clinical and laboratory features of human brucellosis.
Ind J Med Mcrobiol 25(3): 188-202, 2007.
8-Pappas G. and Papadimitriou P.
Challenges in Brucella bacteraemia.
Int J Antimicrob Agents, 30 Suppl 1: 29-31, 2007.
9-Queipo-Ortuño M.I; Colmenero J.D; Reguera J.M; García-Ordóñez M.A; Pach?n M.E; González M. and Morata P.
Rapid diagnosis of human brucellosis by SYBR Green I-based real-time PCR assay and melting curve analysis in serum samples.
Clin Microbiol Infect; 11(9): 713–718, 2005.
10-Taleski V.
An overview of introducing various laboratory tests for diagnosis of human brucellosis in the Republic of Macedonia.
Maced J Med Sci; 3(3): 239-245, 2010.
|
| |
| المجلد 6 ,
العدد 8
, صفر 1434 - كانون الثاني (يناير) 2013 |
|
|
|
